Method Article
Isolamento e coltura di cellule ciliate cocleari primarie da topi neonatali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo articolo, presentiamo un protocollo dettagliato per l'isolamento e la coltura di cellule ciliate cocleari primarie dai topi. Inizialmente, l'organo di Corti è stato sezionato da coclee murine neonatali (di 3-5 giorni) al microscopio. Successivamente, le cellule sono state digerite enzimaticamente in una sospensione unicellulare e identificate utilizzando l'immunofluorescenza dopo diversi giorni in coltura.
Abstract
Le cellule ciliate cocleari sono i recettori sensoriali del sistema uditivo. Queste cellule si trovano nell'organo di Corti, l'organo sensoriale responsabile dell'udito, all'interno del labirinto osseo dell'orecchio interno. Le cellule ciliate cocleari sono costituite da due tipi anatomicamente e funzionalmente distinti: cellule ciliate esterne e interne. Il danno a uno di essi provoca la perdita dell'udito. In particolare, poiché le cellule ciliate interne non possono rigenerarsi e il loro danno è permanente. Pertanto, la coltivazione in vitro di cellule ciliate primarie è indispensabile per studiare gli effetti protettivi o rigenerativi delle cellule ciliate cocleari. Questo studio mirava a scoprire un metodo per isolare e coltivare le cellule ciliate di topo.
Dopo la rimozione manuale della parete laterale cocleare, l'epitelio uditivo è stato meticolosamente sezionato dal miolo cocleare al microscopio, incubato in una miscela composta da tripsina-EDTA allo 0,25% per 10 minuti a 37 °C e delicatamente sospeso nel terreno di coltura utilizzando un puntale per pipette da 200 μL. La sospensione cellulare è stata fatta passare attraverso un filtro cellulare, il filtrato è stato centrifugato e le cellule sono state coltivate in piastre a 24 pozzetti. Le cellule ciliate sono state identificate in base alla loro capacità di esprimere un complesso di meccanotrasduzione, la miosina-VIIa, che è coinvolta nelle tensioni motorie, e tramite marcatura selettiva della F-actina utilizzando falloidina. Le cellule hanno raggiunto l'>90% di confluenza dopo 4 giorni in coltura. Questo metodo può migliorare la nostra comprensione delle caratteristiche biologiche delle cellule ciliate coltivate in vitro e dimostrare l'efficienza delle colture di cellule ciliate cocleari, stabilendo una solida base metodologica per ulteriori ricerche uditive.
Introduzione
Le cellule ciliate cocleari svolgono un ruolo importante nel rilevamento del suono e nella trasmissione del segnale al nervo uditivo. Le cellule ciliate sono cellule meccanicistiche che funzionano come recettori sensoriali primari e convertono le vibrazioni sonore in segnali elettrici nei vertebrati. L'epitelio sensoriale dell'orecchio interno dei mammiferi comprende una singola fila di cellule ciliate interne e tre file di cellule ciliate esterne. In diverse aree di base della membrana, le cellule ciliate percepiscono i suoni a frequenze diverse (tra 20 e 2.000 Hz)1. La funzione delle cellule ciliate esterne è un processo di amplificazione meccanica attiva che aiuta a mettere a punto l'orecchio interno dei mammiferi, conferendo un'elevata sensibilità al suono. Le cellule ciliate interne sono responsabili del rilevamento dei suoni. Dopo la depolarizzazione graduale, le informazioni acustiche vengono trasmesse al cervello attraverso le fibre nervose uditive2.
La perdita dell'udito può essere causata da difetti genetici, invecchiamento, traumi da rumore o dall'uso eccessivo di farmaci ototossici, che costituiscono un grave problema di salute in tutto il mondo 3,4. La perdita dell'udito deriva principalmente da danni irreversibili alle cellule ciliate5. Per quanto riguarda la perdita dell'udito indotta dal rumore, sebbene i ricercatori abbiano raggiunto un consenso su diversi dettagli della sua eziologia, manca una comprensione completa dei numerosi meccanismi sottostanti. Le cellule ciliate esterne sono particolarmente vulnerabili alla sovraesposizione acustica6. Le cellule ciliate cocleari meccanosensibili sono coinvolte nella perdita dell'udito legata all'età; Tuttavia, i meccanismi molecolari e cellulari alla base della degenerazione delle cellule ciliate rimangono sconosciuti. Diversi cambiamenti nei processi molecolari portano all'invecchiamento delle cellule ciliate, allo stress ossidativo, alla risposta al danno del DNA, all'autofagia e alla disregolazione dell'espressione e della trascrizione dei geni correlati alla specializzazione delle cellule ciliate7.
Poiché l'orecchio interno è racchiuso nell'osso temporale, in profondità nell'osso più duro del corpo, è sperimentalmente inaccessibile, ponendo una sfida alle indagini sui meccanismi di riparazione e rigenerazione delle cellule ciliate. Quindi, la creazione di colture in vitro per studiare la funzione delle cellule ciliate è diventata un metodo ideale per la ricerca sui meccanismi di rigenerazione e lesione dell'orecchio interno. Le procedure per la preparazione di colture organotipiche cocleari sono state descritte in studi precedenti 8,9,10. I ricercatori di tutto il mondo hanno impiegato varie tecniche di microdissezione cocleare e di preparazione della superficie. Nonostante le sfide persistenti, vari sistemi di coltura di cellule ciliate primarie sono stati stabiliti con successo in vitro. Le colture di organi cocleari contengono vari tipi di cellule, tra cui cellule ciliate, cellule di Deiters, cellule di Hensen, cellule pilastro e fibre nervose uditive. Una comprensione approfondita dei cambiamenti nelle cellule ciliate a livello cellulare e molecolare dopo una lesione consentirà lo sviluppo di strumenti di ricerca più potenti. Questo studio mirava a dimostrare i passaggi per isolare gli organi cocleari dai topi neonatali e staccare enzimaticamente le abbondanti cellule ciliate per gli studi in vitro. La natura delle cellule coltivate è stata confermata utilizzando la colorazione in immunofluorescenza.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati (n. 2021-847) dal Comitato per l'uso e la cura degli animali dell'Università di Xi'an Jiaotong.
1. Sterilizzazione e preparazione del materiale
- Sterilizzare gli strumenti di dissezione utilizzando la disinfezione a vapore ad alta temperatura e ad alta pressione e asciugarli in un'incubatrice a 50 °C per una notte.
- Preparare in anticipo 100 mL di terreno di coltura contenente il 10% di siero fetale bovino (FBS) e 10 mg/mL di penicillina/streptomicina (aggiungere 10 mL di FBS e 10 μL di soluzione madre di penicillina a 90 mL di terreno di Dulbecco Modified Eagle Medium (EMEM)) e conservare a 4 °C.
2. Dissezione e asportazione dell'osso temporale per la raccolta degli epiteli uditivi
- Sopprimere un numero totale di 10 topi neonati (di età compresa tra P3 e P5) mediante decapitazione su ghiaccio. Utilizzare una metodologia alternativa ed eticamente approvata, se necessario.
- Tenere la testa in posizione, aprire il cuoio capelluto lungo la sutura sagittale utilizzando forbici microoperatorie e separare e fissare il cuoio capelluto bilateralmente con le dita, come mostrato nella Figura 1A.
- Rimuovere il cervello utilizzando un piccolo elevatore periostale e dividere in due il cranio basale. Taglia il cranio con le forbici e capovolgilo in avanti per aprire il cranio; Usa la punta delle forbici per raschiare il cervello ed esporre la base del cranio.
- Osservare le ossa temporali bilaterali alla base del cranio (Figura 1C). Usa le forbici per tagliare la base del cranio lungo la linea mediana, raschiare via la pelle e rimuovere l'osso non necessario (Figura 1D,D').
- Conservare e trasferire le ossa temporali in piastre di Petri sterili da 35 mm contenenti una soluzione salina bilanciata di Hank (HBSS) fresca (Figura 1E).
- Utilizzare due pinze a punta #5 per rimuovere la bolla e il tessuto circostante dalla porzione petrosa dell'osso temporale (Figura 1E).
NOTA: In questa fase, il labirinto osseo nell'osso temporale dei topi non sarebbe completamente calcificato e sarebbe facilmente sezionato usando il forcipe. - Tenere la pinza con una mano per fissare la parte semicircolare dell'osso temporale e infilare il piede inferiore della pinza nella nicchia rotonda della finestra con l'altra mano per separare l'osso laterale della coclea dal vestibolo della scala. Rimuovere con cautela la porzione petrosa dell'osso temporale senza toccare l'epitelio OC. Successivamente, separare e rimuovere con cura il labirinto osseo della coclea dall'estremità basale all'estremità apicale (Figura 1F).
- Microisolare con cura l'organo dell'epitelio sensoriale di Corti dal modiolo utilizzando una pinza a #5 punte (Figura 1G).
- Tenere il legamento spirale, separarlo con cura dalla stria vascolare con una pinza microoperatoria e trasferire l'epitelio uditivo pulito in una piastra di coltura sterile da 3 mm contenente HBSS utilizzando una pipetta da 200 μL (Figura 1H).
- Raccogliete 20 campioni da ciascun animale e trasferiteli rapidamente in una capsula di Petri sterile da 100 mm contenente HBSS per la fase successiva della preparazione (Figura 1).
3. Disaggregazione enzimatica per l'ottenimento di cellule ciliate uditive
- Trasferire l'epitelio uditivo in 10 mL di DMEM fresco contenente lo 0,25% di tripsina e incubare a 37 °C per 12 min.
- Utilizzando un puntale per pipette da 200 μL, separare delicatamente le cellule ciliate dalla lamina basale e dalle altre cellule al microscopio operatorio.
- Aggiungere altri 10 mL di terreno di coltura per inibire la disaggregazione.
- Filtrare le cellule sospese nel terreno di coltura attraverso un filtro da 70 μm, raccogliere il filtrato in una provetta pulita da 50 ml e centrifugarlo a 300 × g per 5 minuti.
- Risospendere le cellule ciliate in almeno 5 mL di terreno di coltura pipettandole delicatamente su e giù utilizzando un puntale per pipette da 1.000 μL. Evitare di introdurre bolle.
- Posizionare in anticipo un vetrino coprioggetti sul fondo di una piastra a sei pozzetti. Contare le cellule e coltivarle a una densità di 10,6 cellule/mL in piastre a sei pozzetti.
- Far crescere le cellule aderenti in 2 mL di DMEM (contenente il 10% di FBS, 100 unità/mL di penicillina e 100 μg/mL di streptomicina) a 37 °C e il 5% di CO2 . Cambiare il terreno di coltura ogni giorno.
NOTA: Va detto che l'utilizzo di questo protocollo non comporta l'ottenimento di cellule ciliate pure. Sulla base di questo metodo di coltura cellulare primaria, si consiglia di utilizzare cellule d2 o d3 per ulteriori studi, poiché le cellule ciliate potrebbero costituire circa il 70% delle cellule in coltura ed essere in buono stato.
4. Colorazione immunofluorescente
- Prelevare le cellule coltivate da d1 a d6 (un pozzetto al giorno). Aspirare il terreno di coltura e sciacquare le cellule 2 volte con soluzione salina tamponata con fosfato (PBS).
- Fissare le cellule con paraformaldeide al 4% per 15 minuti a temperatura ambiente (RT).
- Rimuovere il fissativo e sciacquare le cellule per 3 x 3 minuti con PBS.
- Permeabilizzare le cellule con PBS contenente lo 0,2% di Triton X-100 per 10 minuti a RT.
- Incubare le cellule permeabilizzate con una soluzione bloccante costituita da FBS al 10% in PBS per 20 minuti a RT.
- Colorare le cellule con anticorpo monoclonale anti-miosina (diluito a 1:200 in PBS) a 4 °C durante la notte.
- Lavare le cellule 3 volte con PBS sterile e incubarle con anticorpo secondario (Alexa Fluor 594 goat anti-rabbit MYO7A, diluito 1:500 in PBS) e falloidina marcata con fluoresceina (Alexa Fluor 488, per identificare la struttura cellulare) per 2 ore a RT.
- Sciacquare le cellule 3 volte con PBS per rimuovere gli anticorpi secondari.
- Aggiungere 1-2 gocce di mezzo di montaggio con DAPI sui vetrini, montare i vetrini coprioggetti e posizionarli sotto un microscopio confocale a scansione laser per catturare foto delle cellule.
5. Analisi statistica
- Eseguire l'analisi della varianza a due vie (ANOVA) seguita dai test post hoc di Tukey per analizzare le variazioni dei valori di grigio della miosina-VIIa e della falloidina nel tempo. Utilizzare il metodo di marcatura delle lettere per contrassegnare le differenze statistiche.
- Eseguire ulteriori ANOVA unidirezionali seguite dai test post-hoc di Tukey per confrontare il rapporto cellulare falloidina-positivo tra i campioni cellulari dal giorno 1 al giorno 6 e il rapporto cellulare miosina-VII-positivo negli stessi giorni.
Risultati
Seguendo questo protocollo, abbiamo seminato le cellule isolate. I semi primari di cellule ciliate cocleari sono stati considerati efficaci se le cellule non galleggiavano nel terreno di coltura e non si diffondevano entro 24 ore. Abbiamo determinato il numero di cellule ciliate dopo che hanno aderito e si sono diffuse in aggregati piatti sul fondo del piatto. Dopo 1 giorno, le cellule ciliate vive sono state strettamente aderenti al fondo della piastra di coltura e le cellule non aderenti sono state rimosse mediante risciacquo con PBS. Tipicamente, il numero di cellule è raddoppiato dopo 3 giorni di coltura (Figura 2).
L'immunofluorescenza (IF) ha rivelato l'espressione della miosina-VIIa e della falloidina fino a d6 (Figura 3A). Abbiamo osservato che il valore grigio della miosina-VIIa e il rapporto cellulare positivo sono diminuiti con il tempo, mentre il valore grigio della falloidina e il rapporto cellulare positivo sono rimasti gli stessi rispetto a quelli di d1 dopo la coltura (Figura 3B-D). Abbiamo usato una coltura organica come controllo positivo per verificare che le cellule positive alla miosina-VIIa fossero effettivamente cellule ciliate. La figura supplementare S1 mostra la colorazione in immunofluorescenza della miosina-VIIa (verde), della falloidina (verde) e del 4′6-diamidino-2-fenilindolo (DAPI, blu) nell'epitelio uditivo dopo 2 giorni di coltura.
Usando IF, abbiamo confermato che le cellule ottenute erano cellule ciliate. In particolare, abbiamo osservato che la maggior parte delle cellule in coltura mostrava una colorazione positiva per la proteina miosina-VIIa (rossa), marcatore uditivo delle cellule, mostrando anche un aspetto allungato al microscopio a fluorescenza (Figura 3A). Questi risultati hanno suggerito che le cellule coltivate erano principalmente cellule ciliate.
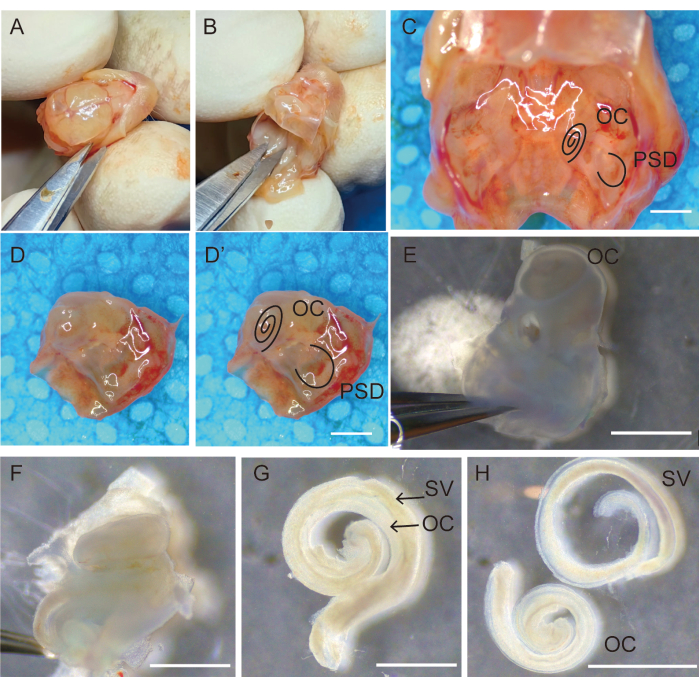
Figura 1: Dissezione e rimozione dell'osso temporale per la raccolta degli epiteli uditivi. (A) Decapitazione e apertura del cranio lungo la sutura sagittale; (B) rimozione del cervello. (C) Vista delle ossa temporali bilaterali situate nella base del cranio. Le ossa temporali destre (D) dopo aver rimosso le ossa e le tissure che circondano l'osso temporale (D') contrassegnate con OC e PSD. (E) Trasferimento delle ossa temporali in una soluzione salina bilanciata di Hank (HBSS) fresca, rimuovere la staffa e posizionarla con la finestra ovale rivolta verso l'alto. (F) Separare e rimuovere con cura il labirinto osseo della coclea dall'estremità basale a quella apicale. L'organo dell'epitelio sensoriale di Corti (G) aderiva alla stria vascolare, (H) separato dalla stria vascolare. Barre di scala = 1.000 μm (C-H). Abbreviazioni: OC = organo di Corti; PSD = canale semicircolare posteriore; SV = stria vascolare. Fare clic qui per visualizzare una versione più grande di questa figura.
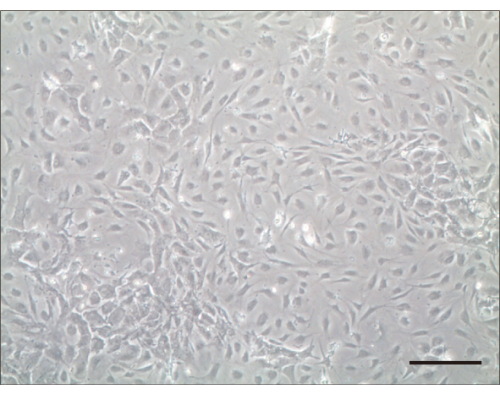
Figura 2: Cellule ciliate 4 giorni dopo la coltura. Esame microscopico leggero 4 giorni dopo la coltura. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
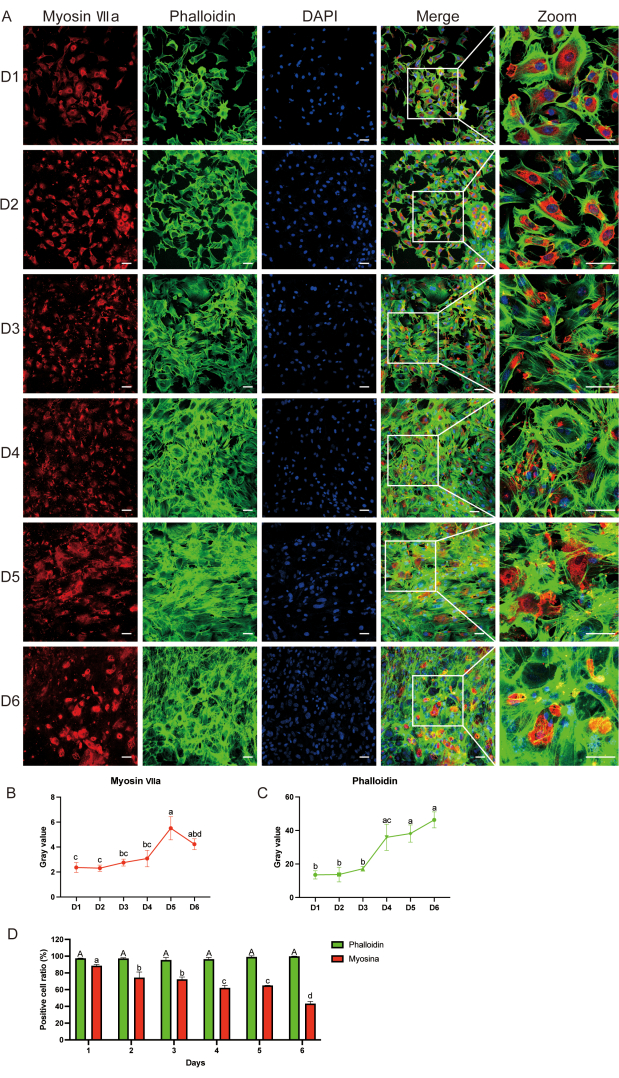
Figura 3: Rilevamento dei marcatori di superficie delle cellule ciliate mediante immunofluorescenza. (A) Colorazione in immunofluorescenza della miosina-VIIa (rosso), falloidina (verde) e DAPI (blu) dal giorno 1 al giorno 6 dopo la coltura cellulare. (B, C) Analisi del valore di grigio della miosina-VIIa e della falloidina; Le differenze statistiche sono indicate da lettere. (D) Confronto del rapporto cellulare falloidina-positivo tra campioni cellulari dal giorno 1 al giorno 6 e miosina-VII negli stessi giorni. Le lettere maiuscole rappresentano i risultati statistici per la falloidina, mentre le lettere minuscole rappresentano i risultati statistici per la miosina-VIIa. I dati sono presentati come media ± errore standard della media. N = 5; Barra graduata = 50 μm. L'analisi bidirezionale della varianza (ANOVA) seguita dal test post hoc di Tukey è stata eseguita per l'analisi del valore grigio della miosina-VIIa e della falloidina. L'ANOVA unidirezionale è stata eseguita per il confronto del rapporto tra le cellule positive alla falloidina e alla miosina-VII tra i campioni cellulari da d 1 a d 6. Lettere diverse indicano differenze statistiche nella colorazione della falloidina, mentre lettere minuscole indicano differenze statistiche nella colorazione della miosina-VIIa. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare S1: Rilevamento in immunofluorescenza di marcatori di superficie delle cellule ciliate in coltura organica. La colorazione in immunofluorescenza della miosina-VIIa (verde), della falloidina (verde) e della DAPI (blu) è stata eseguita su d 2 della coltura organica. Barra della scala = 10 μm. Abbreviazioni: IHC, cellula ciliata interna; OHC, cellula ciliata esterna; DAPI, 4′,6-diamidino-2-fenilindolo. Fare clic qui per scaricare il file.
Figura supplementare S2: Rilevamento in immunofluorescenza di marcatori di superficie in cellule ciliate di passaggio. (A) La colorazione in immunofluorescenza della miosina-VIIa (rosso), della falloidina (verde) e della DAPI (blu) è stata eseguita su colture organiche nei passaggi 2 e 3. (B) Confronto del numero di cellule positive alla falloidina, cellule positive alla miosina VIIa e cellule totali dalle cellule primarie al passaggio 3. N = 3; Barra graduata = 100 μm. I dati sono mostrati come media ± deviazione standard. Fare clic qui per scaricare il file.
Discussione
Rispetto alla linea cellulare HEI-OC1, le colture primarie di cellule ciliate hanno replicato in modo più accurato lo stato fisiologico delle cellule in vivo. Pertanto, il metodo di coltura primaria uditiva stabilito isolando cellule viventi dagli organi cocleari e coltivandole immediatamente sembra essere uno strumento prezioso per una ricerca approfondita sui sistemi uditivi. Alcune tecniche sono fondamentali per una cultura di successo. In primo luogo, ridurre al minimo la durata della separazione dell'organo di Corti dall'osso temporale aumenta la probabilità di un'attività sostenuta delle cellule ciliate. Di conseguenza, è imperativo per i ricercatori ridurre al minimo l'intervallo di tempo tra la dissezione e l'immersione degli organi nella PBS. Sulla base delle nostre osservazioni sperimentali, una durata di circa 2-3 ore è sufficiente per sezionare 10 topi e ottenere le 20 orecchie interne alla volta. Durante il processo di disaggregazione enzimatica, si consiglia di limitare la durata a 12 minuti e trasferire gli organi cocleari nelle pipette dopo un periodo di incubazione di 8 minuti. Gli organi sono stati osservati al microscopio dopo circa 10 cicli di pipettaggio e la disaggregazione enzimatica è stata interrotta quando quasi tutte le cellule si erano staccate dalla membrana basilare. In caso contrario, gli organi sono stati restituiti all'incubatrice per altri 4 minuti. Anche la scelta dell'antibiotico è importante. Si consiglia di utilizzare 10 mg/mL di penicillina/streptomicina per prevenire potenziali problemi di contaminazione perché alcuni antibiotici aminoglicosidici possono essere ototossici e portare alla morte delle cellule ciliate.
Sebbene le miosine di classe VII siano ampiamente espresse nei tessuti animali, la miosina-VIIa è espressa solo nelle cellule ciliate degli organi vestibolari e cocleari dell'orecchio interno. Le miosine di classe VIIa svolgono un ruolo importante nel mantenimento della struttura delle stereociglia, in quanto aiutano a interconnettere le stereociglia nella regione del collegamento della caviglia nelle cellule ciliate11. A seguito di un aumento della durata della coltura cellulare primaria e del numero di passaggi cellulari, anche la degradazione della miosina-VIIa è aumentata nel tempo, mentre la falloidina è rimasta stabile, indicando che la funzione delle cellule uditive è diminuita con il tempo. Il principale limite di questo protocollo è che le cellule uditive possono essere utilizzate solo entro 6-7 giorni e impiegano più tempo a crescere rispetto alle cellule HEI-OC112. Inoltre, è inevitabile che le cellule primarie alla fine senescono e muoiono, mostrando un potenziale di crescita limitato. Inoltre, i tempi e i costi economici dell'isolamento e della coltura delle cellule ciliate sono spesso elevati e richiedono una vasta esperienza. L'organo di Corti contiene una varietà di cellule neurosensoriali, tra cui i capelli interni, i peli esterni e le cellule di supporto. Questo protocollo ha introdotto un metodo per separare e coltivare queste cellule in vitro. Le cellule primarie possono essere distinte tra capelli e cellule di supporto colorando per la miosina-VIIa e Sox2, rispettivamente13,14. Le cellule ciliate esterne e interne svolgono funzioni diverse. Le cellule ciliate esterne alterano rapidamente la loro lunghezza e rigidità in risposta ai cambiamenti nel potenziale di membrana e vengono trasdotte in cellule ciliate interne. La prestina è una proteina motoria delle cellule ciliate esterne, mentre Slc17a8 (vGlut3) è specificamente espressa nelle IHC e può essere utilizzata per distinguere le cellule ciliate interne in vitro15,16,17,18.
Rispetto alle colture organiche, la morfologia delle cellule ciliate cambia significativamente nelle colture primarie di cellule ciliate, determinando diverse morfologie e funzioni di meccanotrasduzione. Le colture organiche sono colture cellulari primarie tridimensionali che mostrano un pattern cellulare stereotipato, polarità, formazione di fasci di capelli e connessioni neurali all'interno degli organi di Corti. Al contrario, le cellule primarie HEI-OC1 hanno una tipica forma poligonale e crescono piatte attraverso l'aderenza statica in un ambiente di coltura bidimensionale19. Le colture organiche e le cellule primarie sono isolate direttamente dai tessuti e presentano una morfologia cellulare normale e importanti marcatori correlati alla funzione. Tuttavia, a differenza delle cellule HEI-OC1, che sono generalmente altamente proliferate, più facili da coltivare e trasfettare e possono essere mantenute per decenni, queste cellule hanno una durata di vita limitata e una capacità di espansione limitata.
Le cellule primarie presentano molti vantaggi nella coltura cellulare. Poiché le cellule primarie sono ottenute dai tessuti del corpo e coltivate in condizioni di crescita ottimali, imitano da vicino l'ambiente tissutale in vivo . L'uso di cellule primarie evita molte obiezioni etiche sollevate sulla sperimentazione animale e fornisce risultati più rilevanti rispetto alle linee cellulari. Le cellule primarie preselezionate sono modelli adeguati che rappresentano fedelmente la segnalazione molecolare in vivo. Le cellule di donatori diversi rispondono in modo diverso alle citochine pro-infiammatorie. I costi dell'isolamento e della coltura sono spesso elevati, anche se sono meno costosi di quelli dei modelli animali. I materiali e gli animali utilizzati nella coltura primaria di cellule ciliate qui descritta erano semplici, il loro costo era relativamente basso e il sistema era facile da usare. Se non vengono mantenute condizioni di coltura ottimali, le caratteristiche delle cellule primarie possono cambiare con passaggi successivi. Con l'aumentare del numero di passaggi, anche lo stato della cellula si è indebolito (Figura supplementare S2). Poiché sono state derivate direttamente dai tessuti corporei nativi senza modifiche, le cellule ciliate uditive ottenute hanno imitato da vicino il loro stato e la loro fisiologia in vivo. Pertanto, le cellule ciliate primarie forniscono un eccellente sistema modello per lo studio della fisiologia e della biochimica delle cellule ciliate, compreso il metabolismo cellulare e la tossicità dei farmaci. Sebbene le cellule primarie possano essere mantenute solo per pochi giorni in vitro, possono essere immortalizzate e divise indefinitamente dopo la trasformazione genetica per ottenere linee cellulari secondarie.
In conclusione, l'attuale protocollo descrive l'isolamento delle cellule ciliate uditive dall'osso temporale utilizzando la microdissezione e la disaggregazione enzimatica. L'intero protocollo ha richiesto circa 3 ore, dalla dissezione del topo alla placcatura cellulare. Le cellule coltivate sono state mantenute ad alta purezza e sono rimaste sane per 6-7 giorni. Nonostante i limiti intrinseci delle colture primarie di cellule ciliate, che sono limitate a soli due passaggi, questo protocollo ha impiegato metodologie e materiali semplici, presentando così una nuova strada per condurre ricerche altamente efficienti sulle cellule ciliate cocleari.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (NFSC 82101224 to YG)
Materiali
| Name | Company | Catalog Number | Comments |
| 100 mm BioLite cell culture dish | Thermo Fisher Scientific | 130182 | using for culture |
| 35 mm Nunc cell culture dish | Thermo Fisher Scientific | 150318 | using for culture |
| 6-well palate | Thermo Fisher Scientific | 310109005 | using for culture |
| 70 µm cell strainers | BD Company | 352350 | using for filter |
| Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | immunofluorescent staining |
| Anti-rabbit IgG Alexa Fluor 488 | Thermo Fisher Scientifc | A11008 | immunofluorescent staining |
| day 3-5 neonatal murine | provided by Xi'an Jiaotong University | ||
| Dulbecco’s Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | using for culture |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483020 | using for culture |
| Forceps | Dumont | 5# | using for dissection |
| Leica anatomy microscope | Germany | S9i | using for dissection |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | using for culture |
| Rabbit plyclonal to Myosin VIIa | Abcam company | ab92996 | immunofluorescent staining |
| Scissor | Belevor | 10cm/04.0524.10 | using for dissection |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | immunofluorescent staining |
| Trypsin | Thermo Fisher Scientific | 25200072 | using for culture |
Riferimenti
- Tani, T., Koike-Tani, M., Tran, M. T., Shribak, M., Levic, S. Postnatal structural development of mammalian Basilar Membrane provides anatomical basis for the maturation of tonotopic maps and frequency tuning. Sci Rep. 11 (1), 7581 (2021).
- Goutman, J. D., Elgoyhen, A. B., Gomez-Casati, M. E. Cochlear hair cells: The sound-sensing machines. FEBS Lett. 589 (22), 3354-3361 (2015).
- Joo, Y., et al. The Contribution of Ototoxic Medications to Hearing Loss Among Older Adults. J Gerontol A Biol Sci Med Sci. 75 (3), 561-566 (2020).
- Nieman, C. L., Oh, E. S. Hearing Loss. Ann Intern Med. 173 (11), ITC81-ITC96 (2020).
- Mao, H., Chen, Y. Noise-Induced Hearing Loss: Updates on Molecular Targets and Potential Interventions. Neural Plast. 2021, 4784385 (2021).
- Morioka, S., et al. Hearing vulnerability after noise exposure in a mouse model of reactive oxygen species overproduction. J Neurochem. 146 (4), 459-473 (2018).
- Liu, H., et al. Molecular and cytological profiling of biological aging of mouse cochlear inner and outer hair cells. Cell Rep. 39 (2), 110665 (2022).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic Culture of Neonatal Murine Inner Ear Explants. Front Cell Neurosci. 13, 170 (2019).
- Ding, D., et al. Cisplatin ototoxicity in rat cochlear organotypic cultures. Hear Res. 282 (1-2), 196-203 (2011).
- Abitbol, J., et al. Cisplatin-induced ototoxicity in organotypic cochlear cultures occurs independent of gap junctional intercellular communication. Cell Death Dis. 11 (5), 342 (2020).
- Li, S., et al. Myosin-VIIa is expressed in multiple isoforms and essential for tensioning the hair cell mechanotransduction complex. Nat Commun. 11 (1), 2066 (2020).
- Kalinec, G. M., Park, C., Thein, P., Kalinec, F. Working with auditory HEI-OC1 cells. J Vis Exp. (115), (2016).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. J Vis Exp. (107), (2016).
- Xu, J., et al. Identification of mouse cochlear progenitors that develop hair and supporting cells in the organ of Corti. Nat Commun. 8, 15046 (2017).
- Zheng, J., et al. Prestin is the motor protein of cochlear outer hair cells. Nature. 405 (6783), 149-155 (2000).
- Ruel, J., et al. Impairment of SLC17A8 encoding vesicular glutamate transporter-3, VGLUT3, underlies nonsyndromic deafness DFNA25 and inner hair cell dysfunction in null mice. Am J Hum Genet. 83 (2), 278-292 (2008).
- Seal, R. P., et al. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).
- Luo, Z., et al. Three distinct Atoh1 enhancers cooperate for sound receptor hair cell development. Proc Natl Acad Sci U S A. 119 (32), e2119850119 (2022).
- Kalinec, G., Thein, P., Park, C., Kalinec, F. HEI-OC1 cells as a model for investigating drug cytotoxicity. Hear Res. 335, 105-117 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon