Method Article
新生小鼠原代耳蜗毛细胞的分离和培养
摘要
在此,我们提出了从小鼠中分离和培养原代耳蜗毛细胞的详细方案。最初,在显微镜下从新生儿(3-5天龄)鼠耳蜗中解剖Corti的器官。随后,将细胞酶消化成单细胞悬液,并在培养数天后使用免疫荧光进行鉴定。
摘要
耳蜗毛细胞是听觉系统的感觉受体。这些细胞位于内耳骨迷宫内负责听觉的感觉器官Corti器官中。耳蜗毛细胞由两种解剖学和功能上不同的类型组成:外毛细胞和内毛细胞。其中任何一个的损坏都会导致听力损失。值得注意的是,由于内部毛细胞无法再生,并且对它们的损害是永久性的。因此,原代毛细胞的 体外 培养对于研究耳蜗毛细胞的保护或再生作用是必不可少的。本研究旨在发现一种分离和培养小鼠毛细胞的方法。
手动去除耳蜗侧壁后,在显微镜下从耳蜗中仔细解剖听觉上皮,在由0.25%胰蛋白酶-EDTA组成的混合物中在37°C下孵育10分钟,并使用200μL移液器吸头轻轻悬浮在培养基中。将细胞悬液通过细胞过滤器,离心滤液,并在 24 孔板中培养细胞。根据毛细胞表达参与运动张力的机械转导复合物肌球蛋白-VIIa的能力以及通过使用鬼笔环肽选择性标记 F-肌动蛋白来鉴定毛细胞。细胞在培养 4 天后达到 >90% 的汇合度。该方法可以增强我们对体外培养毛细胞生物学特性的理解,并证明耳蜗毛细胞培养的效率,为进一步的听觉研究奠定了坚实的方法学基础。
引言
耳蜗毛细胞在声音检测和信号传递到听觉神经中起着重要作用。毛细胞是机械细胞,在脊椎动物中充当主要感觉受体并将声音振动转化为电信号。哺乳动物内耳的感觉上皮包括单排内毛细胞和三排外毛细胞。在不同的基本膜区域,毛细胞感知不同频率(20 至 2,000 Hz)的声音1。外毛细胞的功能是一个主动的机械放大过程,有助于微调哺乳动物的内耳,赋予对声音的高灵敏度。内毛细胞负责检测声音。分级去极化后,声学信息通过听觉神经纤维2传递到大脑。
听力损失可能是由遗传缺陷、衰老、噪音创伤或过度使用耳毒性药物引起的,这些都是世界范围内的主要健康问题 3,4。听力损失主要由毛细胞不可逆的损伤引起5.关于噪声引起的听力损失,尽管研究人员已就其病因的几个细节达成共识,但缺乏对众多潜在机制的全面了解。外毛细胞特别容易受到声学过度暴露的影响6.机械敏感的耳蜗毛细胞与年龄相关的听力损失有关;然而,毛细胞变性的分子和细胞机制仍然未知。分子过程的几种变化导致毛细胞老化、氧化应激、DNA 损伤反应、自噬以及与毛细胞特化相关的基因表达和转录失调7.
由于内耳被包裹在颞骨中,深入身体最坚硬的骨骼,因此在实验上无法进入,这对研究毛细胞修复和再生机制提出了挑战。因此,建立用于研究毛细胞功能的体外培养物已成为研究内耳再生和损伤机制的理想方法。制备耳蜗器官型培养物的程序已在早期研究中描述8,9,10。世界各地的研究人员采用了各种人工耳蜗显微切割和表面处理技术。尽管存在持续的挑战,但各种原代毛细胞培养系统已成功在体外建立。耳蜗器官培养物包含多种细胞类型,包括毛细胞、Deiters 细胞、Hensen 细胞、支柱细胞和听觉神经纤维。深入了解损伤后毛细胞在细胞和分子水平上的变化将有助于开发更强大的研究工具。本研究旨在证明从新生小鼠中分离耳蜗器官并酶促分离丰富的毛细胞用于体外研究的步骤。使用免疫荧光染色确认培养细胞的性质。
研究方案
所有动物实验均获得习交通大学动物使用与护理委员会批准(编号:2021-847)。
1.灭菌和材料准备
- 使用高温高压蒸汽消毒对解剖工具进行灭菌,并在50°C培养箱中干燥过夜。
- 制备100mL含有10%胎牛血清(FBS)和10mg / mL青霉素/链霉素的培养基(将10mL FBS和10μL青霉素储备溶液加入90mL的Dulbecco改良Eagle培养基(EMEM)中)并储存在4°C。
2.颞骨的解剖和切除以收集听觉上皮
- 通过在冰上斩首对总共10只新生小鼠(年龄在P3和P5之间)实施安乐死。如果需要,使用其他合乎道德的方法。
- 将头部固定到位,使用微操作剪刀沿矢状缝合线打开头皮,并用手指将头皮分开并双侧固定,如图 1A所示。
- 使用小型骨膜升降机取出大脑,并将基底颅骨一分为二。用剪刀剪开头盖骨,向前翻转以打开头骨;用剪刀尖刮开大脑,露出头骨底部。
- 观察颅骨底部的双侧颞骨(图1C)。用剪刀沿中线切开颅骨底部,刮掉皮肤,去除任何不必要的骨头(图1D,D')。
- 将颞骨保留并转移到含有新鲜Hank平衡盐溶液(HBSS)的35mm无菌培养皿中(图1E)。
- 使用两个#5尖镊子从颞骨的岩部去除大疱和周围组织(图1E)。
注意:在这个阶段,小鼠颞骨中的骨迷路不会完全钙化,并且很容易使用镊子解剖。 - 一只手握住镊子固定颞骨的半圆形部分,另一只手将镊子的下脚插入圆窗龛,将耳蜗的外侧骨与鳞状前庭分开。小心地去除颞骨的岩部,不要接触OC上皮。随后,小心地分离并移除耳蜗的骨迷宫,从基底端到顶端(图1F)。
- 使用#5尖镊子小心地将Corti感觉上皮器官与modiolus进行微分离(图1G)。
- 握住螺旋韧带,用微操作镊子小心地将其与血管纹分离,并使用200μL移液管将干净的听觉上皮转移到含有HBSS的3mm无菌培养皿中(图1H)。
- 从每只动物中收集20个标本,并将它们快速转移到含有HBSS的100mm无菌培养皿中,用于下一步制备步骤(图1)。
3. 酶解聚获得听觉毛细胞
- 将听觉上皮转移到含有0.25%胰蛋白酶的10mL新鲜DMEM中,并在37°C孵育12分钟。
- 使用200μL移液器吸头,在手术显微镜下轻轻地将毛细胞与基底层和其他细胞分开。
- 再加入 10 mL 培养基以抑制分解。
- 通过70μm过滤器过滤培养基中的悬浮细胞,将滤液收集在干净的50mL管中,并以300× g 离心5分钟。
- 使用 1,000 μL 移液器吸头轻轻上下移液,将毛细胞重悬于至少 5 mL 培养基中。避免引入气泡。
- 提前将盖玻片放在六孔板的底部。计数细胞,并在六孔板中以 106 个细胞/mL 的密度培养它们。
- 在37°C和5%CO2下,在2mL DMEM(含有10%FBS,100单位/ mL青霉素和100μg/ mL链霉素)中培养贴壁细胞。每天更换培养基。
注意:应该提到的是,使用此协议不会导致获得纯毛细胞。基于这种原代细胞培养方法,我们建议使用 d2 或 d3 细胞进行进一步研究,因为毛细胞可能约占培养细胞的 70% 并且处于良好状态。
4.免疫荧光染色
- 从d1到d6收获培养的细胞(每天一个孔)。吸出培养基并用磷酸盐缓冲盐水 (PBS) 冲洗细胞 2 次。
- 在室温(RT)下用4%多聚甲醛固定细胞15分钟。
- 取出固定剂并用PBS冲洗细胞3 x 3分钟。
- 在室温下用含有0.2%Triton X-100的PBS透化细胞10分钟。
- 在室温下,将透化的细胞与含有10%FBS的PBS封闭溶液孵育20分钟。
- 用抗肌球蛋白单克隆抗体(在PBS中以1:200稀释)在4°C下染色细胞过夜。
- 用无菌 PBS 洗涤细胞 3 次,并用二抗(Alexa Fluor 594 山羊抗兔 MYO7A,在 PBS 中以 1:500 稀释)和荧光素标记的鬼笔环肽(Alexa Fluor 488,以鉴定细胞结构)在室温下孵育 2 小时。
- 用 PBS 冲洗细胞 3 次以去除二抗。
- 在载玻片上加入1-2滴含有DAPI的封固剂,安装盖玻片,并将它们置于激光扫描共聚焦显微镜下以捕获细胞的照片。
5. 统计分析
- 进行双向方差分析 (ANOVA),然后进行 Tukey 事后检验,以分析肌球蛋白-VIIa 和鬼笔环肽灰度值随时间的变化。使用字母标记方法标记统计差异。
- 执行额外的单因素方差分析,然后进行 Tukey 的事后检验,以比较第 1 天至第 6 天细胞样本之间的鬼笔环肽阳性细胞比率和同一天的肌球蛋白-VII 阳性细胞比率。
结果
按照该协议,我们接种了分离的细胞。如果原代耳蜗毛细胞种子没有漂浮在培养基中并在 24 小时内扩散,则认为这些细胞是成功的。我们确定了毛细胞粘附并扩散成培养皿底部的扁平聚集体后的数量。1天后,将活毛细胞紧紧粘附在培养皿底部,并用PBS冲洗除去非贴壁细胞。通常,培养3天后细胞数量增加一倍(图2)。
免疫荧光(IF)显示肌球蛋白-VIIa和鬼笔环肽的表达直到d6(图3A)。我们观察到肌球蛋白-VIIa灰度值和阳性细胞比率随时间推移而降低,而鬼笔环肽灰度值和阳性细胞比率与培养后d1时保持不变(图3B-D)。我们使用有机培养物作为阳性对照来验证肌球蛋白-VIIa阳性细胞确实是毛细胞。补充图 S1 显示了培养 2 天后听觉上皮细胞中肌球蛋白-VIIa(绿色)、鬼笔环肽(绿色)和 4′6-二脒基-2-苯基吲哚(DAPI,蓝色)的免疫荧光染色。
使用IF,我们确认获得的细胞是毛细胞。特别是,我们观察到大多数培养的细胞对听觉细胞标志肌球蛋白-VIIa(红色)蛋白的染色呈阳性,在荧光显微镜下也表现出细长的外观(图3A)。这些结果表明,培养的细胞主要是毛细胞。
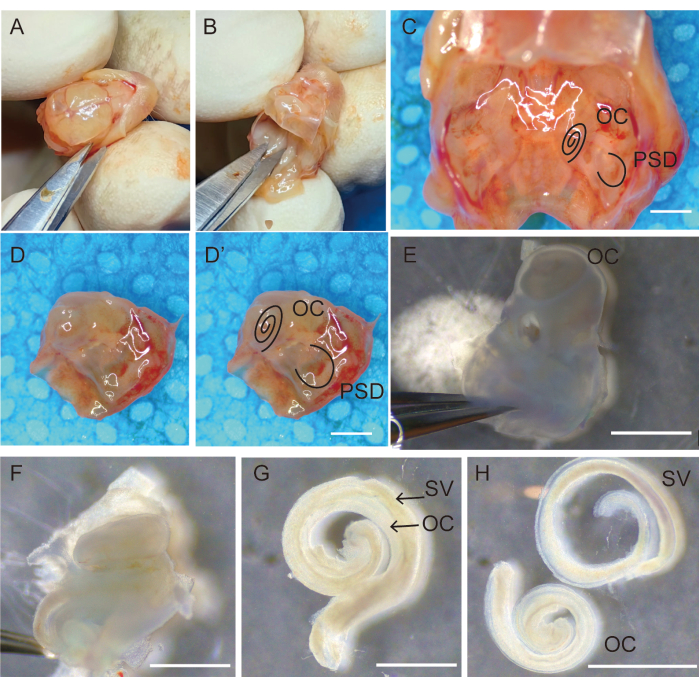
图 1:用于收集听觉上皮的颞骨解剖和切除。 (A)沿矢状缝合线斩首并打开颅骨;(二)切除脑。(C) 位于颅底的双侧颞骨视图。去除颞骨周围的骨头和颞骨周围的颞骨 (D') 后,右侧颞骨 (D) 标有 OC 和 PSD。(E) 将颞骨转移到新鲜的汉克平衡盐溶液 (HBSS) 中,去除镫骨并将椭圆形窗口朝上放置。(F) 小心地分离并移除耳蜗的骨迷路,从基底到顶端。Corti感觉上皮器官(G)粘附在血管纹上,(H)与血管纹分离。比例尺 = 1,000 μm (C-H)。缩写:OC = Corti 器官;PSD = 后半规管;SV = 血管纹。请点击这里查看此图的较大版本.
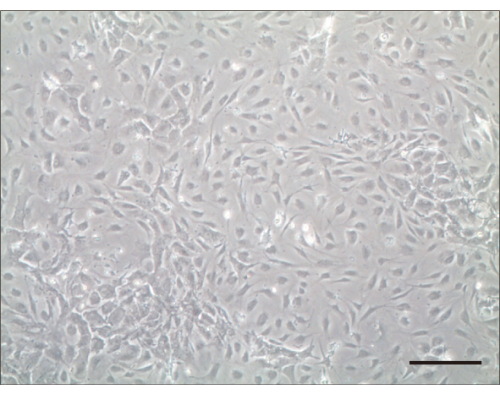
图 2:培养后 4 天的毛细胞。 培养后4天进行光学显微镜检查。比例尺 = 100 μm。 请点击这里查看此图的较大版本.
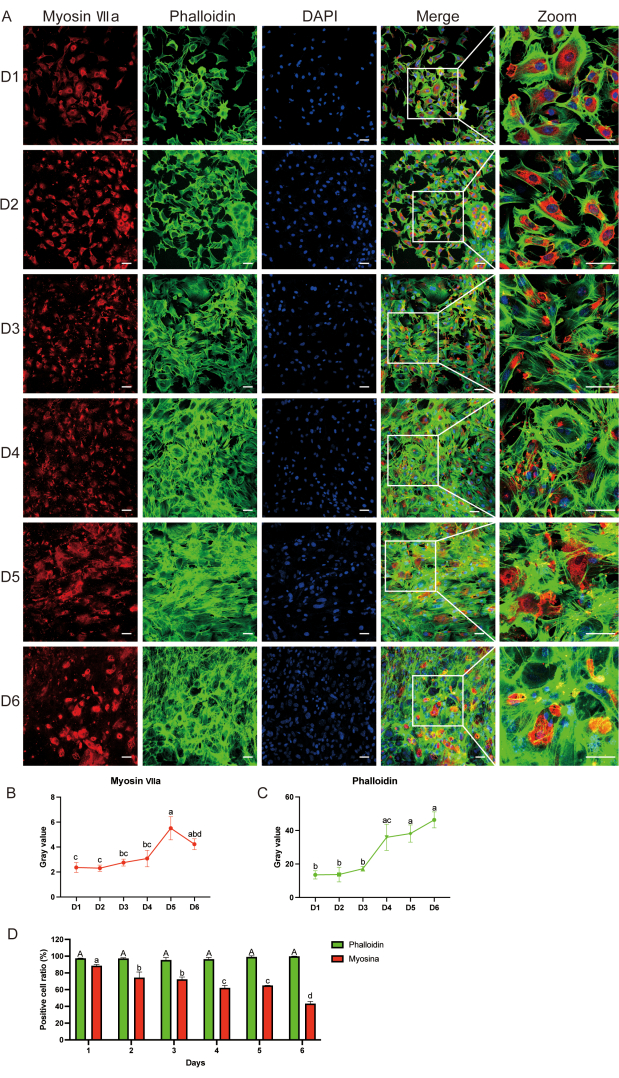
图 3:使用免疫荧光检测毛细胞表面标志 物。 (A) 细胞培养后第 1 天至第 6 天的肌球蛋白-VIIa(红色)、鬼笔环肽(绿色)和 DAPI(蓝色)免疫荧光染色。(乙,丙)肌球蛋白-VIIa和鬼笔环肽的灰度值分析;统计差异用字母表示。(D) 第 1 天至第 6 天细胞样本与同一天肌球蛋白 VII 之间鬼笔环肽阳性细胞比率的比较。大写字母表示鬼笔环肽的统计结果,而小写字母表示肌球蛋白-VIIa 的统计结果。数据表示为均值的平均值±标准误。N = 5;比例尺 = 50 μm。对肌球蛋白-VIIa和鬼笔环肽进行双因素方差分析(ANOVA),然后进行Tukey事后检验。进行单因素方差分析,比较第 1 天至第 6 天细胞样品之间的鬼笔环肽和肌球蛋白-VII 阳性细胞比率。不同的字母表示鬼笔环肽染色的统计学差异,而小写字母表示肌球蛋白-VIIa染色的统计学差异。 请点击这里查看此图的较大版本.
补充图S1:有机培养物中毛细胞表面标志物的免疫荧光检测。 对有机培养物的第 2 天进行肌球蛋白-VIIa(绿色)、鬼笔环肽(绿色)和 DAPI(蓝色)的免疫荧光染色。比例尺 = 10 μm。缩写:IHC,内毛细胞;OHC, 外毛细胞;DAPI,4′,6-二脒基-2-苯基吲哚。 请点击这里下载此文件。
补充图S2:传代毛细胞表面标志物的免疫荧光检测。 (A) 在第 2 代和第 3 代对有机培养物进行肌球蛋白-VIIa(红色)、鬼笔环肽(绿色)和 DAPI(蓝色)的免疫荧光染色。(B) 鬼笔环肽阳性细胞数、肌球蛋白-VIIa 阳性细胞数和原代细胞数至第 3 代传代细胞总数的比较。N = 3;比例尺 = 100 μm。数据显示为平均值±标准差。 请点击这里下载此文件。
讨论
与HEI-OC1细胞系相比,毛细胞的原代培养更准确地复制了体内细胞的生理状态。因此,通过将活细胞从耳蜗器官中分离出来并立即培养它们而建立的听觉原代培养方法似乎是广泛研究听觉系统的宝贵工具。某些技术对于成功的文化至关重要。首先,最小化Corti器官与颞骨分离的持续时间可增强毛细胞持续活动的可能性。因此,研究人员必须尽量减少器官解剖和浸入PBS之间的时间间隔。根据我们的实验观察,大约2-3小时的持续时间足以解剖10只小鼠并一次获得20只内耳。在酶解聚过程中,建议将持续时间限制在12分钟,并在孵育8分钟后将耳蜗器官转移到移液器中。大约10个移液周期后,在显微镜下观察器官,当几乎所有细胞都从基底膜上分离时,酶解聚停止。否则,将器官送回培养箱中再放置4分钟。抗生素的选择也很重要。我们建议使用 10 mg/mL 青霉素/链霉素来防止潜在的污染问题,因为一些氨基糖苷类抗生素可能具有耳毒性并导致毛细胞死亡。
虽然VII类肌球蛋白在动物组织中广泛表达,但肌球蛋白-VIIa仅在内耳前庭和耳蜗器官的毛细胞中表达。VIIa 类肌球蛋白在维持立体纤毛结构中起着重要作用,因为它们有助于连接毛细胞中踝关节连接区域的立体纤毛11。随着原代细胞培养时间和细胞传代次数的增加,肌球蛋白-VIIa的降解也随时间增加,而鬼笔环肽保持稳定,表明听觉细胞的功能随时间而下降。该协议的主要局限性是听觉细胞只能在 6-7 天内使用,并且比 HEI-OC1 细胞12 生长需要更长的时间。此外,原代细胞最终衰老和死亡是不可避免的,表现出有限的生长潜力。此外,毛细胞分离和培养的时间和经济成本通常很高,需要广泛的专业知识。Corti 的器官包含多种神经感觉细胞,包括内毛、外毛和支持细胞。该协议介绍了一种在体外分离和培养这些细胞的方法。原代细胞可以通过肌球蛋白-VIIa 和 Sox2 染色来区分毛发和支持细胞,分别为13,14。外毛细胞和内毛细胞执行不同的功能。外毛细胞响应膜电位的变化迅速改变其长度和刚度,并被转导到内毛细胞中。Prestin 是外毛细胞的运动蛋白,而 Slc17a8 (vGlut3) 在 IHC 中特异性表达,可用于体外区分内毛细胞15,16,17,18。
与有机培养物相比,原代毛细胞培养物中毛细胞的形态变化显著,导致形态和机械转导功能不同。有机培养物是三维原代细胞培养物,在Corti器官内表现出刻板的细胞模式、极性、毛束形成和神经连接。相比之下,原代 HEI-OC1 细胞具有典型的多边形形状,并通过在二维培养环境中静态粘附而平坦生长19。有机培养物和原代细胞直接从组织中分离出来,表现出正常的细胞形态和重要的功能相关标志物。然而,与HEI-OC1细胞不同,HEI-OC1细胞通常具有高度增殖性,更容易培养和转染,并且可以维持数十年,这些细胞的寿命有限,扩增能力有限。
原代细胞在细胞培养中具有许多优势。由于原代细胞是从身体组织中获得并在最佳生长条件下培养的,因此它们与 体内 组织环境非常相似。使用原代细胞避免了许多关于动物实验的伦理异议,并提供比细胞系更相关的结果。预选的原代细胞是充分的模型,可以密切代表 体内的分子信号转导。来自不同供体的细胞对促炎细胞因子的反应不同。分离和培养的成本通常很高,尽管它们比动物模型便宜。这里描述的原代毛细胞培养中使用的材料和动物简单,成本相对较低,并且系统易于操作。如果不能保持最佳培养条件,原代细胞的特性可能会随着随后的传代而改变。随着传代次数的增加,细胞状态也减弱(补充图S2)。由于它们直接来源于天然身体组织,未经修饰,因此获得的听觉毛细胞与它们的体内状态和生理机能非常相似。因此,原代毛细胞为研究毛细胞的生理生化,包括细胞代谢和药物毒性提供了极好的模型系统。虽然原代细胞在体外只能维持几天,但它们可以在基因转化后永生化并无限分裂,以获得次生细胞系。
总之,目前的方案描述了使用显微切割和酶分解从颞骨中分离听觉毛细胞。从小鼠解剖到细胞铺板,整个方案大约需要3小时。培养的细胞保持高纯度,并保持健康 6-7 天。尽管原代毛细胞培养物的固有局限性仅限于两次传代,但该协议采用了简单的方法和材料,从而为对耳蜗毛细胞进行高效研究提供了新的途径。
披露声明
作者没有要披露的利益冲突。
致谢
这项工作得到了中国国家自然科学基金(NFSC 82101224 to YG)的支持
材料
| Name | Company | Catalog Number | Comments |
| 100 mm BioLite cell culture dish | Thermo Fisher Scientific | 130182 | using for culture |
| 35 mm Nunc cell culture dish | Thermo Fisher Scientific | 150318 | using for culture |
| 6-well palate | Thermo Fisher Scientific | 310109005 | using for culture |
| 70 µm cell strainers | BD Company | 352350 | using for filter |
| Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | immunofluorescent staining |
| Anti-rabbit IgG Alexa Fluor 488 | Thermo Fisher Scientifc | A11008 | immunofluorescent staining |
| day 3-5 neonatal murine | provided by Xi'an Jiaotong University | ||
| Dulbecco’s Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | using for culture |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483020 | using for culture |
| Forceps | Dumont | 5# | using for dissection |
| Leica anatomy microscope | Germany | S9i | using for dissection |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | using for culture |
| Rabbit plyclonal to Myosin VIIa | Abcam company | ab92996 | immunofluorescent staining |
| Scissor | Belevor | 10cm/04.0524.10 | using for dissection |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | immunofluorescent staining |
| Trypsin | Thermo Fisher Scientific | 25200072 | using for culture |
参考文献
- Tani, T., Koike-Tani, M., Tran, M. T., Shribak, M., Levic, S. Postnatal structural development of mammalian Basilar Membrane provides anatomical basis for the maturation of tonotopic maps and frequency tuning. Sci Rep. 11 (1), 7581 (2021).
- Goutman, J. D., Elgoyhen, A. B., Gomez-Casati, M. E. Cochlear hair cells: The sound-sensing machines. FEBS Lett. 589 (22), 3354-3361 (2015).
- Joo, Y., et al. The Contribution of Ototoxic Medications to Hearing Loss Among Older Adults. J Gerontol A Biol Sci Med Sci. 75 (3), 561-566 (2020).
- Nieman, C. L., Oh, E. S. Hearing Loss. Ann Intern Med. 173 (11), ITC81-ITC96 (2020).
- Mao, H., Chen, Y. Noise-Induced Hearing Loss: Updates on Molecular Targets and Potential Interventions. Neural Plast. 2021, 4784385 (2021).
- Morioka, S., et al. Hearing vulnerability after noise exposure in a mouse model of reactive oxygen species overproduction. J Neurochem. 146 (4), 459-473 (2018).
- Liu, H., et al. Molecular and cytological profiling of biological aging of mouse cochlear inner and outer hair cells. Cell Rep. 39 (2), 110665 (2022).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic Culture of Neonatal Murine Inner Ear Explants. Front Cell Neurosci. 13, 170 (2019).
- Ding, D., et al. Cisplatin ototoxicity in rat cochlear organotypic cultures. Hear Res. 282 (1-2), 196-203 (2011).
- Abitbol, J., et al. Cisplatin-induced ototoxicity in organotypic cochlear cultures occurs independent of gap junctional intercellular communication. Cell Death Dis. 11 (5), 342 (2020).
- Li, S., et al. Myosin-VIIa is expressed in multiple isoforms and essential for tensioning the hair cell mechanotransduction complex. Nat Commun. 11 (1), 2066 (2020).
- Kalinec, G. M., Park, C., Thein, P., Kalinec, F. Working with auditory HEI-OC1 cells. J Vis Exp. (115), (2016).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. J Vis Exp. (107), (2016).
- Xu, J., et al. Identification of mouse cochlear progenitors that develop hair and supporting cells in the organ of Corti. Nat Commun. 8, 15046 (2017).
- Zheng, J., et al. Prestin is the motor protein of cochlear outer hair cells. Nature. 405 (6783), 149-155 (2000).
- Ruel, J., et al. Impairment of SLC17A8 encoding vesicular glutamate transporter-3, VGLUT3, underlies nonsyndromic deafness DFNA25 and inner hair cell dysfunction in null mice. Am J Hum Genet. 83 (2), 278-292 (2008).
- Seal, R. P., et al. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).
- Luo, Z., et al. Three distinct Atoh1 enhancers cooperate for sound receptor hair cell development. Proc Natl Acad Sci U S A. 119 (32), e2119850119 (2022).
- Kalinec, G., Thein, P., Park, C., Kalinec, F. HEI-OC1 cells as a model for investigating drug cytotoxicity. Hear Res. 335, 105-117 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。