Method Article
בידוד ותרבית של תאי שיער שבלול ראשוניים מעכברי יילודים
In This Article
Summary
במאמר זה אנו מציגים פרוטוקול מפורט לבידוד וטיפוח תאי שערת שבלול ראשוניים מעכברים. בתחילה, האיבר של קורטי נותח מהיילוד (בגיל 3-5 ימים) שבלול מורין תחת מיקרוסקופ. לאחר מכן, התאים עוכלו אנזימטית לתרחיף חד-תאי וזוהו באמצעות אימונופלואורסנציה לאחר מספר ימים בתרבית.
Abstract
תאי שיער שבלול הם קולטני החישה של מערכת השמע. תאים אלה ממוקמים באיבר של קורטי, איבר החישה האחראי על השמיעה, בתוך מבוך הגלוסקמה של האוזן הפנימית. תאי שיער של השבלול מורכבים משני סוגים שונים מבחינה אנטומית ותפקודית: תאי שיער חיצוניים ופנימיים. נזק לכל אחד מהם גורם לאובדן שמיעה. יש לציין כי תאי השערה הפנימיים אינם יכולים להתחדש, והנזק להם הוא קבוע. לפיכך, טיפוח במבחנה של תאי שיער ראשוניים הוא הכרחי לחקר ההשפעות המגינות או המתחדשות של תאי שיער שבלול. מחקר זה נועד לגלות שיטה לבידוד וטיפוח תאי שיער של עכברים.
לאחר הסרה ידנית של דופן השבלול הצידית, אפיתל השמע נותח בקפידה מהמודיולוס השבלול תחת מיקרוסקופ, הודגר בתערובת המורכבת מ-0.25% טריפסין-EDTA למשך 10 דקות ב-37°C, והושעה בעדינות בתווך תרבית באמצעות קצה פיפטה של 200 μL. תרחיף התאים הועבר דרך מסנן תאים, התסנין היה צנטריפוגי, והתאים גודלו בתרבית בלוחות של 24 בארות. תאי השערה זוהו על סמך יכולתם לבטא קומפלקס מכנוטרנסדוקציה, מיוזין-VIIa, המעורב במתחים מוטוריים, ובאמצעות תיוג סלקטיבי של F-אקטין באמצעות פאלואדין. התאים הגיעו למפגש של >90% לאחר 4D בתרבית. שיטה זו יכולה לשפר את הבנתנו את המאפיינים הביולוגיים של תאי שיער בתרבית חוץ גופית ולהדגים את היעילות של תרביות תאי שיער שבלול, ולבסס בסיס מתודולוגי מוצק למחקר שמיעתי נוסף.
Introduction
תאי שיער של השבלול ממלאים תפקידים חשובים בזיהוי צלילים ובהעברת אותות לעצב השמיעה. תאי שיער הם תאים מכניסטיים המתפקדים כקולטני חישה ראשוניים וממירים תנודות קול לאותות חשמליים בבעלי חוליות. אפיתל החישה של האוזן הפנימית של היונקים מורכב משורה אחת של תאי שיער פנימיים ושלוש שורות של תאי שיער חיצוניים. באזורים בסיסיים שונים בממברנה, תאי השערה קולטים צלילים בתדרים שונים (בין 20 ל-2,000 הרץ)1. תפקידם של תאי השערה החיצוניים הוא תהליך הגברה מכני פעיל המסייע לכוונן את האוזן הפנימית של היונקים, ומעניק רגישות גבוהה לקול. תאי השערה הפנימיים אחראים על זיהוי צלילים. לאחר דפולריזציה מדורגת, מידע אקוסטי מועבר למוח דרך סיבי עצב השמיעה2.
ליקוי שמיעה עלול להיגרם על ידי פגמים גנטיים, הזדקנות, טראומה לרעש או שימוש מופרז בתרופות אוטוטוקסיות, המהוות דאגה בריאותית מרכזית ברחבי העולם 3,4. ליקוי שמיעה נובע בעיקר מנזק בלתי הפיך לתאי השערה5. בנוגע לאובדן שמיעה הנגרם כתוצאה מרעש, למרות שהחוקרים הגיעו להסכמה על מספר פרטים של האטיולוגיה שלו, חסרה הבנה מקיפה של המנגנונים הבסיסיים הרבים. תאי השערה החיצוניים פגיעים במיוחד לחשיפת יתר אקוסטית6. תאי שיער שבלול רגישים למכנו מעורבים באובדן שמיעה הקשור לגיל; עם זאת, המנגנונים המולקולריים והתאיים העומדים בבסיס ניוון תאי השערה עדיין אינם ידועים. מספר שינויים בתהליכים המולקולריים מובילים להזדקנות תאי שיער, עקה חמצונית, תגובת נזק לדנ"א, אוטופגיה וחוסר ויסות של ביטוי ושעתוק גנים הקשורים להתמחות תאי השערה7.
מכיוון שהאוזן הפנימית עטופה בעצם הרקתית, עמוק בעצם הקשה ביותר בגוף, היא אינה נגישה באופן ניסיוני, מה שמציב אתגר לחקירת מנגנוני התיקון וההתחדשות של תאי השערה. לפיכך, הקמת תרביות חוץ גופיות לחקר תפקודם של תאי השערה הפכה לשיטה אידיאלית למחקר על מנגנוני ההתחדשות והפציעה של האוזן הפנימית. ההליכים להכנת תרביות אורגנוטיפיות שבלול תוארו במחקרים קודמים 8,9,10. חוקרים ברחבי העולם השתמשו בטכניקות שונות של מיקרודיסקציה של שבלול והכנת פני שטח. למרות האתגרים המתמשכים, מערכות שונות של תרביות תאי שיער ראשוניות הוקמו בהצלחה במבחנה. תרביות איברי שבלול מכילות סוגי תאים שונים, כולל תאי שיער, תאי דייטר, תאי הנסן, תאי עמוד וסיבי עצב שמיעתיים. הבנה מעמיקה של השינויים בתאי השערה ברמה התאית והמולקולרית לאחר פציעה תאפשר פיתוח כלי מחקר חזקים יותר. מחקר זה נועד להדגים את השלבים לבידוד איברי השבלול מעכברי יילודים ולניתוק אנזימטי של תאי השערה השופעים לצורך מחקרי מבחנה. אופי התאים בתרבית אושר באמצעות צביעה אימונופלואורסצנטית.
Protocol
כל הניסויים בבעלי חיים אושרו (מס' 2021-847) על ידי הוועדה לשימוש וטיפול בבעלי חיים באוניברסיטת שיאן ג'יאוטונג.
1. עיקור והכנת חומרים
- יש לעקר את כלי הדיסקציה באמצעות חיטוי קיטור בטמפרטורה גבוהה ובלחץ גבוה ולייבש אותם באינקובטור של 50 מעלות צלזיוס למשך הלילה.
- הכינו מראש 100 מ"ל של מדיום התרבית המכיל 10% נסיוב בקר עוברי (FBS) ו-10 מ"ג/מ"ל פניצילין/סטרפטומיצין (הוסיפו 10 מ"ל FBS ו-10 מיקרוליטר של תמיסת מלאי פניצילין ל-90 מ"ל של מדיום הנשר המעובד (EMEM) של דולבקו) ואחסנו בטמפרטורה של 4°C.
2. דיסקציה והסרה של העצם הטמפורלית לאיסוף אפיתל שמיעתי
- הרדימו מספר כולל של 10 עכברים שזה עתה נולדו (בגילאי P3 ו-P5) על ידי עריפת ראשים על קרח. השתמש במתודולוגיה חלופית שאושרה מבחינה אתית, במידת הצורך.
- החזיקו את הראש במקומו, פתחו את הקרקפת לאורך תפר הקשת באמצעות מספריים מיקרו-ניתוחיים, הפרידו וקיבעו את הקרקפת באופן דו-צדדי עם האצבעות, כפי שמוצג באיור 1A.
- הסר את המוח באמצעות מעלית פריאוסטאלית קטנה וחתך את גולגולת הבסיס. חותכים את הגולגולת במספריים והופכים קדימה כדי לפתוח את הגולגולת; השתמש בקצה המספריים כדי לגרד את המוח ולחשוף את בסיס הגולגולת.
- התבוננו בעצמות הרקתיות הדו-צדדיות בבסיס הגולגולת (איור 1C). השתמשו במספריים כדי לחתוך את בסיס הגולגולת לאורך קו האמצע, לגרד את העור ולהסיר עצם מיותרת (איור 1D,D').
- שמרו והעבירו את העצמות הרקתיות לצלחות פטרי סטריליות בקוטר 35 מ"מ המכילות תמיסת מלח מאוזנת טרייה של האנק (HBSS) (איור 1E).
- השתמשו בשני מלקחיים מחודדים #5 כדי להסיר את הבולה ואת הרקמה שמסביב מהחלק הפטרוסי של העצם הרקתית (איור 1E).
הערה: בשלב זה, המבוך הגרמי בעצם הרקתית של העכברים לא יסתייד לחלוטין וניתן יהיה לנתח אותו בקלות באמצעות מלקחיים. - החזיקו את המלקחיים ביד אחת כדי לקבע את החלק החצי עגול של העצם הרקתית ותקעו את כף הרגל התחתונה של המלקחיים בגומחת החלון העגולה ביד השנייה כדי להפריד את העצם הצידית של השבלול מפרוזדור הסקאלה. בזהירות להסיר את החלק petrous של העצם הטמפורלית מבלי לגעת אפיתל OC. לאחר מכן, הפרידו בזהירות והסרו את המבוך הגרמי של השבלול מהקצה הבסיסי לקצה האפי (איור 1F).
- בזהירות מיקרו לבודד את האיבר של אפיתל חושי קורטי מן modiolus באמצעות מלקחיים #5 מחודדים (איור 1G).
- אחזו ברצועה הספירלית, הפרידו אותה בזהירות מהסטריה וסקולריס בעזרת מלקחיים מיקרו-ניתוחיים, והעבירו את אפיתל השמע הנקי לצלחת תרבית סטרילית בקוטר 3 מ"מ המכילה HBSS באמצעות פיפטה של 200 מיקרוליטר (איור 1H).
- אספו 20 דגימות מכל חיה והעבירו אותן במהירות לצלחת פטרי סטרילית בקוטר 100 מ"מ שמכילה HBSS לשלב ההכנה הבא (איור 1).
3. דיסאגרגציה אנזימטית לקבלת תאי שיער שמיעתיים
- להעביר את אפיתל השמיעה ל 10 מ"ל של DMEM טרי המכיל 0.25% טריפסין לדגור ב 37 ° C במשך 12 דקות.
- בעזרת קצה פיפטה של 200 μL, מפרידים בעדינות את תאי השערה מהלמינה הבסיסית ותאים אחרים תחת מיקרוסקופ פעיל.
- הוסף עוד 10 מ"ל של מדיום תרבית כדי לעכב את disaggregation.
- מסננים את התאים המרחפים בתווך התרבית דרך מסנן 70 מיקרומטר, אוספים את התסנין בצינור נקי של 50 מ"ל וצנטריפוגות אותו ב 300 × גרם למשך 5 דקות.
- יש להשהות מחדש את תאי השערה בלפחות 5 מ"ל של מדיום תרבית על ידי הקפאתם בעדינות מעלה ומטה באמצעות קצה פיפטה של 1,000 מיקרוליטר. הימנעו מהחדרת בועות.
- מניחים מראש מכסה בתחתית צלחת בת שש בארות. ספרו את התאים ותרבו אותם בצפיפות של 106 תאים / מ"ל בלוחות של שש בארות.
- לגדל את התאים הדבקים ב 2 מ"ל של DMEM (המכיל 10% של FBS, 100 יחידות / מ"ל של פניצילין, ו 100 מיקרוגרם / מ"ל של סטרפטומיצין) ב 37 ° C ו 5% CO2. לשנות את המדיום התרבותי כל יום.
הערה: יש לציין כי שימוש בפרוטוקול זה אינו מביא לקבלת תאי שיער טהורים. בהתבסס על שיטת תרבית תאים ראשונית זו, אנו ממליצים להשתמש בתאי d2 או d3 למחקרים נוספים, שכן תאי שיער עשויים להוות כ-70% מהתאים בתרבית ולהיות במצב טוב.
4. צביעה אימונופלואורסצנטית
- קצרו את התאים בתרבית מ-d1 עד d6 (באר אחת ביום). שאפו את מדיום התרבית ושטפו תאים פי 2 במי מלח חוצצי פוספט (PBS).
- תקן תאים עם 4% paraformaldehyde במשך 15 דקות בטמפרטורת החדר (RT).
- הסר את התאים המקבעים ושטוף במשך 3 x 3 דקות עם PBS.
- חדרו את התאים עם PBS המכיל 0.2% Triton X-100 למשך 10 דקות ב-RT.
- לדגור את התאים permeabilized עם פתרון חסימה המורכב של 10% FBS ב PBS במשך 20 דקות ב RT.
- הכתימו את התאים בנוגדן חד-שבטי אנטי-מיוזין (מדולל ב-1:200 ב-PBS) ב-4°C למשך הלילה.
- שטפו את התאים 3x עם PBS סטרילי ודגרו עליהם עם נוגדן משני (Alexa Fluor 594 עז נגד ארנב MYO7A, מדולל 1:500 ב-PBS) ופלואידין עם תווית פלואורסצאין (Alexa Fluor 488, כדי לזהות את מבנה התא) במשך שעתיים ב-RT.
- שטפו את התאים 3x עם PBS כדי להסיר את הנוגדנים המשניים.
- הוסף 1-2 טיפות של אמצעי הרכבה עם DAPI על המגלשות, הרכיב את הכיסויים והנח אותם תחת מיקרוסקופ קונפוקלי סורק לייזר כדי לצלם תמונות של התאים.
5. ניתוח סטטיסטי
- בצע ניתוח דו-כיווני של שונות (ANOVA) ואחריו בדיקות פוסט-הוק של Tukey כדי לנתח את השינויים בערכים האפורים של מיוזין-VIIa ופאלואידין לאורך זמן. השתמש בשיטת סימון האותיות כדי לסמן הבדלים סטטיסטיים.
- בצע ANOVAs חד-כיווניים נוספים ולאחר מכן בדיקות פוסט-הוק של Tukey כדי להשוות את יחס התאים החיוביים לפאלואידין בין דגימות תאים מיום 1 ליום 6 לבין יחס התאים החיובי מיוזין-VII באותם ימים.
תוצאות
בעקבות פרוטוקול זה, זרענו את התאים המבודדים. זרעים ראשוניים של תאי שערת שבלול נחשבו מוצלחים אם התאים לא צפו בתווך התרבית והתפשטו תוך 24 שעות. קבענו את מספר תאי השערה לאחר שהם נדבקו והתפשטו לצברים שטוחים בתחתית המנה. לאחר יום אחד, תאי שיער חיים הודבקו בחוזקה לתחתית צלחת התרבית ותאים שאינם נדבקים הוסרו על ידי שטיפה עם PBS. בדרך כלל, מספר התאים הוכפל לאחר 3D של תרבית (איור 2).
אימונופלואורסנציה (IF) חשפה את הביטוי של מיוזין-VIIa ופאלואידין עד d6 (איור 3A). ראינו שהערך האפור של מיוזין-VIIa ויחס התאים החיובי ירדו עם הזמן, בעוד שהערך האפור של פלואדין ויחס התאים החיובי נשארו זהים בהשוואה לאלה שהיו ב-d1 אחרי תרבית (איור 3B-D). השתמשנו בתרבית אורגנית כבקרה חיובית כדי לוודא שהתאים החיוביים למיוזין-VIIa הם אכן תאי שיער. איור משלים S1 מראה את הצביעה האימונופלואורסצנטית של מיוזין-VIIa (ירוק), פאלואדין (ירוק) ו-4′6-diamidino-2-phenylindole (DAPI, כחול) באפיתל השמע לאחר יומיים של תרבית.
באמצעות IF, אישרנו כי התאים שהתקבלו היו תאי שיער. בפרט, ראינו שרוב התאים בתרבית הראו צביעה חיובית עבור סמן תאי השמיעה מיוזין-VIIa (חלבון אדום), שגם הציג מראה מוארך תחת מיקרוסקופ פלואורסצנטי (איור 3A). תוצאות אלה הצביעו על כך שתאי התרבית היו בעיקר תאי שיער.
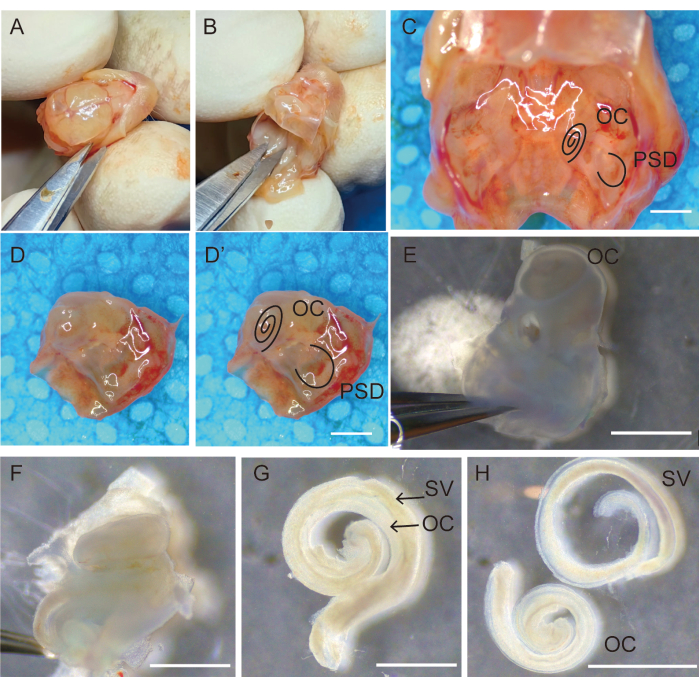
איור 1: דיסקציה והסרה של העצם הרקתית לצורך איסוף אפיתל שמיעתי. (A) עריפת ראשה ופתיחתה של הגולגולת לאורך התפר הסגיטלי; (B) הסרת המוח. (C) מבט על העצמות הרקתיות הדו-צדדיות הממוקמות בבסיס הגולגולת. העצמות הרקתיות הימניות (D) לאחר הסרת עצמות וסדקים סביב העצם הרקתית (D') המסומנים ב-OC וב-PSD. (E) העברת עצמות רקתיות לתמיסת מלח מאוזנת טרייה של האנק (HBSS), הסירו את הרצועות והניחו כשהחלון הסגלגל כלפי מעלה. (F) יש להפריד בזהירות ולהסיר את המבוך הגרמי של השבלול מהקצה הבסיסי לקצה האפיקאלי. האיבר של אפיתל החישה קורטי (G) נצמד לסטריה וסקולריס, (H) מופרד מהסטריה וסקולריס. פסי קנה מידה = 1,000 מיקרומטר (C-H). קיצורים: OC = איבר של קורטי; PSD = תעלה חצי עגולה אחורית; SV = stria vascularis. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
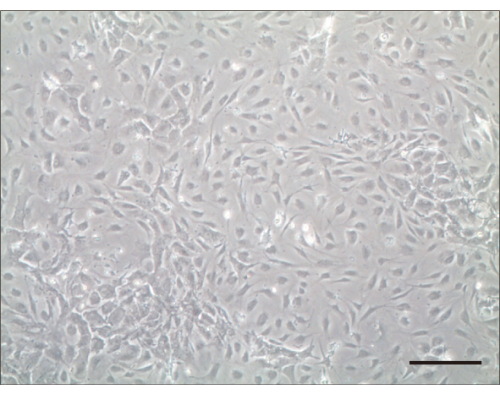
איור 2: תאי שיער 4 ימים לאחר התרבית. בדיקה מיקרוסקופית קלה 4 ימים לאחר התרבית. סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
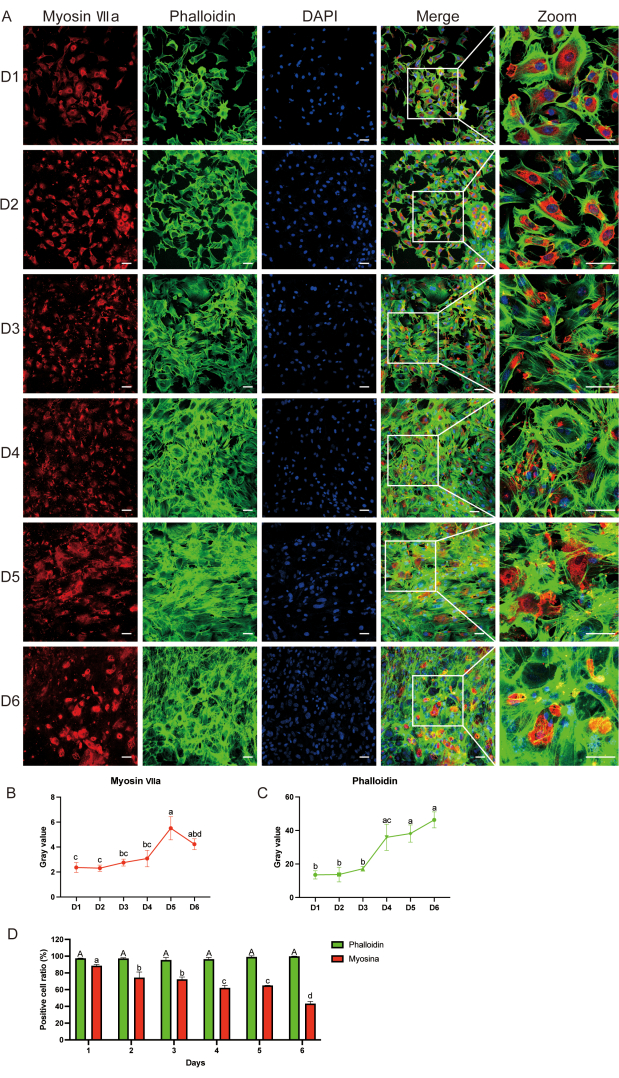
איור 3: זיהוי סמנים על פני השטח של תאי השערה באמצעות אימונופלואורסצנציה . (A) צביעת מיוזין-VIIa (אדום), פאלואדין (ירוק) ו-DAPI (כחול) מיום 1 עד יום 6 לאחר תרבית תאים. (ב, ג) ניתוח ערך אפור של מיוזין-VIIa ופאלואדין; הבדלים סטטיסטיים מסומנים על ידי אותיות. (D) השוואה של יחס תאים חיובי לפלואדין בין דגימות תאים מיום 1 ליום 6, לבין מיוזין-VII באותם ימים. אותיות גדולות מייצגות תוצאות סטטיסטיות עבור פאלואדין, בעוד שאותיות קטנות מייצגות תוצאות סטטיסטיות עבור מיוזין-VIIa. הנתונים מוצגים כממוצע ± שגיאת תקן של הממוצע. N = 5; סרגל קנה מידה = 50 מיקרומטר. ניתוח דו-כיווני של שונות (ANOVA) ואחריו מבחן פוסט-הוק של Tukey בוצע עבור ניתוח ערך אפור של מיוזין-VIIa ו phalloidin. ANOVA חד-כיווני בוצע להשוואה של יחס תאים חיובי לפאלואדין ולמיוזין-VII בין דגימות תאים מ-d 1 ל-d 6. אותיות שונות מצביעות על הבדלים סטטיסטיים בצביעת פלואדין, ואילו אותיות קטנות מצביעות על הבדלים סטטיסטיים בצביעת מיוזין-VIIa. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים S1: זיהוי אימונופלואורסנציה של סמנים על פני השטח של תאי השערה בתרבית אורגנית. צביעה אימונופלואורסצנטית של מיוזין-VIIa (ירוק), פאלואדין (ירוק) ו-DAPI (כחול) בוצעה על d 2 של תרבית אורגנית. סרגל קנה מידה = 10 מיקרומטר. קיצורים: IHC, תא שיער פנימי; OHC, תא שיער חיצוני; DAPI, 4′,6-diamidino-2-phenylindole. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S2: זיהוי אימונופלואורסנציה של סמנים על פני השטח בתאי שיער חתוכים. (A) צביעה אימונופלואורסצנטית של מיוזין-VIIa (אדום), פאלואדין (ירוק) ו-DAPI (כחול) בוצעה על תרביות אורגניות במעברים 2 ו-3. (B) השוואה בין מספר התאים החיוביים לפלואדין, תאים חיוביים למיוזין-VIIa וסך התאים מתאים ראשוניים למעבר 3. N = 3; סרגל קנה מידה = 100 מיקרומטר. הנתונים מוצגים כממוצע ± סטיית תקן. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בהשוואה לקו התאים HEI-OC1, תרביות ראשוניות של תאי שיער שכפלו בצורה מדויקת יותר את המצב הפיזיולוגי של תאים in vivo. לכן, שיטת התרבית הראשונית השמיעתית שנקבעה על ידי בידוד תאים חיים מאיברי השבלול וטיפוחם המיידי נראית ככלי רב ערך למחקר מקיף על מערכות שמיעתיות. טכניקות מסוימות חיוניות לתרבות מצליחה. ראשית, מזעור משך ההפרדה של איבר קורטי מהעצם הטמפורלית מגביר את הסבירות לפעילות מתמשכת של תאי שיער. כתוצאה מכך, חובה על החוקרים למזער את מרווח הזמן בין הדיסקציה והטבילה של איברים ב-PBS. בהתבסס על התצפיות הניסיוניות שלנו, משך זמן של כ-2-3 שעות מספיק כדי לנתח 10 עכברים ולקבל את 20 האוזניים הפנימיות בכל פעם. במהלך תהליך פירוק אנזימטי, מומלץ להגביל את משך הזמן ל -12 דקות ולהעביר את איברי השבלול לפיפטות לאחר תקופת דגירה של 8 דקות. האיברים נצפו במיקרוסקופ לאחר כ-10 מחזורי צנרת, והפירוק האנזימטי הופסק כאשר כמעט כל התאים התנתקו מהקרום הבזילרי. אחרת, האיברים הוחזרו לאינקובטור למשך 4 דקות נוספות. הבחירה של אנטיביוטיקה הוא גם חשוב. אנו ממליצים להשתמש ב-10 מ"ג/מ"ל פניצילין/סטרפטומיצין כדי למנוע בעיות זיהום פוטנציאליות מכיוון שחלק מהאנטיביוטיקות של אמינוגליקוזיד עלולות להיות אוטוטוקסיות ולהוביל למוות של תאי שיער.
למרות שמיוזינים מסוג VII באים לידי ביטוי נרחב ברקמות בעלי חיים, מיוזין-VIIa מתבטא רק בתאי השערה של איברי שיווי המשקל והשבלול של האוזן הפנימית בלבד. מיוזינים מדרגה VIIa ממלאים תפקיד חשוב בשמירה על מבנה הסטריאוסיליה, שכן הם מסייעים לחבר סטריאוסיליה באזור קישור הקרסול בתאי שיער11. בעקבות עלייה במשך תרבית התאים הראשונית ובמספר מעברי התא, גם ההתפרקות של מיוזין-VIIa גדלה עם הזמן, בעוד שפאלואדין נשאר יציב, מה שמצביע על כך שתפקוד תאי השמיעה ירד עם הזמן. המגבלה העיקרית של פרוטוקול זה היא שניתן להשתמש בתאי שמיעה רק תוך 6-7 ימים ולוקח זמן רב יותר לגדול מאשר תאי HEI-OC112. יתר על כן, זה בלתי נמנע כי תאים ראשוניים בסופו של דבר מזדקנים ומתים, מפגינים פוטנציאל צמיחה מוגבל. יתר על כן, הזמן והעלויות הכלכליות של בידוד תאי שיער ותרבית הם לעתים קרובות גבוהים ודורשים מומחיות רבה. האיבר של קורטי מכיל מגוון של תאים נוירו-חושיים, כולל שיער פנימי, שיער חיצוני ותאים תומכים. פרוטוקול זה הציג שיטה להפרדה וטיפוח תאים אלה במבחנה. ניתן להבחין בין תאים ראשוניים לתאים תומכים על ידי צביעה עבור מיוזין-VIIa ו-Sox2, בהתאמה13,14. תאי שיער חיצוניים ופנימיים מבצעים תפקידים שונים. תאי השערה החיצוניים משנים במהירות את אורכם ואת נוקשותם בתגובה לשינויים בפוטנציאל הממברנה ומומרים לתאי שיער פנימיים. פרסטין הוא חלבון מוטורי של תאי השערה החיצוניים, בעוד Slc17a8 (vGlut3) מבוטא באופן ספציפי ב- IHCs וניתן להשתמש בו להבחנה בין תאי שיער פנימיים במבחנה15,16,17,18.
בהשוואה לתרביות אורגניות, המורפולוגיה של תאי השערה משתנה באופן משמעותי בתרביות תאי השערה הראשוניים, וכתוצאה מכך מורפולוגיות שונות ותפקודי מכנוטרנסדוקציה שונים. תרביות אורגניות הן תרביות תאים ראשוניות תלת-ממדיות המציגות תבניות תאיות סטריאוטיפיות, קוטביות, היווצרות צרור שיער וקשרים עצביים בתוך איברי הקורטי. לעומת זאת, תאי HEI-OC1 ראשוניים הם בעלי צורה מצולעת טיפוסית והם גדלים שטוחים באמצעות היצמדות סטטית בסביבת תרבית דו-ממדית19. תרביות אורגניות ותאים ראשוניים מבודדים ישירות מרקמות ומציגים מורפולוגיה תקינה של התא וסמנים חשובים הקשורים לתפקוד. עם זאת, בניגוד לתאי HEI-OC1, שהם בדרך כלל בעלי שגשוג רב, קלים יותר לתרבית ולטרנספקט, ויכולים להישמר במשך עשרות שנים, לתאים אלה יש תוחלת חיים סופית ויכולת התפשטות מוגבלת.
לתאים ראשוניים יתרונות רבים בתרבית תאים. מכיוון שתאים ראשוניים מתקבלים מרקמות הגוף ומתורבתים בתנאי גידול אופטימליים, הם מחקים באופן הדוק את סביבת הרקמה in vivo . השימוש בתאים ראשוניים מונע התנגדויות אתיות רבות שהועלו לגבי ניסויים בבעלי חיים ומספק תוצאות רלוונטיות יותר מאשר קווי תאים. תאים ראשוניים שנבחרו מראש הם מודלים מתאימים המייצגים באופן הדוק איתות מולקולרי in vivo. תאים מתורמים שונים מגיבים באופן שונה לציטוקינים מעודדי דלקת. עלויות הבידוד והתרבות הן לעתים קרובות גבוהות, אם כי הן זולות יותר מאלה של מודלים של בעלי חיים. החומרים ובעלי החיים ששימשו בתרבית תאי השערה הראשונית שתוארה כאן היו פשוטים, עלותם הייתה נמוכה יחסית, והמערכת הייתה קלה לתפעול. אם תנאי התרבית האופטימליים אינם נשמרים, המאפיינים של התאים הראשוניים עשויים להשתנות עם המעברים הבאים. ככל שמספר המעברים גדל, גם מצב התא נחלש (איור משלים S2). מכיוון שהם נגזרו ישירות מרקמות גוף טבעיות ללא שינוי, תאי השערה השמיעתיים שהתקבלו חיקו מקרוב את מצב in vivo ואת הפיזיולוגיה שלהם. לכן, תאי שיער ראשוניים מספקים מערכת מודל מצוינת לחקר הפיזיולוגיה והביוכימיה של תאי השערה, כולל מטבוליזם של תאים ורעילות תרופות. למרות שתאים ראשוניים יכולים להישמר רק למספר ימים במבחנה, הם יכולים להיות מונצחים ומחולקים ללא הגבלת זמן לאחר טרנספורמציה גנטית כדי להשיג שורות תאים משניות.
לסיכום, הפרוטוקול הנוכחי תיאר בידוד של תאי שיער שמיעתיים מהעצם הרקתית באמצעות מיקרודיסקציה ודיסאגרגציה אנזימטית. הפרוטוקול כולו ארך כ-3 שעות, מדיסקציה של עכבר ועד ציפוי תאים. תאים בתרבית נשמרו בטוהר גבוה ונשארו בריאים במשך 6-7 ימים. למרות המגבלות המובנות של תרביות תאי שיער ראשוניות, המוגבלות לשני מעברים בלבד, פרוטוקול זה השתמש במתודולוגיות ובחומרים פשוטים, ובכך הציג אפיק חדשני לביצוע מחקר יעיל ביותר על תאי שיער שבלול.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (NFSC 82101224 to YG)
Materials
| Name | Company | Catalog Number | Comments |
| 100 mm BioLite cell culture dish | Thermo Fisher Scientific | 130182 | using for culture |
| 35 mm Nunc cell culture dish | Thermo Fisher Scientific | 150318 | using for culture |
| 6-well palate | Thermo Fisher Scientific | 310109005 | using for culture |
| 70 µm cell strainers | BD Company | 352350 | using for filter |
| Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | immunofluorescent staining |
| Anti-rabbit IgG Alexa Fluor 488 | Thermo Fisher Scientifc | A11008 | immunofluorescent staining |
| day 3-5 neonatal murine | provided by Xi'an Jiaotong University | ||
| Dulbecco’s Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | using for culture |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483020 | using for culture |
| Forceps | Dumont | 5# | using for dissection |
| Leica anatomy microscope | Germany | S9i | using for dissection |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | using for culture |
| Rabbit plyclonal to Myosin VIIa | Abcam company | ab92996 | immunofluorescent staining |
| Scissor | Belevor | 10cm/04.0524.10 | using for dissection |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | immunofluorescent staining |
| Trypsin | Thermo Fisher Scientific | 25200072 | using for culture |
References
- Tani, T., Koike-Tani, M., Tran, M. T., Shribak, M., Levic, S. Postnatal structural development of mammalian Basilar Membrane provides anatomical basis for the maturation of tonotopic maps and frequency tuning. Sci Rep. 11 (1), 7581 (2021).
- Goutman, J. D., Elgoyhen, A. B., Gomez-Casati, M. E. Cochlear hair cells: The sound-sensing machines. FEBS Lett. 589 (22), 3354-3361 (2015).
- Joo, Y., et al. The Contribution of Ototoxic Medications to Hearing Loss Among Older Adults. J Gerontol A Biol Sci Med Sci. 75 (3), 561-566 (2020).
- Nieman, C. L., Oh, E. S. Hearing Loss. Ann Intern Med. 173 (11), ITC81-ITC96 (2020).
- Mao, H., Chen, Y. Noise-Induced Hearing Loss: Updates on Molecular Targets and Potential Interventions. Neural Plast. 2021, 4784385 (2021).
- Morioka, S., et al. Hearing vulnerability after noise exposure in a mouse model of reactive oxygen species overproduction. J Neurochem. 146 (4), 459-473 (2018).
- Liu, H., et al. Molecular and cytological profiling of biological aging of mouse cochlear inner and outer hair cells. Cell Rep. 39 (2), 110665 (2022).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic Culture of Neonatal Murine Inner Ear Explants. Front Cell Neurosci. 13, 170 (2019).
- Ding, D., et al. Cisplatin ototoxicity in rat cochlear organotypic cultures. Hear Res. 282 (1-2), 196-203 (2011).
- Abitbol, J., et al. Cisplatin-induced ototoxicity in organotypic cochlear cultures occurs independent of gap junctional intercellular communication. Cell Death Dis. 11 (5), 342 (2020).
- Li, S., et al. Myosin-VIIa is expressed in multiple isoforms and essential for tensioning the hair cell mechanotransduction complex. Nat Commun. 11 (1), 2066 (2020).
- Kalinec, G. M., Park, C., Thein, P., Kalinec, F. Working with auditory HEI-OC1 cells. J Vis Exp. (115), (2016).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. J Vis Exp. (107), (2016).
- Xu, J., et al. Identification of mouse cochlear progenitors that develop hair and supporting cells in the organ of Corti. Nat Commun. 8, 15046 (2017).
- Zheng, J., et al. Prestin is the motor protein of cochlear outer hair cells. Nature. 405 (6783), 149-155 (2000).
- Ruel, J., et al. Impairment of SLC17A8 encoding vesicular glutamate transporter-3, VGLUT3, underlies nonsyndromic deafness DFNA25 and inner hair cell dysfunction in null mice. Am J Hum Genet. 83 (2), 278-292 (2008).
- Seal, R. P., et al. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).
- Luo, Z., et al. Three distinct Atoh1 enhancers cooperate for sound receptor hair cell development. Proc Natl Acad Sci U S A. 119 (32), e2119850119 (2022).
- Kalinec, G., Thein, P., Park, C., Kalinec, F. HEI-OC1 cells as a model for investigating drug cytotoxicity. Hear Res. 335, 105-117 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved