Method Article
항생제 내성의 진화에서 다중 플라스 미드의 역할 테스트
요약
여기 우리는 항생제 내성의 진화에서 다중 플라스 미드의 역할을 테스트 하는 실험 방법 제시.
초록
다중 플라스 미드는 원핵생물에서 매우 풍부 하지만 세균 진화에서 그들의 역할 제대로 이해 남아 있습니다. 우리는 최근에 증가 유전자 복사 셀 다중 플라스 미드를 제공한 당 플라스 미드로 인코딩된 유전자의 진화를 가속 수는 것을 보여주었다. 이 작품에서는, 우리는 유전자 진화를 촉진 하는 다중 플라스 미드의 능력을 테스트 하는 실험 시스템을 제시. 간단한 분자 생물학 방법을 사용 하 여, 우리는 항생제 저항 유전자 대장균 MG1655, 염색체 또는 다중 플라스 미드에 삽입할 수 있는 모델 시스템을 건설 한다. 우리 항생제의 농도 증가 따라 다른 변종을 전파 실험 진화 접근을 사용 하 고 우리는 시간이 지남에 세균성 인구의 생존을 측정. 선택 항생제 분자 그리고 저항 유전자는 유전자 돌연변이의 인수를 통해 저항을 부여만 수 있습니다. "진화 구조" 이렇게 항생제 내성의 획득 홍보 다중 플라스 미드의 잠재력을 테스트 하는 간단한 방법을 제공 합니다. 실험 시스템의 다음 단계에서는 항생제 내성의 분자 기초는 특징 이다. 돌연변이 식별 하기 위해 항생제 내성의 수집에 대 한 책임 우리가 사용 하 여 전체 인구와 클론에서 얻은 샘플의 깊은 DNA 연속. 마지막으로, 연구에서 유전자에 돌연변이의 역할을 확인, 우리 부모의 배경에서 그들을 재구성 하 고 테스트 결과 긴장의 저항 표현 형.
서문
항생제 저항 박테리아에는 주요 건강 문제1입니다. 근본적인 수준에서 병원 성 박테리아에 항생제 내성의 확산은 자연 선택2,3진화의 간단한 예입니다. 간단히 말하면, 항생제를 사용 하 여 생성 내성 변종에 대 한 선택 합니다. 진화 생물학에 있는 중요 한 문제는 따라서, 항생제에 저항을 진화 세균성 인구 수에 영향을 주는 요소를 이해 하는 것입니다. 선택 실험 박테리아의 진화 생물학을 조사 하는 매우 강력한 도구로 등장 하 고이 필드 진화 문제4,,56의 넓은 범위에 대 한 놀라운 통찰력을 생산 하고있다. 실험 진화에서 단일 부모의 부담에서 시작 하는 세균성 인구는 정의 하 고 긴밀 하 게 제어 된 조건 하에서 passaged 직렬. 이러한 문화의 성장 하는 동안 발생 하는 돌연변이의 일부 세균 피트 니스, 증가 하 고 이러한 문화를 통해 자연 선택에 의해 확산. 실험 기간 동안 인구의 샘플 비 진화 냉동된 화석 레코드를 만들기 위해 주기적으로 저온 유지 됩니다. 박테리아 인구 진화 하 접근의 다양 한 숫자를 사용할 수 있지만 두 가지 가장 일반적인 방법 적합성 분석 실험, 그들의 먼 조상과 전체 게놈 시퀀싱, 즉 경쟁 진화 박테리아의 능력을 측정 하는 그 드라이브 적응 유전자 변화를 식별 하는 데 사용. 선구적인 작업 리처드 Lenski와 동료7,8, 다음 실험 진화에 표준 접근 복제 인구 수가 상대적으로 적은 도전 하고있다 (일반적으로 < 10)에 새로운 적응을 환경 문제, 새로운 탄소 소스, 온도, 또는 육 식 살 균 소 등입니다.
항생제 내성 박테리아에의 한 감염 저항 높은 만큼 환자 조직에 치명적인 수준 항생제 농도 증가 하는 것은 큰 문제가 된다. 임상 세균이 임계값 항생제 농도, 임상 중단점 이상 항생제의 과다 복용에 저항을 진화 하는 것을 허용 하는 무슨에 따라서 관심이. 이 실험적으로 연구 하는 방법? 세균성 인구 수가 적은 항생제의 높은 복용량으로 도전, Lenski 스타일에서 실험, 그리고 가장 가능성이 결과 경우 항생제 멸종을 모든 인구를 몰 것 이다. 같은 시간에 사용 되는 항생제의 복용량은 부모의 긴장의 최소 억제 농도 (MIC) 아래 낮은 경우 다음 가능성이 크다 세균성 인구 저항, 임상 관련 레벨을 진화 할 것 이다 특히 저항 큰 비용을 수행합니다. 이러한 두 가지 시나리오 사이의 한 타협 "진화 구조" 실험9,,1011을 사용 하는 것입니다. 이 방법에서는, 문화는 매우 큰 수 (일반적으로 > 40) 증가 시간이 지남에, 일반적으로 항생제 농도 두 배로 모든 주12항생제의 복용과 함께 도전 이다. 이 실험의 특징은 어떤 인구 증가 저항을 진화 하지 않는 멸종 구동 될 것입니다. 이 방법으로 도전 대부분 인구, 구동 하지만 작은 진화 하는 저항의 높은 수준으로 유지 됩니다. 이 문서에서 우리는이 실험 설계를 사용 하 여 저항의 진화에 다중 플라스 미드 기여를 조사 하는 방법을 보여줍니다.
박테리아는 두 가지 주요 노선, 염색체 돌연변이, 그리고 모바일 유전 요소, 주로 플라스 미드13의 인수를 통해 항생제에 저항을 취득. 플라스 미드 활용14,15박테리아 사이의 저항 유전자를 옮길 수 있기 때문에 항생제 내성의 진화에 중요 한 역할을 재생 합니다. 플라스 미드의 크기와 생물학에 따라 두 그룹으로 나눌 수 있습니다: "작은", 세균성 세포 및 "큰" 높은 사본 수, 낮은 복사 번호16,17. 항생제 내성의 진화에 큰 플라스 미드의 역할 그들은 저항 및 멀티 저항 박테리아15중 보급의 핵심 드라이버는 conjugative 플라스 미드를 포함 하기 때문에 광범위 하 게 문서화 되었습니다. 작은 다중 플라스 미드 박테리아17,18, 매우 일반적인 있으며 그들은 종종 항생제 저항 유전자19에 대 한 코드. 그러나, 항생제 내성의 진화에서 작은 다중 플라스 미드의 역할에 공부 되었습니다 했다.
최근 작품에서 우리는 다중 플라스 미드가 그들은 유전자 돌연변이 속도 셀12당 더 높은 유전자 복사본 수를 증가 하 여 수행 하는 유전자의 진화를 가속 수 제안. 그것은 다중 플라스 미드 3 세대에 대 한 저항을 부여 하는 가장-1 돌연변이의 외관의 속도 가속 표시 했다 E. 콜라이 긴장 MG1655 및 β-lactamase 유전자 즐편-1 실험 모델을 사용 하 여 cephalosporin ceftazidime입니다. 이러한 결과 표시 다중 플라스 미드 항생제 내성의 진화에 중요 한 역할을 재생 있습니다.
여기, 우리는 우리가 개발 하는 방법에 대 한 자세한 설명을 제시 다중 플라스 미드 중재 항생제 내성의 진화를 조사. 이 메서드는 세 가지 다른 단계: 연구는 다중 플라스 미드 또는 호스트 박테리아의 염색체에 유전자의 첫 번째, 삽입. 둘째, 선택적인 압력에 적응 하는 다른 긴장의 잠재력을 평가 하기 위해 실험 진화 (진화 구조)의 사용. 그리고 세 번째, 분자 기초 플라스 미드 중재 진화 DNA 시퀀싱 및 부모의 유전자 형에서 개별적으로 의심된 돌연변이 재구성을 사용 하 여 기본을 결정.
마지막으로, 여기에 설명 된 프로토콜 항생제 내성의 진화를 조사 하도록 설계 되었습니다, 비록 한 주장할 수 있다이 방법은 어떤 multicopy에 돌연변이 의해 취득 하는 혁신의 진화를 분석 하 일반적으로 도움이 될 수 있습니다. 플라스 미드로 인코딩된 유전자입니다.
프로토콜
1. 항생제 저항 유전자를 인코딩 실험 시스템의 건설
참고: 여기 대장균 MG1655 플라스 미드 또는 염색체 인코딩 항생제 저항 유전자의 받는 사람 부담으로 사용 되었다. 항생제 저항 유전자는 염색체 또는 그렇지 않으면 isogenic 스트레인 (그림 1)에서 다중 플라스 미드에 인코딩됩니다.
-
Λ 페이지 통합 사이트 (attB)20 MG1655의 염색체의 항생제 저항 유전자를 삽입
- 증폭 PCR에 의해 염색체 attB 사이트의 양쪽에서 500 bp 긴 지역. Oligonucleotides YbhC-F를 사용 하 여 (5'-CCTGTACCGTACAGAGTAAT-3')와 attB-R (5'-GCCCGCCACCCTCCGGGCCGGTATAAAAAAGCAGGCTTCA-3')는 왼쪽된 상 동 지역 및 attB-F에 대 한 (5'-AGCGCCCTAGCGCCCGCTCCTTATACTAACTTGAGCGAAA-3') 및 YbhB/R (5'- TGGCGATAATATTTCACCGC-3') 적당 한. 뇌관 Tem1-pBAD-F를 사용 하 여 구편-1 저항 유전자 증폭 (5'-TGAAGCCTGCTTTTTTATACCGGCCCGGAGGGTGGCGGGC-3')와 Tem1-pBAD-R (5'-TTTCGCTCAAGTTAGTATAAGGAGCGGGCGCTAGGGCGCT-3'). 약 20 뇌관 디자인 bp (5' 끝) 시퀀스 complementarity 조각에 융합 하는 것을 보여주는.
- 퓨즈 (를 포함 하 여 그것의 발기인 지구) 항생제 저항 유전자 PCR 제품을 상 동 지역에서 30 분 동안 50 ° C 등온선 어셈블리21를 사용 하 여.
- Electroporate MG1655 세포 포함 플라스 미드 pKOBEG.
참고: pKOBEG는 λ를 포함 하는 열에 민감한 벡터 이다 빨간 기계, 염색체와 PCR 제품22사이의 homology 기반 유전자 교류를 추진.- 1.1.2 단계23 에서 제품의 1 µ L를 사용 하 여 4 ° C에서 2 mm 큐 벳에 electrocompetent 셀의 40 µ L 및 2.5 kV. Resuspend LB 국물 + 0.2 %arabinose λ의 식을 유지 하기의 1 mL에 빨간 기계 세포.
- Microfuge 관에 총 볼륨을 전송 하 고 염색체에 삽입 하 여 저항 마커의 phenotypic 표정 수 있도록 강렬한 떨고 (200 rpm 궤도 셰이 커에)와 30 ° C (pKOBEG에 대 한 허용 온도)에서 2 h를 품 어.
- LB agar 항생제 저항 유전자 (암 피 실린 또는 carbenicillin 즐편-1대 100 mg/l)에 대 한 선택 하려면 적절 한 항생제를 포함 하는 셀 접시
- 100 µ L 한 페 트리 접시에 접시와 볼륨의 나머지 부분을 아래로 회전, 신선한 파운드 국물의 100 µ L에서 resuspend 다른 배양 접시에 접시. 42 ° c.에서 밤새 품 어
참고:이 온도 pKOBEG의 복제에 대 한 관대 한 비. 이러한 조건에서 성장할 수 식민지 pKOBEG 잃게됩니다와 attB 사이트에 통합 하는 저항 유전자를 발표할 예정 이다 (편의상이 긴장 이라고 불릴 것 이다 MG1655:가 리사 에 여기에서). - 페니와 함께 접시의 식민지를 복제 하 여 pKOBEG의 손실에 대 한 테스트 (어떤 pKOBEG에 대 한 항생제 저항 마커 포함).
참고: 30 º C의 허용 온도에서 페니 격판덮개에 성장의 부족은 플라스 미드의 부재의 지표. - 클론을 확인, PCR 증폭 외부 뇌관 YbhC Extern을 사용 하 여 건설 (5'-TTTGTGACCAGAAGACCGCA-3') 및 YbhB Extern (5'-CTCATCAGTAACGATCTGCG-3'), 젤 전기 이동 법을 통해 amplicon 시퀀스의 정확한 크기를 확인 합니다 삽입 된 유전자의 순서가 정확한 확인을 정화 제품.
-
다중 플라스 미드에 항생제 저항 유전자를 삽입 합니다.
참고: 때문에 매우 높은 복사 번호와 플라스 미드 세균성 호스트 피트 니스에 큰 감소를 부과 하는 경향이, 좋습니다 복제, p3655 등의 자연의 기원과 다중 플라스 미드의 사용 (pSU18T-pBADgfp2, ColE1 형 원산지 복제24)입니다. 이 플라스 미드는 일반적으로 약의 적당 한 복사 번호를 제시 셀 당 15-20 복사본.- PCR (발기인 지역 포함) 선택의 항생제 저항 유전자를 증폭 하 고 PCR 제품 phosphorylate 플라스 미드 PCR 증폭 중추에 선:
- PCR 증폭 항생제 저항 유전자; 즐편-1 사용 뇌관 Tem1-pBAD-F (5'-TGAAGCCTGCTTTTTTATACCGGCCCGGAGGGTGGCGGGC-3')와 Tem1-pBAD-R (5'-TTTCGCTCAAGTTAGTATAAGGAGCGGGCGCTAGGGCGCT-3').
- 정제 제품 제조업체의 지침에 따라 T4 polynucleotide 키를 사용 하 여 phosphorylate
- PCR 증폭 높은 중 합 효소와 oligonucleotides pBAD-F를 사용 하 여 플라스 미드 백본 (5'-CGTTGATCGGCACGTAAGAG-3')와 pBAD-R (5'-AAACGACGGCCAGTGCCAAG-3').
- T4-리가 사용 하 여 두 PCR 파편을 위하여 제조 업체의 지침에 따라.
- Electroporate, 앞에서 설명한, 결 찰 제품 및 항생제 저항 유전자 (암 피 실린 또는 100 mg/L에서 carbenicillin에 대 한 적절 한 항생제 선택의 1 µ L의 최대 electrocompetent 대장균 DH5-α 세포의 40 µ L 즐편-1)에 대 한 및 플라스 미드 백본.
참고: arabinose 여기로 LB 보충 필요는 없습니다. - 독자의 선택의 상업적인 소형 예비 키트를 사용 하 여 플라스 미드를 추출:
- 실 온에서 12000 x g에서 centrifuging 여 하룻밤 문화의 5 mL을 수확. Resuspend 물의 resuspension 솔루션의 250 µ L에서 세포와 섞어 잘. 세포의 용 해 솔루션의 250 µ L을 추가 하 고 잘 혼합. 중화의 350 µ L을 추가 하 고 잘 혼합.
- DNA 바인딩 열 키트, 1 분 동안 원심 분리기에서 제공 하는 상쾌한을 전송 하 고 삭제를 통해 흐름. 세척 솔루션, 1 분간 centrifuging와 각 세척에서 flowthrough 삭제의 500 µ L 열 두 번 씻는 다. 잔여 세척 버퍼를 제거 하려면 1 추가 분에 대 한 빈 열 원심
- 깨끗 한 튜브는 열을 놓고 elute 순화 된 DNA를 막에 매우 순수한 물 50 µ L를 추가 합니다. 1-2 분 원심 하 고 흐름을 통해 순화 된 플라스 미드를 포함 하는 수집. 생어 시퀀스 삽입된 시퀀스 외부에서 뇌관을 사용 하 여 순서 올바른지 확인 없는 돌연변이 진화 실험 전에 저항 유전자에 존재 하는 플라스 미드의 유전자.
- 일단 순서 확인 electroporate 대장균 MG1655 피로, 위에서 설명한 대로 플라스 미드.
참고:이 변형 생성 MG1655/바지.
- PCR (발기인 지역 포함) 선택의 항생제 저항 유전자를 증폭 하 고 PCR 제품 phosphorylate 플라스 미드 PCR 증폭 중추에 선:
2. 실험적 진화 항생제 저항 (그림 1) 진화 구조 접근
- 파운드 플레이트에 연구 긴장 밖으로 행진: MG1655::가 리사 와 MG1655/바지 플러스 취약 부모의 스트레인, MG1655.
참고: 플라스 미드 바지 이어야 한다 MG1655, 안정 그래서 파운드 접시에 항생제를 추가할 필요가 없습니다. 변이 대장균 에 요금은 충분히 낮은 그래서 그것이 각 단계에서 플라스 미드 시퀀스를 확인 하는 데 필요한 건축 확인 합니다. - 각 잘에서 파운드의 200 µ L 96 잘 접시를 준비 하 고 (한 접시 스트레인 당) 독립적인 스에서 각 스트레인의 48 고립 된 식민지를 예방. 37 ° C와 200 rpm에서 하룻밤 접시를 품 어. 이러한 설립자 인구의 냉동된 재고 유지.
참고: 방지 하 고 96 잘 접시에서 문화 교차 오염에 대 한 제어, intercalating 96 잘 접시에 걸쳐 박테리아 없는 매체와 접종된 웰 스에 의해 바둑판 플레이트 설계를 사용 합니다. 이 플레이트 설계를 사용 하 여 전체 실험 진화 중. - 접종 2 µ L 새로운 96 잘 접시에 창시자 인구와 플레이트의 각 우물에서 연구에서 항생제의 하위 전공으로 각 잘에서 파운드의 198 µ L로 하 여 진화 구조 실험을 시작 합니다. 진화 구조 접근에 대 한 3 개의 긴장의 각각에 대 한 파운드에서 항생제의 ¼ 또는 최소 억제 농도 (MIC, 결정 이전25)의 1/8 시작 하 고 매일 항생제의 농도 두 번. 인구의 저항 돌연변이26취득 기회를 최대화 하기 위해이 방법을 사용 합니다. 37 ° C와 20 h 200 rpm에서 번호판을 품 어.
참고: 창시자 인구의 하룻밤 OD를 측정 합니다. 긴장 가운데 OD에 큰 차이가 있다면 잘 당 세포의 동일한 번호와 함께 실험을 시작 하는 초기 inoculum을 수정 합니다. - 매일, 야간 문화 후 각 모집단의 OD를 측정 하 고 2.3, 더블 전날 보다 항생제의 농도 가진 새로운 96 잘 접시에에서 설명 된 대로, 문화의 전송을 수행. 플레이트 20 h 37 ° c와 200 rpm을 품 어.
참고: 1: 100 희석 요인이 하루 약 6-7 세대 생산. - 동시에, 2.3 및 2.4, 하지만 항생제의 부재에 설명 된 대로 동일한 조건에서 각 변형의 컨트롤 인구를 전파 합니다.
참고: 제어 인구 항생제와 박테리아 실험 조건에 적응을 돕는 일반적인 돌연변이의 존재 때문에 발생 하는 돌연변이 사이 차별 도움이 됩니다. 병렬 돌연변이 항생제의 부재에서 발생 하는 박테리아 실험 조건에 적응 하도록 돕는 것 항생제 내성에 관련이 없습니다. - 600의 파장에서 흡 광도 측정 하 여 살아남은 인구 수 매일 추적 플레이트 리더를 사용 하 여 문화권의 nm (OD).
참고: 광학 밀도 값 0.1 나타냅니다 인구의 멸종 보다 낮은. 그림 2 생존 곡선의 예를 참조 하십시오. - (3-5 일 마다) 모든 인구를 주기적으로 냉동된 재고 유지.
- [RStudio (버전 0.99.486)에 "생존" 패키지] 로그-순위 테스트를 사용 하 여 항생제12의 농도 증가 따라 시간이 지남에 다른 긴장의 인구의 생존에 통계적 차이 확인 하.
참고:이 실험 경우 다중 plasmids 약효는 특정 항생제 및 유전자 연구에 대 한 항생제 내성의 진화를 결정 합니다.
3. 분자 기초 항 생 저항 (그림 1)의 진화의
- 인구와 클론의 대표 번호에서 전체 DNA 추출 긴장 및 치료 수행. 부모 긴장을 포함 (MG1655, MG1655::가 리사 와 MG1655/바지) 실험 기간 동안 축적 하는 돌연변이 검출 하기 수 있기를.
참고: DNA 추출 키트의 예에 대 한 자료의 표를 참조. 각 키트에는 다른 프로토콜; 제조업체 지침을 따릅니다. - 계량 DNA 품질 및 농도. DNA 품질 및 농도 확인 하기 위해 다른 방법이 있다. 260 nm/280 nm의 흡 광도 260 nm/230 nm의 비율을 측정 하는 품질을 결정 합니다. 형광, DNA 바인딩 염료를 사용 하 여 제조업체의 지침에 따라 DNA 농도 측정 하 고 거기 확인을 agarose 젤 전기 이동 법이 DNA 저하 또는 RNA 오염.
- 전체 인구 및 개별 샘플에서 사용 하 여 깊은 DNA 시퀀싱 항생제 내성의 유전 기초 조사를 복제 합니다.
참고: 우리는 인간 유전학, 옥스포드, 영국에 대 한 모든 시퀀싱 Wellcome 신뢰 센터에서 실시. 자세한 내용은 참조 산 밀란 외. 201612. - Breseq 0.26.1 파이프라인27,28 를 사용 하 여 다형성 모드를 사용 하 여 인구에 있는 돌연변이의 주파수를 견적 하는 돌연변이 검출. 실험 기간 동안 축적 된 돌연변이 검출 하기 위하여 부모의 게놈을 다른 진화 게놈 비교 합니다.
- 비교 그 인구 제어 인구에 있는 동시에 축적 된 돌연변이 돌연변이 박테리아 일반적인 실험 조건 (적응을 돕는 사이 분화 하는 항생제의 농도 증가에서 진화 그 제어 인구에서 발견) 그 항 생 저항 (항생제 압력을 복종 하는 인구에 독점적으로 그)에 관련 된.
참고: 병렬 돌연변이의 수 이므로 일반적으로 낮은 치료 사이 다른 병렬 변이 쉽게 평가 될 수 있다. 그것은 꽤 찾을 가능성이 연구 항생제 저항 유전자에 돌연변이 제외 하 고 다른 돌연변이 염색체에 항 생 저항, porins 또는 경과 시스템12같은 돌연변이와 관련 된. - 이 프로토콜의 섹션 1에서 동일한 방법을 사용 하 여 부모의 긴장에서 항생제 저항 유전자에 돌연변이 재구성 합니다. 1.1와 1.2 (를 사용 하 여 진화 유전자 PCR 템플릿으로) 부모의 배경에서 새로운 돌연변이 소개 하는 프로토콜의 포인트에 따라. 항생제 저항 phenotypes 돌연변이의 역할을 확인 하는 이러한 새로운 건축의 분석.
결과
우리의 이전 작품에서 진화 β-lactamase 유전자 즐편-1 제 3 세대 cephalosporin ceftazidime12 에 저항을 부여 쪽으로 조사 되었다. 이 유전자는 돌연변이 즐편-1 편-1은 ceftazidime29등 cephalosporins의 활동의 범위를 확장할 수 있습니다 편-1 ceftazidime에 저항을 부여 하지 않습니다, 하지만 때문에 선정 되었다. Β-lactamases 등 수정 효소 활동의 그들의 범위에서 변화를 선도 하는 aminoglycoside 항생제 내성 효소에 있는 돌연변이 일반적인29,30. 이 실험 시스템은 효소의이 종류의 진화를 탐구 하는 것이 이상적입니다. 이 프로토콜에 따라 성공적인 실험의 상세한 보고서 산 밀란 외를 참조 하십시오. 201612.
여기,이 실험 시스템의 가능한 결과의 예 (이 예제에 사용 되는 데이터는 실제 참고) 프로토콜을 설명 하기 위해 제공 됩니다. Multicopy의 잠재적인 역할 조사에서 항생제 저항 유전자의 진화에 플라스 미드 공부 (부르 자 그것 가 리사)이이 예제에서 우리 다음 위에서 설명한 프로토콜의 섹션 1 실험 시스템 개발. 실험 생산 세: MG1655, MG1655::가 리사 와 MG1655/바지. (Ceftazidime와 meropenem) 두 개의 다른 ß-락탐 항생제에 저항을 진화 프로토콜의 2 절에서 설명 하는 단계에 따라 테스트를 했다. 그림 2 는 연구 집단의 생존 곡선을 보여준다. 이 예제에서는 MG1655/바지 ceftazidime MG1655 또는 MG1655에서 그에 비해 진화에 속하는 인구의 생존에 크게 증가::가 리사 (로그 순위 테스트, P< 0.05). 다른 한편으로, meropenem, 경우 다른 계통에 속하는 집단의 생존에 중요 한 차이가 있다 (로그 순위 테스트, P> 0.05). 따라서, 이러한 결과 다중 플라스 미드에 유전자 리사 의 존재 저항 ceftazidime를 하지만 meropenem의 진화 potentiates 것이 좋습니다.
실험의 마지막 단계, 항생제 내성의 분자 기초 조사는 프로토콜의 섹션 3에에서 설명 된 대로. 첫째, DNA 시퀀싱 저항 표현 형에 대 한 책임 수 있는 리사 에 돌연변이 발표할 예정 이다. 그리고 둘째, 부모의 MG1655 (모두에서 염색체와 플라스 미드)에 리사 돌연변이의 재건 확인 또는 항생제 저항 표현 형에 그들의 역할을 무시.
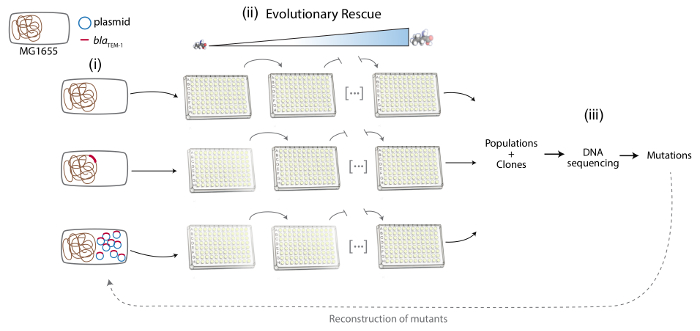
그림 1 . 프로토콜의 여러 단계의 도식 대표. 왼쪽에서 오른쪽: (i) 실험 시스템의 건설: MG1655, MG1655::가 리사 와 MG1655/바지. 세균성 염색체 갈색, 파란색에서 플라스 미드, 가 리사 유전자 빨간색에서으로 표시 됩니다. (실험적 항생제 저항을 진화 ii) 진화 구조 접근: 다른 긴장의 여러 인구는 항생제의 농도 증가에서 전파 됩니다. (iii) 항 생 저항 분자의 분석: 진화 인구와 클론, 항생제 내성 변이의 탐지 및 부모의 스트레인에 이러한 돌연변이의 재건에서 샘플링 하는 DNA의 연속. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
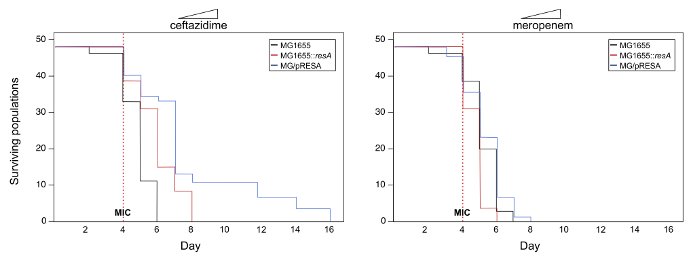
그림 2. 항생제의 농도 증가 함께 생존 곡선. 변종 MG1655, MG1655에 속하는 실행 가능한 인구 수의 표현::리사, 그리고 시간이 지남에 MG1655/바지. 각 스트레인의 48 인구 항생제 ceftazidime와 meropenem의 농도 증가 따라 전파 했다 1 일에 마이크의 1/8 시작 하 고 매일 항생제 농도 두 배로. 빨간색 파선된 세로선 연구에서 항생제의 마이크를 나타냅니다. Ceftazidime의 경우에 시간이 지남에 따라 다른 계통에 속하는 집단의 생존에 중요 한 차이 (로그 순위 테스트, P< 0.05). 결정적인, 플라스 미드를 운반 하는 인구만 항생제의 높은 수준의 농도까지 살아남을 수 있습니다. 다른 한편으로, meropenem, 경우 시간이 지남에 따라 다른 집단의 생존에 중요 한 차이가 있다 (로그 순위 테스트, P> 0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
우리는 분자 생물학, 실험 진화 및 다중 플라스 미드 박테리아에 항생제 내성의 진화에서의 역할을 조사 하도록 깊은 DNA 시퀀싱을 결합 하 여 새로운 프로토콜을 제시. 이 프로토콜은 다양 한 분야에서 기술을, 비록 그것을 개발 하는 데 필요한 모든 방법을 간단 하 고 일반 미생물학 실험실에서 수행할 수 있습니다. 프로토콜의 가장 중요 한 단계는 아마 모델 시스템 긴장의 건설과 실험 진화 후 관찰 (이 정확한 동일한 메서드를 사용 하 여 수행 됩니다) 돌연변이의 재건 이다. 그러나, 등온선 어셈블리 시스템21, 분자 생물학에 있는 경험의 중간 수준 가진 모든 사용자가 구현할 수 있도록이 프로토콜 크게 단순화 합니다.
프로토콜의 또 다른 중요 한 단계는 항생제의 농도 증가에서 실험적인 발전 이다. 예를 들어,이 프로토콜 ¼-1/8의 긴장과 매일 항생제의 농도 두 배로 마이크의 실험을 시작 합니다. 그러나, 항생제의 더 낮은 비율 멸종26에서 진화 구조의 기회를 증가할 수 있었다. 따라서, 항생제 농도의 변화 속도 항생제 내성의 진화를 홍보 하기 위해 수정할 수 있는 매개 변수 중 하나입니다.
DNA 시퀀싱 및 분석 실험 디자인의 주요 측면 또한 있습니다. 전체 인구에서 하는 실험에서 서로 다른 시간 지점에서 개별 클론에서 DNA 샘플에서 시퀀싱을 수행 하면 결과 더 간단 합니다. 시퀀싱 결과 인구에서 시간 및 잠재적인 이벤트의 클론 간섭 치료, 뿐만 아니라 유익한 돌연변이의 선택적 스윕 중 돌연변이 프로필에 일반적인 차이 발표할 예정 이다. 인구에서 시퀀스를 분석할 때 그것은 결코 어떤 인구에서 10% 주파수를 능가 하는 돌연변이 필터링 할 좋습니다. 개별 클론에서 시퀀스 인구에서 얻은 결과 확인 하는 데 도움이 하 고, 가장 중요 한 것은, 인구 수준에서 관찰 하는 다른 변이 사이의 특정 조합을 공개. 이러한 특정 연결 epistatic 배웠으므로 돌연변이 세균 적응31에 중요 한 역할을 발견 하는 데 도움이 있습니다.
이 방법을 사용 하 여, 우리는 최근 표시 다중 플라스 미드 그리고 증가 진 복용량12 인해 돌연변이의 효과 증폭 시켜 새로운 돌연변이의 외관의 속도 증가 의해 처음으로 항생제 내성의 진화를 가속 . 따라서, 우리는 항생제 내성의 진화를 조사 하는 도구로 메서드를 개발 하지만 그것은 훨씬 더 넓은 범위의 응용 프로그램을 할 수 있습니다. 즉,이 시스템 새로운 또는 향상 된 기능으로 보다 일반적인 방법으로 진화를 어떤 세균 유전자의 기능을 조사 하기 위해 사용 될 수 있습니다. 이 시스템 사용 될 수, 예를 들어 새로운 탄소 기판32를 사용 하는 대사 효소/통로의 기능을 테스트 하려면. 또한, hypermutators (박테리아 DNA 불일치 복구에 관련 된 셀룰러 시스템에서 결함) 대신 사용 될 수 hypermutators에 의해 도입 mutational 바이어스를 피하고 박테리아에 적응 유전자 진화를 조사.
공개
저자는 공개 없다.
감사의 말
이 작품 Instituto de에 의해 지원 되었다 건배 카를로스 3 세 (Estatal 계획 데 나 + D + 내가 2013-2016 년): CP15-00012, PI16-00860 및 CIBER (CB06/02/0053), 공동 자금 유럽 지역 개발 기금 ' 유럽을 달성 하는 방법 ' 부여 (ERDF). 재는 마드리드 (2016-T1/바이오-1105)와 I의 지역의 정부의 Atracción 드 talento 프로그램에 의해 지원 + 스페인 정부의 드 Economía, 산업 y Competitividad (BIO2017-85056-P)의 D Excelencia. ASM Instituto de에서 미겔 세르 친교에 의해 지원 됩니다 건배 카를로스 3 세 (MS15/00012) 공동는 유럽 사회 기금에 의해 자금을 "당신의 미래에 투자" (ESF) 그리고 ERDF.
자료
| Name | Company | Catalog Number | Comments |
| Thermocycler | BioRad | C1000 | |
| Electroporator | BiorRad | 1652660 | |
| Electroporation cuvettes | Sigma-Aldrich | Z706078 | |
| NanoDrop 2000/2000c | Thermo Fisher Scientific | ND-2000 | Determine DNA quality measuring the ratios of absorbance 260nm/280nm and 260nm/230nm |
| Incubator | Memmert | UF1060 | |
| Incubator (shaker) | Cole-Parmer Ltd | SI500 | |
| Electrophoresis power supply | BioRad | 1645070 | Agarose gel electrophoresis |
| Electrophoresis chamber | BioRad | 1704405 | Agarose gel electrophoresis |
| Pippettes | Biohit | 725020, 725050, 725060, 725070 | |
| Multi-channel pippetes | Biohit | 728220, 728230, 728240 | |
| Plate reader Synergy HTX | BioTek | BTS1LF | |
| Inoculating loops | Sigma-Aldrich | I8388 | |
| 96-well plates | Falcon | 351172 | |
| LB | BD Difco | DF0446-17-3 | |
| LB agar | Fisher scientific | BP1425-500 | |
| Phusion Polymerase | Thermo Fisher Scientific | F533S | |
| Gibson Assembly | New England Biolabs | E2611S | |
| Resctriction enzymes | Fermentas FastDigest | ||
| Antibiotics | Sigma-Aldrich | ||
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | Plasmid extraction kit |
| Wizard Genomic DNA Purification Kit | Promega | A1120 | gDNA extraction kit |
| DNeasy Blood & Tissue Kits | Qiagen | 69506 | gDNA extraction kit |
| Electroporation cuvettes | Sigma-Aldrich | Z706078 | |
| Petri dishes | Sigma-Aldrich | D9054 | |
| Cryotubes | ClearLine | 390701 | |
| 96-well plates (-80ºC storage) | Thermo Fisher Scientific | 249945 | |
| QuantiFluor dsDNA System | Promega | E2670 | Quantification of DNA concentartion |
| Agarose | BioRad | 1613100 | Agarose gel electrophoresis |
| 50x TAE buffer | BioRad | 1610743 | Agarose gel electrophoresis |
| T4 Polynucleotide Kinase | Thermo Fisher Scientific | EK0031 | |
| T4 DNA Ligase | Thermo Fisher Scientific | EL0014 |
참고문헌
- Neill, J. TACKLING DRUG-RESISTANT INFECTIONS GLOBALLY: FINAL REPORT AND RECOMMENDATIONS. Review on Antimicrobal Resistance. , (2016).
- Palmer, A. C., Kishony, R. Understanding, predicting and manipulating the genotypic evolution of antibiotic resistance. Nat Rev Genet. 14 (4), 243-248 (2013).
- MacLean, R. C., Hall, A. R., Perron, G. G., Buckling, A. The population genetics of antibiotic resistance: integrating molecular mechanisms and treatment contexts. Nat Rev Genet. 11 (6), 405-414 (2010).
- Buckling, A., Maclean, R. C., Brockhurst, M. A., Colegrave, N. The Beagle in a bottle. Nature. 457 (7231), 824-829 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Elena, S. F., Lenski, R. E. Evolution experiments with microorganisms: The dynamics and genetic bases of adaptation. Nature Reviews Genetics. 4 (6), 457-469 (2003).
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-Term Experimental Evolution in Escherichia coli. I. Adaptation and Divergence During 2,000 Generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Bennett, A. F., Dao, K. M., Lenski, R. E. Rapid evolution in response to high-temperature selection. Nature. 346 (6279), 79-81 (1990).
- Bell, G. Evolutionary rescue and the limits of adaptation. Philosophical Transactions of the Royal Society B-Biological Sciences. 368 (1610), (2013).
- Bell, G., Gonzalez, A. Adaptation and Evolutionary Rescue in Metapopulations Experiencing Environmental Deterioration. Science. 332 (6035), 1327-1330 (2011).
- Bell, G., Gonzalez, A. Evolutionary rescue can prevent extinction following environmental change. Ecology Letters. 12 (9), 942-948 (2009).
- San Millan, A., Escudero, J. A., Gifford, D. R., Mazel, D., MacLean, R. C. Multicopy plasmids potentiate the evolution of antibiotic resistance in bacteria. Nature Ecology & Evolution. 1, 0010(2016).
- Alekshun, M. N., Levy, S. B. Molecular mechanisms of antibacterial multidrug resistance. Cell. 128 (6), 1037-1050 (2007).
- Ochman, H., Lawrence, J. G., Groisman, E. A. Lateral gene transfer and the nature of bacterial innovation. Nature. 405 (6784), 299-304 (2000).
- Carattoli, A. Plasmids and the spread of resistance. Int J Med Microbiol. 303 (6-7), 298-304 (2013).
- Smillie, C., Garcillán-Barcia, M. P., Francia, M. V., Rocha, E. P., de la Cruz, F. Mobility of plasmids. Microbiol Mol Biol Rev. 74 (3), 434-452 (2010).
- San Millan, A., Heilbron, K., Maclean, R. C. Positive epistasis between co-infecting plasmids promotes plasmid survival in bacterial populations. ISME J. , (2013).
- Stoesser, N., et al. Evolutionary History of the Global Emergence of the Escherichia coli Epidemic Clone ST131. MBio. 7 (2), (2016).
- San Millan, A., et al. Multiresistance in Pasteurella multocida is mediated by coexistence of small plasmids. Antimicrob Agents Chemother. 53 (8), 3399-3404 (2009).
- Escudero, J. A., et al. Unmasking the ancestral activity of integron integrases reveals a smooth evolutionary transition during functional innovation. Nat Commun. 7, 10937(2016).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A. 97 (12), 6640-6645 (2000).
- Chaveroche, M. K., Ghigo, J. M., d'Enfert, C. A rapid method for efficient gene replacement in the filamentous fungus Aspergillus nidulans. Nucleic Acids Res. 28 (22), 97(2000).
- Le Roux, F., Binesse, J., Saulnier, D., Mazel, D. Construction of a Vibrio splendidus mutant lacking the metalloprotease gene vsm by use of a novel counterselectable suicide vector. Appl Environ Microbiol. 73 (3), 777-784 (2007).
- Performance standards for antimicrobial susceptibility testing; 19th ed. Approved standard M100-S19. , Clinical and Laboratory Standards Institute. Wayne, PA, USA. (2009).
- Lindsey, H. A., Gallie, J., Taylor, S., Kerr, B. Evolutionary rescue from extinction is contingent on a lower rate of environmental change. Nature. 494 (7438), 463-467 (2013).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
- Barrick, J. E., et al. Identifying structural variation in haploid microbial genomes from short-read resequencing data using breseq. BMC Genomics. 15, 1039(2014).
- Salverda, M. L., De Visser, J. A., Barlow, M. Natural evolution of TEM-1 β-lactamase: experimental reconstruction and clinical relevance. FEMS Microbiol Rev. 34 (6), 1015-1036 (2010).
- Ramirez, M. S., Tolmasky, M. E. Aminoglycoside modifying enzymes. Drug Resist Updat. 13 (6), 151-171 (2010).
- Jerison, E. R., Desai, M. M. Genomic investigations of evolutionary dynamics and epistasis in microbial evolution experiments. Current Opinion in Genetics & Development. 35, 33-39 (2015).
- Toll-Riera, M., San Millan, A., Wagner, A., MacLean, R. C. The Genomic Basis of Evolutionary Innovation in Pseudomonas aeruginosa. PLoS Genet. 12 (5), 1006005(2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유