Method Article
DNA 종이 접기 분석 및 실험에 대한 운모와 실리콘 기판의 제조
요약
Reproducible cleaning processes for substrates used in DNA origami research are described, including bench-top RCA cleaning and derivatization of silicon oxide. Protocols for surface preparation, DNA origami deposition, drying parameters, and simple experimental set-ups are illustrated.
초록
The designed nature and controlled, one-pot synthesis of DNA origami provides exciting opportunities in many fields, particularly nanoelectronics. Many of these applications require interaction with and adhesion of DNA nanostructures to a substrate. Due to its atomically flat and easily cleaned nature, mica has been the substrate of choice for DNA origami experiments. However, the practical applications of mica are relatively limited compared to those of semiconductor substrates. For this reason, a straightforward, stable, and repeatable process for DNA origami adhesion on derivatized silicon oxide is presented here. To promote the adhesion of DNA nanostructures to silicon oxide surface, a self-assembled monolayer of 3-aminopropyltriethoxysilane (APTES) is deposited from an aqueous solution that is compatible with many photoresists. The substrate must be cleaned of all organic and metal contaminants using Radio Corporation of America (RCA) cleaning processes and the native oxide layer must be etched to ensure a flat, functionalizable surface. Cleanrooms are equipped with facilities for silicon cleaning, however many components of DNA origami buffers and solutions are often not allowed in them due to contamination concerns. This manuscript describes the set-up and protocol for in-lab, small-scale silicon cleaning for researchers who do not have access to a cleanroom or would like to incorporate processes that could cause contamination of a cleanroom CMOS clean bench. Additionally, variables for regulating coverage are discussed and how to recognize and avoid common sample preparation problems is described.
서문
먼저 2006 년에 도입 된 DNA 종이 접기의 DNA 올리고 뉴클레오티드의 자기 조립 특성이 설계 가능한 높은 순서 나노 구조를 제조 사용합니다. 구조의 무수한가보고되고있다 1, 웃는 3 차원 상자를 래치하는면에 이르기까지. 2 DNA 종이 접기가 작용 될 수있다 다양한 생체 분자 및 나노 구조와 나노 전자, 의학, 양자 컴퓨팅 연구의 응용 프로그램에 상승을 제공합니다. (3) 그러나, 분석 및 많은 미래의 응용 프로그램뿐만 아니라 구조 설계에 따라, 또한 표면에 DNA 종이 접기 나노 구조의 접착에 있습니다. 운모 관능 규소 산화물 :이 논문에 설명 된 방법은 기판의 두 종류의 DNA 접기 샘플의 제조와 관련된.
이 0.02 nm의 나노 ± 0.37의 층 높이로, 원자 평면이기 때문에 운모는 DNA 종이 접기 연구에 대한 선택의 기판이다. (4) 또한 EAS입니다ILY 샘플 준비 및 원자 힘 현미경 (AFM) 연구는 간단하게 정리. 백운모 각 벽개면 칼륨의 높은 밀도를 포함하고 있지만, 이러한 경우에 물에 이온은 운모 표면에서 멀리 확산. 운모 기판에 DNA 접기의 결합을 중재하는, 마그네슘 2+ 운모 음전하 리버스 정전 기판 (도 1A)에 DNA 포스페이트 골격에 결합하는 데 사용된다. 어닐링 된 DNA의 5 혼합물 대형의 존재하에 마그네슘 2+로 끝나는 표면에 DNA 종이 접기의 부착이 단일 가닥 올리고 뉴클레오티드 (주식 가닥)의 접착력보다 훨씬 강력하기 때문에 주식 가닥의 과잉은 운모에 높은 범위와 좋은 이미지를 제공합니다. 니켈 2+ 2+ 및 Co를 포함하는 다른 양으로 하전 된 이온은 운모에 DNA의 접착력을 제어하기 위해 사용될 수있다. 6,7 adhE 유전자를 매개 할 수있는 용액과 일가 가의 양이온의 농도를 변화DNA 종이 접기의 시온과 표면 확산 속도. 8 그러나, 운모 기판을 준비하고 증착하고 종이 접기를 세정에 대한 프로토콜은 종종 명시 적으로 명확한 프로토콜없이 출판 원고에. 9 설명되지는 재생 가능한 결과를 얻기 어려울 수 있습니다.
운모는 절연체이므로 일부 나노 전자 응용을위한 기판으로서 적합하지 않다. 얇은 자연 산화물과 패시베이션 실리콘 입 / 출력 구조 및 지형지 물을 생성하기에 앞서 무료 금속 산화물 반도체 (CMOS) 공정과의 호환성을 포함한 바람직한 전기적 성질을 갖는다. 공기에 저장된 실리콘 웨이퍼는 두꺼운 열 산화물 또는 높은 입자 개수와 비교적 더러운 얇은 자연 산화막 중 하나와 비활성화된다. 산화 규소 운모보다 훨씬 더 낮은 표면 전하 밀도를 가지며, 전하 밀도는 산화물 준비 및 이력에 크게 의존한다. 마그네슘에 이온 농도는 ABO150 mm로했습니다, 좋은 커버리지 (최대 4 / μm의 2) 직사각형의 DNA 종이 접기의 산소 플라즈마 처리 된 실리콘 기판에 달성 될 수있다; 그러나,이 농도 범위는 사용되는 크기와 나노 구조물의 설계에 따라 달라질 수있다. (10)를 대체 프로토콜을 표면 전하를 튜닝하기에 3- 아미노 프로필 트리에 톡시 실란 (APTES) (도 1b)의 양이온 성 자기 조립 단분자막을 첨부하는 것 산화물. APTES에 일차 아민을 기판의 전하 및 소수성을 수정 9 이하 pH 값에서 양성자 화 될 수있다. APTES의 완전한 단층 11 성공적으로 증착되는, 실리콘 적절 아메리카 라디오 공사 (RCA) 프로토콜을 사용하여 청소해야 . 이러한 프로토콜은 유기 잔류 물 및 입자 오염물을 제거 수산화 암모늄과 과산화수소 용액 (RCA1)의 치료를 포함한다. 수성 플루오르 화 수소산 용액에 짧은 에칭과 함께 자연 산화물 층을 제거산화물을 준수 어떤 이온 성 오염 물질. 마지막으로, 샘플은 얇고 균일 한 산화물 층을 금속 이온 오염 물질을 제거하고 형성하는 염산 및 과산화수소 용액 (RCA2)에 노출되어있다. (12) 대부분의 크린룸가 사용될 수 있는지에 대한 엄격한 규칙으로, CMOS 청소 프로토콜 후드를 지정했다 이 분야에서. 일반적인 문제는 midbandgap 트랩을 생성하여 CMOS 구조의 전자 성질을 방해 할 수 나트륨과 같은 이온의 형태로 제공됩니다. (13) 이온 일반적으로 사용하는 다른 연구자에 대한 문제의 CMOS 화장실을 오염시키고 원인이 될 수 DNA 종이 접기 준비 및 증착 버퍼에 사용 클린 룸. 이러한 이유로, 우리 그룹은 벤치 청소 '더러운'의 CMOS DNA 종이 접기 연구에 사용되는 작은 샘플 용으로 배열 사용합니다. 이 프로세스는 기존의 클린 룸 셋업에 좋은 대안이며, 클린 룸의 CMOS 벤치에 액세스 할 수없는 실험실에 적합 할 수있다.
프로토콜
1. 실험 계획 및 자재 준비
- 실험에 사용되는 DNA 접기의 디자인, 농도, 및 기능을 결정한다. 14-16 여기서는 ㎎ / 2 + 용액 (40 mM 트리스 염기, 20mM의 1X TAE 제조 DNA 접기 직사각형 디자인을 사용 아세트산, 2 mM의 EDTA, 12 mM의 아세트산 마그네슘, pH를 8.0). 17
- 모든 팁, 튜브, 용기를 압력솥하는 데 사용합니다. 이 자료는 호환되는 모든 오토 클레이브해야합니다.
- 세척을 위해 멸균 물 공급을 준비합니다. 18 MΩ X 센티미터의 물을 약 500 ml의 멸균 항아리 채우기, 열판에 장소, 오프 캡으로 5 분간 끓여하고, 핫 플레이트 떨어져 병을 용기에 배치하지만 강화하지 뚜껑 식지 . 냉장고에 보관하고 새로운 공급을 매월 또는 필요한 경우를 준비합니다.
2. 운모 기판을 준비
- 적당한 크기로 잘라 기판 (가위로 1cm X 1cm 사각형). 운모는 얇고 깨지기 쉽다. 또한, 절단이 필요하지 않습니다 디스크 형태의 운모를 구입할 수 있습니다.
- 양면 테이프를 사용 운모 쪼개짐. 양면 테이프에 부착 할 때 운모 이온을 인터로 분리 광물의 층으로 구성되고, 각 층이 박리 될 수있다. (18)
- 확인이이 테이프에 단단히 부착하고, 테이프 디스펜서에 여전히 양면 테이프에 운모 사각형을 배치합니다. 조심스럽게 운모 테이프 사이의 핀셋을 밀어 최상위 층을 제거하고 테이프에 유지됩니다. 즉시 제거 후, 운모 광장 깨끗한면이 아래로 향하게해야합니다. 용기에 보관하기 전에 운모를 뒤집어해야합니다.
- 가장 상위 계층과 적절한 청소의 완전한 제거를 보장하기 위해 3-4 번 반복합니다.
- 또한, 양면 테이프의 조각으로 컨테이너 또는 테이블 상단에 운모를 준수하고 두 번째 조각의에를 사용틱 및 최상위 운모 층을 벗겨. 다른 방법은 DNA를 증착 및 세정 의한 지원 제 밀착성 어려운 샘플을 건조하게되지만 운모 적절히, 두 경우 모두에서 세정한다.
운모 3. 입금 DNA 종이 접기
- 간단히, 솔루션 나노 구조의 분산도 보장하기 위해 와류 믹서를 사용하여 DNA 종이 접기의 병을 섞는다.
- 피펫 피펫 팁이 기판에 닿지 않도록 보장 운모 위에 솔루션의 4 μL. 적절한 범위를 보장하기 위해 약 10 분 동안 운모의 DNA 종이 접기를 남겨주세요. 증착 시간은 원하는 커버리지뿐만 아니라 사용되는 DNA 접기의 농도 (도 2 및 3)에 따라 달라질 것이다.
- 싱크 또는 다른 액체 용기를 통해 멸균 수 100 ㎕를 사용하여 운모 기판의 오프 DNA 종이 접기 솔루션을 씻어. 핀셋을 사용하여 운모를 선택합니다. 에 물을 피펫기판, 핀셋의 끝을 향해 강하의 흐름. 여분의 물을 제거하기 위해 날카로운 움직임 아래로 운모를 흔들어. 물이 샘플의 오염을 피하기 위하여 핀셋을 향하여 흐를 수 있도록 직립 핀셋을 잡아.
- 1 분 동안 질소를 일정하게 (N 2)와 기판을 건조. 물기가 제거되어 있는지 확인합니다. 멸균의 추가 100 μL와 린스를 반복합니다. 추가로 3 분 동안 N 2 기판을 건조시킨다. 완전히 건조 기판 성공적인 원자력 현미경 (AFM) 분석 (도 4)에 필요하다.
- 밀폐 용기에 AFM 또는 저장소를 사용하여 기판을 분석한다.
/ 실리콘 청소 셋업 4. CMOS
- 주의 : CMOS 설정을 사용하는 경우, 항상 개인 보호 장비를 사용합니다. 시약은 강산, 강염기, 불화 수소산 (HF) 및 CA 강한 산화제를 포함시약이 제대로 처리되지 않을 경우 N 폐 용매와 반응. 다음 안전주의 사항을 준수 :
- 다른 프로세스 나 셋업과 화학 후드 하우스 CMOS 벤치.
- CMOS 벤치를 사용할 때 니트릴 장갑, 실험실 코트, 안전 고글, 큰 산업 니트릴 장갑, 유출 앞치마, 그리고 항상 얼굴 가리개를 착용 할 것.
- 솔루션이 준비 될 때 보조 봉쇄와 같은 플라스틱 통을 사용합니다.
- 농축 된 HF 처리를위한 불활성 불소계 고분자 측정 비커를 사용합니다.
- 어떤 피부 노출에 대한 응급 처치 칼슘 글루코 네이트 연고를 사용할 수 있도록.
- 적절히 훈련 된 사람 만이 프로세스를 수행 할 수있다.
- 항상 랩의 또 다른 멤버가 비상시에 존재 확인.
- 후드에 모든 화학 물질에 대한 물질 안전 보건 자료의 정보를 유지합니다.
- 기관의 또는 회사의 화학 물질 유출 및 노출 정책에 익숙합니다.
참고 : HF 쉽게 피부를 침투노출이 발생하는 경우 뼈와 신경 손상에 영향을 미치는, 칼슘 소제이다. 농축 불화 수소산 몇 밀리리터 피부 노출 위험조차 치명적일 수있다. 발생하지 않습니다 노출을 보장하기 위해 필요한주의 사항을 설정합니다.
- 별도의 핫 플레이트에 별도의 250 mL 유리 비커에 RCA1과 RCA2을 수행합니다. 각 비커는 교반 막대를 포함해야합니다. 교반 막대는 전구에 쾅하지 않도록 고정 온도계를 사용하여 용액의 온도를 모니터링합니다. 증발의 영향을 감소하기 위해 시계 접시를 사용하여 비이커 커버.
- RCA1 준비
- 측정 비커를 사용하여 지정된 RCA1 비이커에 18 MΩ X 센티미터에 50 ml의 물을 넣습니다.
- 비커에 진한 수산화 암모늄 15 ㎖ (NH 4 OH)를 추가한다. 물 25 mL를 측정 비커를 씻어 RCA1 비커에 세정 수를 추가합니다.
- 열판에 열 교반기를 켜고 70 ° C에 RCA1 목욕을 가지고.
- RCA1 비이커에 30 % 과산화수소 (H 2 O 2)의 15 ㎖의 추가. H 2 O 2 후 1 시간 이내에 RCA1 솔루션을 사용하는 추가되었습니다. 과산화수소 15 ㎖를 목욕마다 첨가하면 조 사흘의 범위 내에서 여러 번 사용될 수있다.
- 물로 측정 비커를 씻어 적절한 RCA1 폐기물 병에 린스를 폐기합니다.
- RCA2 준비
- 철저하게 세척 측정 비커를 사용하여 지정된 RCA2 비커에 18 MΩ X 센티미터 물 70 ML을 추가합니다.
- 진한 염산 (HCL)의 15 ML을 추가합니다. 물 20ml와 측정 비커를 씻어 RCA2 비커에 추가합니다.
- 열을 증가시키고 용액을 70 ° C에 도달 할 때까지의 속도를 열판 교반한다.
- 30 % H 2 O 2의 15 ML을 추가합니다. RCA1 목욕과 마찬가지로, H 2 O 2가 추가 될 때부터 1 시간 내에서이 솔루션을 사용한다; 또한, 욕조H 2 O (2)의 15 ㎖를 각각 사용 전에 첨가하면 사흘 기간 내에 여러 번 재사용 될 수있다.
- HF 용액 준비
- 불활성 불소 중합체 비커에 물 50 ㎖를 놓습니다.
- 측정 4 플라스틱 측정 비이커에서 농축 불화 수소산 (49 %)의 용액 및 불활성 불소계 고분자 비이커에 추가.
- HF 비이커에 린스 물을 첨가, 50 ml의 물 개의 비이커 측정 플라스틱을 헹군다. 물로 측정 비커를 씻어 내고 지정된 HF 폐기물 용기의 세척을 버린다.
5. 준비 및 실리콘 기판을 세정
- 칩으로 실리콘 웨이퍼를 절단
- 실리콘 웨이퍼의 연마면에 평평한 수직 격자와 평행 한 방향을 식별한다. 이러한 방향은 절단 사각형 더욱 쉽게하기 위해 사용된다. 다음은 cleav에 관련된실리콘 <110> 보내고과 것은 다른 결정 방위에 적합하지 않을 수 있습니다.
- 이러한 냅킨 같은 부드러운 표면에 실리콘 웨이퍼 연마 측 업을 놓습니다. 다이아몬드 팁 스크라이브 펜, 기본 평면 가장자리를 따라 웨이퍼의 부드럽게 닉 바닥을 사용. 닉 아래, 같은 클립 같이 작은 와이어를 놓고 부드럽게 닉의 양쪽에 손가락이나 핀셋을 배치하고 아래로 밀어 웨이퍼에 압력을 적용합니다. 이렇게하면 자연의 절단 방향의 결정 격자 선을 따라 두 부분으로 웨이퍼를 분리합니다.
- 다른 냅킨, 연필 및 통치자로, 상단과 냅킨의 하단 모두에 점을 표시하여 사각형의 원하는 폭을 측정한다. 직선이 점을 연결합니다. 이것은 심지어 정사각형 모양에 대한 가이드 라인이 될 것입니다.
- 장소 웨이퍼의 한 라인에 플러시 냅킨에 측정 선 사이에 에지 최초의 반 단계 5.1.2에서 갓 PIEC 수직 고장을 반복ES는 이제 절단 사각형의 폭이어야한다. 냅킨에 수평으로 웨이퍼를 돌립니다. 수직 라인 사이를 놓고 단계 5.1.2의 과정을 반복한다.
- 긁힘 방지하기 위해 탈 이온수로 가득 깨끗한 유리 병에 갓 절단 웨이퍼 칩을 저장합니다. 실리콘 칩은 무한정 저장 될 수 있지만, 실험을 시작하기 전에 세척되어야한다.
- 실리콘의 CMOS 청소
- RCA1 용액이 적절한 온도에 도달하면. 산소 기포가 칩 및 비이커 벽에 형성된다.이 "직경 불활성 불소계 고분자 바구니를 사용하여 용액에서 열 1cm X 1cm 실리콘 칩 여덟 잠수함 NO이면 버블 링은 2 O 2가 저하 H, 발생합니다. 서로 붙지 칩을 유지하기 위해 아래로 몇 분 간격으로 10 ~ 20 분 동안 용액에 칩을 남겨 바구니를 교반합니다.
- 최대 실리콘 칩이 들어있는 바구니를 들고 잘 배수. T를 통해 바구니를 이동및 폐기물 비커 O를 18 MΩ X의 형상 물로 깨끗이 헹군다. 세척 비커에 담그고까지 흔들 리기 아래로 20 초 동안. 바구니 배수 및 폐기물 비커에 걸쳐 물로 깨끗이 헹군다. RCA1 지정 폐기물로 폐기 병 비이커를 비우고 물로 리필.
- RCA1 세정이 완료된 후 10 ~ 20 초 동안 1시 50분 HF 비이커에 바구니를 배치했다. 칩 및 HF를 섞어 부드러운 상하 움직임을 사용합니다. HF가 완전히 떨어져 배출 할 수 있도록 덩크 양동이를 들어 올립니다.
참고 :이 칩의 표면은 소수성한다 물이 칩 젖은, 대신 높은 접촉 각도 방울을 형성하지 않습니다. 이것은 실리콘 산화물 에칭되었고 칩은 현재의 Si-H 결합에 의해 종료되는 것을 나타낸다. - 세척 비커를 놓고 플라스틱 욕조에 비커를 씻어, 린스 비커 위에 바구니를 이동하고 18 MΩ X 센티미터의 물로 씻어. 세척 비커에 바구니 잠수함 20 초 동안 교반.
- 두 번째 드레인과 rins를 완료18 MΩ X 센티미터 물 E주기. 린스 비이커에 세척수를 버리고 물로 세척 비이커 리필. 지정된 플라스틱 HF 폐기물 병에 모든 폐기물을 따르십시오.
- RCA2 용액이 적절한 온도에 도달되면 상기 바스켓을 사용하여 용액에 실리콘 칩 잠수함. 10 ~ 20 분 동안 용액에 둡니다. 이 칩은 지금 인해 얇은 (1-2 ㎚) 산화막의 성장에 친수성 될 것입니다.
- 시간의 적절한 양 후에 제거하고 RCA1와 동일한 세척 절차를 따르십시오. 해당 RCA2 폐기물 용기에 폐기물 폐기하십시오. 플라스틱 핀셋 바구니에서 각각의 칩을 제거 물로 씻어, 질소로 바람을 불어 건조.
- 플라스틱 웨이퍼 상자에 18 MΩ X 센티미터의 물을 유리 병에 보관 칩. 청소 후 약 3 일 동안 물에 저장 될 때 실리콘 깨끗한 유지됩니다. 작업 영역이 제대로 정리되어 있고 CMOS 장갑의 외부를 세척되어 있는지 확인합니다. CM을 남겨주세요후드 OS 장갑 건조.
APTES 기능화 실리콘 6. 입금 DNA 종이 접기
- 실리콘에 자기 조립 단분자막 형성
- 열기 전에 실온으로 따뜻한 APTES. 병이 너무 차가운 경우, 응축 보관시 APTES의 가수 분해를 일으키는 원인이 될 수 있습니다. 18 MΩ X 센티미터 물 1,980 μL와 혼합하는 깨끗한 섬광 유리 병 및 소용돌이에 APTES의 20 μl를 추가합니다. 바로이 솔루션을 사용합니다.
- , 섬광 유리 병에 청소 실리콘 칩 반사 측 업을 놓고 그것을 캡, 20 분 동안 앉아 보자. 핀셋을 사용하여 칩을 제거하고 200 물 μL 및 N 2의 흐름과 함께 1 분 동안 건조 씻어.
- APTES 기능화 실리콘에 DNA 종이 접기를 입금
주 : 기능화 실리콘에 DNA 종이 접기를 증착하는 단계는 운모에 증착하는 것과 유사합니다.- 간단히 DNA 종이 접기 유리 병 및 피펫에게 솔루션의 4 μL를 혼합실리콘 기판 상. 필요한 경우, 관능 규소 운모 기판보다 더 소수성이기 때문에, 전체 기판을 커버하도록 사용되는 DNA 접기 용액의 부피를 증가시킨다. 다운 증착 용액을 누르는지 장기간 동안 증발 증착을 방지하기 위해 유리 커버 슬립을 사용한다.
- 용액의 농도는 사용하기 위해 필요한 시간의 양은 원하는 적용 범위에 대해 스탠드 (표면에 따르면 시간과 농도의 효과를도 2 및도 3 참조)를 보자. 멸균 18 MΩ X 센티미터 물 100 ㎕로 기판을 세척하여 1 분 동안 N 2와 건조.
- 멸균의 추가 100 μL로 세정을 반복하고 3 분 동안 N 2 기판을 건조.
- 추가 실험 또는 이미징을 수행 할 수있을 때까지 깨끗한 용기에 샘플을 저장합니다. 샘플은 어떻게 무에 따라 스토리지의 약 1-2주 후 입자의 축적을 보여주기 시작채널 그들은 처리됩니다.
7. AFM 이미징 및 DNA 종이 접기 샘플의 이미지 분석
- 영상을 위해 공기 모드를 누르면에서 AFM을 사용합니다. 탭핑 모드하면 최소한의 힘은 접촉 모드에 비해 약해 나노 구조물에 적용되는 것을 보장한다.
참고 : 영상 매개 변수는 악기에 의존 할 것이다. 제시된 모든 이미지는 멀티 모드 나노 스코프 스코프 IIIa를 사용하여 캡처했다. - 골드 반사 코팅 공기 모드를 눌러 비접촉 선택 AFM 프로브 / 300 kHz의 ~의 공진 주파수 (공칭), 40 N / M 및 팁 반경 <10 나노 미터의 일정한 힘.
- 공정 및 나노 스코프 분석 소프트웨어를 사용하여 AFM 이미지를 분석한다. ImageJ에를 사용하여 커버리지 계산을 수행합니다. (19)
결과
두 변수는 기판 상에 DNA 접기의 범위를 지시 : 용액의 농도 및 노출 시간. 흡착 운모에 DNA 접기의 특성 및 작용 화 실리콘 산화물을 APTES 이전에보고되어있다. (13)을 증착 용액 및 운모에 최종 커버리지에서 DNA 접기의 농도 간의 관계를 농도 증가의 결과를 나타낸 표 1 및도 2에 나타내었다 증가 범위에서. 바인딩의 시간 의존성은 그림 3. 표면 범위에서 볼 수는 이전에 운모에 DNA 종이 접기의 결합 행동 수정 실리콘 산화물 표면을 정량화하는 연구 하였다. 1X TAE 버퍼에 12 mM의 마그네슘의 DNA 종이 접기는 표면에 30 분 흡수 시간 후 운모에 83.3 %, 3.1 % ± 범위를 가지고있다. APTES의 SAMs 변성 실리콘 산화물에 따르면 최대 운모에 따르면 최대 미만 60 분 후에 관찰되었다.높은 표면 적용 범위는 산화 규소 관능 APTES에 필요한 경우 더 긴 증착 시간이 필요하다.
가난한 샘플 준비를 일으킬 수있는 여러 가지 변수가 있습니다. 가장 골칫거리는 불충분 한 세척 및 건조입니다. 완충액이 적절히 세정되지 않으면, 큰 응집체가 기판 (도 4a)를 형성한다. 나노 구조 표면 (그림 4B)에 마그네슘 염의 패치에 부착 할 때 'DNA 종이 접기 섬'이 관찰된다. 마지막으로, 높은 샘플에 따르면, 그것은 어려운 AFM을 이용한 나노 구조를 차별화 할 수있게 개별적인 DNA 접기 (도 4C) 사이의 브릿 징 버퍼 과잉 성분을 갖는 것이 가능하다. 이들 결과는 모두 운모 및 실리콘 기판에 대한 철저한 세척과 건조 프로토콜을 수행하여 피할 수있다.
산화 규소 기판 상에 APTES 필름의 형성뿐만 아니라 문제를 제기 할 수있다. 실리콘 웨이퍼는이제거해야 거친 실리콘 산화물 층이 기능화 전에 개질 부드럽고 얇게 실리콘 산화막. 적절하게 세정 된 실리콘 기판이도 5a에 도시되어있다. 실리콘 웨이퍼의 세정 동안, 두 개의 칩은 시약 (도 5b)에 대한 노출을 차단하고, 서로에 붙어하게하는 것이 가능이기 때문에, 반드시 실리콘 칩의 개수가 너무 높지 않은 것이 중요하다. 세정 실리콘 일주일 이상 18 MΩ의 X cm 물에 기억되어있는 경우, 오염 물질 층을 재 형성하며 recleaning 필요하다. APTES 공급 장치는 시료 준비에 문제가 발생할 수 있습니다. APTES 용이 단층 형성을위한 기초가되는, 가수 분해 중합한다. (20)이 중합의 정도 APTES가 노출되는 물의 농도에 의존한다. 시간이 지남에 따라 그리고 반복 사용으로 물 APTES 병 안에 응축을 오염하는 것이 가능하다공급. 그 결과 중합은 기판 (그림 5C)을 준수 큰 집계를 생산하고 있습니다. 증가 된 조도 및 집계의 존재는 어려운 AFM을 이용하여 DNA 나노 구조를 식별합니다. 그것은 냉장고에 비닐 봉지에 APTES 병을 저장하고, APTES가 응축을 방지하기 위해 열기 전에 실온으로 따뜻한 병 수 있도록하는 것이 좋습니다.
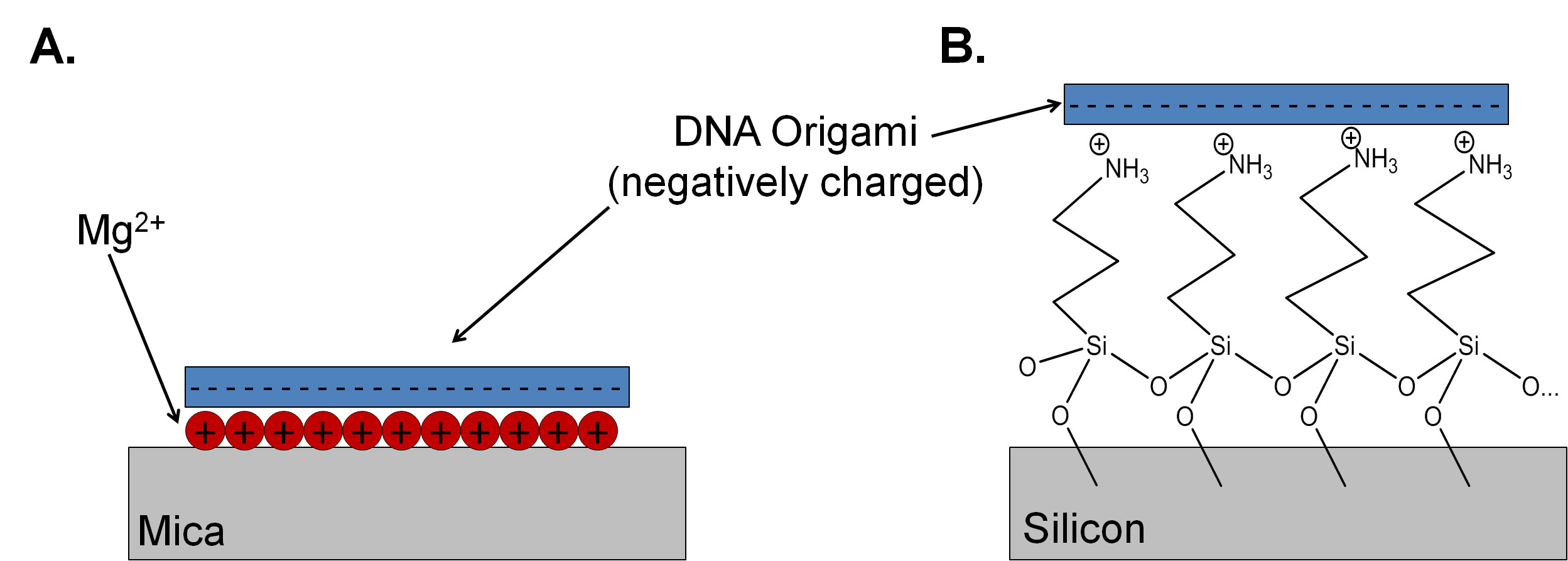
도 1 운모 바인딩 개략도 (A) 운모 및 (B)의 DNA 접기위한 결합기구를 비교하는 기능화 APTES 산화 규소 (일정한 축척에 따른 것은 아님). 가의 양이온, 통상의 Mg 2+의 존재에 의해 매개된다. 양성자 화 아민의 단층을 3- 아미노 프로필 트리에 톡시 실란이 산화 실리콘 기판 상에의 접착을 촉진하기 위해 사용된다 종료.
도 (A)가 2nm, (B) 4 nM의, 및 (C)에 6 nM의 운모. 모든 화상 높이 스케일이 5 내지 10 분간 증착 한 후 가변 범위를 나타내는 2 AFM 이미지.

1X TAE 버퍼 2 나노 DNA 종이 접기, 12 mM의 마그네슘 그림 표면 범위 3. 동향 2+. MICA = 보라색 라인과 원 마커, APTES = 노란색 라인과 삼각형 표식. N = 표준 오차의 결정 3.

그림 4. 불량 세척 및 건조에 나노 구조의 (A) 기판 상에 솔루션을 통합, (B)의 DNA 종이 접기 섬, 및 (c) 브리징이 발생할 수 있습니다과량 완충 염의 존재하에 높은 커버리지 샘플. 모든 화상 높이 스케일은 5 ㎚이다.

그림 5. (A) 청소 실리콘은 1 평방 미크론 이상 0.5 미만의 RMS 거칠기를 가져야한다. 전체 APTES SAM은 (B). 1 평방 미크론 이상 (1) (A)보다 RMS 거칠기 이하가 있어야 좋은 자연 산화막에 증착 1 평방 미크론 이상 2.29 나노 미터의 RMS 거칠기와 불완전 청소 실리콘 산화막을 형성 필름을 APTES. . APTES 막의 갭 및 조도를 참고 (C)는 응축수로 오염 된 폐기물 APTES의 샘플로부터 형성된 표면 APTES; APTES 병 형태의 큰 입자의 가수 분해. 모든 이미지의 높이 규모는 5 ㎚이다.
varyin와 운모 기판 표 1. 퍼센트 범위 측정G DNA 종이 접기 용액의 농도. 모든 증착 시간은 10 분이다.
| DNA 종이 접기 솔루션 | 운모 기판에 % 적용 범위 |
| 2 nM의 | 8.49 ± 2.67 (N = 5) |
| 4 nm의 | 55.89 ± 5.65 (N = 3) |
| 6 nM의 | 77.44 ± 1.89 (N = 4) |
토론
일관되고 이상적인 결과를 달성하기 위해 강조해야 할 몇 가지 단계가 있습니다. 운모 샘플 엄격한 철저한 세척을 다음과 같이 3.3 및 3.4에서와 같이, 정권 건조 개별 DNA 접기의 고품질 화상이 대표 결과 섹션에서 설명한 다양한 문제없이 AFM을 이용하여 달성 될 수 있다는 것을 보장한다. 실리콘 샘플을위한 가장 중요의 기판의 청결도이다. 철저 꼼꼼하게 단계 5.2에서 설명한 세정 절차에 따라 적절하게 세정하는 것은 실리콘 산화막의 표면이 달성되도록 보장 할 것이다. 또한, 품질과 과산화수소, 불산과 같은 화학 약품 APTES의 유효성을 모니터링하는 과정을 원활하게 실행되도록한다.
설명 된 기술들은 APTES의 수용액에 한정되지 않는다. APTES와 trimethylaminopropyltrimethoxysilyl 클로라이드 (TMAC)의 혼합 단층은 우리를 할 수 있습니다조정에 ED 실리콘 표면 전하 및 변수의 DNA 종이 접기 접착력을 촉진한다. 11 TMAC은 영구적으로 충전 단자 급을 포함 아민 -N (CH3) 3 +, APTES의 pH 의존성 요금에 비해. 용액 환경 양성자 상태 또는 TMAC 캔 곡의 용액 농도 혼합 단분자막의 표면 전하를 변화 TMAC의 전하에 영향을 미치는 상기 기판과 DNA 접기 사이의 상호 작용에 영향을주지 않기 때문이다. 최적 DNA 접기는 SAM을 100 % 내지 40 % 농도의 TMAC 함유에 대응 0.75-1.5 전하가 2nm /의 표면 전하를 갖는 단층 관찰되었다 바인딩. 이 최적의 표면 전하가 APTES SAM에 120 종이 접기 / TMAC 샘스에 μm의 2에 약 110 종이 접기 / μm의 2의 DNA 종이 접기 커버리지를 자극했다.
실리콘의 장점 중 하나는 리소그래피 패터닝 공정과의 호환성이다. 높은 마그네슘농도는 규소에 DNA 접기의 선택적 결합을 촉진하기 위해, 플라즈마 - 처리 된 실리콘 산화물이 함께 사용될 수있다. 거리 마그네슘 이온 헹굼 피하기 위해 증착 용액에서 샘플을 제거하고 DNA 접기 변형 때는주의해야한다. 공유 실리콘 산화물 표면에 양이온을 부착 21,22 APTES 처리 형태를 세척하도록 또는 완충액 또는 물 않는 린스 첨부 된 DNA 종이 접기에 손상을주지. '분자 리프트 오프'방법은 실리콘 기판을 패터닝 및 DNA 종이 접기 접착을 촉진하기위한 또 다른 가능한 노선이다. 실리콘 기판은 전자 빔 리소그래피를 이용하여 패터닝되고 APTES는 노광 된 기판 상에 증착된다. 포토 레지스트 리프트 오프 후, DNA 접기 우선적 APTES 결합, 패턴 화 된 표면 상에 증착 될 수있다. (23)
기판과의 DNA 종이 접기의 상호 작용은 연구와 응용 프로그램에 대한 새로운 길을 열고, 안정성을 변경합니다. DNA의 origam나는 나노 크기의 볼 변경 및 최소한의 화학적 변화없이 150 ℃로 가열 할 수있다 운모에 부착. (24)이 나노 구조는 70 ° C. 25 위 탈 혼성화 완료 용액에서 DNA 종이 접기의 취약성, 완전히 대조적이다, (26)이 가열 된 안정성은 산화 실리콘 기판 상에 유지된다.도 27 헥산, 톨루엔, 에탄올, 형상 및 나노 구조물에 따르면 등 다양한 용매 시스템에서 유지된다. DNA 접기의 놀라운 안정성은 플라즈마 강화 증착, 포토 레지스트와 공통 용매의 사용, 독특한 화학적 증착 환경 바와 호환 생각 하였다 애플리케이션, DNA 접기와 함께 사용될 수 있음을 나타낸다. 그러나, DNA 종이 접기는 그 기능을 유지할지 여부를 아직 알 수없는 가능한 응용 프로그램을 제한 할 수 있습니다.
고온에서의 DNA 종이 접기의 안정성 비록S 및 용매 시스템의 제한된 수 결정된에서, 기판 상에 DNA 접기의 장기 안정성은 아직 알려져 있지 않다. 멸균 기법을 사용 가능한 오염을 방지 할 필요가 있지만,이 표면은 증착 후 회피 할 수 없다. 이미징 및 시료 분석은 시료 전처리 후 거의 즉시 완료해야합니다; 시료 입자의 축적 및 깨진 DNA 나노 구조물을 포함한 시료 분해 다양한 예는 종종 식별된다 (주 초과) 너무 오래 저장된 경우. 나노, 바이오 센서, 및 다른 기판 기반 DNA 접기 응용 가능한 연구 도로는 DNA의 시간 의존 불안정화에 의해 제한 될 수있다. 오랜 기간 동안 안정성을 필요로하는 애플리케이션을 위해 이러한 기술의 한계를 확인하는 것은 추가 조사가 필요합니다.
공개
The authors have nothing to disclose.
감사의 말
The authors thank Dr. Gary Bernstein for use of the AFM.
자료
| Name | Company | Catalog Number | Comments |
| Eppendorf epT.I.P.S. Reloads, capacity 2-200 μl | VWR International, LLC | 22491733 | 10 reload tray of 96 tips |
| Microcentrifuge Tubes, Polypropylene | VWR International, LLC | 87003-290 | 0.65 ml, natural |
| Research Plus Pippete - Single Channel - 20-200 μl | A. Daigger & Company, Inc. | EF8960F-3120000054 EACH | Adjustable Volume |
| Research Plus Pippete - Single Channel - 2-20 μl | A. Daigger & Company, Inc. | EF8960D-3120000038 EACH | Adjustable Volume |
| Scotch 237 Permanent Double-Sided Tape | Office Depot, Inc. | 602710 | 3/4" x 300", Pack of 2 |
| Vortex Mixer | Thermo Scientific | M37610-33Q | |
| Wafer container single, 2" (50 mm), 60 mm x 11 mm | Electron Microscopy Sciences | 64917-2 | 6 per pack |
| 6" Wafer, P-type, <100> orientation, w/ primary flat | Nova Electronic Materials, Ltd. | GC49266 | |
| Powder-Free Nitrile Examination Gloves | VWR International, LLC | 82062-428 | Catalog number is for size large |
| High Accuracy Noncontact probes with Au reflective coating | K-Tek Nanotechnology, Inc. | HA_NC/15 | |
| Autoclave Pan | A. Daigger & Company, Inc. | NAL692-5000 EF25341C | |
| Sol-Vex II Aggressive Gloves, Size: 9-9.5; 15 mil, 13 inch - 1 dz | Spectrum Chemical Mfg. Corp. | 106-15055 | Before use, rinse with water and scrub together until no bubbles form on the gloves. |
| Tweezers PTFE 200 mm Square | Dynalon Corp. | 316504-0002 | |
| Muscovite Mica Sheets V-5 Quality | Electron Microscopy Sciences | 71850-01 | 10 per pack |
| Mica Disc, 10 mm | Ted Pella, Inc | 50 | Mica discs are optional |
| Scriber Diamon Pen for Glassware | VWR International, LLC | 52865-005 | |
| Scintillation Vials, Borosilicate Glass, with Screw Cap - 20 ml | VWR International, LLC | 66022-060 | Case of 500, with attached polypropylene cap and pulp foil liner |
| 4 x 5 Inch Top PC-200 Hot Plate, 120 V/60 Hz | Dot Scientific, Inc. | 6759-200 | |
| Straight-Sided Glass Jars, Wide Mouth | VWR International, LLC | 89043-554 | Case of 254, caps with pulp/vinyl liner attached |
| Standar-Grade Glass Beaker, 250 ml Capacity | VWR International, LLC | 173506 | |
| Beakers, PTFE | VWR International, LLC | 89026-022 | For use with HF |
| Shallow form watch glass, 3" | VWR International, LLC | 66112-107 | Case of 12 |
| Plastic Storage Container | VWR International, LLC | 470195-354 | For secondary container |
| General-Purpose Liquid-In-Glass Thermometers | VWR International, LLC | 89095-564 | |
| High precision and ultra fine tweezers | Electron Microscopy Sciences | 78310-0 | |
| Polycarbonate Faceshield | Fisher Scientific, Inc. | 18-999-4542 | |
| Neoprene Apron | Fisher Scientific, Inc. | 19-810-609 | |
| Calcium Gluconate, Calgonate | W.W Grainger, Inc. | 13W861 | Tube, 25 g |
| Hydrogen Peroxide 30% CR ACS 500 ml | Fisher Scientific, Inc. | H325 500 | HARMFUL, TOXIC |
| 3-Aminopropyltriethoxysilane | Gelest Inc. | SIA0610.0-25GM | Let warm to room temperature before use. |
| Ammonium hydroxide, 2.5 L | Fisher Scientific, Inc. | A669-212 | HARMFUL, TOXIC |
| Hydrochloric acid | Fisher Scientific, Inc. | A144-212 | HARMFUL, TOXIC |
| Hydrofluoric acid | Fisher Scientific, Inc. | A147-1LB | HARMFUL, TOXIC |
| MultiMode Nanoscope IIIa | Veeco Instruments, Inc. | Any AFM capable of tapping mode is suitable for analysis | |
| Dunk basket | Made in lab | Made in lab | The dunk basket was made using the bottom of a PTFE bottle with holes drilled in, PTFE handle, and all PTFE screws. |
참고문헌
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440, 297-302 (2006).
- Anderson, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-77 (2009).
- Wang, Z., Ding, B. Engineering DNA Self-Assemblies as Templates for Functional Nanostructures. Acc. Chem. Res. 47, 1654-1662 (2014).
- Xu, K., et al. Graphene Visualizes the First Water Adlayers on Mica at Ambient Conditions. Science. 329, 1188-1191 (2010).
- Bustamante, C., et al. Circular DNA-molecules imaged in air by scanning force microscopy. Biochemistry. 31, 22-26 (1992).
- Hsueh, C., et al. Localized Nanoscopic Surface Measurements of Nickel-Modified Mica for Single-Molecule DNA Sequence Sampling. ACS Appl Mater. Interfaces. 2, 3249-3256 (2010).
- Pastre, D., et al. Anionic polyelectrolyte adsorption on mica mediated by multivalent cations: A solution to DNA imaging by atomic force microscopy under high ionic strengths. Langmuir. 22, 6651-6660 (2006).
- Woo, S., et al. Self-assembly of two-dimensional DNA origami lattices using cation-controlled surface diffusion. Nature Communications. 5, 4889(2014).
- Vesenka, J., et al. Substrate preparation for reliable imaging of DNA molecules with the scanning force microscope. Ultramicroscopy. 42-44, 1243-1249 (1992).
- Adsorption studies of DNA origami on silicon dioxide. Albrechts, B., et al. 21st Micromechanics and Micro Systems Europe Workshop 2010, , (2010).
- Sarveswaran, K., et al. Adhesion of DNA Nanostructures and DNA Origami to lithographically patterned self-assembled monolayers in Si[100]. Proc. of SPIE-Soc. Opt. Eng. 7637, 76370M-1(2010).
- Kern, W., Puotien, D. A. Cleaning solutions based on hydrogen peroxide for use in silicon semiconductor technology. RCA Rev. 31, 187-206 (1970).
- Pillers, M., Goss, V., Lieberman, M. Electron-Beam Lithography and Molecular Liftoff for Directed Attachment of DNA Nanostructures on Silicon: Top-down Meets Bottom-up. Acc. Chem. Res. 47, 1759-1767 (2014).
- Saccá, B., Niemery, C. M. DNA Origami: The Art of Folding DNA. Angew. Chem. Int. Ed. 51, 58-66 (2012).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Res. 37, 5001-5006 (2009).
- Ben-Ishay, E., et al. Designing a Bio-responsive Robot from DNA. Origami. J. Vis. Exp. (77), e50268(2013).
- Woo, S., et al. Programmable molecular recognition based on the geometry of DNA nanostructures. Nature Chemistry. 3, 620-627 (2011).
- Schlegel, M. L., et al. Cation sorption on the muscovite (001) surface in chloride solutions using high-resolution X-ray reflectivity. Geochim. Cosmochim. Acta. 70, 3549-3565 (2006).
- Rasband, W. S., Howarter, J. A., et al. National Institutes of Health. Langmuir. 22, Bethesda, Maryland, USA. 11142-11147 (2006).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4, 557-561 (2009).
- Hung, A. M., et al. Large-area spatially ordered arrays of gold nanoparticles directed by lithographically confined DNA origami. Nature Nanotechnology. 5, 121-126 (2010).
- Sarveswaran, K., et al. et al.Adhesion of DNA nanostructure and DNA origami to lithographically patterned self-assembled monolayers on Si[100. Proc. SPIE-Int. Soc. Opt. Eng. 7637, 76370M(2010).
- Pillers, M. A., Lieberman, M. Thermal stability of DNA origami on mica. J. Vac. Sci. Technol. B. 32, 040602(2014).
- Song, J., et al. Direct Visualization of Transient Thermal Response of a DNA. Origami. J. Am. Chem. Soc. 134, 9844(2012).
- Wei, X., et al. Mapping the thermal behavior of DNA origami nanostructures. J. Am. Chem. Soc. 135 (16), 6165-6176 (2013).
- Hyojeong Kim,, et al. Stability of DNA Origami Nanostructures under Diverse Chemical Environments. Chem. Mater. 26, 5265-5273 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유