Method Article
إعداد ميكا والسيليكون ركائز لDNA اوريغامي التحليل والتجريب
In This Article
Summary
Reproducible cleaning processes for substrates used in DNA origami research are described, including bench-top RCA cleaning and derivatization of silicon oxide. Protocols for surface preparation, DNA origami deposition, drying parameters, and simple experimental set-ups are illustrated.
Abstract
The designed nature and controlled, one-pot synthesis of DNA origami provides exciting opportunities in many fields, particularly nanoelectronics. Many of these applications require interaction with and adhesion of DNA nanostructures to a substrate. Due to its atomically flat and easily cleaned nature, mica has been the substrate of choice for DNA origami experiments. However, the practical applications of mica are relatively limited compared to those of semiconductor substrates. For this reason, a straightforward, stable, and repeatable process for DNA origami adhesion on derivatized silicon oxide is presented here. To promote the adhesion of DNA nanostructures to silicon oxide surface, a self-assembled monolayer of 3-aminopropyltriethoxysilane (APTES) is deposited from an aqueous solution that is compatible with many photoresists. The substrate must be cleaned of all organic and metal contaminants using Radio Corporation of America (RCA) cleaning processes and the native oxide layer must be etched to ensure a flat, functionalizable surface. Cleanrooms are equipped with facilities for silicon cleaning, however many components of DNA origami buffers and solutions are often not allowed in them due to contamination concerns. This manuscript describes the set-up and protocol for in-lab, small-scale silicon cleaning for researchers who do not have access to a cleanroom or would like to incorporate processes that could cause contamination of a cleanroom CMOS clean bench. Additionally, variables for regulating coverage are discussed and how to recognize and avoid common sample preparation problems is described.
Introduction
لأول مرة في عام 2006، اوريغامي DNA تستخدم طبيعة الذاتي تجميع من [أليغنوكليوتيد DNA لإنتاج النانو designable وأمر غاية. 1 تم الإبلاغ عن عدد لا يحصى من الهياكل، بدءا من الوجوه المبتسمة لصناديق مغلق 3-الأبعاد. يمكن functionalized 2 DNA اوريغامي مع مختلف الجزيئات الحيوية والنانو، مما أدى إلى التطبيقات البحثية في الإلكترونيات النانوية، والطب، والحوسبة الكمومية. 3 ومع ذلك، فإن التحليل والعديد من التطبيقات في المستقبل، لا يعتمد فقط على التصميم الهيكلي، ولكن أيضا على التصاق النانو اوريغامي DNA على الأسطح. الطرق الموضحة في هذه المخطوطة تتعلق إعداد عينات DNA اوريغامي على نوعين من ركائز: الميكا وأكسيد السيليكون functionalized.
الميكا هو الركيزة الاختيار للدراسات اوريغامي الحمض النووي لأنه مسطح بالذرة، مع ارتفاع طبقة من 0.37 نانومتر ± 0.02 نانومتر. 4 وهو أيضا قمة شرق آسياتنظيف إيلي، مما يجعل إعداد العينات ومجهر القوة الذرية (AFM) دراسات واضحة. يحتوي ميكا بلدية موسكو كثافة عالية من البوتاسيوم في كل طائرة الانقسام، ولكن هذه الأيونات منتشر بعيدا عن سطح الميكا عندما تكون في الماء. للتوسط الربط اوريغامي الحمض النووي لالركيزة الميكا، ويستخدم المغنيسيوم 2+ لعكس شحنة سالبة من الميكا وكهربية ربط العمود الفقري الفوسفات الحمض النووي لالركيزة (الشكل 1A). 5 مخاليط DNA صلب بحضور كبير تجاوزات من خيوط الأساسية تعطي تغطية عالية وصور جيدة على الميكا لأن التصاق اوريغامي الحمض النووي لالمغنيسيوم 2+ سطح -terminated هو أقوى بكثير من التصاق [أليغنوكليوتيد واحدة الذين تقطعت بهم السبل (خيوط الأساسية). غيرها من أيونات موجبة الشحنة، بما في ذلك ني 2+ والتعاون 2+ يمكن أن تستخدم للسيطرة على التصاق DNA على الميكا. 6،7 تغيير تركيز أحادي التكافؤ وثنائي التكافؤ الكاتيونات في حل يمكن التوسط adheسيون ونشرها سطح معدلات اوريغامي DNA. 8 ومع ذلك، غالبا ما لا يوصف بروتوكول لإعداد ركائز الميكا وإيداع والشطف اوريغامي صراحة في المخطوطات التي تم نشرها. 9 بدون بروتوكول واضح، يمكن أن النتائج استنساخه يكون من الصعب الحصول عليها.
الميكا هو عازل، لذلك ليست مناسبة باعتبارها الركيزة لبعض التطبيقات في الإلكترونيات النانوية. السيليكون تخمل مع أكسيد الأصلي رقيقة له خصائص الإلكترونية مرغوب فيه، بما في ذلك التوافق مع إمكانية أشباه الموصلات أكسيد المعادن (CMOS) تجهيز مسبق لإنشاء إدخال الهياكل / الإخراج والميزات الطبوغرافية. ومطلية رقائق السليكون المخزنة في الهواء إما مع أكسيد الحراري سميكة أو رقيقة فيلم أكسيد الأصلي الذي هو القذرة نسبيا، مع عدد الجسيمات عالية. أكسيد السيليكون لديه أقل من ذلك بكثير كثافة الشحنة السطحية من الميكا، وكثافة الشحنة تعتمد بشكل كبير على إعداد أكسيد والتاريخ. في المغنيسيوم ABO تركيزات أيونهاء 150 ملم، التغطيات جيدة (تصل إلى 4 / ميكرون 2) اوريغامي DNA مستطيلة يمكن تحقيقه على الأكسجين البلازما تعامل ركائز السيليكون. ومع ذلك، هذا التركيز والتغطية قد تتغير اعتمادا على حجم وتصميم النانو المستخدمة. 10 إن بروتوكول بديل لضبط الشحنة السطحية هو إرفاق أحادي الطبقة الموجبة من 3 aminopropyltriethoxysilane (APTES) (الشكل 1B) الذاتي تجميعها ل أكسيد. يمكن البروتونية وأمين أساسي على APTES في قيم الرقم الهيدروجيني أقل من 9 وتعديل التهمة وللا مائية الركيزة. 11 لأحادي الطبقة كاملة من APTES تودع بنجاح، والسيليكون يجب أن تنظف بشكل مناسب باستخدام هيئة الإذاعة الأمريكية (RCA) البروتوكولات . وتشمل هذه البروتوكولات العلاج في هيدروكسيد الأمونيوم ومحلول بيروكسيد الهيدروجين (RCA1) لإزالة المخلفات العضوية والملوثات الجسيمات. A حفر قصيرة في محلول حامض الهيدروفلوريك يزيل طبقة أكسيد الأم جنبا إلى جنب معأي ملوثات الأيونية التي تلتزم أكسيد. أخيرا، تتعرض العينات إلى حمض الهيدروكلوريك ومحلول بيروكسيد الهيدروجين (RCA2) لإزالة المعادن والملوثات الأيونية وتشكيل رقيقة، وطبقة أكسيد موحدة. وقد عينت 12 معظم غرف الأبحاث أغطية للبروتوكولات التنظيف CMOS، مع قواعد صارمة حول ما يمكن استخدامه في هذه المجالات. وهناك مشكلة مشتركة تأتي في شكل أيونات مثل الصوديوم، والذي يمكن أن يعطل خصائص الإلكترونية من الهياكل CMOS من خلال خلق الفخاخ midbandgap. تستخدم 13 الأيونات عادة في إعداد وترسب مخازن اوريغامي الحمض النووي يمكن أن يلوث حمامات CMOS ويسبب مشاكل للباحثين آخرين باستخدام الغرفة نظيفة. لهذا السبب، يستخدم مجموعتنا CMOS "القذرة" تنظيف مقاعد البدلاء رتبت خصيصا لعينات صغيرة تستخدم للبحث اوريغامي DNA. هذه العملية هي بديل جيد للالتقليدي غرف الأبحاث انشاء وربما تكون مناسبة للمختبرات التي ليس لديها إمكانية الوصول إلى مقعد CMOS غرف الأبحاث.
Protocol
1. تجربة التخطيط وتحضير المواد
- تحديد التصميم، والتركيز، وظائف اوريغامي DNA التي سيتم استخدامها في التجارب. 14-16 هنا، ونحن نستخدم تصميم DNA اوريغامي المستطيل أعدت في 1X TAE / المغنيسيوم 2+ حل (40 ملي تريس القاعدة، 20 مم حمض الخليك، 2 مم EDTA و 12 ملي خلات المغنيسيوم، ودرجة الحموضة 8.0) 17
- الأوتوكلاف كل النصائح، وأنابيب، وحاويات لاستخدامها. يجب على جميع هذه المواد يكون الأوتوكلاف متوافقة.
- إعداد العرض من الماء المعقم للالشطف. ملء وعاء معقم مع ما يقرب من 500 مل من 18 MΩ X سم المياه، ومكان على موقد، يغلي لمدة 5 دقائق مع غطاء الخروج، واتخاذ جرة الخروج من موقد والسماح لتبرد مع غطاء يوضع على الحاوية ولكن ليس شددت . تخزينها في الثلاجة وإعداد امدادات جديدة كل شهر أو عند الضرورة.
2. إعداد ميكا الركيزة
- قطع ركائز إلى الحجم المناسب (1 سم × 1 سم الساحات) مع مقص. الميكا رقيقة وهشة. بدلا من ذلك، شراء الميكا في شكل القرص الذي لا يحتاج إلى قطع.
- يلتصق الميكا باستخدام الشريط على الوجهين. يتكون الميكا من طبقات من المعادن مفصولة الإقحام الأيونات، كل طبقة يمكن خلع عندما انضمت إلى الشريط على الوجهين. 18
- ضع الساحات الميكا على الشريط على الوجهين لا يزال في موزع الشريط، والتأكد من التقيد بحزم على الشريط. الشريحة بعناية ملاقط بين الميكا والشريط، سيتم إزالة أعلى معظم طبقة وتبقى على الشريط. مباشرة بعد الإزالة، فإن الساحة الميكا يكون جانبها نظيفة أسفل. تأكد من الوجه الميكا أكثر من قبل تخزينها في وعاء.
- كرر ذلك ثلاث إلى أربع مرات لضمان إزالة كاملة من الطبقة العليا الأكثر والنظافة الكافية.
- بدلا من ذلك، والتمسك الميكا إلى وعاء أو فوق المنضدة بقطعة من الشريط مزدوجة من جانب واستخدام قطعة ثانية إلى sوضع علامة على وتقشر أعلى معظم طبقة الميكا. سيتم تنظيفها الميكا بشكل صحيح في كلتا الحالتين، على الرغم من أن طريقة بديلة يجعل إيداع DNA والشطف والتجفيف العينة صعوبة بسبب التصاق الثاني إلى الدعم.
3. إيداع DNA اوريغامي على ميكا
- لفترة وجيزة، ومزيج القارورة اوريغامي DNA باستخدام خلاط دوامة لضمان حتى تشتت النانو في الحل.
- ماصة 4 ميكرولتر من حل على الميكا، والتأكد من أن الطرف ماصة لا تلمس الركيزة. مغادرة اوريغامي DNA على الميكا لحوالي 10 دقيقة لضمان التغطية الكافية. الوقت ترسب سوف تختلف تبعا لتركيز اوريغامي DNA المستخدمة فضلا عن تغطية المطلوب (أرقام 2 و 3).
- شطف الحل اوريغامي DNA الخروج من الركيزة الميكا باستخدام 100 ميكرولتر من الماء المعقم أكثر من بالوعة أو غيرها من وعاء السائل. التقاط الميكا باستخدام الملقط. ماصة للماء علىالركيزة، مع تدفق الهبوط نحو غيض من ملاقط. يهز الميكا مع نزولا حركة حادة لإزالة الماء الزائد. عقد ملاقط تستقيم حتى أن المياه سوف تتدفق نحو ملاقط لتجنب تلوث العينة.
- يجف الركيزة مع دفق مستمر من النيتروجين (N 2) لمدة 1 دقيقة. تأكد من إزالة أي المياه الزائدة. تكرار شطف مع 100 ميكرولتر إضافية من الماء المعقم. يجف الركيزة مع N 2 لمدة 3 دقائق إضافية. A الركيزة جافة تماما ضرورية لمجهر القوة الذرية (AFM) التحليل الناجح (الشكل 4).
- تحليل الركيزة باستخدام AFM أو تخزينها في حاوية مغلقة.
4. CMOS / سيليكون تنظيف مجموعة المتابعة
- تنبيه: عند استخدام CMOS انشاء، واستخدام معدات الوقاية الشخصية في جميع الأوقات. وتشمل الكواشف الأحماض القوية والقواعد القوية، وحامض الهيدروفلوريك (HF)، وعوامل مؤكسدة قوية الذي كاليفورنيان تتفاعل مع المذيبات النفايات إذا لم يتم التخلص منها بشكل صحيح من الكواشف. الالتزام باحتياطات السلامة التالية:
- بيت CMOS مقاعد البدلاء في غطاء الكيميائية مع عدم وجود عمليات أخرى أو مجموعة عمليات.
- ارتداء قفازات النتريل، ومعطف مختبر، نظارات السلامة، وقفازات النتريل كبيرة الصناعية، وساحة التسرب، ودرع الوجه في جميع الأوقات عند استخدام مقاعد البدلاء CMOS.
- استخدام عبوات بلاستيكية كما الاحتواء الثانوي عند إعداد الحلول.
- استخدام المفلورة كوب قياس البوليمر خامل للتعامل مع HF المركزة.
- جعل الكالسيوم غلوكونات مرهم كما تتوفر الإسعافات الأولية لأي تعرض الجلد.
- السماح فقط موظفين مدربين تدريبا سليما لأداء هذه العملية.
- تأكد دائما من عضو آخر في المختبر موجود في حالة الطوارئ.
- الحفاظ على المعلومات MSDS لجميع المواد الكيميائية بالقرب من غطاء محرك السيارة.
- أن يكون على دراية المؤسسة تسرب المواد الكيميائية والتعرض سياسات الشركة أو.
ملاحظة: HF يتخلل بسهولة الجلدوهو زبال الكالسيوم، مما يؤثر على العظام والأعصاب الضارة إذا حدث التعرض. تعرض البشرة لبضع ملليلتر من حمض الهيدروفلوريك المركزة يمكن أن تكون خطيرة، وحتى مميتة. إنشاء الاحتياطات اللازمة لضمان التعرض لا يحدث.
- أداء RCA1 وRCA2 في منفصلة 250 مل الأكواب الزجاجية على سخانات منفصلة. يجب أن يحتوي كل كوب بقضيب. رصد درجات الحرارة من الحل باستخدام موازين الحرارة فرضت ذلك بقضيب لا فرقعة إلى لمبة. تغطية الأكواب باستخدام الزجاج ووتش للحد من آثار التبخر.
- إعداد RCA1
- وضع 50 مل من 18 MΩ X سم الماء في الكأس RCA1 المعينة باستخدام كوب القياس.
- إضافة 15 مل من هيدروكسيد الأمونيوم المركزة (NH 4 OH) إلى الدورق. شطف كوب قياس مع 25 مل من الماء وإضافة ماء الشطف إلى الكأس RCA1.
- بدوره على الحرارة والنمام على موقد وجلب حمام RCA1 إلى 70 درجة مئوية.
- إضافة 15 مل من 30٪ بيروكسيد الهيدروجين (H 2 O 2) إلى دورق RCA1. تمت إضافة استخدام الحل RCA1 في حدود 1 ساعة بعد H 2 O 2. الحمام يمكن استخدام عدة مرات في غضون فترة زمنية لا تتجاوز ثلاثة أيام إذا تم إضافة 15 مل من بيروكسيد إلى الحمام في كل مرة.
- شطف كوب القياس جيدا بالماء وتجاهل شطف في زجاجة النفايات RCA1 المناسبة.
- إعداد RCA2
- إضافة 70 مل من 18 MΩ X سم الماء إلى كوب RCA2 المعينة باستخدام كوب قياس تشطف جيدا.
- إضافة 15 مل من حمض الهيدروكلوريك المركز (حمض الهيدروكلوريك). شطف كوب قياس مع 20 مل من الماء وإضافته إلى كوب RCA2.
- زيادة الحرارة ويحرك سرعة موقد حتى يصل إلى حل 70 ° C.
- إضافة 15 مل من 30٪ H 2 O 2. مثل الحمام RCA1، استخدم هذا الحل في حدود 1 ساعة من عند إضافة H 2 O 2. بالإضافة إلى ذلك، فإن حماميمكن إعادة استخدامها عدة مرات خلال فترة زمنية لا تتجاوز ثلاثة أيام إذا تم إضافة 15 مل من H 2 O 2 قبل كل استعمال.
- HF إعداد الحل
- وضع 50 مل من الماء في دورق خامل البوليمر المفلورة.
- قياس 4 مل من حمض الهيدروفلوريك المركزة (49٪) في قياس كوب من البلاستيك وإضافته إلى كوب خامل البوليمر المفلورة.
- التشطيف البلاستيك قياس كأس مع ما مجموعه 50 مل من الماء، إضافة ماء الشطف إلى الكأس HF. تغسل كوب القياس جيدا بالماء وتجاهل الغسيل في حاوية النفايات HF المعينة.
5. إعداد وتنظيف الركيزة السيليكون
- قطع رقائق السليكون إلى شرائح
- التعرف على اتجاهات شعرية عمودية ومتوازية على سطح مصقول شقة للرقاقة السيليكون. وتستخدم هذه الاتجاهات للمساعدة في جعل الساحات الشق أسهل. الإرشادات التالية تتعلق cleavالسيليكون <110> جي وربما لا تكون مناسبة لتوجهات الكريستال أخرى.
- وضع رقاقة السيليكون مصقول جانب المتابعة على سطح ناعم، مثل منديل. باستخدام قلم الكاتب ذات الرؤوس الماس، بلطف نيك أسفل الرقاقة على طول حافة مسطحة الأولية. وضع الأسلاك الصغيرة، مثل مشبك، تحت نيك وتطبيق الضغط بلطف على الرقاقة عن طريق وضع الأصابع أو ملاقط على جانبي الشق، ودفع إلى أسفل. وسوف نفعل ذلك فصل رقاقة إلى نصفين على طول خط الكريستال شعرية في الاتجاه يلتصق الطبيعي.
- على منديل آخر، مع قلم رصاص ومسطرة، وقياس من العرض المطلوب من المربعات عن طريق وضع النقاط على كل من أعلى وأسفل منديل. ربط هذه النقاط مع خطوط مستقيمة. وهذا سيكون بمثابة توجيهي لالأشكال حتى مربع.
- مكان واحد للرقاقة نصفين الحافة الأولى بين السطور تقاس على منديل مسح على الخط وتكرار في الخطوة 5.1.2 وكسر حديثا عمودي PIECوينبغي أن يكون وفاق الآن عرض الساحات المشقوق. تحويل رقاقة أفقيا على منديل. وضعه بين السطور العمودية وتكرار هذه العملية في الخطوة 5.1.2.
- تخزين رقائق رقاقة المشقوق حديثا في قارورة نظيفة مملوءة بالماء DI لمنع الخدش. رقائق السيليكون يمكن تخزينها لأجل غير مسمى، ولكن يجب تنظيف قبل بدء التجارب.
- CMOS تنظيف السيليكون
- عندما وصلت الى حل RCA1 درجة حرارة مناسبة، غمر ثمانية إلى عشرة 1 سم × 1 سم رقائق السيليكون في حل باستخدام الخاملة سلة البوليمر المفلورة مع "قطر 2. سوف فقاعات الأكسجين تشكل على رقائق والجدران الكأس. إذا لم يكن هناك يحدث محتدما، وH 2 O 2 تتردى، واتركوا رقائق في حل لمدة 10 إلى 20 دقيقة، تهييج سلة صعودا وهبوطا كل بضع دقائق للحفاظ على رقائق من الالتصاق معا.
- رفع سلة تحتوي على رقائق السيليكون صعودا واستنزاف جيدا. نقل سلة أنحاء رس الكأس النفايات وشطف جيدا مع 18 MΩ X سم المياه. تزج في دورق غسل وتهزهز صعودا وهبوطا لمدة 20 ثانية. استنزاف سلة وشطف جيدا بالماء على الكأس النفايات. تفريغ الكأس النفايات في زجاجة النفايات RCA1 المعينة وإعادة ملء مع الماء.
- بعد التنظيف RCA1 اكتمال، ضع السلة في الدورق 01:50 HF لمدة 10 إلى 20 ثانية. استخدام الحركة لأعلى ولأسفل لطيف لمزيج الرقائق وHF. رفع دلو دونك للسماح للHF لتستنزف تماما.
ملاحظة: يجب أن تكون الأسطح رقاقة مسعور. الماء لن الرطب رقاقة، ولكن بدلا من ذلك شكل قطرات مع زوايا اتصال عالية. هذا يدل على أن أكسيد السيليكون تم محفورا بعيدا ويتم إنهاء رقاقة الآن بروابط سي-H. - ضع الكأس غسل وشطف الكأس في حوض من البلاستيك، ونقل سلة على الكأس شطف وشطف مع 18 MΩ X سم المياه. غمر السلة في الكأس غسل وتستنهض الهمم لمدة 20 ثانية.
- استكمال استنزاف الثاني وrinsدورة الإلكترونية مع 18 MΩ X سم المياه. تفريغ مياه الغسيل إلى الدورق شطف وإعادة ملء كوب غسل بالماء. صب كل النفايات في زجاجة النفايات HF البلاستيك المعينة.
- عندما وصلت الى حل RCA2 درجة حرارة مناسبة، غمر رقائق السيليكون في الحلول باستخدام السلة. ترك في حل لمدة 10 إلى 20 دقيقة. فإن رقاقة يكون الآن ماء بسبب نمو (1-2 نانومتر) أكسيد رقيقة.
- إزالة بعد كمية مناسبة من الوقت واتباع نفس الإجراءات الشطف بالنسبة للRCA1. التخلص من النفايات في حاوية النفايات RCA2 المناسبة. إزالة كل رقاقة من السلة مع ملاقط من البلاستيك، ويشطف بالماء، وضربة الجافة مع النيتروجين.
- متجر رقائق في مربع رقاقة من البلاستيك أو في قارورة من 18 MΩ X سم المياه. سوف السيليكون تبقى نظيفة عند تخزينها في الماء لمدة حوالي ثلاثة أيام بعد التنظيف. تأكد من أن منطقة العمل يتم تنظيف بشكل صحيح حتى وتم غسلها السطح الخارجي للقفازات CMOS. مغادرة CMقفازات OS في غطاء محرك السيارة لتجف.
6. إيداع DNA اوريغامي على السيليكون APTES بين functionalized
- الذاتي تجميعها واحد رقائق تشكيل على السيليكون
- APTES الحارة لRT قبل الافتتاح. إذا كانت زجاجة باردة جدا، قد يحدث التكثيف، مما تسبب التحلل من APTES أثناء التخزين. إضافة 1980 ميكرولتر من 18 MΩ X سم ماء و 20 ميكرولتر من APTES إلى قارورة التلألؤ نظيفة ودوامة لخلط. استخدام هذا الحل على الفور.
- وضع تنظيف رقاقة السيليكون يعكس في جانب المتابعة في قارورة التلألؤ، تتويج، وترك الجلوس لمدة 20 دقيقة. إزالة الشريحة باستخدام الملقط وشطف مع 200 ميكرولتر من الماء وتجف لمدة 1 دقيقة مع تيار من N 2.
- إيداع اوريغامي DNA على APTES Functionalized السليكون
ملاحظة: الخطوات لإيداع اوريغامي DNA على السيليكون functionalized هي مماثلة لتلك التي لإيداع على الميكا.- مزيج لفترة وجيزة القارورة اوريغامي DNA وماصة 4 ميكرولتر من محلولعلى الركيزة السيليكون. إذا لزم الأمر، وزيادة حجم محلول اوريغامي DNA تستخدم لتغطية الركيزة برمتها السيليكون functionalized أكثر مسعور من الركيزة الميكا. استخدام زلة غطاء زجاجي للضغط على حل ترسب إلى أسفل ومنع التبخر خلال ترسبات طويلة.
- اسمحوا الحل الوقوف لمقدار الوقت اللازم لالتركيز المستخدم والتغطية المطلوبة (انظر الشكلين 2 و 3 للتأثير من الوقت والتركيز على التغطية السطحية). شطف الركيزة مع 100 ميكرولتر من العقيمة 18 MΩ X سم ماء والجافة مع N 2 لمدة 1 دقيقة.
- تكرار الشطف مع 100 ميكرولتر إضافية من الماء المعقم وتجفيف الركيزة مع N 2 لمدة 3 دقائق.
- تخزين العينة في وعاء نظيف حتى المزيد من التجارب أو التصوير لا يمكن أن يؤديها. تبدأ عينات لإظهار تراكم الجسيمات بعد حوالي 1-2 أسابيع من تخزين اعتمادا على كيفية موالفصل يتم التعامل معها.
التصوير 7. AFM وتحليل الصور من عينات DNA اوريغامي
- استخدام AFM في استغلال الوضع في الهواء لأغراض التصوير. التنصت وضع يضمن الحد الأدنى من القوة سيتم تطبيقها على النانو الهشة، بالمقارنة مع وضع الاتصال.
ملاحظة: سوف المعلمات التصوير سيتوقف على الصك. تم القبض على جميع الصور المعروضة باستخدام المتعدد Nanoscope الثالث ألف. - اختر تحقيقات AFM لعدم الاتصال / التنصت وضع في الهواء، مع الذهب طلاء عاكسة، تردد الرنين (الاسمي) من ~ 300 كيلو هرتز، قوة ثابتة من 40 N / م، وطرف دائرة نصف قطرها <10 نانومتر.
- عملية وتحليل الصور AFM باستخدام NanoScope برامج التحليل. إجراء عمليات حسابية تغطية باستخدام يماغيج 19
النتائج
متغيرين تملي تغطية اوريغامي DNA على الركيزة: تركيز المحلول والتعرض الوقت. تم الإبلاغ عن خصائص امتصاص اوريغامي DNA على الميكا وAPTES أكسيد السيليكون functionalized سابقا. 13 وتتلخص العلاقة بين تركيز اوريغامي الحمض النووي في حل ترسب والتغطيات النهائية على الميكا في الجدول 1 والشكل 2، والتي تبين زيادة تركيز النتائج في زيادة التغطية. ويعتبر الاعتماد وقت ملزم في الشكل (3). التغطية السطحية درست سابقا لقياس السلوك ملزم اوريغامي DNA على الميكا وتعديل السطوح أكسيد السيليكون. اوريغامي الحمض النووي في 12 ملي المغنيسيوم في المخزن 1X TAE ديه 83.3٪ ± 3.1٪ من التغطية على الميكا بعد 30 دقيقة الوقت امتصاص على السطح. ويلاحظ تغطية الحد الأقصى على أكسيد السيليكون مع تعديل APTES سام بعد 60 دقيقة، وهو أقل من تغطية الحد الأقصى على الميكا. Aهناك حاجة إلى وقت أطول ترسب إذا كان مطلوبا أو تغطية سطح عالية على APTES functionalized أكسيد السيليكون.
هناك العديد من المتغيرات التي يمكن أن تسبب ضعف إعداد العينات. الأكثر إزعاجا هو عدم كفاية الشطف والتجفيف. إذا لم يتم شطفها حل العازلة بشكل صحيح، وحدات كبيرة تشكل على الركيزة الشكل (4A). ويلاحظ "الجزر اوريغامي DNA" عندما تنضم إليها النانو لبقع من أملاح المغنيسيوم على السطح (الشكل 4B). أخيرا، مع عينات تغطية عالية، فمن الممكن أن تكون مكونات عازلة الزائدة سد بين اوريغامي DNA الفردية (الشكل 4C)، مما يجعل من الصعب التفريق النانو باستخدام AFM. ويمكن تجنب هذه النتائج عن طريق اتباع نظام شامل الشطف والتجفيف بروتوكول لكل من الميكا والسيليكون ركائز.
تشكيل الأفلام APTES على ركائز أكسيد السيليكون يمكن أن تثير مشاكل كذلك. رقائق السليكون لديهاالخام طبقة أكسيد السيليكون التي يجب إزالتها وسلاسة وأرق طبقة أكسيد السيليكون إصلاحه قبل أن يتم functionalized. ويتضح A الركيزة السيليكون تنظيفها بشكل صحيح في الشكل 5A. أثناء التنظيف للرقاقة السيليكون، من المهم للتأكد من عدد من رقائق السيليكون ليست مرتفعة جدا، كما أنه من الممكن لاثنين من رقائق لتصبح عالقة مع بعضها البعض، ومنع التعرض للالكواشف (الشكل 5B). إذا كان قد تم تخزينها السيليكون تنظيفها في 18 MΩ X سم المياه لأكثر من أسبوع واحد، فإن طبقة الملوثات إصلاح وrecleaning ضروري. توريد APTES يمكن أيضا أن يسبب مشاكل مع إعداد العينات. APTES يبلمر بسهولة من خلال التحلل، التي هي أساس لتشكيل أحادي الطبقة. 20 مدى هذه البلمرة يعتمد على تركيز الماء التي يتعرض لها APTES ل. مع مرور الوقت ومن خلال الاستخدام المتكرر، فمن الممكن للمياه أن تتكثف داخل زجاجة APTES وتلوثالعرض. البلمرة الناتجة تنتج المجاميع الكبيرة التي تلتزم الركيزة (الشكل 5C). زيادة خشونة وجود المجاميع يجعل بتحديد النانو DNA باستخدام AFM صعوبة. ومن الممارسات الجيدة لتخزين زجاجة APTES في كيس من البلاستيك في الثلاجة، والسماح للAPTES زجاجة الحار RT قبل فتح لتجنب التكثيف.
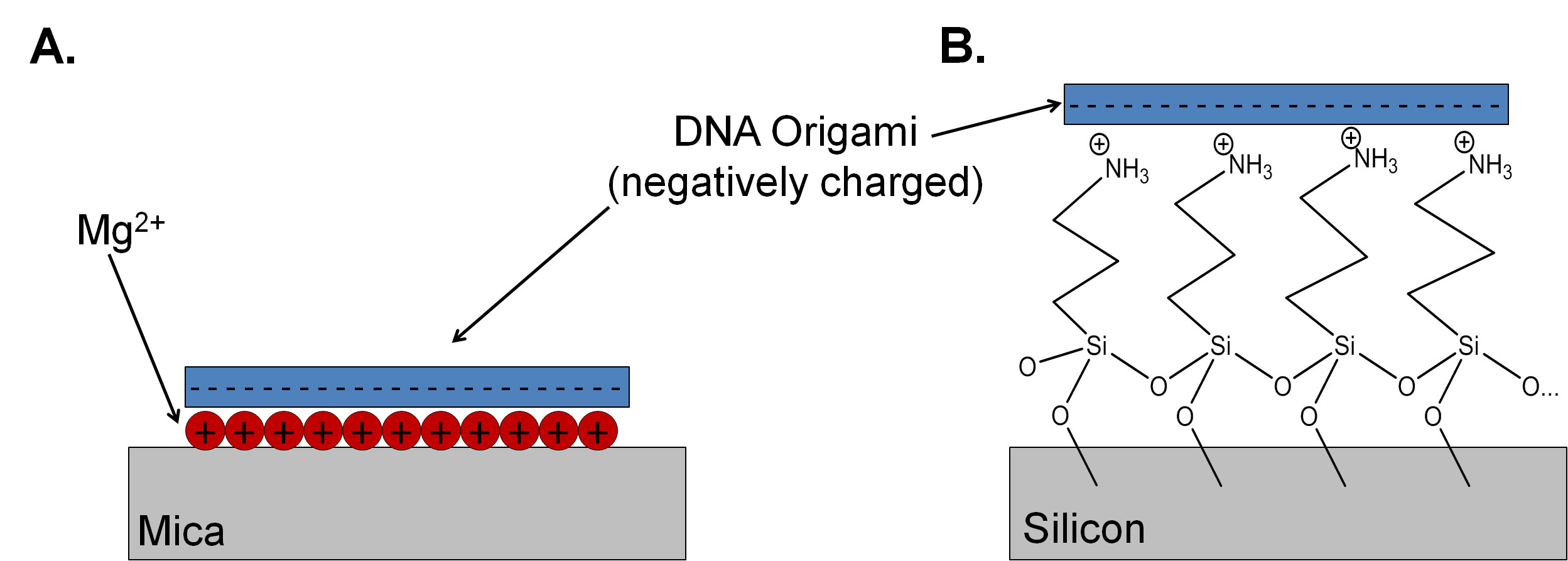
وتتوسط الشكل 1. أكسيد السيليكون مقارنة آلية ملزمة لاوريغامي DNA على (A) والميكا و(B) APTES functionalized التخطيطي (لا لتوسيع نطاق). ملزم مع الميكا من خلال وجود الكاتيونات ثنائي التكافؤ، وعادة المغنيسيوم 2+. إنهاء أحادي الطبقة من أمين البروتونية يستخدم 3-aminopropyltriethoxysilane لتعزيز التصاق على الركيزة أكسيد السيليكون.

الشكل 2. الصور AFM توضح تغطية متغيرة بعد 10 دقيقة ترسبات من (A) 2 نانومتر، (B) 4 نانومتر، و (C) 6 نانومتر على الميكا. مقياس ارتفاع لجميع الصور هي 5 نانومتر.

الشكل 3. الاتجاهات في تغطية السطح ل2 نانومتر اوريغامي DNA في المخزن 1X TAE، 12 ملي المغنيسيوم 2+. ميكا = سطر الأرجواني ودائرة علامات، APTES = الخطوط الصفراء وعلامات مثلث. N = 3 في تحديد الخطأ المعياري.

الرقم 4. ضعف الشطف والتجفيف يمكن أن يسبب (A) تجميع حل على الركيزة، (B) جزر اوريغامي DNA، و (C) سد النانو علىعينات تغطية عالية في وجود الأملاح الزائدة عازلة. وعلى نطاق وارتفاع لجميع الصور هي 5 نانومتر.

يجب أن يكون الرقم 5. (A) السيليكون تنظيف RMS خشونة أقل من 0.5 Å أكثر من 1 ميكرون مربع. أودعت A الكامل APTES SAM على أكسيد الأصلي الجيد يجب أن يكون لديك خشونة RMS أقل من 1 Å أكثر من 1 ميكرون مربع (B) APTES الفيلم تشكلت على شكل أكسيد السيليكون تنظيفها بشكل غير كامل مع RMS خشونة 2.29 نانومتر أكثر من 1 ميكرون مربع. ملاحظة الثغرات وخشونة من الفيلم APTES (C) APTES سطح تشكلت من عينة من APTES ملوثة بالنفايات المختصرة. التحلل في أشكال APTES زجاجة الجسيمات الكبيرة. مقياس ارتفاع لجميع الصور هي 5 نانومتر.
الجدول 1. النسبة قياسات تغطية ركائز الميكا مع varyinز DNA تركيزات حل اوريغامي. جميع الأوقات ترسب هي 10 دقيقة.
| الحل DNA اوريغامي | تغطية٪ على ميكا الركيزة |
| 2 نانومتر | 8.49 ± 2.67 (N = 5) |
| 4 نانومتر | 55.89 ± 5.65 (N = 3) |
| 6 نانومتر | 77.44 ± 1.89 (N = 4) |
Discussion
هناك العديد من الخطوات التي من الضروري التأكيد على تحقيق نتائج متسقة ومثالية. للحصول على عينات والميكا، وبعد الشطف صارم وشامل وتجفيف النظام، كما هو الحال في الخطوات 3.3 و 3.4، وضمان صور عالية الجودة من اوريغامي DNA الفردية يمكن أن يتحقق باستخدام AFM دون مشاكل مختلفة المبينة في القسم ممثل النتائج. من الأهمية بمكان لعينات السيليكون هو نظافة الركيزة. وبعد إجراءات التنظيف هو موضح في الخطوة 5.2 تماما وبدقة أؤكد أن تنظيفها بشكل مناسب السيليكون سطح أكسيد ستتحقق. بالإضافة إلى ذلك، ومراقبة جودة وفعالية المواد الكيميائية، مثل بيروكسيد الهيدروجين، وحامض الهيدروفلوريك، وAPTES، وضمان أن الإجراء يسير بشكل سلس.
الأساليب المذكورة لا تقتصر على المحاليل المائية فقط من APTES. A أحادي الطبقة مختلطة من APTES وكلوريد trimethylaminopropyltrimethoxysilyl (TMAC) يمكن أن يكون لناإد لضبط الشحنة السطحية السيليكون وتعزيز متغير اوريغامي DNA التصاق. 11 TMAC يحتوي على الرباعية محطة مشحونة بشكل دائم أمين -N (CH 3) 3 +، مقارنة مع التهمة التي تعتمد على درجة الحموضة APTES. لأن البيئة الحل لا يؤثر على الحالة protonation أو تهمة TMAC، متفاوتة تركيز المحلول من TMAC يمكن أن تصل قيمتها التهمة سطح أحادي الطبقة المختلطة ويؤثر على التفاعل بين الركيزة واوريغامي DNA. اوريغامي DNA الأمثل لوحظ ملزمة لالطبقات الوحيدة وجود تهمة سطح ،75-1،5 رسوم / 2 نانومتر، والتي تتطابق مع صواريخ سام تحتوي على 100٪ إلى 40٪ تركيز TMAC. ودفعت هذه التهمة سطح الأمثل التغطيات اوريغامي الحمض النووي لنحو 110 اوريغامي / ميكرون 2 على APTES صواريخ سام و 120 اوريغامي / ميكرون 2 على TMAC صواريخ سام.
ميزة واحدة من السيليكون هي توافقه مع عمليات الزخرفة الحجرية. المغنيسيوم عاليةتركيزات يمكن استخدامها مع أكاسيد السيليكون المعالجة البلازما لتعزيز الربط انتقائية اوريغامي الحمض النووي لالسيليكون. يجب توخي الحذر عند إزالة عينة من محلول ترسيب لتجنب الشطف أيونات المغنيسيوم بعيدا وتشويه اوريغامي DNA. 21،22 عملية أشكال APTES تساهميا المرفقة الكاتيونات على سطح أكسيد السيليكون، لذلك غسل أو شطف مع العازلة أو الماء لا لا ضرر في اوريغامي DNA المرفقة. طريقة 'الاقلاع الجزيئي "هو طريقة أخرى محتملة للالزخرفة ركائز السيليكون وتعزيز اوريغامي DNA التصاق. هو نمط الركيزة السيليكون باستخدام شعاع الالكترون الطباعة الحجرية ويترسب APTES على الركيزة عرضة للخطر. بعد الاقلاع من مقاومة للضوء، يمكن أن تودع اوريغامي الحمض النووي على سطح منقوشة، ملزمة بشكل تفضيلي إلى APTES 23
التفاعل اوريغامي الحمض النووي مع ركيزة يتغير استقراره، وفتح مجالات جديدة للبحث والتطبيقات. origam DNAط تلتزم الميكا يمكن تسخينها إلى 150 درجة مئوية دون تغيير واضح الأبعاد النانوية والتغيرات الكيميائية الحد الأدنى. 24 هذا هو في تناقض صارخ مع هشاشة اوريغامي الحمض النووي في حل، حيث النانو كاملة dehybridized فوق 70 ° C 25، ويحتفظ 26 هذا الاستقرار على ساخنة ركائز أكسيد السيليكون. 27 وحتى في أنظمة المذيبات المختلفة، مثل الهكسان والتولوين، والإيثانول، وشكل وتغطية النانو والحفاظ عليها. استقرار المستغرب اوريغامي DNA يشير إلى أن التطبيقات التي كان يعتقد في السابق غير متوافقة، مثل البلازما تعزيز ترسيب الأبخرة، واستخدام مقاومات الضوء المشتركة والمذيبات، وبيئات الترسيب الكيميائي فريدة من نوعها، ويمكن استخدامها جنبا إلى جنب مع اوريغامي DNA. ومع ذلك، إذا كان اوريغامي DNA الحفاظ على وظائفها لا يزال مجهولا وربما تحد من التطبيقات الممكنة.
على الرغم من أن الاستقرار اوريغامي DNA عند درجة حرارة مرتفعةالصورة وتم تحديد عدد محدود من أنظمة المذيبات، والاستقرار على المدى الطويل اوريغامي DNA على ركائز لا يزال مجهولا. استخدام تقنيات معقمة ضروري لتجنب تلوث محتمل، ولكن هذا لا يمكن تجنبها بعد الترسيب السطح. يجب أن تكتمل التصوير وتحليل العينات على الفور تقريبا بعد إعداد العينات. إذا تم تخزين العينة لفترة طويلة جدا (أكثر من أسبوع) وكثيرا ما حددت أمثلة مختلفة من تدهور عينة، بما في ذلك تراكم الجسيمات والنانو DNA مكسورة. قد تكون السبل الممكنة البحوث في النانو إلكترونيات، biosensing، والركيزة استنادا أخرى DNA تطبيقات اوريغامي محدودة بسبب تعتمد على الوقت زعزعة الاستقرار في الحمض النووي. التعرف على القيود المفروضة على هذه التقنيات للتطبيقات التي تتطلب الاستقرار لفترات أطول من الوقت يتطلب مزيدا من التحقيق.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Dr. Gary Bernstein for use of the AFM.
Materials
| Name | Company | Catalog Number | Comments |
| Eppendorf epT.I.P.S. Reloads, capacity 2-200 μl | VWR International, LLC | 22491733 | 10 reload tray of 96 tips |
| Microcentrifuge Tubes, Polypropylene | VWR International, LLC | 87003-290 | 0.65 ml, natural |
| Research Plus Pippete - Single Channel - 20-200 μl | A. Daigger & Company, Inc. | EF8960F-3120000054 EACH | Adjustable Volume |
| Research Plus Pippete - Single Channel - 2-20 μl | A. Daigger & Company, Inc. | EF8960D-3120000038 EACH | Adjustable Volume |
| Scotch 237 Permanent Double-Sided Tape | Office Depot, Inc. | 602710 | 3/4" x 300", Pack of 2 |
| Vortex Mixer | Thermo Scientific | M37610-33Q | |
| Wafer container single, 2" (50 mm), 60 mm x 11 mm | Electron Microscopy Sciences | 64917-2 | 6 per pack |
| 6" Wafer, P-type, <100> orientation, w/ primary flat | Nova Electronic Materials, Ltd. | GC49266 | |
| Powder-Free Nitrile Examination Gloves | VWR International, LLC | 82062-428 | Catalog number is for size large |
| High Accuracy Noncontact probes with Au reflective coating | K-Tek Nanotechnology, Inc. | HA_NC/15 | |
| Autoclave Pan | A. Daigger & Company, Inc. | NAL692-5000 EF25341C | |
| Sol-Vex II Aggressive Gloves, Size: 9-9.5; 15 mil, 13 inch - 1 dz | Spectrum Chemical Mfg. Corp. | 106-15055 | Before use, rinse with water and scrub together until no bubbles form on the gloves. |
| Tweezers PTFE 200 mm Square | Dynalon Corp. | 316504-0002 | |
| Muscovite Mica Sheets V-5 Quality | Electron Microscopy Sciences | 71850-01 | 10 per pack |
| Mica Disc, 10 mm | Ted Pella, Inc | 50 | Mica discs are optional |
| Scriber Diamon Pen for Glassware | VWR International, LLC | 52865-005 | |
| Scintillation Vials, Borosilicate Glass, with Screw Cap - 20 ml | VWR International, LLC | 66022-060 | Case of 500, with attached polypropylene cap and pulp foil liner |
| 4 x 5 Inch Top PC-200 Hot Plate, 120 V/60 Hz | Dot Scientific, Inc. | 6759-200 | |
| Straight-Sided Glass Jars, Wide Mouth | VWR International, LLC | 89043-554 | Case of 254, caps with pulp/vinyl liner attached |
| Standar-Grade Glass Beaker, 250 ml Capacity | VWR International, LLC | 173506 | |
| Beakers, PTFE | VWR International, LLC | 89026-022 | For use with HF |
| Shallow form watch glass, 3" | VWR International, LLC | 66112-107 | Case of 12 |
| Plastic Storage Container | VWR International, LLC | 470195-354 | For secondary container |
| General-Purpose Liquid-In-Glass Thermometers | VWR International, LLC | 89095-564 | |
| High precision and ultra fine tweezers | Electron Microscopy Sciences | 78310-0 | |
| Polycarbonate Faceshield | Fisher Scientific, Inc. | 18-999-4542 | |
| Neoprene Apron | Fisher Scientific, Inc. | 19-810-609 | |
| Calcium Gluconate, Calgonate | W.W Grainger, Inc. | 13W861 | Tube, 25 g |
| Hydrogen Peroxide 30% CR ACS 500 ml | Fisher Scientific, Inc. | H325 500 | HARMFUL, TOXIC |
| 3-Aminopropyltriethoxysilane | Gelest Inc. | SIA0610.0-25GM | Let warm to room temperature before use. |
| Ammonium hydroxide, 2.5 L | Fisher Scientific, Inc. | A669-212 | HARMFUL, TOXIC |
| Hydrochloric acid | Fisher Scientific, Inc. | A144-212 | HARMFUL, TOXIC |
| Hydrofluoric acid | Fisher Scientific, Inc. | A147-1LB | HARMFUL, TOXIC |
| MultiMode Nanoscope IIIa | Veeco Instruments, Inc. | Any AFM capable of tapping mode is suitable for analysis | |
| Dunk basket | Made in lab | Made in lab | The dunk basket was made using the bottom of a PTFE bottle with holes drilled in, PTFE handle, and all PTFE screws. |
References
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440, 297-302 (2006).
- Anderson, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-77 (2009).
- Wang, Z., Ding, B. Engineering DNA Self-Assemblies as Templates for Functional Nanostructures. Acc. Chem. Res. 47, 1654-1662 (2014).
- Xu, K., et al. Graphene Visualizes the First Water Adlayers on Mica at Ambient Conditions. Science. 329, 1188-1191 (2010).
- Bustamante, C., et al. Circular DNA-molecules imaged in air by scanning force microscopy. Biochemistry. 31, 22-26 (1992).
- Hsueh, C., et al. Localized Nanoscopic Surface Measurements of Nickel-Modified Mica for Single-Molecule DNA Sequence Sampling. ACS Appl Mater. Interfaces. 2, 3249-3256 (2010).
- Pastre, D., et al. Anionic polyelectrolyte adsorption on mica mediated by multivalent cations: A solution to DNA imaging by atomic force microscopy under high ionic strengths. Langmuir. 22, 6651-6660 (2006).
- Woo, S., et al. Self-assembly of two-dimensional DNA origami lattices using cation-controlled surface diffusion. Nature Communications. 5, 4889 (2014).
- Vesenka, J., et al. Substrate preparation for reliable imaging of DNA molecules with the scanning force microscope. Ultramicroscopy. 42-44, 1243-1249 (1992).
- Albrechts, B., et al. Adsorption studies of DNA origami on silicon dioxide. , (2010).
- Sarveswaran, K., et al. Adhesion of DNA Nanostructures and DNA Origami to lithographically patterned self-assembled monolayers in Si[100]. Proc. of SPIE-Soc. Opt. Eng. 7637, 76370M-1 (2010).
- Kern, W., Puotien, D. A. Cleaning solutions based on hydrogen peroxide for use in silicon semiconductor technology. RCA Rev. 31, 187-206 (1970).
- Pillers, M., Goss, V., Lieberman, M. Electron-Beam Lithography and Molecular Liftoff for Directed Attachment of DNA Nanostructures on Silicon: Top-down Meets Bottom-up. Acc. Chem. Res. 47, 1759-1767 (2014).
- Saccá, B., Niemery, C. M. DNA Origami: The Art of Folding DNA. Angew. Chem. Int. Ed. 51, 58-66 (2012).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Res. 37, 5001-5006 (2009).
- Ben-Ishay, E., et al. Designing a Bio-responsive Robot from DNA. Origami. J. Vis. Exp. (77), e50268 (2013).
- Woo, S., et al. Programmable molecular recognition based on the geometry of DNA nanostructures. Nature Chemistry. 3, 620-627 (2011).
- Schlegel, M. L., et al. Cation sorption on the muscovite (001) surface in chloride solutions using high-resolution X-ray reflectivity. Geochim. Cosmochim. Acta. 70, 3549-3565 (2006).
- Rasband, W. S., Howarter, J. A., et al. National Institutes of Health. Langmuir. 22, 11142-11147 (2006).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4, 557-561 (2009).
- Hung, A. M., et al. Large-area spatially ordered arrays of gold nanoparticles directed by lithographically confined DNA origami. Nature Nanotechnology. 5, 121-126 (2010).
- Sarveswaran, K., et al. et al.Adhesion of DNA nanostructure and DNA origami to lithographically patterned self-assembled monolayers on Si[100. Proc. SPIE-Int. Soc. Opt. Eng. 7637, 76370M (2010).
- Pillers, M. A., Lieberman, M. Thermal stability of DNA origami on mica. J. Vac. Sci. Technol. B. 32, 040602 (2014).
- Song, J., et al. Direct Visualization of Transient Thermal Response of a DNA. Origami. J. Am. Chem. Soc. 134, 9844 (2012).
- Wei, X., et al. Mapping the thermal behavior of DNA origami nanostructures. J. Am. Chem. Soc. 135 (16), 6165-6176 (2013).
- Hyojeong Kim, ., et al. Stability of DNA Origami Nanostructures under Diverse Chemical Environments. Chem. Mater. 26, 5265-5273 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved