Method Article
Preparación de Mica y Silicon Sustratos para el Análisis de Origami ADN y Experimentación
En este artículo
Resumen
Reproducible cleaning processes for substrates used in DNA origami research are described, including bench-top RCA cleaning and derivatization of silicon oxide. Protocols for surface preparation, DNA origami deposition, drying parameters, and simple experimental set-ups are illustrated.
Resumen
The designed nature and controlled, one-pot synthesis of DNA origami provides exciting opportunities in many fields, particularly nanoelectronics. Many of these applications require interaction with and adhesion of DNA nanostructures to a substrate. Due to its atomically flat and easily cleaned nature, mica has been the substrate of choice for DNA origami experiments. However, the practical applications of mica are relatively limited compared to those of semiconductor substrates. For this reason, a straightforward, stable, and repeatable process for DNA origami adhesion on derivatized silicon oxide is presented here. To promote the adhesion of DNA nanostructures to silicon oxide surface, a self-assembled monolayer of 3-aminopropyltriethoxysilane (APTES) is deposited from an aqueous solution that is compatible with many photoresists. The substrate must be cleaned of all organic and metal contaminants using Radio Corporation of America (RCA) cleaning processes and the native oxide layer must be etched to ensure a flat, functionalizable surface. Cleanrooms are equipped with facilities for silicon cleaning, however many components of DNA origami buffers and solutions are often not allowed in them due to contamination concerns. This manuscript describes the set-up and protocol for in-lab, small-scale silicon cleaning for researchers who do not have access to a cleanroom or would like to incorporate processes that could cause contamination of a cleanroom CMOS clean bench. Additionally, variables for regulating coverage are discussed and how to recognize and avoid common sample preparation problems is described.
Introducción
Presentado por primera vez en 2006, el origami de ADN utiliza la naturaleza auto-ensamblaje de oligonucleótidos de ADN para producir nanoestructuras designable y altamente ordenados. 1 Una miríada de estructuras se han reportado, que van desde caras sonrientes a enganchada cajas de 3 dimensiones. 2 ADN origami se puede funcionalizar con diferentes biomoléculas y nanoestructuras, dando lugar a aplicaciones de investigación en nanoelectrónica, la medicina y la computación cuántica. 3 Sin embargo, el análisis y muchas aplicaciones futuras no dependen sólo de diseño estructural, sino también de la adhesión de las nanoestructuras de origami de ADN a las superficies. Los métodos descritos en este manuscrito se refieren a la preparación de muestras de origami de ADN en dos tipos de sustratos: mica y óxido de silicio funcionalizado.
Mica es el sustrato de elección para estudios de origami de ADN porque es atómicamente plana, con una altura de capa de 0,37 ± 0,02 nm nm. 4 También es EASily limpiado, por lo que la preparación de muestras y la microscopía de fuerza atómica (AFM) Estudios sencillo. Mica moscovita contiene una alta densidad de potasio en cada plano de escisión, pero estos iones se difunden fuera de la superficie de mica cuando en el agua. Para mediar en la unión de origami de ADN al sustrato mica, Mg 2+ se utiliza para invertir la carga negativa de la mica y se unen electrostáticamente el esqueleto de fosfato del ADN al sustrato (Figura 1A). 5 Las mezclas de ADN recocido en presencia de gran excesos de hilos básicos dan una alta cobertura y buenas imágenes en la mica, porque la adhesión de origami de ADN a la superficie 2+ -terminated Mg es mucho más fuerte que la adhesión de oligonucleótidos de cadena sencilla (hebras de primera necesidad). Otros iones cargados positivamente, incluyendo Ni y Co 2+ 2+ se pueden utilizar para controlar la adherencia de ADN en mica. 6,7 Cambio de la concentración de cationes monovalentes y divalentes en solución puede mediar adhetasas de origami de ADN sión y difusión superficial. 8 Sin embargo, el protocolo para la preparación de sustratos de mica y depositar y enjuagar el origami a menudo no se describe explícitamente en los manuscritos publicados. 9 Sin un protocolo claro, resultados reproducibles pueden ser difíciles de obtener.
La mica es un aislante, por lo que no es adecuado como sustrato para algunas aplicaciones en nanoelectrónica. Silicio pasivado con un óxido nativo delgada tiene propiedades electrónicas deseables, incluida la compatibilidad con el procesamiento antes de semiconductor de óxido de metal de cortesía (CMOS) para crear estructuras de entrada / salida y las características topográficas. Las obleas de silicio almacenados en el aire se pasivan ya sea con un óxido térmico de espesor o película delgada de óxido nativo que es relativamente sucio, con un alto número de partículas. El óxido de silicio tiene una densidad de carga superficial mucho más baja que la mica, y la densidad de carga es altamente dependiente de la preparación de óxido y la historia. En las concentraciones de iones de magnesio above 150 mM, buenas coberturas (hasta 4 / m 2) de origami de ADN rectangular se puede lograr sobre sustratos de silicio de plasma tratado de oxígeno; sin embargo, esta concentración y la cobertura pueden cambiar dependiendo del tamaño y el diseño de las nanoestructuras que se utiliza. 10 Un protocolo alternativo para el ajuste de la carga superficial es adjuntar un auto-ensamblado monocapa catiónica de 3-aminopropiltrietoxisilano (APTES) (Figura 1B) a el óxido. La amina primaria en APTES puede estar protonado a valores de pH por debajo de 9, la modificación de la carga y la hidrofobicidad del sustrato. 11 Para una monocapa completa de APTES para ser depositado con éxito, el silicio debe ser limpiado apropiadamente utilizando protocolos (RCA) Radio Corporation of America . Estos protocolos incluyen tratamientos en hidróxido de amonio y soluciones de peróxido de hidrógeno (RCA1) para eliminar los residuos orgánicos y los contaminantes de partículas. Un corto grabado en solución acuosa de ácido fluorhídrico elimina la capa de óxido nativo junto concualesquiera contaminantes iónicos que se adhieren al óxido. Finalmente, las muestras se exponen a una solución de ácido clorhídrico y peróxido de hidrógeno (RCA2) para eliminar el metal y contaminantes iónicos y formar una capa de óxido delgada, uniforme. 12 La mayoría de salas blancas han designado capuchas para protocolos de limpieza CMOS, con reglas estrictas sobre lo que se puede utilizar en estas áreas. Un problema común viene en la forma de iones tales como sodio, que pueden alterar las propiedades electrónicas de estructuras CMOS mediante la creación de trampas midbandgap. 13 Los iones comúnmente utilizado en origami de ADN de preparación y deposición tampones podría contaminar los baños CMOS y causar problemas para otros investigadores utilizando la habitación limpia. Por esta razón, nuestro grupo utiliza un CMOS 'sucias' banco de limpieza dispuestos específicamente para las pequeñas muestras utilizadas para la investigación de origami de ADN. Este proceso es una buena alternativa a la sala blanca tradicional puesta a punto y puede ser adecuado para laboratorios que no tienen acceso a un banco de CMOS de sala limpia.
Protocolo
Planificación 1. Experimentar y Preparación de materiales
- Determinar el diseño, la concentración, y la funcionalidad del origami de ADN que será usado en los experimentos. 14-16 Aquí, nosotros usamos un diseño ADN origami rectángulo preparado en 1x TAE / solución de Mg 2+ (40 mM Tris-base, 20 mM ácido acético, EDTA 2 mM y 12 mM acetato de magnesio, pH 8,0). 17
- Autoclave todos los consejos, tubos y envases usados para ser utilizado. Estos materiales deben ser todos autoclave compatible.
- Preparar un suministro de agua estéril para enjuagar. Llenar un frasco estéril con aproximadamente 500 ml de 18 mO x cm de agua, el lugar en una zona de cocción, hervir durante 5 minutos con la tapa, y toma el frasco fuera de la zona de cocción y dejar enfriar con la tapa colocada en el contenedor pero no apretado . Guarde en el refrigerador y preparar una nueva oferta cada mes o cuando sea necesario.
2. Preparación de la Mica Sustrato
- Corte los sustratos al tamaño adecuado (1 cm x 1 cm) cuadrados con unas tijeras. Mica es delgado y quebradizo. Por otra parte, la compra de la mica en forma de disco que no requiere cortar.
- Escindir la mica con cinta de doble cara. Mica se compone de capas de minerales separadas por iones de intercalación, cada capa se puede despegar cuando se adhiere a la cinta de doble cara. 18
- Coloque los cuadrados de mica en la cinta de doble cara todavía en el dispensador de cinta, asegurándose de que se adhiere firmemente a la cinta. Deslice cuidadosamente las pinzas entre la mica y la cinta, la más capa superior se eliminará y se mantienen en la cinta. Inmediatamente después de la eliminación, la plaza mica tendrá frente a su lado limpio hacia abajo. Asegúrese de voltear la mica sobre antes de guardarlo en un recipiente.
- Repita esto tres o cuatro veces para asegurar la eliminación completa de la capa superior más y una limpieza adecuados.
- Alternativamente, adherir la mica a un contenedor o de sobremesa con un trozo de cinta de doble cara y utilizar una segunda pieza para stick hacia y retire la capa superior más mica. La mica se limpiará correctamente en ambos casos, aunque el método alternativo hace depositar ADN y enjuagar y secar la muestra difícil debido a la segunda adherencia al soporte.
3. Depósito ADN Origami en Mica
- Brevemente, mezclar el vial de origami de ADN usando un mezclador de vórtice para asegurar una dispersión uniforme de nanoestructuras en solución.
- Pipeta 4 l de solución sobre la mica, asegurando que la punta de la pipeta no toca el sustrato. Deje el origami de ADN en la mica por aproximadamente 10 minutos para asegurar una cobertura adecuada. El tiempo de deposición puede variar dependiendo de la concentración de origami de ADN utilizado, así como la cobertura deseada (Figuras 2 y 3).
- Enjuague la solución de origami de ADN fuera del substrato de mica usando 100 l de agua estéril sobre un fregadero u otro recipiente de líquido. Recoge la mica con unas pinzas. Pipetear el agua en elsustrato, con el flujo de la gota hacia la punta de las pinzas. Agite la mica con la baja de movimiento afilados para quitar el exceso de agua. Mantenga las pinzas en posición vertical para que el agua fluirá hacia las pinzas para evitar la contaminación de la muestra.
- Se seca el sustrato con una corriente constante de nitrógeno (N 2) durante 1 min. Asegúrese de que se elimina el exceso de agua. Repita el enjuague con un adicional de 100 l de agua estéril. Se seca el sustrato con N 2 durante otros 3 minutos. Un sustrato completamente seco es necesaria para el análisis exitoso microscopía de fuerza atómica (AFM) (Figura 4).
- Analizar el sustrato utilizando AFM o almacenar en un recipiente cerrado.
4. CMOS / Silicon Limpieza Set-up
- PRECAUCIÓN: Cuando se utiliza el CMOS set-up, utilizar equipo de protección personal en todo momento. Los reactivos incluyen ácidos fuertes, bases fuertes, ácido fluorhídrico (HF), y fuertes agentes oxidantes que can reaccionar con disolventes residuales si los reactivos no se desechan convenientemente. Tener en cuenta las siguientes medidas de seguridad:
- Casa el CMOS banco en una campana química con ningún otro proceso o set-ups.
- Use guantes de nitrilo, bata de laboratorio, gafas de seguridad, guantes de nitrilo grandes industriales, un delantal derrame, y una careta en todo momento al utilizar el banco de CMOS.
- Utilice tubos de plástico como de contención secundaria cuando se preparan soluciones.
- Use un vaso de precipitados de medición fluorado polímero inerte para el manejo de la HF concentrado.
- Hacer ungüento gluconato de calcio disponible como primeros auxilios para cualquier exposición de la piel.
- Sólo por personal debidamente capacitado para llevar a cabo el proceso.
- Asegúrese siempre de otro miembro del laboratorio está presente en caso de emergencia.
- Mantenga la información MSDS para todos los productos químicos cerca de la campana.
- Estar familiarizado con la institución de políticas o de derrames químicos y de exposición de la empresa.
Nota: HF penetra fácilmente la piely es un eliminador de calcio, que afecta a los huesos y nervios dañinos si se produce la exposición. La exposición dérmica a unos pocos mililitros de ácido fluorhídrico concentrado puede ser peligroso e incluso mortal. Establecer las precauciones necesarias para garantizar la exposición no se produce.
- Realizar RCA1 y RCA2 en unos vasos separados 250 ml de vidrio en placas separadas. Cada vaso de precipitados debe contener una barra de agitación. Controlar la temperatura de la solución utilizando termómetros sujetadas por lo que la barra de agitación no golpear en el bulbo. Cubrir los vasos de precipitados utilizando un vidrio de reloj para disminuir los efectos de la evaporación.
- Preparación RCA1
- Colocar 50 ml de 18 mO x cm de agua en el vaso RCA1 designado usando un vaso de precipitados de medición.
- Añadir 15 ml de hidróxido de amonio concentrado (NH 4 OH) al vaso de precipitados. Enjuague el vaso de precipitados de medición con 25 ml de agua y añadir el agua de enjuague en el vaso RCA1.
- Encienda el calor y agitador en la placa caliente y llevar el baño RCA1 a 70 ° C.
- Añadir 15 ml de peróxido de hidrógeno al 30% (H 2 O 2) al vaso de precipitados RCA1. Utilice la solución RCA1 dentro de 1 hora después de que el H 2 O 2 se ha añadido. El baño puede ser utilizado varias veces en el lapso de tres días si se añaden 15 ml de peróxido para el baño cada vez.
- Enjuague el vaso de precipitados de medición a fondo con agua y deseche el enjuague en una botella de residuos RCA1 apropiado.
- Preparación RCA2
- Añadir 70 ml de 18 mO x cm de agua al vaso de precipitados RCA2 designado utilizando el vaso de medición minuciosamente enjuagado.
- Añadir 15 ml de ácido clorhídrico concentrado (HCl). Enjuague el vaso de precipitados de medición con 20 ml de agua y añadirlo al vaso de precipitados RCA2.
- Suba el fuego y revuelva velocidad de la placa de cocción hasta que la solución alcanza 70 ° C.
- Añadir 15 ml de 30% de H 2 O 2. Al igual que el baño de RCA1, utilice esta solución dentro de 1 hora de cuando se añade el H 2 O 2; Además, el bañopuede ser reutilizado varias veces en el lapso de tres días si se añade 15 ml de H 2 O 2 antes de cada uso.
- Preparación de la solución HF
- Colocar 50 ml de agua en un vaso de precipitados de polímero fluorado inerte.
- Medida 4 ml de ácido fluorhídrico concentrado (49%) en el vaso medidor de plástico y añadir al vaso de precipitados de polímero fluorado inerte.
- Enjuague el vaso con plástico que mide un total de 50 ml de agua, añadir el agua de enjuague en el vaso HF. Lavar el vaso de precipitados de medición a fondo con agua y deseche los lavados en un contenedor de residuos HF designado.
5. Preparación y Limpieza del Silicio sustrato
- Cortar las obleas de silicio en chips
- Identificar las direcciones de celosía perpendiculares y paralelas en la superficie pulida plana de la oblea de silicio. Estas direcciones se utilizan para ayudar a que las plazas de escisión más fácil. Las siguientes instrucciones se refieren a cleavción de silicio <110> y puede no ser adecuado para otras orientaciones cristalinas.
- Coloque la oblea de silicio pulido de lado sobre una superficie blanda, como una servilleta. Uso de la pluma escriba con punta de diamante, suavemente nick la parte inferior de la oblea a lo largo del borde plano primaria. Coloque un pequeño alambre, tal como un clip, por debajo del nick y aplicar una suave presión a la oblea mediante la colocación de los dedos o unas pinzas en cada lado de la nick y empujando hacia abajo. Hacer esto separar la oblea en dos mitades a lo largo de la línea de red cristalina en la dirección escinden natural.
- En otra servilleta, con un lápiz y una regla, mida la anchura deseada de las plazas marcando puntos en la parte superior y la parte inferior de la servilleta. Conecte estos puntos con líneas rectas. Esto servirá como una guía para las formas, incluso cuadrados.
- Coloque una de las mitades de la oblea de canto primero entre las líneas medidas en la servilleta tiraba contra la línea y repita el paso en 5.1.2 El recién roto perpendicular pieces ahora deben ser la anchura de los cuadrados escindidos. Gire la oblea horizontalmente en la servilleta. Colóquelo entre líneas perpendiculares y repita el proceso en el paso 5.1.2.
- Guarde las virutas de la oblea recién escindidas en un frasco limpio lleno de agua DI para evitar que se raye. Los chips de silicio se pueden almacenar de forma indefinida, pero se deben limpiar antes de comenzar los experimentos.
- CMOS de limpieza de Silicon
- Cuando la solución RCA1 ha alcanzado la temperatura apropiada, sumergir ocho a diez 1 cm x 1 cm chips de silicio en la solución utilizando una cesta de polímero fluorado inerte con un "diámetro 2. Burbujas de oxígeno se formará en los chips y las paredes del vaso de precipitados. Si no hay burbujeo ocurre, el H 2 O 2 es degradada. Deje las fichas en la solución durante 10 a 20 min, agitando la canasta de arriba a abajo cada pocos minutos para mantener las fichas se peguen entre sí.
- Levante la cesta que contiene los chips de silicio y escurrir bien. Mueva la cesta sobre to el vaso de residuos y enjuague bien con 18 mO x cm de agua. Sumerja en el vaso de lavado y agitan arriba y abajo durante 20 segundos. Escurrir la cesta y enjuagar bien con agua sobre el vaso de residuos. Vacíe el recipiente de residuos en una botella de residuos RCA1 designada y vuelva a llenar con agua.
- Después de la limpieza RCA1 es completa, colocar la cesta en el vaso de precipitados 1:50 HF para 10 a 20 seg. Use un suave movimiento ascendente y descendente para mezclar los chips y HF. Levante el cubo volcada para permitir que el HF se drene por completo.
Nota: Las superficies de viruta deben ser hidrófobo; agua no mojar el chip, pero en lugar formar gotitas con altos ángulos de contacto. Esto indica que el óxido de silicio ha sido grabado al agua fuerte de distancia y el chip está ahora terminado por enlaces Si-H. - Poner el vaso de lavado y enjuague vaso en un recipiente de plástico, mover la cesta sobre el vaso de enjuague y enjuague con 18 mO x cm de agua. Sumerja la canasta en el vaso de lavado y agite durante 20 segundos.
- Completar un segundo drenaje y Rinsciclo e con 18 mO x cm de agua. Volcar el agua de lavado en el vaso de enjuague y vuelva a llenar el vaso de lavado con agua. Vierta todos los residuos en una botella de plástico de residuos HF designado.
- Cuando la solución RCA2 ha alcanzado la temperatura apropiada, sumergir los chips de silicio en las soluciones utilizando la cesta. Deja en la solución durante 10 a 20 min. El chip será ahora hidrófila debido al crecimiento de un (1-2 nm) óxido de película delgada.
- Eliminar después de la cantidad adecuada de tiempo y seguir los mismos procedimientos de lavado como para RCA1. Deshágase de los residuos en el contenedor de residuos RCA2 apropiado. Retire cada chip de la cesta con pinzas de plástico, enjuagar con agua y secar con nitrógeno.
- Chips de las tiendas en una caja de obleas de plástico o en un frasco de 18 cm x mO agua. El silicio se mantendrá limpia cuando se almacena en agua durante aproximadamente tres días después de la limpieza. Asegúrese de que el área de trabajo se limpia adecuadamente y el exterior de los guantes CMOS haber sido lavado. Deje la CMGuantes de OS en el capó se sequen.
6. Depósito ADN Origami sobre silicio funcionalizado APTES
- Autoensamblada monocapa Formación sobre silicio
- APTES calentar a temperatura ambiente antes de abrir. Si la botella es demasiado frío, se puede producir condensación, provocando la hidrólisis de los APTES durante el almacenamiento. Añadir 1.980 l de 18 mO x cm de agua y 20 l de APTES a un vial de centelleo limpia y agitar para mezclar. Utilice esta solución inmediatamente.
- Coloque un chip de silicio limpiado reflexivo de lado en el vial de centelleo, colmo, y deje reposar durante 20 minutos. Retire el chip usando pinzas y enjuague con 200 l de agua y en seco durante 1 minuto con una corriente de N2.
- Depositar origami de ADN en APTES funcionalizado Silicio
Nota: Los pasos para depositar origami de ADN en el silicio funcionalizado son análogos a aquellos para depositar sobre mica.- Mezclar brevemente el vial de origami de ADN y pipeta de 4 l de soluciónsobre el sustrato de silicio. Si es necesario, aumentar el volumen de la solución de origami de ADN utilizado para cubrir todo el sustrato como el silicio funcionalizado es más hidrófobo que el sustrato de mica. Utilice una hoja de cubierta de vidrio para presionar la solución de deposición hacia abajo y evitar la evaporación durante largos deposiciones.
- Dejar reposar la solución por la cantidad de tiempo necesario para que la concentración utilizada y la cobertura deseada (véanse las Figuras 2 y 3 para el efecto del tiempo y la concentración en cobertura de la superficie). Enjuagar el sustrato con 100 l de 18 mO x cm de agua estéril y seca con N 2 durante 1 min.
- Repetir el enjuague con un adicional de 100 l de agua estéril y secar el sustrato con N2 durante 3 min.
- Conservar la muestra en un recipiente limpio hasta que otros experimentos o de imágenes se pueden realizar. Las muestras comienzan a mostrar acumulación de partículas después de aproximadamente una a dos semanas de almacenamiento en función de cómo much se manejan.
7. Imaging AFM y Análisis de Imágenes de las muestras de ADN de Origami
- Utilice AFM en modo Tapping en el aire con fines de imagen. El modo de tocar asegura que una fuerza mínima será aplicado a las nanoestructuras frágiles, en comparación con el modo de contacto.
Nota: Los parámetros de imagen serán dependientes en el instrumento. Todas las imágenes presentadas fueron capturados utilizando un MultiMode Nanoscope IIIa. - Seleccione sondas de AFM de no contacto / modo en el aire de tapping, con revestimiento reflectante de oro, una frecuencia de resonancia (nominal) de ~ 300 kHz, fuerza constante de 40 N / m, y punta de radio <10 nm.
- Procesar y analizar las imágenes de AFM utilizando NanoScope Software de Análisis. Realizar cálculos de cobertura usando ImageJ. 19
Resultados
Dos variables determinan la cobertura de origami de ADN en el sustrato: concentración de la solución y tiempo de exposición. Las características de adsorción de origami de ADN en mica y APTES óxido de silicio funcionalizado se ha informado anteriormente. 13 La relación entre la concentración de origami de ADN en la solución de deposición y las coberturas finales sobre mica se resumen en la Tabla 1 y la Figura 2, que muestra el aumento de los resultados de concentración en una mayor cobertura. La dependencia temporal de la unión se ve en la figura 3. Cobertura superficial fue estudiado previamente para cuantificar el comportamiento de enlace de origami de ADN en mica y superficies de óxido de silicio modificados. Origami de ADN en magnesio 12 mM en tampón TAE 1x tiene 83,3% ± 3,1% de cobertura en mica después de 30 min tiempo de absorción en la superficie. La cobertura máxima en óxido de silicio modificado con APTES SAMs se observa después de 60 min, que es menor que la máxima cobertura en mica. LASe necesita mayor tiempo de deposición si se requiere una alta cobertura de superficie sobre la APTES funcionalizados óxido de silicio.
Hay varias variables que pueden provocar una mala preparación de la muestra. El más problemático es el enjuague insuficiente y secado. Si la solución tampón no se enjuaga correctamente, grandes agregados se forman en el sustrato (Figura 4A). se observan "islas 'origami de ADN cuando las nanoestructuras se adhieren a los parches de sales de magnesio en la superficie (Figura 4B). Finalmente, con muestras de alta cobertura, es posible tener los componentes del tampón exceso de puente entre origami ADN individuo (Figura 4C), lo que hace difícil diferenciar nanoestructuras utilizando AFM. Estos resultados se pueden evitar siguiendo un lavado minucioso y el protocolo de secado para ambos sustratos de mica y de silicio.
Formación de películas APTES sobre sustratos de óxido de silicio puede plantear problemas también. Las obleas de silicio tienen unacapa de óxido de silicio en bruto que debe ser eliminado y una capa más suave, más delgada de óxido de silicio reformado antes de que pueda ser funcionalizado. Un sustrato de silicio adecuadamente limpiado se ilustra en la Figura 5A. Durante la limpieza de la oblea de silicio, es importante asegurarse de que el número de chips de silicio no es demasiado alta, ya que es posible para dos chips se atasque, al uno al otro, el bloqueo de la exposición a los reactivos (Figura 5B). Si silicio limpiado se ha almacenado en 18 mO x cm de agua durante más de una semana, la capa contaminante será reformar y nueva limpieza es necesaria. El suministro APTES también puede causar problemas con la preparación de la muestra. APTES polimeriza fácilmente a través de hidrólisis, que es la base para la formación monocapa. 20 El alcance de esta polimerización es dependiente de la concentración de agua que el APTES está expuesto. Con el tiempo y tras el uso reiterado, es posible que el agua se condense dentro de la botella APTES y contamina elde suministro. La polimerización resultante produce grandes agregados que se adhieren al sustrato (Figura 5C). El aumento de la rugosidad y la presencia de agregados hace que la identificación de las nanoestructuras de ADN utilizando AFM difícil. Es una buena práctica para almacenar la botella APTES en una bolsa de plástico en el refrigerador, y dejar que el APTES botella caliente para RT antes de abrir para evitar la condensación.
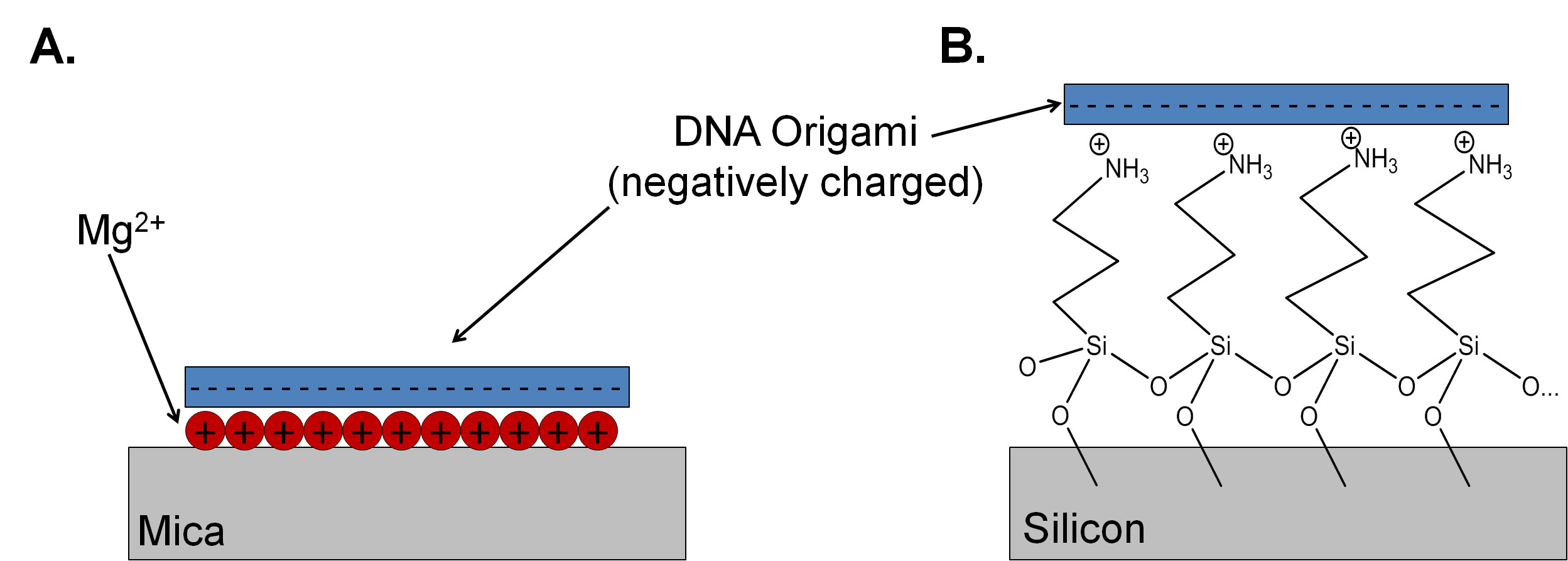
Figura 1. Un óxido de silicio comparando el mecanismo de unión para el origami de ADN en (A) y mica (B) APTES funcionalizado esquemática (no a escala). La unión con mica está mediada por la presencia de cationes divalentes, por lo general Mg 2+. Una monocapa de la amina protonada termina 3-aminopropiltrietoxisilano se utiliza para promover la adhesión sobre el substrato de óxido de silicio.

Figura 2. Imágenes de AFM que ilustran la cobertura variable después de 10 min de las deposiciones (A) 2 nM, (B) 4 nM, y (C) 6 nM sobre mica. La escala de altura para todas las imágenes es de 5 nm.

Figura 3. Tendencias en la cobertura de la superficie de 2 nM origami de ADN en tampón TAE 1x, 12 mM Mg 2 +. Marcadores MICA = línea púrpura y círculo, APTES = líneas amarillas y marcadores triángulo. N = 3 en la determinación del error estándar.

Figura 4. Poor aclarado y secado pueden causar (A) la agregación de solución sobre el sustrato, (b) islas origami de ADN, y (C) de puente de nanoestructuras enmuestras de alta cobertura en la presencia de sales tampón en exceso. La escala de altura para todas las imágenes es de 5 nm.

Figura 5. (A) de silicio Limpio debe tener rugosidad RMS menos de 0,5 Å más de 1 micra cuadrado. Una completa APTES SAM depositada en un buen óxido nativo debe tener una rugosidad RMS menos de 1 Å más de 1 micra cuadrado. (B) APTES película formada sobre un óxido de silicio incompletamente limpiado con rugosidad RMS de 2,29 nm más de 1 micra cuadrado. . Tenga en cuenta las lagunas y la rugosidad de la película APTES (C) APTES superficie formada a partir de una muestra de APTES contaminados con residuos condensada; hidrólisis en las formas de botella APTES partículas grandes. La escala de altura para todas las imágenes es de 5 nm.
Tabla 1. Porcentaje de mediciones de cobertura para sustratos de mica con varying de ADN concentraciones de la solución de origami. Todas las horas de deposición son 10 min.
| Solución de ADN Origami | % Cobertura de Mica Sustrato |
| 2 nM | 8,49 ± 2,67 (N = 5) |
| 4 nM | 55,89 ± 5,65 (N = 3) |
| 6 nM | 77,44 ± 1,89 (N = 4) |
Discusión
Hay varios pasos que hay que hacer hincapié para lograr resultados consistentes y ideales. Para las muestras de mica, siguiendo un estricto y enjuague a fondo y secado régimen, como en los pasos 3.3 y 3.4, se asegurará de que las imágenes de alta calidad de origami de ADN individuales pueden alcanzarse mediante AFM sin los diversos problemas descritos en la sección de Resultados Representante. De importancia primaria para muestras de silicio es la limpieza del sustrato. Siguiendo los procedimientos de limpieza descritos en el paso 5.2 a fondo y meticulosamente se asegurará de que se alcanzará una superficie de óxido de silicio adecuadamente limpiado. Además, el seguimiento de la calidad y la eficacia de los productos químicos, tales como el peróxido de hidrógeno, ácido fluorhídrico, y APTES, se asegurará de que el procedimiento funciona sin problemas.
Las técnicas descritas no se limitan a sólo soluciones acuosas de APTES. Una monocapa mixta de APTES y cloruro trimethylaminopropyltrimethoxysilyl (TMAC) puede ser con nosotrosed para sintonizar la carga superficial de silicio y promover la adhesión origami de ADN variable. 11 El TMAC contiene una cuaternario cargado de forma permanente terminal de amina -N (CH 3) 3 +, en comparación con la carga dependiente del pH en APTES. Debido a que el entorno de solución no afecta el estado de protonación o la carga de TMAC, variando la concentración de la solución de TMAC puede sintonizar la carga superficial de la monocapa mixta y afecta a la interacción entre el sustrato y el origami de ADN. La unión origami ADN óptima se observó para las monocapas que tienen una carga superficial de 0,75-1,5 cargos / NM 2, que corresponde a SAMs que contiene 100% a 40% de concentración TMAC. Esta carga superficial óptima provocó coberturas origami de ADN de aproximadamente 110 origami / m 2 en APTES SAMs y 120 origami / m 2 en la TMAC SAMs.
Una ventaja de silicio es su compatibilidad con los procesos de modelado litográficas. Alta de magnesiolas concentraciones se pueden utilizar con óxidos de silicio tratadas con plasma para promover la unión selectiva de origami de ADN a silicio. Se debe tener cuidado al retirar la muestra de la solución de deposición para evitar enjuague de los iones de magnesio de distancia y deformar el origami de ADN. 21,22 Las formas de proceso APTES unidos covalentemente cationes en la superficie de óxido de silicio, de modo de lavado o aclarado con tampón o agua hace No dañe el origami de ADN adjunto. El método 'despegue molecular "es otra ruta posible para modelar sustratos de silicio y la promoción de la adhesión de origami de ADN. El sustrato de silicio se modela usando litografía por haz de electrones y APTES se deposita sobre el sustrato expuesto. Tras el despegue de la fotoprotección, origami de ADN se puede depositar sobre la superficie modelada, preferentemente unión a los APTES. 23
La interacción de origami de ADN con un sustrato cambia su estabilidad, la apertura de nuevas vías para la investigación y las aplicaciones. Origam ADNi adherido a la mica puede ser calentado a 150 ° C, sin alteración visible de dimensiones nanoestructura y cambios químicos mínimos. 24 Esto está en marcado contraste con la fragilidad de origami de ADN en solución, donde las nanoestructuras son completos dehybridized por encima de 70 ° C. 25, 26 Esta estabilidad se mantiene en sustratos de óxido de silicio con calefacción. 27 Incluso en diversos sistemas de disolventes, tales como hexano, tolueno y etanol, la forma y la cobertura de las nanoestructuras se mantienen. La sorprendente estabilidad de origami de ADN indica que las aplicaciones que se pensaba previamente incompatibles, tales como plasma mejorado de deposición de vapor, el uso de resinas fotosensibles y disolventes comunes, y entornos únicos de deposición química, se pueden usar en conjunción con origami de ADN. Sin embargo, si el origami de ADN a mantener su funcionalidad es aún desconocida y puede limitar las posibles aplicaciones.
Aunque la estabilidad de origami de ADN a temperatura elevadas y en un número limitado de sistemas de disolventes ha sido determinada, la estabilidad a largo plazo de origami de ADN sobre sustratos es aún desconocido. El uso de técnicas estériles es necesario para evitar una posible contaminación, pero esto no se puede evitar después de la deposición de superficie. Imágenes y análisis de la muestra deben ser completado casi inmediatamente después de la preparación de la muestra; si la muestra se almacena durante demasiado tiempo (más de una semana) varios ejemplos de degradación de la muestra a menudo se identifican, incluyendo la acumulación de partículas y nanoestructuras de ADN rotas. Las posibles vías de investigación en nanoelectrónica, biosensores, y otras aplicaciones de origami de ADN sustrato basado pueden estar limitadas por la desestabilización en función del tiempo de la DNA. La identificación de las limitaciones de estas técnicas para aplicaciones que requieren estabilidad por períodos más largos de tiempo requiere mayor investigación.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors thank Dr. Gary Bernstein for use of the AFM.
Materiales
| Name | Company | Catalog Number | Comments |
| Eppendorf epT.I.P.S. Reloads, capacity 2-200 μl | VWR International, LLC | 22491733 | 10 reload tray of 96 tips |
| Microcentrifuge Tubes, Polypropylene | VWR International, LLC | 87003-290 | 0.65 ml, natural |
| Research Plus Pippete - Single Channel - 20-200 μl | A. Daigger & Company, Inc. | EF8960F-3120000054 EACH | Adjustable Volume |
| Research Plus Pippete - Single Channel - 2-20 μl | A. Daigger & Company, Inc. | EF8960D-3120000038 EACH | Adjustable Volume |
| Scotch 237 Permanent Double-Sided Tape | Office Depot, Inc. | 602710 | 3/4" x 300", Pack of 2 |
| Vortex Mixer | Thermo Scientific | M37610-33Q | |
| Wafer container single, 2" (50 mm), 60 mm x 11 mm | Electron Microscopy Sciences | 64917-2 | 6 per pack |
| 6" Wafer, P-type, <100> orientation, w/ primary flat | Nova Electronic Materials, Ltd. | GC49266 | |
| Powder-Free Nitrile Examination Gloves | VWR International, LLC | 82062-428 | Catalog number is for size large |
| High Accuracy Noncontact probes with Au reflective coating | K-Tek Nanotechnology, Inc. | HA_NC/15 | |
| Autoclave Pan | A. Daigger & Company, Inc. | NAL692-5000 EF25341C | |
| Sol-Vex II Aggressive Gloves, Size: 9-9.5; 15 mil, 13 inch - 1 dz | Spectrum Chemical Mfg. Corp. | 106-15055 | Before use, rinse with water and scrub together until no bubbles form on the gloves. |
| Tweezers PTFE 200 mm Square | Dynalon Corp. | 316504-0002 | |
| Muscovite Mica Sheets V-5 Quality | Electron Microscopy Sciences | 71850-01 | 10 per pack |
| Mica Disc, 10 mm | Ted Pella, Inc | 50 | Mica discs are optional |
| Scriber Diamon Pen for Glassware | VWR International, LLC | 52865-005 | |
| Scintillation Vials, Borosilicate Glass, with Screw Cap - 20 ml | VWR International, LLC | 66022-060 | Case of 500, with attached polypropylene cap and pulp foil liner |
| 4 x 5 Inch Top PC-200 Hot Plate, 120 V/60 Hz | Dot Scientific, Inc. | 6759-200 | |
| Straight-Sided Glass Jars, Wide Mouth | VWR International, LLC | 89043-554 | Case of 254, caps with pulp/vinyl liner attached |
| Standar-Grade Glass Beaker, 250 ml Capacity | VWR International, LLC | 173506 | |
| Beakers, PTFE | VWR International, LLC | 89026-022 | For use with HF |
| Shallow form watch glass, 3" | VWR International, LLC | 66112-107 | Case of 12 |
| Plastic Storage Container | VWR International, LLC | 470195-354 | For secondary container |
| General-Purpose Liquid-In-Glass Thermometers | VWR International, LLC | 89095-564 | |
| High precision and ultra fine tweezers | Electron Microscopy Sciences | 78310-0 | |
| Polycarbonate Faceshield | Fisher Scientific, Inc. | 18-999-4542 | |
| Neoprene Apron | Fisher Scientific, Inc. | 19-810-609 | |
| Calcium Gluconate, Calgonate | W.W Grainger, Inc. | 13W861 | Tube, 25 g |
| Hydrogen Peroxide 30% CR ACS 500 ml | Fisher Scientific, Inc. | H325 500 | HARMFUL, TOXIC |
| 3-Aminopropyltriethoxysilane | Gelest Inc. | SIA0610.0-25GM | Let warm to room temperature before use. |
| Ammonium hydroxide, 2.5 L | Fisher Scientific, Inc. | A669-212 | HARMFUL, TOXIC |
| Hydrochloric acid | Fisher Scientific, Inc. | A144-212 | HARMFUL, TOXIC |
| Hydrofluoric acid | Fisher Scientific, Inc. | A147-1LB | HARMFUL, TOXIC |
| MultiMode Nanoscope IIIa | Veeco Instruments, Inc. | Any AFM capable of tapping mode is suitable for analysis | |
| Dunk basket | Made in lab | Made in lab | The dunk basket was made using the bottom of a PTFE bottle with holes drilled in, PTFE handle, and all PTFE screws. |
Referencias
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440, 297-302 (2006).
- Anderson, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-77 (2009).
- Wang, Z., Ding, B. Engineering DNA Self-Assemblies as Templates for Functional Nanostructures. Acc. Chem. Res. 47, 1654-1662 (2014).
- Xu, K., et al. Graphene Visualizes the First Water Adlayers on Mica at Ambient Conditions. Science. 329, 1188-1191 (2010).
- Bustamante, C., et al. Circular DNA-molecules imaged in air by scanning force microscopy. Biochemistry. 31, 22-26 (1992).
- Hsueh, C., et al. Localized Nanoscopic Surface Measurements of Nickel-Modified Mica for Single-Molecule DNA Sequence Sampling. ACS Appl Mater. Interfaces. 2, 3249-3256 (2010).
- Pastre, D., et al. Anionic polyelectrolyte adsorption on mica mediated by multivalent cations: A solution to DNA imaging by atomic force microscopy under high ionic strengths. Langmuir. 22, 6651-6660 (2006).
- Woo, S., et al. Self-assembly of two-dimensional DNA origami lattices using cation-controlled surface diffusion. Nature Communications. 5, 4889(2014).
- Vesenka, J., et al. Substrate preparation for reliable imaging of DNA molecules with the scanning force microscope. Ultramicroscopy. 42-44, 1243-1249 (1992).
- Adsorption studies of DNA origami on silicon dioxide. Albrechts, B., et al. 21st Micromechanics and Micro Systems Europe Workshop 2010, , (2010).
- Sarveswaran, K., et al. Adhesion of DNA Nanostructures and DNA Origami to lithographically patterned self-assembled monolayers in Si[100]. Proc. of SPIE-Soc. Opt. Eng. 7637, 76370M-1(2010).
- Kern, W., Puotien, D. A. Cleaning solutions based on hydrogen peroxide for use in silicon semiconductor technology. RCA Rev. 31, 187-206 (1970).
- Pillers, M., Goss, V., Lieberman, M. Electron-Beam Lithography and Molecular Liftoff for Directed Attachment of DNA Nanostructures on Silicon: Top-down Meets Bottom-up. Acc. Chem. Res. 47, 1759-1767 (2014).
- Saccá, B., Niemery, C. M. DNA Origami: The Art of Folding DNA. Angew. Chem. Int. Ed. 51, 58-66 (2012).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Res. 37, 5001-5006 (2009).
- Ben-Ishay, E., et al. Designing a Bio-responsive Robot from DNA. Origami. J. Vis. Exp. (77), e50268(2013).
- Woo, S., et al. Programmable molecular recognition based on the geometry of DNA nanostructures. Nature Chemistry. 3, 620-627 (2011).
- Schlegel, M. L., et al. Cation sorption on the muscovite (001) surface in chloride solutions using high-resolution X-ray reflectivity. Geochim. Cosmochim. Acta. 70, 3549-3565 (2006).
- Rasband, W. S., Howarter, J. A., et al. National Institutes of Health. Langmuir. 22, Bethesda, Maryland, USA. 11142-11147 (2006).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4, 557-561 (2009).
- Hung, A. M., et al. Large-area spatially ordered arrays of gold nanoparticles directed by lithographically confined DNA origami. Nature Nanotechnology. 5, 121-126 (2010).
- Sarveswaran, K., et al. et al.Adhesion of DNA nanostructure and DNA origami to lithographically patterned self-assembled monolayers on Si[100. Proc. SPIE-Int. Soc. Opt. Eng. 7637, 76370M(2010).
- Pillers, M. A., Lieberman, M. Thermal stability of DNA origami on mica. J. Vac. Sci. Technol. B. 32, 040602(2014).
- Song, J., et al. Direct Visualization of Transient Thermal Response of a DNA. Origami. J. Am. Chem. Soc. 134, 9844(2012).
- Wei, X., et al. Mapping the thermal behavior of DNA origami nanostructures. J. Am. Chem. Soc. 135 (16), 6165-6176 (2013).
- Hyojeong Kim,, et al. Stability of DNA Origami Nanostructures under Diverse Chemical Environments. Chem. Mater. 26, 5265-5273 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados