Method Article
הכנת מצעים נציץ והסיליקון לDNA אוריגמי ניתוח וניסויים
In This Article
Summary
Reproducible cleaning processes for substrates used in DNA origami research are described, including bench-top RCA cleaning and derivatization of silicon oxide. Protocols for surface preparation, DNA origami deposition, drying parameters, and simple experimental set-ups are illustrated.
Abstract
The designed nature and controlled, one-pot synthesis of DNA origami provides exciting opportunities in many fields, particularly nanoelectronics. Many of these applications require interaction with and adhesion of DNA nanostructures to a substrate. Due to its atomically flat and easily cleaned nature, mica has been the substrate of choice for DNA origami experiments. However, the practical applications of mica are relatively limited compared to those of semiconductor substrates. For this reason, a straightforward, stable, and repeatable process for DNA origami adhesion on derivatized silicon oxide is presented here. To promote the adhesion of DNA nanostructures to silicon oxide surface, a self-assembled monolayer of 3-aminopropyltriethoxysilane (APTES) is deposited from an aqueous solution that is compatible with many photoresists. The substrate must be cleaned of all organic and metal contaminants using Radio Corporation of America (RCA) cleaning processes and the native oxide layer must be etched to ensure a flat, functionalizable surface. Cleanrooms are equipped with facilities for silicon cleaning, however many components of DNA origami buffers and solutions are often not allowed in them due to contamination concerns. This manuscript describes the set-up and protocol for in-lab, small-scale silicon cleaning for researchers who do not have access to a cleanroom or would like to incorporate processes that could cause contamination of a cleanroom CMOS clean bench. Additionally, variables for regulating coverage are discussed and how to recognize and avoid common sample preparation problems is described.
Introduction
הוצג לראשונה בשנת 2006, אוריגמי DNA מנצל את הטבע להרכבה העצמית של oligonucleotides DNA לייצר ננו designable והורה מאוד. 1 מספר עצום של מבנים דווח, החל סמיילי פרצופים לנצמד תיבות 3 ממדים. 2 אוריגמי DNA יכול להיות פונקציונליות עם מולקולות ביולוגיות שונות וננו, והוליד יישומי מחקר בnanoelectronics, רפואה, ומחשוב קוונטים. 3 עם זאת, הניתוח ויישומים רבים בעתיד הם לא רק תלוי בעיצוב מבני, אלא גם על ההידבקות של ננו אוריגמי DNA למשטחים. השיטות שתוארו בכתב היד הזה נוגעים להכנת דגימות DNA אוריגמי על שני סוגים של מצעים: נציץ ותחמוצת סיליקון פונקציונליות.
מיכה הוא המצע של בחירה ללימודי אוריגמי DNA כי זה אטומי שטוח, עם גובה שכבה של 0.37 ננומטר ± 0.02 ננומטר. 4 זה גם EASאילי ניקה, מה שהופך את הכנת מדגם ומחקרים במיקרוסקופ כוח אטומי (AFM) פשוטות. נציץ מוסקבאי מכיל צפיפות גבוהה של אשלגן בכל מטוס מחשוף, אבל יונים אלה מפוזר מהמשטח נציץ כאשר במים. לתווך המחייב של אוריגמי DNA למצע נציץ, Mg 2 + משמש כדי להפוך את המטען השלילי של המיקה ואלקטרוסטטי לחייב את עמוד השדרה פוספט DNA למצע (איור 1 א). 5 תערובות של DNA מרותק בנוכחות גדולה קיצוניות של גדילי מצרך לתת כיסוי גבוה ותמונות טובות בתציץ בגלל ההידבקות של אוריגמי DNA למשטח Mg 2 + -terminated היא הרבה יותר חזקה מההידבקות של oligonucleotides חד-גדילים (גדילי מצרך). יונים טעונים חיובי אחרים, כוללים Ni 2 + 2 + Co וניתן להשתמש בם כדי לשלוט בהדבקה של ה- DNA ביציץ. 6,7 שינוי הריכוז של קטיונים חד ערכי ודו ערכיים בפתרון יכול לתווך adheשיעורי שיאון ודיפוזיה פני השטח של אוריגמי DNA. 8 עם זאת, הפרוטוקול להכנת מצעים נציץ והפקדה ושטיפת אוריגמי לעתים קרובות אינו מתוארים בכתבי יד שפורסם. 9 במפורש ללא פרוטוקול ברור, תוצאות לשחזור יכולים להיות קשות להשגה.
מיכה הוא מבודד, כך שזה לא מתאים כמצע ליישומים מסוימים בnanoelectronics. יש סיליקון פסיבציה עם תחמוצת יליד דקה מאפיינים אלקטרוניים רצויים, כולל תאימות עם עיבוד לפני metal-oxide semiconductor חינם (CMOS) כדי ליצור קלט / פלט מבנים ותכונות טופוגרפיות. פרוסות סיליקון המאוחסנות באוויר פסיבציה גם עם תחמוצת תרמית עבה או סרט תחמוצת ילידים דק שהוא יחסית מלוכלך, עם ספירת חלקיקים גבוהה. יש תחמוצת הסיליקון צפיפות מטען משטח נמוכה בהרבה מיציצו, וצפיפות המטען תלויה מאוד בהכנת תחמוצת והיסטוריה. במגנזיום ריכוזי יון ABOיש 150 מ"מ, כיסויים טובים (עד 4 / מיקרומטר 2) של אוריגמי DNA המלבני יכול להיות מושגת על מצעי סיליקון פלזמה טופלה חמצן; עם זאת, ריכוז והכיסוי עשוי להשתנות בהתאם לגודל והעיצוב של ננו בשימוש. 10 פרוטוקול חלופי לכוונון תשלום פני השטח הוא לצרף monolayer עצמי התאספו קטיוני של 3-aminopropyltriethoxysilane (APTES) (איור 1) ל תחמוצת. האמין העיקרית בAPTES ניתן protonated בערכי pH מתחת ל -9, שינוי החיוב והידרופוביות של המצע. 11 לmonolayer של APTES שלם שיופקדו בהצלחה, סיליקון יש לנקות כראוי באמצעות תאגיד רדיו של אמריקה פרוטוקולים (RCA) . פרוטוקולים אלה כוללים טיפולים באמוניום הידרוקסיד ופתרונות מי חמצן (RCA1) כדי להסיר שאריות אורגניות ומזהמים חלקיקים. לחרוט קצר בפתרון חומצה הידרופלואורית המימי מסיר את שכבת תחמוצת ילידים יחד עםכל מזהמים יוניים שלדבוק תחמוצת. לבסוף, דגימות חשופות לחומצה הידרוכלורית ופתרון מי חמצן (RCA2) כדי להסיר מתכת וזיהום יוני וליצור שכבת תחמוצת דקה, אחידה. 12 רוב החדרים נקיים שמיועדים ברדסים לפרוטוקולי ניקוי CMOS, עם כללים נוקשים לגבי מה ניתן להשתמש באזורים אלה. בעיה נפוצה מגיעה בצורה של יונים כמו נתרן, שיכול לשבש את המאפיינים האלקטרוניים של מבני CMOS על ידי יצירת מלכודות midbandgap. משמש 13 יונים נפוצים במאגרי הכנה ותצהיר אוריגמי DNA יכול לזהם את אמבטיות CMOS ולגרום לבעיות לחוקרים אחרים באמצעות החדר הנקי. מסיבה זו, הקבוצה שלנו משתמשת CMOS 'המלוכלך' ניקוי ספסל מסודר במיוחד עבור המדגמים הקטנים המשמשים למחקר אוריגמי DNA. תהליך זה הוא אלטרנטיבה טובה להגדרת החדר הנקי המסורתית ועשוי להיות מתאים למעבדות שאין להם גישה לספסל CMOS החדר הנקי.
Protocol
תכנון ניסוי 1. והכנת חומר
- לקבוע את העיצוב, ריכוז, ואת הפונקציונליות של אוריגמי DNA שישמש בניסויים. 14-16 כאן, אנו משתמשים בעיצוב מלבן אוריגמי DNA הוכן ב1x טה / פתרון 2 + Mg (40 מ"מ טריס בסיס, 20 מ"מ חומצה אצטית, 2 מ"מ EDTA ו -12 אצטט מגנזיום מ"מ, pH 8.0). 17
- החיטוי כל טיפים, צינורות, והמכל לשימוש. חומרים אלה חייבים להיות כל החיטוי תואם.
- הכן אספקה של מים סטריליים לשטיפה. ממלאי צנצנת סטרילית עם כ 500 מיליליטר של מים סנטימטרים X 18 MΩ, מקום על פלטה חמה, להרתיח במשך 5 דקות עם המכסה מעל, ולקחת את הצנצנת משל פלטה חשמלית ולתת מגניב עם המכסה מונח על המכל אבל לא הידק . אחסן במקרר ולהכין אספקה חדשה בכל חודש או בעת צורך.
2. הכנת מצע מיכה
- מצעי Cut לגודל המתאים (1 ס"מ ריבועי 1 סנטימטר) עם מספריים. מיכה הוא דק ופריך. לחלופין, לרכוש נציץ בצורת דיסק שאינו דורשת חיתוך.
- קליב נציץ באמצעות קלטת דו צדדית. מיכה מורכב משכבות של מינרלים מופרדים על ידי intercalating יונים, כל שכבה יכולה להיות התקלפה כאשר דבק הקלטת דו צדדית. 18
- מניחים את הריבועים נציץ בקלטת דו צדדית עדיין במתקן הקלטת, כדי לוודא שהוא דבק בתוקף לקלטת. החלק בזהירות פינצטה בין נציץ והקלטת, העליונה ביותר השכבה יוסר ולהישאר בקלטת. מייד לאחר ההסרה, הכיכר נציץ תהיה הצד הנקי שלה פונה כלפי מטה. הקפד להעיף נציץ מעל לפני האחסון במכל.
- חזור על שלושה עד ארבעה פעמים זה כדי להבטיח הסרת השכבה העליונה ביותר והניקוי נאות מלאה.
- לחלופין, לדבוק נציץ למכל או בטבלה עליונה עם נייר דבק דו צדדי ולהשתמש חתיכה לים שנייהסמן וללקלף את השכבה העליונה ביותר נציץ. נציץ ינוקה כראוי בשני המקרים, למרות שהשיטה החלופית עושה הפקדת DNA ושטיפה וייבוש המדגם קשה בשל ההידבקות השנייה לתמיכה.
3. ההפקדה DNA אוריגמי על מיכה
- בקצרה, לערבב את הבקבוקון של אוריגמי DNA בעזרת מערבל מערבולת כדי להבטיח אפילו פיזור של ננו בפתרון.
- פיפטה 4 μl של פתרון על נציץ, להבטיח כי קצה פיפטה לא נוגע במצע. השאר את אוריגמי DNA ביציץ לכ 10 דקות על מנת להבטיח כיסוי הולם. זמן התצהיר ישתנה בהתאם לריכוז של אוריגמי DNA משמש גם ככיסוי הרצוי (איורים 2 ו -3).
- יש לשטוף את פתרון אוריגמי DNA משל המצע נציץ באמצעות מים סטריליים 100 μl מעל כיור או כלי קיבול נוזלים אחרים. להרים את המיקה באמצעות פינצטה. פיפטה המים במצע, עם הזרימה של הירידה לכיוון הקצה של פינצטה. לנער נציץ עם מטה תנועה חדה כדי להסיר את עודפי המים. החזק את פינצטה זקופה, כך שהמים יזרמו לכיוון פינצטה, כדי למנוע זיהום של המדגם.
- ייבש את המצע עם זרם יציב של חנקן (N 2) 1 דקות. ודא שכל מים עודפים מוסר. חזור על לשטוף עם מים סטריליים 100 μl נוסף. ייבש את המצע עם N 2 ל3 דקות נוספות. מצע יבש לחלוטין הכרחי לניתוח מוצלח במיקרוסקופ כוח אטומי (AFM) (איור 4).
- נתח את המצע באמצעות AFM או חנות במכל סגור.
4. CMOS / ניקוי הסיליקון סט-אפ
- זהירות: בעת השימוש בCMOS הגדרה, להשתמש בציוד מגן אישי בכל העת. ריאגנטים כוללים חומצות חזקות, בסיסים חזקים, חומצה הידרופלואורית (HF), וסוכני חמצון חזקים שCAn להגיב עם ממסים פסולת אם ריאגנטים אינם מסולקים כראוי של. לדבוק באמצעי הזהירות הבא:
- ספסל CMOS בית במנדף כימי ללא תהליכים אחרים או בחר קופצים.
- ללבוש כפפות nitrile, חלוק מעבדה, משקפי בטיחות, כפפות nitrile תעשייתיות גדולות, סינר לשפוך, ומגן פנים בכל העת בעת השימוש בספסל CMOS.
- השתמש אמבטיות פלסטיק כמו בלימה משנית כאשר פתרונות מוכנים.
- השתמש כוס מדידת פולימר פלואור אינרטי לטיפול HF המרוכז.
- הפוך משחה גלוקונאט סידן זמינה כעזרה ראשונה לכל חשיפת עור.
- לאפשר רק בעלי הכשרה מתאימים כדי לבצע את התהליך.
- להבטיח תמיד חבר אחר של המעבדה נמצא במקרה חירום.
- שמור על מידע MSDS לכל הכימיקלים ליד מכסה המנוע.
- להכיר את המוסד של המדיניות או דליפת כימיקלים וחשיפה של החברה.
הערה: HF קלות מחלחל עורונבלות סידן, המשפיעות על עצמות ועצבים מזיקים אם חשיפה מתרחשת. חשיפת עור לכמה מיליליטרים של חומצה הידרופלואורית מרוכזת יכולה להיות מסוכנת ואף קטלנית. להקים אמצעי זהירות דרושה כדי להבטיח חשיפה אינו מתרחשת.
- בצע RCA1 וRCA2 ב250 כוסות זכוכית מיליליטר נפרדות על כיריים נפרדות. כל כוס צריכה להכיל בר ומערבבים. לנטר את הטמפרטורה של הפתרון באמצעות מדחום מהודק כל כך בר מערבבים לא לדפוק לנורה. מכסה את הכוסות באמצעות זכוכית שעון כדי להפחית את ההשפעות של אידוי.
- RCA1 הכנה
- מניחים 50 מיליליטר של מים סנטימטרים X 18 MΩ לתוך כוס RCA1 הייעודית ובכוס מדידה.
- להוסיף 15 מיליליטר של אמוניום הידרוקסיד מרוכז (NH 4 OH) לכוס. יש לשטוף את כוס המדידה עם 25 מיליליטר של מים ומוסיפים את המים לשטוף את כוס RCA1.
- הפעל את החום והבוחש בפלטה החשמלית ולהביא את האמבטיה RCA1 עד 70 ° C.
- להוסיף 15 מיליליטר של 30% מי חמצן (H 2 O 2) לכוס RCA1. השתמש בפתרון RCA1 בתוך שעה 1 אחרי H 2 O 2 נוספו לו. האמבטיה יכולה לשמש מספר פעמים בפרק הזמן של שלושה ימים, אם 15 מיליליטר של מי חמצן נוסף לאמבטיה בכל פעם.
- יש לשטוף את כוס המדידה ביסודיות עם מים וזורקים את השטיפה בבקבוק פסולת RCA1 מתאים.
- RCA2 הכנה
- להוסיף 70 מיליליטר של מים סנטימטרים X 18 MΩ לכוס RCA2 הייעודי בכוס מדידה לשטוף היטב.
- להוסיף 15 מיליליטר של חומצה הידרוכלורית מרוכזת (HCl). יש לשטוף את כוס המדידה עם 20 מיליליטר של מים ולהוסיף אותו לכוס RCA2.
- להגדיל את החום ומערבבים במהירות של פלטה חשמלית עד הפתרון מגיע 70 מעלות צלזיוס.
- להוסיף 15 מיליליטר של 30% H 2 O 2. כמו האמבטיה RCA1, להשתמש בפתרון זה בשעה 1 מכאשר H 2 O 2 הוא הוסיף; בנוסף, האמבטיהניתן לעשות שימוש חוזר מספר פעמים בפרק הזמן של שלושה ימים, אם 15 מיליליטר של H 2 O 2 הוא הוסיף לפני כל שימוש.
- HF פתרון הכנה
- מניחים 50 מיליליטר של מים בכוס פולימר פלואור אינרטי.
- מדד 4 מיליליטר של חומצה המרוכזת הידרופלואורית (49%) בכוס מדידת הפלסטיק ולהוסיף אותו לכוס פולימר פלואור אינרטי.
- יש לשטוף את פלסטיק מדידת כוס עם סך של 50 מיליליטר של מים, הוספת המים שטיפה לכוס HF. לשטוף את כוס המדידה ביסודיות עם מים וזורקים את הכביסות במכל פסולת HF מיועד.
5. הכנה וניקוי מצע סיליקון
- חיתוך פרוס סיליקון לתוך שבבים
- זהה את כיווני סריג בניצב ומקבילים על פני השטח המלוטשים השטוח של פרוסות סיליקון. כיוונים אלה משמשים כדי לסייע להפוך את ריבועי ביקוע קלים יותר. ההוראות שלהלן מתייחסות לcleaving סיליקון <110> ועשוי שלא להיות מתאים לאורינטציות גביש אחרות.
- מניחים את פרוסות סיליקון מלוטשת-צד למעלה על משטח רך, כגון מפית. שימוש בעט הסופר-הטה יהלומים, בעדינות ניק תחתית הרקיק לאורך הקצה השטוח העיקרי. מניחים חוט קטן, כגון מהדק, מתחת לניק ועדינות יפעיל לחץ על הרקיק על ידי הצבת אצבעות או פינצטה בכל צד של ניק ולדחוף למטה. פעולה זו תפריד הרקיק לשני חצאים לאורך קו הסריג הגבישי בכיוון תדבק הטבעי.
- על מפית אחרת, עם עיפרון וסרגל, למדוד את הרוחב הרצוי של הריבועים על ידי סימון נקודות בחלק העליון והחלק התחתון של המפית. חבר נקודות אלה עם קווים ישרים. זה ישמש כקו מנחה לצורות אפילו מרובעות.
- מניחים אחד הרקיק חצאים קצה-ראשון בין השורות נמדדו על המפית סמוקה נגד הקו ולחזור בשלב 5.1.2 נשבר טרי ניצב pieces צריך עכשיו להיות ברוחב של הריבועים ביקעו. הפעל הרקיק אופקי על המפית. מניחים אותו בין השורות בניצב וחזור על התהליך בשלב 5.1.2.
- אחסן את שבבי ופל טרי ביקעו בבקבוקון נקי מלאים במי DI למניעת שריטות. ניתן לאחסן שבבי סיליקון ללא הגבלת זמן, אבל יש לנקות לפני תחילת ניסויים.
- CMOS ניקוי של הסיליקון
- כאשר פתרון RCA1 הגיע לטמפרטורה המתאימה, לצלול שמונה עד עשר 1 ס"מ על שבבי סיליקון 1 סנטימטר בפתרון באמצעות סל פולימר פלואור אינרטי בקוטר 2 ". בועות חמצן תהווה על השבבים וקירות כוס. אם לא מבעבע מתרחש, H 2 O 2 הוא מושפלים. השאר את השבבים בפתרון במשך 10 עד 20 דקות, להסעיר את הסל ואת כל כמה דקות כדי לשמור על השבבים מלהידבק.
- הרם את הסל המכיל את שבבי סיליקון ולנקז היטב. הזז את הסל על to כוס הפסולת ולשטוף היטב במי סנטימטרים X 18 MΩ. לטבול בכוס לשטוף ולהתנועע מעלה ומטה במשך 20 שניות. מסננים את הסל ולשטוף ביסודיות עם מים על כוס הפסולת. רוקן את כוס הפסולת לתוך בקבוק פסולת RCA1 מיועד ולמלא במים.
- לאחר ניקוי RCA1 הושלם, למקם את הסל לתוך כוס 01:50 HF במשך 10 עד 20 שניות. השתמש תנועה למעלה ולמטה עדינה לערבב השבבים וHF. הרם את דלי דאנק כדי לאפשר HF לנקז משם לגמרי.
הערה: משטחי השבב צריכים להיות הידרופובי; מים לא להרטיב את השבב, אבל במקום ליצור טיפות עם זוויות מגע גבוהות. זה מצביע על כך תחמוצת סיליקון כבר חרוטה משם והשבב כעת הופסק על ידי אג"ח Si-H. - מניחים את הכוס לשטוף ולשטוף כוס באמבטית פלסטיק, להעביר את הסל מעל הכוס לשטוף ולשטוף עם מים סנטימטרים X 18 MΩ. להטביע את הסל לתוך הכוס לשטוף ולהתסיס במשך 20 שניות.
- השלם ניקוז וrins שנימחזור ה עם מים סנטימטרים X 18 MΩ. לזרוק את המים לשטוף לתוך הכוס לשטוף ולמלא את הכוס לשטוף עם מים. יוצקים את כל הפסולת לבקבוק פסולת HF פלסטיק מיועד.
- כאשר פתרון RCA2 הגיע לטמפרטורה המתאימה, להטביע את שבבי סיליקון בפתרונות באמצעות הסל. השאר בפתרון במשך 10 עד 20 דקות. השבב עכשיו יהיה הידרופילי בשל צמיחה של (1-2 ננומטר) תחמוצת סרט דק.
- הסר אחרי הכמות המתאימה של זמן ולפי אותו נוהל שטיפה כלRCA1. השלך את הפסולת במכל פסולת RCA2 המתאים. הסר כל שבב מהסל עם פינצטה פלסטיק, לשטוף עם מים, ומכה יבשה עם חנקן.
- שבבי חנות בקופסא פלסטיק או רקיק בבקבוקון של מים סנטימטרים X 18 MΩ. סיליקון יישאר נקי כאשר הם מאוחסנים במים לכשלושה ימים לאחר הניקוי. ודא שאזור העבודה הוא ניקה כראוי וחיצוני של כפפות CMOS נשטפו. השאר את CMכפפות OS בשכונה לייבוש.
6. ההפקדה DNA אוריגמי בהסיליקון פונקציונליות-APTES
- גיבוש חד שכבתי התאסף עצמי על הסיליקון
- APTES החם לRT לפני הפתיחה. אם הבקבוק קר מדי, עיבוי עלול להתרחש, גרימת הידרוליזה של APTES במהלך האחסון. להוסיף 1,980 μl מים סנטימטרים X 18 MΩ ו -20 μl של APTES לבקבוקון נצנץ נקי ומערבולת לערבב. השתמש בפתרון זה באופן מיידי.
- הנח שבב סיליקון ניקה רעיוני-צד-בבקבוקון הנצנץ, כובעו, ולתת לשבת במשך 20 דקות. הסר את השבב באמצעות פינצטה ולשטוף עם 200 μl של מים ויבשים דקות 1 עם זרם של N 2.
- הפקדת אוריגמי DNA על הסיליקון APTES פונקציונליות
הערה: הצעדים להפקדת אוריגמי DNA על סיליקון פונקציונליות הם דומים לאלה להפקדה ביציץ.- בקצרה לערבב בקבוקון אוריגמי DNA ופיפטה 4 μl של פתרוןעל גבי מצע סיליקון. במידת צורך, להגביר את עוצמת הקול של פתרון אוריגמי DNA משמש לכיסוי כל המצע כסיליקון פונקציונליות הוא יותר הידרופובי מהמצע נציץ. השתמש להחליק את מכסה זכוכית ללחוץ על הפתרון בתצהיר למטה ולמנוע אידוי בתצהירים ארוכים.
- תן הפתרון לעמוד לכמות הזמן הדרושה לריכוז בשימוש והכיסוי הרצוי (ראה איורים 2 ו -3 להשפעה של זמן וריכוז בכיסוי פני השטח). יש לשטוף את המצע עם מים סנטימטרים X 18 MΩ סטרילי 100 μl ויבש עם N 2 דקות 1.
- חזור על השטיפה עם מים סטריליים 100 μl נוסף ולייבש את המצע עם N 2 למשך 3 דקות.
- חנות המדגם במכל נקי עד ניתן לבצע ניסויים או הדמיה נוספים. דוגמאות מתחילות להראות הצטברות חלקיקים לאחר כ 1-2 שבועות של אחסון תלוי איך muפרק הם מטופלים.
הדמיה 7. AFM וניתוח תמונה של דוגמאות DNA אוריגמי
- השתמש AFM בקשה מצב באוויר לצורך הדמיה. הקשה מצב מבטיח כי כוח מינימאלי יחול על ננו השביר, בהשוואה למצב קשר.
הערה: הפרמטרים ההדמיה יהיו תלויים במכשיר. כל התמונות שהוצגו נתפסו באמצעות multimode Nanoscope IIIa. - בדיקות בחרו AFM לללא מגע / הקשה מצב באוויר, עם ציפוי זהב רעיוני, תדר תהודה (נומינלי) של ~ 300 kHz, כוח קבוע של 40 רדיוס N / מ ', וקצה <10 ננומטר.
- תהליך ולנתח את התמונות באמצעות AFM NanoScope תוכנת ניתוח. לבצע חישובי כיסוי באמצעות ImageJ. 19
תוצאות
שני משתנים להכתיב את הכיסוי של אוריגמי DNA על המצע: ריכוז פתרון וחשיפת זמן. מאפייני הספיחה של אוריגמי DNA ביציץ וAPTES תחמוצת סיליקון פונקציונליות כבר דווחו בעבר. 13 הקשר בין הריכוז של אוריגמי DNA בפתרון בתצהיר והכיסויים הסופיים על נציץ מסוכמים בטבלה 1 ואיור 2, מראה תוצאות ריכוז הגדלת בכיסוי מוגבר. הזמן-התלות של כריכה ניתן לראות באיור 3. כיסוי שטח נחקר בעבר לכמת את ההתנהגות מחייבת של אוריגמי DNA ביציץ ומשטחי תחמוצת סיליקון שונה. אוריגמי DNA ב -12 מגנזיום מ"מ במאגר 1x טה יש 83.3% ± 3.1% כיסוי על נציץ לאחר זמן קליטה 30 דקות על פני השטח. כיסוי מרבי על תחמוצת סיליקון שונה עם APTES סאמס הוא ציין לאחר 60 דקות, שהוא פחות מהכיסוי המרבי ביציצו.נדרש זמן ארוך יותר בתצהיר אם נדרש כיסוי פני השטח גבוה בAPTES פונקציונליות תחמוצת סיליקון.
ישנם מספר משתנה שיכול לגרום להכנת מדגם עניה. הבעייתי ביותר הוא שטיפה וייבוש לא מספקת. אם פתרון החיץ לא שטף כמו שצריך, אגרגטים גדולים יוצרים על המצע (איור 4 א). "איי אוריגמי DNA" הם נצפו כאשר ננו לדבוק תיקונים של מלחי מגנזיום על פני השטח (איור 4). לבסוף, עם דגימות כיסוי גבוה, ניתן לי רכיבי חיץ עודפים גישור בין אוריגמי DNA הבודד (איור 4C), שהופך אותו קשה להבדיל ננו באמצעות AFM. ניתן להימנע מתוצאות אלה על-ידי ביצוע שטיפה יסודית וייבוש פרוטוקול עבור שני מצעים נציץ וסיליקון.
היווצרות של סרטי APTES על מצעי תחמוצת סיליקון יכולה להוות בעיות גם כן. יש לי פרוסות סיליקוןשכבה מחוספס תחמוצת סיליקון שיש להסירו ושכבה חלקה יותר, דקה יותר תחמוצת סיליקון רפורמה לפני שניתן יהיה פונקציונליות זה. מצע סיליקון ניקה כראוי מודגם באיור 5 א. במהלך הניקוי של פרוסות סיליקון, חשוב לוודא מספר שבבי סיליקון הוא לא גבוה מדי, כפי שזה אפשרי עבור שני שבבים לנתקעים אחד לשני, חסימת חשיפה לחומרים הכימיים (איור 5). אם סיליקון ניקה כבר מאוחסן במי סנטימטרים X 18 MΩ ליותר משבוע אחד, השכבה המזהם תהיה רפורמה וrecleaning הוא הכרחי. אספקת APTES עלולה גם לגרום לבעיות עם הכנת מדגם. APTES polymerizes בקלות באמצעות הידרוליזה, המהווה את הבסיס להיווצרות השכבה. 20 של פילמור זה תלויה במידת הריכוז של מים שAPTES חשוף ל. לאורך זמן ובאמצעות שימוש חוזר ונשנה, זה אפשרי עבור מים להתעבות בתוך בקבוק APTES ולזהםאספקה. פילמור וכתוצאה מכך מייצר אגרגטים גדולים שלדבוק במצע (איור 5 ג). החספוס והנוכחות של אגרגטים מוגברים הופך את זיהוי DNA ננו באמצעות AFM קשה. זה תרגול טוב כדי לאחסן את בקבוק APTES בשקית ניילון במקרר, ולתת APTES בקבוק חם לRT לפני הפתיחה כדי למנוע התעבות.
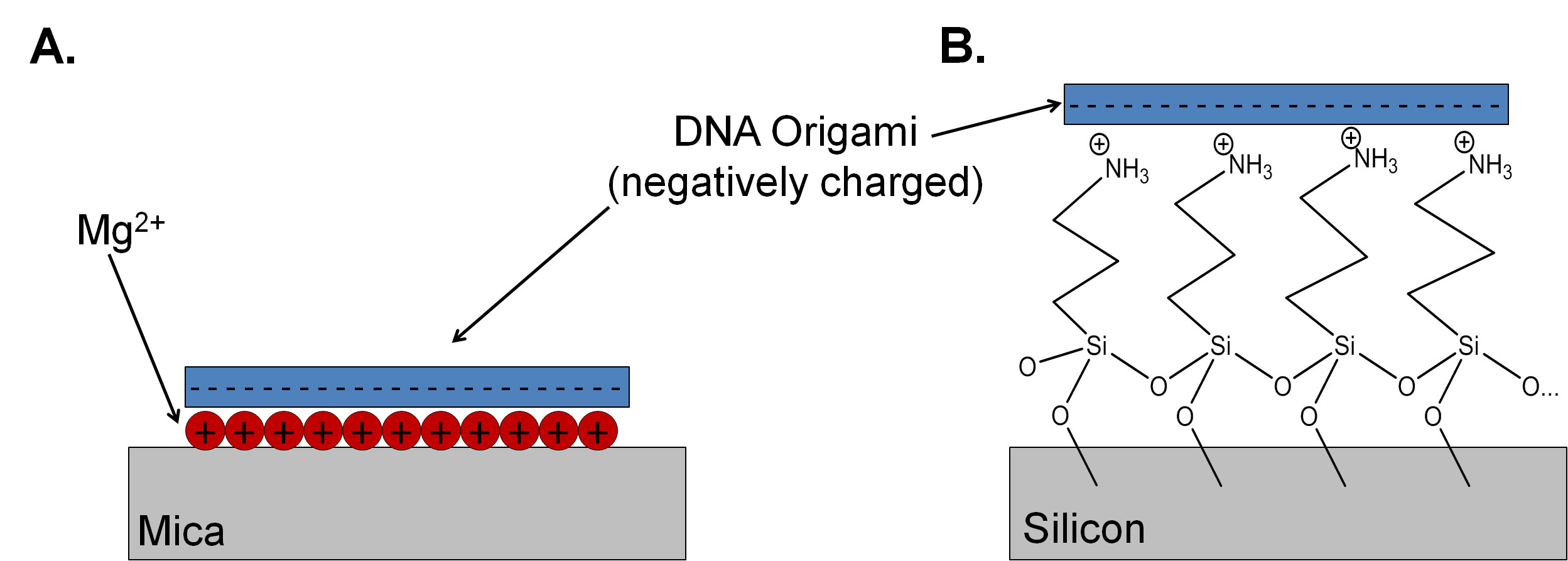
איור 1. תחמוצת סכמטי השוואת מנגנון המחייב לאוריגמי DNA ביציץ () ו- (ב) APTES פונקציונליות סיליקון (לא בקנה מידה). כריכה עם נציץ מתווך על ידי הנוכחות של קטיונים דו ערכיים, בדרך כלל Mg 2 +. Monolayer של אמין protonated הסתיים 3-aminopropyltriethoxysilane משמש לקידום הידבקות במצע תחמוצת סיליקון.

איור 2. תמונות הממחישות AFM כיסוי משתנה לאחר 10 דקות של תצהירים () 2 ננומטר, (ב) 4 ננומטר, ו- (ג) 6 ננומטר ביציצו. בקנה מידה הגובה עבור כל התמונות הוא ננומטר 5.

איור 3. מגמות בכיסוי שטח עבור 2 אוריגמי ננומטר DNA במאגר 1x טה, 12 מ"מ Mg 2 +. סמני מיקה = קו והעיגול סגולים, צהובים = קווי APTES וסמנים משולש. N = 3 בקביעת שגיאה סטנדרטית.

איור 4. שטיפה וייבוש ירודים יכולים לגרום ל() צבירת פתרון במצע, איי אוריגמי DNA (ב '), וגישור (C) של ננו בדגימות כיסוי גבוה בנוכחות מלחי חיץ עודפים. בקנה מידה הגובה עבור כל התמונות הוא 5 ננומטר.

5. (א) סיליקון איור נקי צריך חספוס RMS פחות מ -0.5 Å מעל 1 מיקרון המרובע. APTES SAM מלא הופקד על תחמוצת ילידים טובה צריך חספוס RMS פחות מ 1 על 1 מיקרון המרובע. (ב) APTES סרט נוצר על תחמוצת סיליקון ניקתה חלקי עם חספוס RMS של 2.29 ננומטר מעל 1 מיקרון המרובע. . שים לב לפערים והחספוס של סרט APTES (C) APTES משטח נוצר ממדגם של APTES מזוהם בפסולת תמצית; הידרוליזה בצורות בקבוק APTES חלקיקים גדולים. בקנה מידה הגובה עבור כל התמונות הוא 5 ננומטר.
מדידות כיסוי 1. אחוז שולחן למצעים נציץ עם varyinריכוזי פתרון אוריגמי גרם DNA. כל הזמנים בתצהיר הם 10 דקות.
| פתרון ה- DNA אוריגמי | סיקור% על מצע מיכה |
| 2 ננומטר | 8.49 ± 2.67 (N = 5) |
| 4 ננומטר | 55.89 ± 5.65 (N = 3) |
| 6 ננומטר | 77.44 ± 1.89 (N = 4) |
Discussion
ישנם מספר צעדים שצריכים להדגיש להשגת תוצאות עקביות ואידיאליות. עבור דגימות נציץ, הבא שטיפה קפדנית ויסודית וייבוש משטר, כמו בשלבים 3.3 ו 3.4, יבטיח שתמונות באיכות גבוהה של אוריגמי DNA הבודד ניתן להשיג באמצעות AFM ללא הבעיות השונות המפורטים בסעיף נציגי תוצאות. חשיבות העיקרית לדגימות סיליקון הוא הניקיון של המצע. בעקבות הליכי הניקוי שתוארו בשלב 5.2 ביסודיות ובקפדנות יבטיח כי משטח תחמוצת סיליקון ניקה כראוי יושג. בנוסף, ניטור האיכות והיעילות של חומרים כימיים, כגון מי חמצן, חומצה הידרופלואורית, וAPTES, יבטיח כי ההליך פועל בצורה חלקה.
הטכניקות המתוארות אינן מוגבלות לתמיסות מימיות בלבד של APTES. Monolayer מעורב של APTES וכלוריד trimethylaminopropyltrimethoxysilyl (TMAC) יכול להיות לנואד למנגינת תשלום משטח סיליקון ולקדם את הידבקות אוריגמי DNA משתנה. 11 TMAC מכיל רבעוני מסוף טעונים באופן קבוע האמין -N (CH 3) 3 +, בהשוואה לתשלום התלוי pH על APTES. משום שסביבת הפתרון אינה משפיעה על מדינת protonation או תשלום של TMAC, משתנה ריכוז הפתרון של מנגינת פחית TMAC אחראית על monolayer המעורב פני השטח ומשפיעה על האינטראקציה בין המצע לבין אוריגמי DNA. אוריגמי DNA האופטימלי כריכה נצפה לmonolayers שאחראי על .75-1.5 חיובים / ננומטר 2, אשר תואמים את הסוללות נ"מ המכילות 100% עד 40% ריכוז TMAC פני השטח. תשלום משטח אופטימלי זה תתבקש כיסויי אוריגמי DNA של כ 110 אוריגמי / מיקרומטר 2 על APTES סאמס ו -120 אוריגמי / מיקרומטר 2 על TMAC סאמס.
אחד יתרונות של סיליקון הוא התאימות שלה עם תהליכים הליתוגרפיה. מגנזיום הגבוהריכוזים ניתן להשתמש עם תחמוצות סיליקון שטופל פלזמה לקדם מחייב סלקטיבית של אוריגמי DNA לסיליקון. יש להקפיד בעת הסרת המדגם מהפתרון בתצהיר, כדי למנוע שטיפה משם יוני מגנזיום ולעוות אוריגמי DNA. 21,22 צורות תהליך APTES קוולנטית המצורפות קטיונים על פני השטח תחמוצת סיליקון, כך כביסה או שטיפה עם חיץ או מים עושה לא לפגוע באוריגמי DNA המצורף. שיטת 'השיגור מולקולרי "היא עוד דרך אפשרית לדפוסי מצעי סיליקון וקידום הידבקות אוריגמי DNA. מצע סיליקון הוא בדוגמת באמצעות ליתוגרפיה אלומת האלקטרונים וAPTES מופקד על המצע החשוף. בעקבות שיגור של photoresist, אוריגמי DNA יכול להיות מופקד על פני השטח בדוגמת, מעדיף מחייב APTES. 23
האינטראקציה של אוריגמי DNA עם מצע משנה את יציבותו, פתיחת אפיקים חדשים למחקר ויישומים. origam DNAאני דבקנו נציץ יכול להיות מחומם ל -150 מעלות צלזיוס ללא שינוי נראה של ממדי ננו-מבנה ושינויים כימיים מינימאליים. 24 זאת בניגוד מוחלט לשבריריות של אוריגמי DNA בפתרון, שבו ננו הושלם dehybridized מעל 70 מעלות צלזיוס. 25, 26 יציבות זו נשמרת על מצעי תחמוצת סיליקון מחוממים. 27 גם במערכות ממס מגוונות, כגון הקסאן, טולואן, ואתנול, צורה וכיסוי של ננו נשמרים. היציבות המפתיעה של אוריגמי DNA מצביעה על כך שיישומים שחשבו בעבר שאינו תואם, כגון בתצהיר פלזמה משופרת אדים, שימוש בphotoresists וממסים משותפים, וסביבות תצהיר כימי ייחודיות, ניתן להשתמש בשילוב עם אוריגמי DNA. עם זאת, אם אוריגמי DNA לשמור את הפונקציונליות שלהם עדיין לא ידוע ועלולים להגביל את היישומים אפשריים.
למרות היציבות של אוריגמי DNA בטמפרטורה גבוההים ובמספר מצומצם של מערכות ממס נקבע, היציבות לטווח הארוך של אוריגמי DNA על מצעים עדיין לא ידוע. השימוש בטכניקות סטרילי הוא נחוץ כדי למנוע זיהום אפשרי, אבל לא ניתן להימנע מזה אחרי תצהיר פני השטח. הדמיה וניתוח מדגם חייבת להסתיים כמעט מייד לאחר הכנת מדגם; אם המדגם הוא מאוחסן במשך זמן רב מדי (יותר משבוע) דוגמאות שונות של השפלה מדגם מזוהות לעתים קרובות, כוללים הצטברות חלקיקים וננו DNA השבור. אפיקי מחקר אפשריים בnanoelectronics, biosensing, ויישומים אחרים אוריגמי מצע מבוסס DNA עשויים להיות מוגבלים על ידי יציבות של ה- DNA תלוי זמן. זיהוי המגבלות של טכניקות אלה ליישומים שדורשים יציבות לתקופות זמן ארוכות יותר דורש חקירה נוספת.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Dr. Gary Bernstein for use of the AFM.
Materials
| Name | Company | Catalog Number | Comments |
| Eppendorf epT.I.P.S. Reloads, capacity 2-200 μl | VWR International, LLC | 22491733 | 10 reload tray of 96 tips |
| Microcentrifuge Tubes, Polypropylene | VWR International, LLC | 87003-290 | 0.65 ml, natural |
| Research Plus Pippete - Single Channel - 20-200 μl | A. Daigger & Company, Inc. | EF8960F-3120000054 EACH | Adjustable Volume |
| Research Plus Pippete - Single Channel - 2-20 μl | A. Daigger & Company, Inc. | EF8960D-3120000038 EACH | Adjustable Volume |
| Scotch 237 Permanent Double-Sided Tape | Office Depot, Inc. | 602710 | 3/4" x 300", Pack of 2 |
| Vortex Mixer | Thermo Scientific | M37610-33Q | |
| Wafer container single, 2" (50 mm), 60 mm x 11 mm | Electron Microscopy Sciences | 64917-2 | 6 per pack |
| 6" Wafer, P-type, <100> orientation, w/ primary flat | Nova Electronic Materials, Ltd. | GC49266 | |
| Powder-Free Nitrile Examination Gloves | VWR International, LLC | 82062-428 | Catalog number is for size large |
| High Accuracy Noncontact probes with Au reflective coating | K-Tek Nanotechnology, Inc. | HA_NC/15 | |
| Autoclave Pan | A. Daigger & Company, Inc. | NAL692-5000 EF25341C | |
| Sol-Vex II Aggressive Gloves, Size: 9-9.5; 15 mil, 13 inch - 1 dz | Spectrum Chemical Mfg. Corp. | 106-15055 | Before use, rinse with water and scrub together until no bubbles form on the gloves. |
| Tweezers PTFE 200 mm Square | Dynalon Corp. | 316504-0002 | |
| Muscovite Mica Sheets V-5 Quality | Electron Microscopy Sciences | 71850-01 | 10 per pack |
| Mica Disc, 10 mm | Ted Pella, Inc | 50 | Mica discs are optional |
| Scriber Diamon Pen for Glassware | VWR International, LLC | 52865-005 | |
| Scintillation Vials, Borosilicate Glass, with Screw Cap - 20 ml | VWR International, LLC | 66022-060 | Case of 500, with attached polypropylene cap and pulp foil liner |
| 4 x 5 Inch Top PC-200 Hot Plate, 120 V/60 Hz | Dot Scientific, Inc. | 6759-200 | |
| Straight-Sided Glass Jars, Wide Mouth | VWR International, LLC | 89043-554 | Case of 254, caps with pulp/vinyl liner attached |
| Standar-Grade Glass Beaker, 250 ml Capacity | VWR International, LLC | 173506 | |
| Beakers, PTFE | VWR International, LLC | 89026-022 | For use with HF |
| Shallow form watch glass, 3" | VWR International, LLC | 66112-107 | Case of 12 |
| Plastic Storage Container | VWR International, LLC | 470195-354 | For secondary container |
| General-Purpose Liquid-In-Glass Thermometers | VWR International, LLC | 89095-564 | |
| High precision and ultra fine tweezers | Electron Microscopy Sciences | 78310-0 | |
| Polycarbonate Faceshield | Fisher Scientific, Inc. | 18-999-4542 | |
| Neoprene Apron | Fisher Scientific, Inc. | 19-810-609 | |
| Calcium Gluconate, Calgonate | W.W Grainger, Inc. | 13W861 | Tube, 25 g |
| Hydrogen Peroxide 30% CR ACS 500 ml | Fisher Scientific, Inc. | H325 500 | HARMFUL, TOXIC |
| 3-Aminopropyltriethoxysilane | Gelest Inc. | SIA0610.0-25GM | Let warm to room temperature before use. |
| Ammonium hydroxide, 2.5 L | Fisher Scientific, Inc. | A669-212 | HARMFUL, TOXIC |
| Hydrochloric acid | Fisher Scientific, Inc. | A144-212 | HARMFUL, TOXIC |
| Hydrofluoric acid | Fisher Scientific, Inc. | A147-1LB | HARMFUL, TOXIC |
| MultiMode Nanoscope IIIa | Veeco Instruments, Inc. | Any AFM capable of tapping mode is suitable for analysis | |
| Dunk basket | Made in lab | Made in lab | The dunk basket was made using the bottom of a PTFE bottle with holes drilled in, PTFE handle, and all PTFE screws. |
References
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440, 297-302 (2006).
- Anderson, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-77 (2009).
- Wang, Z., Ding, B. Engineering DNA Self-Assemblies as Templates for Functional Nanostructures. Acc. Chem. Res. 47, 1654-1662 (2014).
- Xu, K., et al. Graphene Visualizes the First Water Adlayers on Mica at Ambient Conditions. Science. 329, 1188-1191 (2010).
- Bustamante, C., et al. Circular DNA-molecules imaged in air by scanning force microscopy. Biochemistry. 31, 22-26 (1992).
- Hsueh, C., et al. Localized Nanoscopic Surface Measurements of Nickel-Modified Mica for Single-Molecule DNA Sequence Sampling. ACS Appl Mater. Interfaces. 2, 3249-3256 (2010).
- Pastre, D., et al. Anionic polyelectrolyte adsorption on mica mediated by multivalent cations: A solution to DNA imaging by atomic force microscopy under high ionic strengths. Langmuir. 22, 6651-6660 (2006).
- Woo, S., et al. Self-assembly of two-dimensional DNA origami lattices using cation-controlled surface diffusion. Nature Communications. 5, 4889(2014).
- Vesenka, J., et al. Substrate preparation for reliable imaging of DNA molecules with the scanning force microscope. Ultramicroscopy. 42-44, 1243-1249 (1992).
- Adsorption studies of DNA origami on silicon dioxide. Albrechts, B., et al. 21st Micromechanics and Micro Systems Europe Workshop 2010, , (2010).
- Sarveswaran, K., et al. Adhesion of DNA Nanostructures and DNA Origami to lithographically patterned self-assembled monolayers in Si[100]. Proc. of SPIE-Soc. Opt. Eng. 7637, 76370M-1(2010).
- Kern, W., Puotien, D. A. Cleaning solutions based on hydrogen peroxide for use in silicon semiconductor technology. RCA Rev. 31, 187-206 (1970).
- Pillers, M., Goss, V., Lieberman, M. Electron-Beam Lithography and Molecular Liftoff for Directed Attachment of DNA Nanostructures on Silicon: Top-down Meets Bottom-up. Acc. Chem. Res. 47, 1759-1767 (2014).
- Saccá, B., Niemery, C. M. DNA Origami: The Art of Folding DNA. Angew. Chem. Int. Ed. 51, 58-66 (2012).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Res. 37, 5001-5006 (2009).
- Ben-Ishay, E., et al. Designing a Bio-responsive Robot from DNA. Origami. J. Vis. Exp. (77), e50268(2013).
- Woo, S., et al. Programmable molecular recognition based on the geometry of DNA nanostructures. Nature Chemistry. 3, 620-627 (2011).
- Schlegel, M. L., et al. Cation sorption on the muscovite (001) surface in chloride solutions using high-resolution X-ray reflectivity. Geochim. Cosmochim. Acta. 70, 3549-3565 (2006).
- Rasband, W. S., Howarter, J. A., et al. National Institutes of Health. Langmuir. 22, Bethesda, Maryland, USA. 11142-11147 (2006).
- Kershner, R. J., et al. Placement and orientation of individual DNA shapes on lithographically patterned surfaces. Nature Nanotechnology. 4, 557-561 (2009).
- Hung, A. M., et al. Large-area spatially ordered arrays of gold nanoparticles directed by lithographically confined DNA origami. Nature Nanotechnology. 5, 121-126 (2010).
- Sarveswaran, K., et al. et al.Adhesion of DNA nanostructure and DNA origami to lithographically patterned self-assembled monolayers on Si[100. Proc. SPIE-Int. Soc. Opt. Eng. 7637, 76370M(2010).
- Pillers, M. A., Lieberman, M. Thermal stability of DNA origami on mica. J. Vac. Sci. Technol. B. 32, 040602(2014).
- Song, J., et al. Direct Visualization of Transient Thermal Response of a DNA. Origami. J. Am. Chem. Soc. 134, 9844(2012).
- Wei, X., et al. Mapping the thermal behavior of DNA origami nanostructures. J. Am. Chem. Soc. 135 (16), 6165-6176 (2013).
- Hyojeong Kim,, et al. Stability of DNA Origami Nanostructures under Diverse Chemical Environments. Chem. Mater. 26, 5265-5273 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved