Method Article
定量的代謝フラックス研究のための洗浄済みヒト血小板の調製
要約
血小板代謝は、特に出血および血栓性疾患における血小板の過活動および低活動性の役割に関連しているため、興味深いものです。血漿からの血小板の単離は、一部の代謝アッセイに必要です。ここで紹介するのは、洗浄した血小板から細胞内代謝産物を単離する方法です。
要約
血小板は、止血と自然免疫応答に不可欠な役割を果たす血球です。血小板の過活動性と低活動性は代謝障害に関与しており、血栓症と出血の両方のリスクを高めます。血小板の活性化と代謝は密接に関連しており、前者を測定する方法は数多くありますが、後者を測定する方法は比較的少ないです。他の血液細胞や血漿成分の干渉を受けずに血小板代謝を研究するには、血小板を単離する必要がありますが、血小板のせん断感度と不可逆的に活性化する能力のために、このプロセスは簡単ではありません。ここで紹介するのは、血小板アゴニストによる刺激に敏感な静止血小板を生成する血小板単離(洗浄)のプロトコルです。血小板阻害剤を添加して連続的な遠心分離ステップを行い、全血から血小板を単離し、制御されたアイソスモティックバッファーに再懸濁します。この方法は、顆粒分泌およびインテグリン活性のマーカーによって測定される低活性化で、全血からの血小板の30%〜40%の回収を再現性よく生成します。血小板数と燃料濃度を正確に制御できるため、ユーザーはさまざまな代謝状況を調査できます。
概要
血小板は小さく(直径2〜4μm)、血栓形成の厳密に制御されたプロセスである止血に重要な役割を果たす無核細胞です1。血管の完全性に不可欠ですが、血小板は健康上の悪影響にも関与しています。血小板は、深部静脈血栓症(DVT)や動脈血栓症(AT)に関与しており、これらは血管を閉塞する血栓であり、局所的な血液供給の減少につながるか、血栓の一部が壊れる(塞栓する)と、肺、心臓、または脳への血液供給を妨げる可能性があります2,3,4,5,6,7 .血小板過敏性は、高血圧、糖尿病、および癌の併存疾患であり、DVTおよびAT8,9,10の発生率の増加につながります。血小板の活性化と代謝は密接に関連しており11,12、治療戦略として血小板代謝を標的とすることへの関心が高まっています13,14。活性化時に発生する正確な代謝の再配線については議論があり、これは活発な研究分野です15。疾患における血小板機能障害とその代謝との関連に対する関心の高まりは、血小板を分離し、その代謝を研究するための再現性のある方法の必要性を強調しています。
ヒト血小板は通常、静脈穿刺によって得られ、その後全血から単離されます。 洗浄された血小板は、連続的な洗浄および遠心分離ステップ16によって全血から分離される。これはもともとマスタードのグループ17によって行われ、カゼナーヴのグループ18によってわずかに変更されました。別の代替法は、ゲル濾過血小板であり、これは、アガロースゲルビーズ19の充填カラムを用いたサイズ排除クロマトグラフィーにより、多血小板血漿(PRP)から得ることができる。多くの洗浄プロトコルは、ヒトおよびげっ歯類の血液の両方に対して存在し、様々なアッセイ20,21,22,23に対して最適化されているが、血小板代謝の測定には最適化されていない。
血小板代謝を研究する技術には、タツノオトシゴXFアナライザー11,24,25,26,27による生体エネルギー測定、細胞外フラックス測定11,13,24、メタボロミクス14,28、および同位体支援代謝フラックス分析(13C-MFA)29が含まれます.メタボローム研究では、通常、目標は、2つの異なる条件(例えば、安静時と活性化血小板14)の間で変化する経路を決定することである。メタボロミクス研究では、液体クロマトグラフィー-質量分析(LC-MS)を使用します。これらの研究は、細胞内または細胞外代謝物に対して行うことができ、しばしばパスウェイ分析または主成分分析(PCA)と組み合わされる14,28。同位体支援代謝フラックス分析(13C-MFA)では、トレーサーと呼ばれる標識基質を細胞に供給し、このトレーサーが反応ネットワークを介してどのように伝播するかをLC-MSで測定します。この技術により、反応レベル分解能29,30で代謝経路を通るフラックスの計算が可能になります。全血および多血小板血漿(PRP)では、燃料濃度(グルコース、グルタミン、酢酸など)はドナー間の変動性に左右され、血漿中に存在するアルブミンおよび性ホルモン結合グロブリンは、ホルモン、薬物、およびその他の生物学的に関連する分子の活性濃度を変化させる可能性がある31。洗浄された血小板は、既知の燃料濃度を含むユーザー定義の媒体に血小板を懸濁する方法を提供し、13C-MFA32に適合します。
ここでは、代謝アッセイに使用できる血小板を生成するための血小板洗浄の方法について説明します。このプロトコルは、赤血球および白血球の汚染が少ない静止血小板を生成します。 血小板活性化状態は、血小板活性化マーカーのフローサイトメトリーを介してモニターされました。このプロトコルは、全血中の血小板数に対して少なくとも30%〜40%の血小板回収率を再現性よく達成します。この技術で得られた洗浄血小板は代謝分析技術に適しており、細胞内代謝物抽出法は、ユーザーが選択した分析(LC-MS、GC-MS、測光アッセイなど)に合わせて調整できます。
プロトコル
この研究は、コロラド大学アンシュッツメディカルキャンパスから治験審査委員会の承認を受けました。書面による同意は、すべての研究参加者から得られました。参加者は、過去48時間にアルコールを摂取しなかった、または過去10日間に非ステロイド性抗炎症薬(NSAID)を摂取しなかったと報告しました。このプロジェクトは、国立衛生研究所の国立心臓・肺・血液研究所の賞番号R61HL141794でサポートされています。
1.採血
- 採血の準備をします。採血は訓練を受けた瀉血専門医によって行われることをお勧めします。
- 19Gの針を使用して、内側の腕に静脈穿刺を行います。
- 最初の~2mLを無添加のバキュテイナーに集めて廃棄します。これは、血小板を活性化する可能性のある損傷した内皮細胞から化学シグナル伝達分子を除去するためです。最初の2mLを採取した後、止血帯を取り外して血小板のせん断応力を軽減します。
- 残りの血液を抗凝固剤クエン酸デキストロース(ACD-A)バキュテーナーに14:3(血液:ACD-A)の比率で収集します。.採血後、各バキュテイナーを静かに反転させて、血液と抗凝固剤を混合します。
2.血小板洗浄
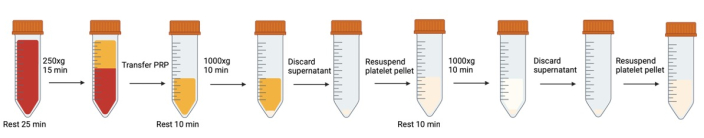
図1:血小板洗浄に関与する連続的な遠心分離および再懸濁ステップ。この図の拡大版を表示するには、ここをクリックしてください。
注意: 気泡の発生は避けてください。トランスファーピペットを使用して、気泡が形成されたとき、特に遠心分離前に気泡を除去します。血液/血小板のチューブが開いている/閉じているたびに、キャップを閉じる前にチューブに息を吹き込んでCO2 レベルを上げることをお勧めします。
- 遠心分離機を37°Cに予熱して、温度の影響を減らします。プロトコールの各遠心分離ステップ間で、遠心分離機を37°Cに維持します。
- ウォーターバスを37°Cに予熱します。 グルコースを含む改変タイロード緩衝液を水浴に入れます。
注:変更されたTyrodeのバッファーレシピは、 補足ファイル1にあります。 - すべてのバキューナーから採取した全血を50mLのポリプロピレンコニカルチューブに混ぜ合わせます。45°の角度でカットしたベベルカットピペットチップを使用して、適切な量のサンプルを採取し、細胞カウントを行います( 細胞カウントを参照)。
- 細口径トランスファーピペットで慎重に吸引することにより、発生した気泡を取り除きます。
- 血液を37°Cのウォーターバスで25分間休ませます これにより、可逆的に活性化された状態(体から取り出されたり、チューブからチューブに移されたりすることなど)の血小板が休息状態に戻ることができます。
- 遠心分離中の活性化を防ぐため、500 nMのプロスタグランジンI2 (PGI2)と0.02 U/mLのアピラーゼを全血に加え、一度反転させて穏やかに混合します。 ナローボアトランスファーピペットを使用して、発生した気泡を取り除きます。
注:適切なPGI2 およびアピラーゼレシピの手順は、 補足ファイル1に記載されています。 - 全血を遠心分離して多血小板血漿(PRP)を得ます(全血42 mLに対して250 x g で15分間)ブレーキなし(37°C)で。
- PRP(バフィーコートと赤血球層の上にある黄色の層)を、広口径トランスファーピペットを使用して新しい50mLコニカルチューブに静かに集めます。
- 移すときは、きれいな円錐形のチューブを傾け、PRPをチューブの側面にそっと通します。気泡を避けてください。
- バフィーコート(PRPと赤血球の間の白血球の層)を乱さないように、約3mmのPRPを残してください。邪魔されると、トランスファーピペットに突然白い渦が巻かれたように見えます。
- 細胞数を測定し( 血小板のカウントを参照)、次の洗浄ステップのための再懸濁量を決定します。
- 37°Cで10分間休ませます。
- ベベルカットピペットチップを使用して、フローサイトメトリー用のサンプルを採取します( フローサイトメトリーを参照)。
- 500 nM PGI2 と 0.02 U/mL のアピラーゼを PRP に加え、一度静かに反転させて混合します。
- 1000 x g 、37°C(加速度:0、ブレーキ:0)で10分間遠心分離します。ブレーキは使用しないでください。ペレットはコンパクトではなく、急ブレーキがかかると再混合が発生する可能性があります。
- 遠心分離中に、再懸濁量を決定します。75% の回復を想定します。細胞密度を約3x105 細胞/μLとします。
- バルク容量にはプラスチック製のワイドボアトランスファーピペットを使用し、ペレットの近くの残りの液体には1mLピペット(カットされていない先端)を使用して上清を吸引します。チューブの底にあるペレットには触れないでください。
- 500 nM PGI2 と 0.02 U/mL のアピラーゼを修飾 Tyrode バッファーに添加します。ステップ16で計算した量のバッファーを、円錐形チューブの側面に滴り落ちてゆっくりと加えます。
- ベベルカットチップと1mLピペットチップを使用して、数回ピペッティングで優しく上下させることで、ペレットを穏やかに再懸濁します。
- 容量を300μLに設定し、液体ラインより上でプランジャーを完全に押し下げてから、ピペットを液体の下に置き、最初のストップまで来てください。これにより、科学者は、血小板を活性化する可能性のある気泡を誤って生成することなく、ペレットを再懸濁することができます。
- 時折、ペレットの底に目に見える赤血球の輪があります。これを再一時停止しないでください。
- ペレットが再懸濁されたら、広口径のトランスファーピペットを使用して、再懸濁したペレットを新しい円錐形のチューブに移し、赤血球や目に見えて凝集した細胞を残します。
- 手順 11 から 20 を繰り返します。新鮮なアリコートから500 nM PGI2 と0.02 U/mLを改変Tyrodeバッファーに必ず追加してください(ステップ18の改変Tyrode'sバッファーは再利用しないでください、PGI2 は不安定すぎます)。
- セルカウントのサンプルを採取します。必要に応じて、改変されたタイロード緩衝液で血小板濃度を調整します。.
- ベベルカットピペットチップを使用して、フローサイトメトリー用のサンプルを採取します。
- 血小板を37°Cで1時間休ませて、阻害剤が消耗する時間を確保し、可逆的に活性化された血小板が休止状態に戻るのを待ちます。
- ワイドボアピペットでやさしく混ぜます。フローサイトメトリー用のサンプルを採取します。
- 洗浄された休止血小板は、代謝分析に使用する準備が整いました。
3. 血小板のカウント
- 血小板は、自動血球カウンター(製造元の指示に従ってください)または血球計算盤33のいずれかを使用してカウントできます。
4. フローサイトメトリー
- 準備
- 抗体ミックスのセットアップと血小板活性化を測定するためのフローサイトメーターの準備に関する詳細なプロトコルとベストプラクティスのレビューは、他の場所で見つけることができます34,35。
- サンプリング
- フローサイトメトリー用のサンプルを採取する場合は、ベベルカットピペットチップを使用して血小板懸濁液を採取します。これを抗体を入れた微量遠心チューブにゆっくりと加え、軽くフリックして混合します。30秒間インキュベートします。
- ベベルカットピペットチップを使用して、血小板懸濁液/抗体混合物を96ウェルプレート上の適切なウェルに移します。
- すぐにウェルに固定剤を添加して細胞を固定します。
- 固定後8時間以内にフローサイトメーターで測定します。
- アゴニスト感度試験
- 洗浄後、15 mLコニカルチューブ2本(1本は安静時コントロール用、もう1本はトロンビン活性化コントロール用)を取っておきます。
- ベベルカットピペットチップを使用して、100 μLの血小板懸濁液を各円錐チューブに静かにピペットで固定します。37°Cで1時間休ませます。
- 1時間の休息後、0.1 U / mLのトロンビンを1つのチューブに追加し(トロンビンの準備手順は 補足ファイル1に記載されています)、もう1つのチューブにビヒクルを追加します。.37°Cで15分間インキュベートします。
- 各チューブのフローサイトメトリーサンプルを採取して、アゴニストに対する血小板の感受性を測定します。
5. 定量的代謝フラックス分析のためのサンプリング
- 焼 入
注:代謝の消光は、正確な代謝フラックスを測定するために必要なステップです。細胞を急速に冷却し、その温度を4°C以下に維持すると、代謝が十分に遅くなり、サンプリングされた細胞がバルクからの細胞の代謝を正確に反映するように、代謝が本質的に停止したと想定できます。使用できる方法はさまざまですが、急速冷却の必要性と漏れの最小化のバランスをとるには、冷塩水(-4°C)の生理食塩水36を使用してください。塩がその後の分析を妨げる場合は、別の流体(メタノール/水、エタノールなど)を使用できます37.- 生理食塩水のアリコートを準備して凍結します。各生理食塩水アリコートを目的のサンプルの6倍の量にします。
注:通常の生理食塩水レシピは 、補足ファイル1にあります。 - 微量遠心分離機を0°Cに予冷します。
- 部分的に凍結した生理食塩水(<-4°C)に血小板懸濁液を1:6の比率で回収します(例、微量遠心チューブで150μLの血小板懸濁液を750μLの生理食塩水に回収します)。
注:血小板/生理食塩水を氷の上に15分以上放置しないでください。 - 16,000 x g、0°Cで10分間遠心分離します。
- 上清は外部代謝物分析用に保存し、ペレットは細胞内代謝物の抽出と測定用に保存します。分析の準備が整うまで、両方を-20°Cで保存してください。
- このプロセスを、目的の時間間隔とサンプル時間ポイントの数にわたって繰り返します。
- 生理食塩水のアリコートを準備して凍結します。各生理食塩水アリコートを目的のサンプルの6倍の量にします。
- 細胞内代謝物抽出
- 0.5 mLの予め冷却した7:3メタノール水(-20°C)を急冷したペレットに加えます。1分間激しく渦巻きます。
- 液体窒素で凍結し、0°Cで解凍し、さらに2サイクル繰り返します。
- 懸濁液を16,000 x g で-4°Cで10分間遠心分離します。
- 上清を新しい微量遠心チューブに集めます。
- ステップ3のペレットを使用し、50:50メタノール:水で抽出プロトコル(ステップ1〜3)を繰り返します。2 番目に収集した抽出を 1 番目の抽出物に追加します。一晩乾燥させます。
- 乾燥抽出物を150 μLのLC-MSグレードの水(または目的の分析に適した他の溶解剤)に再懸濁します。4°Cで15分間混合します。 短時間ボルテックスし、0.22 μmの微量遠心チューブに移して細胞の破片を取り除きます。16,000 x g 、4°Cで5分間遠心分離します。
- 遠心分離機から取り出し、さらに50 μLのオプティマ水をフィルターにピペットで移し、再度遠心分離(5分、16,000 x g 、4°C)してフィルターをすすぎます。分析のために収集します。
結果
図 2 の代表的な結果は、3 人の男性と 3 人の女性を含む 6 人の異なる献血者を表しています。全血に対する血小板収量を図2Aに示します。最終的な血小板回復率は平均52%±3%でした(標準偏差、n = 6)。最終血小板数と白血球の汚染を比較し、自動血液分析装置を用いて測定しました。白血球数は全細胞の0.1%未満でした(図2B)。洗浄プロセスと1時間の休息を通じて、血小板は低いP-セレクチン曝露を維持しましたが、トロンビン治療には強く反応しました(図2C)。結合したフィブリノーゲンは、最初の1000 x gスピン後に急上昇しますが、2回目の1000 x gスピン後には5%未満に戻ります。P-セレクチン曝露と同様に、結合したフィブリノーゲンは、1時間の安静後のトロンビン処理後に劇的に増加します(図2D)。サイズ、シングレット、およびCD42a陽性の代表的なゲーティングを図3A-Cに示します。これらの連続するゲートを通過するイベントは、P-セレクチン曝露と結合したフィブリノーゲンを探すために使用されます。P-セレクチン陽性血小板およびフィブリノーゲン陽性血小板の代表的なゲーティングを図3D-Eに示します。図 3D はビヒクルコントロールで処理した血小板サンプルを示し、図 3E は 0.1 U/mL トロンビンを添加した 15 分後の血小板サンプルを示しています。
洗浄した血小板を使用して、 図4に示すように、定量的な取り込みおよび排泄実験を行いました。血小板を洗浄し、5 mmol/Lのグルコースと20 mmol/Lのアセテートを最終洗浄懸濁液に加えました。0.1 U/mLのトロンビンまたはビヒクルを、1時間の休息後に洗浄した血小板懸濁液に加えました。サンプルを採取し、トロンビンを30分間添加した後、15分ごとに急冷しました。上清を使用して、自動測光アッセイを使用して細胞外乳酸、グルコース、および酢酸の濃度の変化を測定しました。フラックスは、代謝物の濃度の経時的な回帰傾きを取ることによって計算されました。 図4 は、代表的なドナー3人について計算された代謝物フラックスを示しています。すべてのドナーの乳酸フラックスは陽性で、乳酸が産生されていることを示し、グルコースと酢酸フラックスは陰性で、消費されていることを示していました。倍率の変化にはばらつきがありますが、トロンビン処理により、各ドナーの安静時と比較してフラックスの大きさが増加しました。

図2:(A)洗浄プロセスの各ステップで全血に対して回収された血小板の割合。n = 6、エラーバーは標準偏差を表します。(B)洗浄プロセス終了時の血小板細胞数と白血球細胞数。(C)フローサイトメトリーで測定した、P-セレクチン発現陽性の血小板の割合。n = 6、エラーバーは標準偏差を表します。(D)フローサイトメトリーで測定した、フィブリノーゲン陽性の血小板の割合。n = 6、エラーバーは標準偏差を表します。. この図の拡大版を表示するには、ここをクリックしてください。

図3:血小板フローサイトメトリーの代表的なゲーティング。 血小板は、(A)前方散乱光(FSC)および側方散乱光(SSC)でサイズをゲート化し、(B)FSC幅およびFSC高さの単一細胞をゲート化し、(C)CD42a陽性をゲート化します。これらの連続するゲートを通過するイベントは、アクティブ化マーカーを探すために使用されます。(D)休止型コントロール血小板サンプルのP-セレクチンおよびフィブリノーゲンの発現。ここで測定される活性化マーカーは、P-セレクチンPECy5およびFITC-フィブリノーゲンです。(E)0.1 U/mL トロンビン処理血小板サンプルに対する P-セレクチンおよびフィブリノーゲンの発現。ここで測定される活性化マーカーは、P-セレクチンPECy5およびFITC-フィブリノーゲンです。 この図の拡大版を表示するには、ここをクリックしてください。
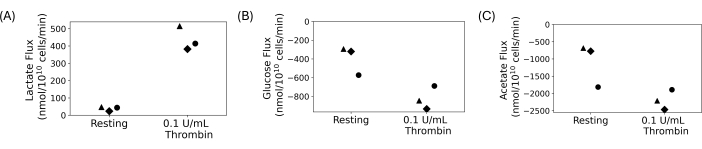
図4: (A)安静時およびトロンビン活性化状態の3つの異なるドナーの乳酸排泄率。(B)安静時およびトロンビン活性化状態の3人の異なるドナーのグルコース取り込み率。(C)安静時およびトロンビン活性化状態の3つの異なるドナーのアセテート取り込み率。 この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:バッファーおよび試薬調製のレシピと説明書。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
血小板は、せん断応力やアゴニストの存在など、環境に非常に敏感です38,39。これにより、血小板の取り扱いと分離が困難になり、阻害剤と広口径ピペットの使用が重要になります40。基本的なPBSでPGI2を調製しないと、PGI241が急速に劣化するため、PGI2の適切な保管と調製が不可欠です。せん断による活性化のリスクを最小限に抑えるには、ワイドボアピペット、ベベルカットピペットチップ、および19ゲージの瀉血針を使用します。
必然的に、血小板の一部は洗浄プロセスの各ステップで失われます(図2A)。すべての血小板が血漿層に到達するわけではなく、バフィーコート層に近すぎる血漿を収集すると、白血球が汚染されるリスクがあります。さらに、血小板の集団は再懸濁時に凝集して底に沈むため、再懸濁のたびに再懸濁したペレットをきれいなチューブに移すことの重要性が強調されています。図2Dでは、最初の1000 x gスピンの後、フィブリノーゲン結合が増加し、2番目の1000 x gスピン後に減少することに注意してください。フローサイトメトリー用のサンプルは、いずれの場合も10分間の休息時間後に収集されました。この集団の一部が静止状態を回復する可能性がありますが、この集団は最初の 10 分間の休息後に存在するため、この活性化された集団の一部は、再懸濁時に凝集してチューブの底に落ちる可能性があります。
フローサイトメトリーの使用は厳密には必要ではありませんが、血小板が休止状態にあり、洗浄プロセスの最後にアゴニストに反応できるかどうかをモニターすることは有益です。さらに、特に洗浄中に血小板の大部分が視覚的に凝集しているように見える場合は、各ステップでフローサイトメトリーを実施することで、問題が発生している場所を特定するのに役立ちます。まれですが、約20のドナー実験のうち1つは、休息期間中に自発的に血小板が活性化するため、除外する必要があります。血小板活性化マーカーのフローサイトメトリー解析は、血小板を用いた実験の前に、アゴニストに対する静止と感度を検証するための貴重なツールです。
フローサイトメトリーを使用してアゴニストに対する血小板応答を測定するために、一部の研究では、血小板をアゴニストと抗体カクテルで室温で10〜30分間インキュベートしてから、42,43,44を固定します。1時間の休息後、休止中のコントロール血小板を固定する前に室温で20分間インキュベートすると、活性化が過大評価されます。.この活性化は、血小板を37°Cで20分間インキュベートすると起こらないため、この明らかな活性化は、阻害剤が摩耗し、急激な温度変化によって血小板が活性化するために起こることが示唆されています。洗浄プロセス中に固定するために20分待っても、この人工的な活性化は誘発されませんが、これは1時間の休息中の阻害剤の作用の減衰によるものである可能性があります。血小板の真の活性化状態を捕捉するには、37°Cでインキュベーションを行うか、抗体との短時間(30秒)のインキュベーション後に血小板を固定することをお勧めします。
洗浄された血小板は、他の血球や血漿成分の干渉なしに血小板を研究する方法を提供します。これらは、代謝研究など、細胞外環境を操作する必要がある研究に最適です。最終的な血小板懸濁液の密度は調整可能で、人間の血小板数のばらつきを最小限に抑えるように制御できます。代謝研究では、血小板炭素基質のカスタム濃度を制御することができます。図4に示す代表的な結果は、炭素基質としてグルコースとアセテートを添加し、乳酸を産生した取り込み排泄実験によるものです。図4では、ドナー間に生物学的なばらつきがありますが、トロンビン処理により乳酸産生が増加する一方で、グルコースとアセテートの消費量は増加します。これは文献と一致します。血小板は、活性化時に好気性解糖と酸化的リン酸化の速度を増加させることが知られています13,14,15,45。 この手法は、さまざまな栄養条件下で、または最終的な血小板懸濁液中に異なるイオンを使用して血小板を研究するために適用できます。
洗浄された血小板の研究は価値がありますが、人工環境は 生体内で環境を再現するものではないことに留意することが重要です。したがって、洗浄された血小板は、研究者が血小板機能のみに関心がある状況でのみ使用する必要があります。すべての in vitro 研究と同様に、結果は慎重に解釈する必要があります。最終洗浄後、血小板をカルシウム濃度2 mMの修飾チロード緩衝液に再懸濁することをお勧めします。P-セレクチンおよびフィブリノーゲン結合発現は、洗浄プロセス後1.5時間(1時間の休息を含む2.5時間)までしか測定されていないため、科学者はその時間内に洗浄した血小板懸濁液を使用するか、血小板の忠実度を検証することをお勧めします。この研究では、凝集など、血小板機能に関する他の古典的な指標は測定しませんでした。
当社のプロトコルで調製した洗浄済み血小板は静止状態であり、P-セレクチンおよびフィブリノーゲンのフローサイトメトリー測定によって検証されます。細胞外環境中の代謝基質、ホルモン、血小板アゴニストを正確に制御できるため、科学者は選択したシステムで血小板代謝を研究することができます。
開示事項
著者には報告すべき利益相反はありません。
謝辞
著者らは、Pierre Mangin博士の研究室のEmily Janus-Bell博士とClarisse Mouriaux博士、およびJorge DiPaola博士の研究室のKatrina Bark氏の指導とアドバイスに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
参考文献
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved