Method Article
洗涤人血小板的制备用于定量代谢通量研究
摘要
血小板代谢值得关注,特别是因为它与血小板过度活跃和低下在出血和血栓性疾病中的作用有关。从血浆中分离血小板对于某些代谢测定是必要的;这里介绍的是一种从洗涤的血小板中分离细胞内代谢物的方法。
摘要
血小板是在止血和先天免疫反应中起重要作用的血细胞。血小板亢进和低动与代谢紊乱有关,增加了血栓形成和出血的风险。血小板活化和代谢密切相关,前者测量的方法很多,但后者的测量方法相对较少。为了在没有其他血细胞和血浆成分干扰的情况下研究血小板代谢,必须分离血小板,由于血小板剪切敏感性和不可逆激活的能力,这一过程并非易事。这里介绍的是一种血小板分离(洗涤)方案,它产生对血小板激动剂刺激敏感的静止血小板。使用连续离心步骤并添加血小板抑制剂从全血中分离血小板并将其重悬于受控的等渗缓冲液中。该方法可重现地从全血中回收 30%–40% 的血小板,通过颗粒分泌和整合素活性标志物测量,活化率低。血小板计数和燃料浓度可以精确控制,以允许用户探测各种代谢情况。
引言
血小板是小的(直径 2-4 μm)的无核细胞,在止血中起重要作用,止血是严格调节的凝块形成过程1。虽然血小板对血管完整性至关重要,但也与不良健康事件有关。血小板与深静脉血栓形成 (DVT) 和动脉血栓形成 (AT) 有关,它们是阻塞血管的凝块,导致局部血液供应减少,或者,如果凝块脱落(栓塞),它们会阻塞肺部、心脏或大脑的血液供应 2,3,4,5,6,7.血小板高反应性是高血压、糖尿病和癌症的合并症,导致 DVT 和 AT 的发生率增加 8,9,10。血小板活化和代谢密切相关11,12,导致人们对靶向血小板代谢作为一种治疗策略的兴趣增加13,14。关于激活时发生的确切代谢重新布线存在争议,这是研究15 的一个活跃领域。对疾病中血小板功能障碍及其与代谢联系的兴趣增加,强调了需要一种可重复的方法来分离血小板并研究其代谢。
人血小板通常通过静脉穿刺获得,然后从全血中分离出来。 通过连续洗涤和离心步骤16 将洗涤后的血小板与全血分离。这最初是由 Mustard 的第17 组完成的,并由 Cazenave 的第18 组略微修改。另一种替代方法是凝胶过滤的血小板,可以使用琼脂糖凝胶珠填充柱,通过体积排阻色谱从富血小板血浆 (PRP) 中获得19。存在许多适用于人和啮齿动物血液的洗涤方案,并针对各种测定进行了优化20、21、22、23,但不适用于测量血小板代谢。
研究血小板代谢的技术包括通过 Seahorse XF 分析仪进行生物能量测量 11,24,25,26,27,细胞外通量测量 11,13,24,代谢组学 14,28 和同位素辅助代谢通量分析 (13C-MFA)29.在代谢组学研究中,目标通常是确定两种不同情况之间改变的通路(例如,静息血小板与活化血小板14)。代谢组学研究涉及使用液相色谱-质谱法 (LC-MS)。这些研究可以针对细胞内或细胞外代谢物进行,并且通常与通路分析或主成分分析 (PCA) 相结合14,28。同位素辅助代谢通量分析 (13C-MFA) 包括为细胞提供称为示踪剂的标记底物,并使用 LC-MS 测量该示踪剂如何在反应网络中传播。该技术允许以29,30 的反应水平分辨率计算通过代谢途径的通量。在全血和富含血小板的血浆 (PRP) 中,燃料浓度(葡萄糖、谷氨酰胺、乙酸盐等)受供体间变异性的影响,血浆中存在的白蛋白和性激素结合球蛋白会改变激素、药物和其他生物学相关分子的活性浓度31。洗涤后的血小板提供了一种将血小板悬浮在用户定义的培养基(包括已知的燃料浓度)中的方法,该方法与 13C-MFA32 兼容。
这里描述的是一种血小板洗涤以产生可用于代谢测定的血小板的方法。该方案可产生红细胞和白细胞污染低的静止血小板。 通过血小板活化标志物的流式细胞术监测血小板活化状态。相对于全血中的血小板计数,该方案可重复地实现至少 30%-40% 的血小板回收。用该技术获得的洗涤血小板适用于代谢分析技术,并且细胞内代谢物提取方法可以根据用户选择的分析(LC-MS、GC-MS、光度测定等)进行定制。
研究方案
该研究获得了科罗拉多大学安舒茨医学校区机构审查委员会的批准。已获得所有研究参与者的书面同意。参与者报告说他们在过去 48 小时内没有饮酒,在过去 10 天内没有服用非甾体抗炎药 (NSAID)。该项目由美国国立卫生研究院国家心肺血液研究所支持,奖励编号为 R61HL141794。
1. 采血
- 准备抽血。建议由训练有素的抽血师进行采血。
- 使用 19 G 针对手臂内侧进行静脉穿刺。
- 将第一个 ~2 mL 收集到无添加剂的真空中并丢弃。这是为了从受损的内皮细胞中去除可能激活血小板的化学信号分子。收集最初的 2 mL 后,取下止血带以减少血小板上的剪切应力。
- 将剩余的血液以 14:3 的比例收集到抗凝剂柠檬酸盐葡萄糖 (ACD-A) 真空剂中(血液:ACD-A)。采血后轻轻倒置每个真空采血器,以混合血液和抗凝剂。
2. 血小板洗涤
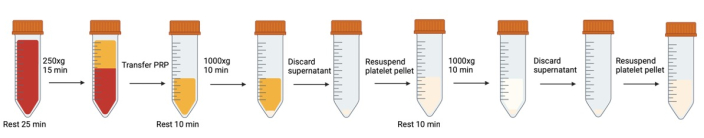
图 1:血小板洗涤中涉及的连续离心和重悬步骤。请单击此处查看此图的较大版本。
注意:避免气泡产生。使用移液管去除形成的气泡,尤其是在离心之前。每次打开/关闭血液/血小板管时,建议在关闭盖子之前向管中呼气,以增加 CO2 水平。
- 将离心机预热至 37 °C 以减少温度影响。在方案中的每个离心步骤之间,将离心机保持在 37 °C。
- 将水浴预热至 37 °C。 将含有葡萄糖的改良 Tyrode 缓冲液放入水浴中。
注意:修改后的 Tyrode 缓冲液配方可在 补充文件 1 中找到。 - 将从所有真空采血管中收集的全血合并到 50 mL 聚丙烯锥形管中。使用斜切的移液器吸头,以 45° 角切割,取适当的样品体积进行细胞计数(参见 细胞计数)。
- 去除使用窄口径移液管小心吸液产生的任何气泡。
- 让血液在 37 °C 的水浴中静置 25 分钟这允许处于可逆激活状态的血小板(从体内取出、从试管转移到试管等)恢复到静息状态。
- 为防止离心过程中的激活,向全血中加入 500 nM 前列腺素 I2 (PGI2) 和 0.02 U/mL 三磷酸腺苷双磷酸酶,并倒置一次轻轻混匀。 去除使用窄口径移液管产生的任何气泡。
注:有关正确 PGI2 和 apyrase 配方的说明,请参阅 补充文件 1。 - 离心全血以获得富血小板血浆 (PRP)(42 mL 全血在 250 x g 下离心 15 分钟),无需制动 (37 °C)。
- 使用大口径移液管将 PRP(血沉棕黄层和红血层上方的顶部黄色层)轻轻收集到新的 50 mL 锥形管中。
- 转移时,倾斜干净的锥形管,然后轻轻地将 PRP 沿管侧面运行。避免气泡。
- 留下大约 3 毫米的 PRP,以避免干扰血沉棕黄层(PRP 和红血之间的白细胞层)。如果受到干扰,这将看起来像移液管中突然出现白色漩涡。
- 进行细胞计数(参见 血小板计数)以确定下一个洗涤步骤的重悬体积。
- 在 37 °C 下静置 10 分钟。
- 使用斜切移液器吸头,取样用于流式细胞术(参见 流式细胞术)。
- 向 PRP 中加入 500 nM PGI2 和 0.02 U/mL 双磷酸腺苷双相腺酶,轻轻颠倒一次混合。
- 在 37 °C 下以 1000 x g 离心 10 分钟(加速度:0 制动:0)。请勿使用制动器。颗粒不紧凑,突然刹车会导致重新混合。
- 离心时,确定重悬体积。假设恢复率为 75%。使细胞密度约为 3x105 个细胞/μL。
- 使用塑料宽口径移液管吸出大体积上清液,使用 1 mL 移液管(未切割吸头)吸出沉淀附近剩余的液体。避免接触管底部的沉淀。
- 向改良的 Tyrode 缓冲液中加入 500 nM PGI2 和 0.02 U/mL 双磷酸腺苷双磷酸酶。顺锥形管的侧面滴流,缓慢加入步骤 16 中计算量的缓冲液。
- 使用斜切吸头和 1 mL 移液器吸头,轻轻上下吹打数次,轻轻重悬沉淀。
- 将体积设置为 300 μL,在液线上方完全按下柱塞,然后将移液器置于液体下方并上升到第一个停止点。这将使科学家能够重悬沉淀,而不会意外产生可能激活血小板的气泡。
- 有时,沉淀底部有一圈可见的红细胞。避免重新挂起 this。
- 沉淀重悬后,使用宽口径移液管将重悬的沉淀转移到新的锥形管中,留下任何红细胞或明显聚集的细胞。
- 重复步骤 11-20。确保从新鲜等分试样中加入 500 nM PGI2 和 0.02 U/mL 到改良的 Tyrode 缓冲液中(不要重复使用第 18 步中的改良 Tyrode 缓冲液,PGI2 太不稳定)。
- 取样进行细胞计数。根据需要使用改良的 Tyrode 缓冲液调整血小板浓度。
- 使用斜切移液器吸头采集样品进行流式细胞术。
- 让血小板在 37 °C 下静置 1 小时,以便有时间让抑制剂消退,并允许任何可逆活化的血小板恢复到静止状态。
- 用大口径移液器轻轻混合。采集样品进行流式细胞术。
- 洗涤后的静息血小板现在可以用于代谢分析。
3. 血小板计数
- 可以使用自动血细胞计数器(遵循制造商的说明)或血细胞计数器33 对血小板进行计数。
4. 流式细胞术
- 制备
- 设置抗体混合物和准备流式细胞仪以测量血小板活化的最佳实践的详细方案和综述可在其他地方找到34,35。
- 采样
- 采集样品进行流式细胞术时,使用斜切移液器吸头收集血小板悬液。慢慢将其添加到含有抗体的微量离心管中,然后轻轻轻弹混合。孵育 30 秒。
- 使用斜切移液器吸头,将血小板悬液/抗体混合物转移到 96 孔板上的适当孔中。
- 立即向孔中加入固定剂以固定细胞。
- 固定后 8 小时内在流式细胞仪上运行。
- 激动剂敏感性测试
- 洗涤后,留出 2 个 15 mL 锥形管,一个用于静息对照,一个作为凝血酶活化对照。
- 使用斜切移液器吸头将 100 μL 血小板悬液轻轻移液到每个锥形管中。在 37 °C 下静置 1 小时。
- 休息一小时后,将 0.1 U/mL 凝血酶添加到一根管中(凝血酶制备说明可在 补充文件 1 中找到),并将载体添加到另一根管中。在 37 °C 孵育 15 分钟。
- 取每管的流式细胞术样品,以确定血小板对激动剂的敏感性。
5. 定量代谢通量分析的采样
- 淬火
注意:淬灭代谢是测量准确代谢通量的必要步骤。快速冷却细胞并将其温度保持在 4 °C 或以下可减慢新陈代谢,以至于可以假设它基本上停止,以便取样细胞准确反映本体细胞的代谢。可以使用多种方法,但为了平衡快速冷却的需要和尽量减少泄漏,请使用冷 (-4 °C) 生理盐水36。如果盐会干扰后续分析,可以使用另一种液体(甲醇/水、乙醇等)37.- 准备并冷冻等分试样的生理盐水。将每个盐水等分试样制成所需样品体积的 6 倍。
注意:生理盐水配方可以在 补充文件 1 中找到。 - 将微量离心机预冷至 0 °C。
- 以 1:6 的比例在部分冷冻的生理盐水 (< -4 °C) 中收集血小板悬液(例如,将 150 μL 血小板悬液收集到微量离心管中的 750 μL 盐水中)。
注:血小板/生理盐水溶液在冰上放置的时间不要超过 15 分钟。 - 以 16,000 x g , 0 °C 离心 10 分钟。
- 保存上清液用于外部代谢物分析,保存沉淀用于细胞内代谢物提取和测量。将两者储存在 -20 °C 直至准备好进行分析。
- 在所需的时间间隔和采样时间点数量上重复此过程。
- 准备并冷冻等分试样的生理盐水。将每个盐水等分试样制成所需样品体积的 6 倍。
- 细胞内代谢物提取
- 向淬灭的沉淀中加入 0.5 mL 预冷的 7:3 甲醇-水,温度为 -20 °C。剧烈涡旋 1 分钟。
- 在液氮中冷冻,在 0 °C 解冻,然后再重复 2 个循环。
- 将悬浮液在 -4 °C 下以 16,000 x g 离心 10 分钟。
- 将上清液收集在新的微量离心管中。
- 使用步骤 3 中的沉淀,并用 50:50 甲醇:水重复提取方案(步骤 1-3)。将第二个收集的数据提取添加到第一个数据提取中。晾干一夜。
- 将干燥的提取物重悬于 150 μL LC-MS 级水(或适用于预期分析的其他溶剂)中。在 4 °C 下混合 15 分钟。 短暂涡旋并转移到 0.22 μm 微量离心管中以去除细胞碎片。以 16,000 x g 和 4 °C 离心 5 分钟。
- 从离心机中取出,再吸取 50 μL optima 水到过滤器上,然后再次离心(5 分钟,16,000 x g 和 4 °C)以冲洗过滤器。收集以供分析。
结果
图 2 中的代表性结果代表了 6 个不同的献血者,包括 3 名男性和 3 名女性。血小板产量相对于全血如图 2A 所示。最终血小板回收率平均为 52% ± 3% (标准差,n=6)。使用自动血液学分析仪测量与白细胞污染相比的最终血小板计数。白细胞计数低于总细胞数的 0.1%(图 2B)。通过洗涤过程和休息小时,血小板保持较低的 P-选择素暴露,但对凝血酶处理反应强烈(图 2C)。结合的纤维蛋白原在第一次 1000 x g 旋转后达到峰值,但在第二次 1000 x g 旋转后恢复到 5% 以下。与 P-选择素暴露一样,休息一小时后凝血酶处理后结合的纤维蛋白原急剧增加(图 2D)。大小、单细胞和 CD42a 阳性的代表性门控如图 3A-C 所示。通过这些连续门的事件用于查找 P-选择素暴露和结合的纤维蛋白原。P-选择素阳性和纤维蛋白原阳性血小板的代表性门控如图 3D-E 所示。图 3D 显示了用载体对照处理的血小板样品,图 3E 显示了加入 0.1 U/mL 凝血酶后 15 分钟的血小板样品。
洗涤后的血小板用于进行定量摄取和排泄实验,如图 4 所示。洗涤血小板,向最终洗涤的悬浮液中加入 5 mmol/L 葡萄糖和 20 mmol/L 乙酸盐。静置 1 小时后,将 0.1 U/mL 凝血酶或载体添加到洗涤的血小板悬浮液中。收集样品,并在添加凝血酶 30 分钟后每 15 分钟淬灭一次。上清液用于通过自动光度测定法测量细胞外乳酸、葡萄糖和乙酸盐浓度的变化。通量是通过取代谢物浓度随时间变化的回归斜率来计算的。 图 4 显示了三个代表性供体的计算代谢物通量。所有供体的乳酸通量均为阳性,表明正在产生乳酸,葡萄糖和乙酸盐通量为阴性,表明它们正在被消耗。虽然倍数变化存在变化,但与静息相比,凝血酶治疗导致每个供体的通量大小增加。

图 2:(A) 洗涤过程每个步骤中相对于全血回收的血小板百分比。n=6,误差线表示标准差。(B) 洗涤过程结束时的血小板和白细胞计数。(C) 通过流式细胞术测量 P-选择素表达阳性的血小板百分比。n=6,误差线表示标准差。(D) 纤维蛋白原阳性血小板的百分比,通过流式细胞术测量。n=6,误差线表示标准差。. 请单击此处查看此图的较大版本。

图 3:血小板流式细胞术的代表性门控。 血小板 (A) 用前向散射 (FSC) 和侧向散射 (SSC) 进行大小门控,(B) 然后对具有 FSC 宽度和 FSC 高度的单个细胞进行门控,以及 (C) 对 CD42a 阳性进行门控。通过这些连续门的事件用于查找激活标记。(D) 静息对照血小板样品的 P-选择素和纤维蛋白原表达。这里测量的激活标志物是 P-选择素 PECy5 和 FITC-纤维蛋白原。(E) 0.1 U/mL 凝血酶处理的血小板样品的 P-选择素和纤维蛋白原表达。这里测量的激活标志物是 P-选择素、PECy5 和 FITC-纤维蛋白原。 请单击此处查看此图的较大版本。
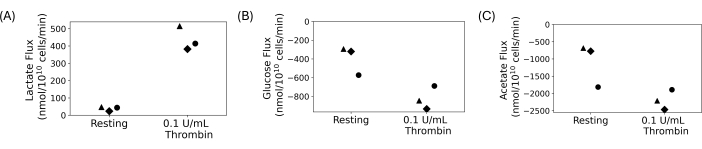
图 4: (A) 静息和凝血酶激活条件下三种不同供体的乳酸排泄率。(B) 三种不同供体在静息和凝血酶激活条件下的葡萄糖摄取率。(C) 三种不同供体在静息和凝血酶激活条件下的乙酸盐摄取率。 请单击此处查看此图的较大版本。
补充文件 1:缓冲液和试剂制备配方和说明。请点击此处下载此文件。
讨论
血小板对其环境非常敏感,包括剪切应力和激动剂的存在38,39。这使得血小板难以处理和分离,因此使用抑制剂和大口径移液器至关重要40。正确储存和制备 PGI2 至关重要,因为未能在碱性 PBS 中制备 PGI2 将导致 PGI2 的快速降解 41。为了最大限度地降低剪切诱导激活的风险,请使用宽口径移液器、斜口移液器吸头和 19 号静脉切开针。
不可避免地,在洗涤过程的每个步骤中都会丢失一部分血小板(图 2A)。并非所有血小板最终都会进入血浆层,将血浆收集得太靠近血沉棕黄层有白细胞污染的风险。此外,血小板群在重悬后聚集并沉到底部,强调了每次重悬后将重悬沉淀转移到干净试管中的重要性。请注意,在图 2D 中,纤维蛋白原结合在第一次 1000 x g 旋转后增加,然后在第二次 1000 x g 旋转后下降。在每种情况式细胞术样品均在休息 10 分钟后收集。该种群的一部分可能会恢复其静止性质,但由于该种群在第一次 10 分钟休息后仍然存在,因此该激活种群的一部分可能会在重悬时聚集并落到管底。
虽然流式细胞术的使用不是绝对必要的,但监测血小板是否静止并且能够在洗涤过程结束时对激动剂做出反应是有益的。此外,特别是如果大部分血小板在洗涤过程中在视觉上呈团块状,则在每个步骤中进行流式细胞术有助于确定问题出现的位置。虽然不常见,但必须排除 20 个供体实验中的大约 1 个,因为在休息期间会自发地激活血小板。血小板活化标志物的流式细胞术分析是在涉及血小板的实验之前验证静止和对激动剂的敏感性的宝贵工具。
为了使用流式细胞术测量血小板对激动剂的反应,一些研究允许血小板在室温下在激动剂和抗体混合物中孵育 10-30 分钟,然后固定 42,43,44。静置一小时后,在固定静息对照血小板之前在室温下孵育 20 分钟会导致高估活化率。当血小板在 37 °C 下孵育 20 分钟时,不会发生这种激活,这表明这种明显的激活是因为抑制剂已经消失并且突然的温度变化激活了血小板。在洗涤过程中等待 20 分钟固定也不会诱导这种人工激活,这可能是由于抑制剂在休息一小时期间的作用减弱。为了捕获血小板的真实激活状态,建议在 37 °C 下进行孵育,或者在与抗体短暂孵育(30 秒)后固定血小板。
洗涤后的血小板提供了一种研究血小板的方法,而不受其他血细胞和血浆成分的干扰。它们非常适合必须纵细胞外环境的研究,包括代谢研究。最终血小板悬液的密度是可调的,并且能够进行控制,以最大限度地减少人与人之间血小板计数的差异。对于代谢研究,可以控制血小板碳底物的定制浓度。图 4 所示的代表性结果来自摄取和排泄实验,其中葡萄糖和乙酸盐作为碳底物添加,并产生乳酸。虽然图 4 中供体之间存在生物学差异,但凝血酶处理后乳酸产生增加,而葡萄糖和乙酸盐消耗增加。这与文学一致;已知血小板在激活后会增加其有氧糖酵解和氧化磷酸化速率 13,14,15,45。 该技术可用于研究不同营养条件下的血小板或最终血小板悬液中具有不同离子的血小板。
虽然洗涤血小板研究很有价值,但重要的是要记住,人工环境并不能概括 体内环境。因此,洗涤后的血小板应仅在研究人员仅对血小板功能感兴趣的情况下使用。与所有 体外 研究一样,必须谨慎解释结果。建议在最后一次洗涤后,将血小板重悬于钙浓度为 2 mM 的改良 Tyrode 缓冲液中。P-选择素和纤维蛋白原结合表达仅在洗涤过程后 1.5 小时(包括休息时间 2.5 小时)内测量,因此建议科学家在该时间窗口内使用洗涤后的血小板悬液,或以其他方式验证血小板的保真度。本研究没有测量血小板功能的其他经典指标,例如聚集。
用我们的方案制备的洗涤血小板是静止的,通过 P-选择素和纤维蛋白原的流式细胞术测量进行验证。细胞外环境中的代谢底物、激素和血小板激动剂可以得到精确控制,使科学家能够在他们选择的系统中研究血小板代谢。
披露声明
作者没有需要报告的利益冲突。
致谢
作者要感谢 Pierre Mangin 博士实验室的 Emily Janus-Bell 博士和 Clarisse Mouriaux 博士以及 Jorge DiPaola 博士实验室的 Katrina Bark 提供的指导和建议。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
参考文献
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。