Method Article
Preparación de plaquetas humanas lavadas para estudios cuantitativos de flujo metabólico
En este artículo
Resumen
El metabolismo de las plaquetas es de interés, particularmente en lo que se refiere al papel de la hiperactividad e hipoactividad plaquetaria en el sangrado y los trastornos trombóticos. El aislamiento de las plaquetas del plasma es necesario para algunos ensayos metabólicos; Aquí se presenta un método para aislar metabolitos intracelulares de plaquetas lavadas.
Resumen
Las plaquetas son células sanguíneas que desempeñan un papel integral en la hemostasia y la respuesta inmunitaria innata. La hiperactividad e hipoactividad plaquetaria se han implicado en trastornos metabólicos, aumentando el riesgo de trombosis y hemorragia. La activación de las plaquetas y el metabolismo están estrechamente vinculados, con numerosos métodos para medir el primero, pero relativamente pocos para el segundo. Para estudiar el metabolismo de las plaquetas sin la interferencia de otras células sanguíneas y componentes del plasma, las plaquetas deben aislarse, un proceso que no es trivial debido a la sensibilidad al cizallamiento de las plaquetas y su capacidad de activarse irreversiblemente. Se presenta aquí un protocolo para el aislamiento de plaquetas (lavado) que produce plaquetas quiescentes que son sensibles a la estimulación por agonistas plaquetarios. Se utilizan pasos sucesivos de centrifugación con la adición de inhibidores de plaquetas para aislar las plaquetas de la sangre total y resuspenderlas en un tampón isosmótico controlado. Este método produce de forma reproducible una recuperación del 30%-40% de las plaquetas de la sangre total con baja activación, medida por los marcadores de secreción de gránulos y actividad de integrinas. El recuento de plaquetas y la concentración de combustible se pueden controlar con precisión para permitir al usuario sondear una variedad de situaciones metabólicas.
Introducción
Las plaquetas son células anucleadas pequeñas (2-4 μm de diámetro) que desempeñan un papel importante en la hemostasia, el proceso estrechamente reguladode formación de coágulos. Si bien son vitales para la integridad vascular, las plaquetas también están implicadas en eventos adversos para la salud. Las plaquetas están involucradas en la trombosis venosa profunda (TVP) y la trombosis arterial (TA), que son coágulos que ocluyen los vasos sanguíneos, lo que provoca una disminución del suministro de sangre a nivel local o, si partes del coágulo se desprenden (embolizan), pueden bloquear el suministro de sangre a los pulmones, el corazón o el cerebro 2,3,4,5,6,7 . La hiperreactividad plaquetaria es una comorbilidad de la hipertensión, la diabetes y el cáncer, lo que conduce a una mayor incidencia de TVP y TA 8,9,10. La activación plaquetaria y el metabolismo están estrechamente relacionados11,12, lo que lleva a un mayor interés en dirigirse al metabolismo plaquetario como estrategia terapéutica13,14. Existe un debate sobre el recableado metabólico exacto que se produce tras la activación, y este es un campo de estudio activo15. Este creciente interés en la disfunción plaquetaria en la enfermedad y sus vínculos con el metabolismo subraya la necesidad de un método repetible para aislar las plaquetas y estudiar su metabolismo.
Las plaquetas humanas generalmente se obtienen por venopunción y luego se aíslan de la sangre completa. Las plaquetas lavadas se separan de la sangre total mediante sucesivas etapas de lavado y centrifugación16. Esto fue hecho originalmente por el grupo17 de Mustard, y modificado ligeramente por el grupo18 de Cazenave. Otra alternativa son las plaquetas filtradas en gel, que pueden obtenerse a partir de plasma rico en plaquetas (PRP) mediante cromatografía de exclusión por tamaño utilizando una columna empaquetada de perlas de gel de agarosa19. Existen muchos protocolos de lavado tanto para la sangre humana como para la de roedores, y están optimizados para diversos ensayos 20,21,22,23, pero no para medir el metabolismo de las plaquetas.
Las técnicas para estudiar el metabolismo plaquetario incluyen mediciones bioenergéticas a través del analizador Seahorse XF 11,24,25,26,27, mediciones de flujo extracelular 11,13,24, metabolómica 14,28 y análisis de flujo metabólico asistido por isótopos (13C-MFA)29. En los estudios metabolómicos, el objetivo suele ser determinar las vías alteradas entre dos condiciones diferentes (por ejemplo, plaquetas en reposo frente a plaquetas activadas14). Los estudios metabolómicos implican el uso de cromatografía líquida-espectrometría de masas (LC-MS). Estos estudios se pueden realizar para metabolitos intra o extracelulares y frecuentemente se acoplan con análisis de vías o análisis de componentes principales (PCA)14,28. El análisis de flujo metabólico asistido por isótopos (13C-MFA) consiste en alimentar a las células con un sustrato marcado conocido como trazador y medir cómo se propaga este trazador a través de una red de reacción con LC-MS. Esta técnica permite el cálculo de flujos a través de rutas metabólicas con resolución de nivel de reacción29,30. En la sangre total y el plasma rico en plaquetas (PRP), la concentración de combustible (glucosa, glutamina, acetato, etc.) está sujeta a la variabilidad de un donante a otro, y la albúmina y la globulina fijadora de hormonas sexuales presentes en el plasma pueden alterar la concentración activa de hormonas, fármacos y otras moléculas biológicamente relevantes31. Las plaquetas lavadas ofrecen un método para suspender las plaquetas en un medio definido por el usuario, incluidas las concentraciones de combustible conocidas, que es compatible con 13C-MFA32.
Aquí se describe un método de lavado de plaquetas para producir plaquetas que se pueden utilizar en ensayos metabólicos. El protocolo produce plaquetas quiescentes con bajo nivel de contaminación de glóbulos rojos y glóbulos blancos. El estado de activación plaquetaria se monitorizó mediante citometría de flujo de marcadores de activación plaquetaria. Este protocolo logra de forma reproducible al menos un 30%-40% de recuperación de plaquetas en relación con el recuento de plaquetas en la sangre total. Las plaquetas lavadas obtenidas con esta técnica son adecuadas para las técnicas de análisis metabólico, y el método de extracción de metabolitos intracelulares se puede adaptar al análisis a elección del usuario (LC-MS, GC-MS, ensayo fotométrico, etc.).
Protocolo
El estudio recibió la aprobación de la Junta de Revisión Institucional del Campus Médico Anschutz de la Universidad de Colorado. Se obtuvo el consentimiento por escrito de todos los participantes del estudio. Los participantes informaron que no habían consumido alcohol durante las 48 horas anteriores ni medicamentos antiinflamatorios no esteroideos (AINE) durante los diez días anteriores. Este proyecto cuenta con el apoyo del Instituto Nacional del Corazón, los Pulmones y la Sangre de los Institutos Nacionales de Salud bajo el premio número R61HL141794.
1. Extracción de sangre
- Preparación para la extracción de sangre. Se recomienda que la recolección de sangre sea realizada por un flebotomista capacitado.
- Realizar la venopunción en la parte interna del brazo con una aguja de 19 G.
- Recoja los primeros ~ 2 ml en un vacutainer sin aditivos y deséchelo. Esto es para eliminar las moléculas de señalización química de las células endoteliales dañadas que pueden activar las plaquetas. Después de recolectar los 2 ml iniciales, retire el torniquete para reducir el esfuerzo cortante en las plaquetas.
- Recoja el resto de la sangre en vacutainers de citrato dextrosa antiocoagulante (ACD-A) en una proporción de 14:3 (sangre:ACD-A). Invierta suavemente cada vacutainer después de la extracción de sangre para mezclar la sangre y el anticoagulante.
2. Lavado de plaquetas
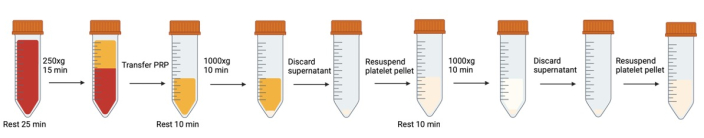
Figura 1: Etapas sucesivas de centrifugación y resuspensión involucradas en el lavado de plaquetas. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Evite la generación de burbujas de aire. Utilice pipetas de transferencia para eliminar las burbujas cuando se formen, especialmente antes de la centrifugación. Cada vez que los conductos de sangre/plaquetas se abren/cierran, se recomienda respirar dentro del tubo antes de cerrar el tapón para aumentar el nivel deCO2 .
- Precaliente la centrífuga a 37 °C para reducir los efectos de la temperatura. Entre cada paso de centrifugación del protocolo, mantenga la centrífuga a 37 °C.
- Precalentar el baño maría a 37 °C. Coloque el tampón Tyrode modificado con glucosa en el baño de agua.
NOTA: la receta modificada del tampón de Tyrode se puede encontrar en el Archivo Suplementario 1. - Combine la sangre entera recolectada de todos los vacutainers en tubos cónicos de polipropileno de 50 mL. Con una punta de pipeta de corte biselado cortada en un ángulo de 45°, tome el volumen de muestra adecuado para realizar un recuento de células (consulte Recuento de células).
- Elimine las burbujas generadas por la aspiración cuidadosa con una pipeta de transferencia de diámetro estrecho.
- Deje reposar la sangre en un baño de agua durante 25 minutos a 37 °C Esto permite que las plaquetas en un estado de activación reversible (al ser extraídas del cuerpo, transferidas de un tubo a otro, etc.) vuelvan a un estado de reposo.
- Para evitar la activación durante la centrifugación, añadir 500 nM de prostaglandinaI2 (PGI2) y 0,02 U/mL de apirasa a la sangre total y mezclar suavemente invirtiendo una vez. Elimine las burbujas generadas con una pipeta de transferencia de diámetro estrecho.
NOTA: Las instrucciones para la receta adecuada de IGP2 y apirasa se pueden encontrar en el Archivo Suplementario 1. - Centrifugar la sangre entera para obtener plasma rico en plaquetas (PRP) (15 minutos a 250 x g para 42 mL de sangre total) sin freno (37 °C).
- Recoja suavemente el PRP (capa amarilla superior por encima de la capa leucocitaria y capa de sangre roja) en un nuevo tubo cónico de 50 ml utilizando una pipeta de transferencia de diámetro ancho.
- Al transferir, incline un tubo cónico limpio y pase suavemente el PRP por el costado del tubo. Evite las burbujas de aire.
- Deje aproximadamente 3 mm de PRP para evitar alterar el pelaje leucocitario (la capa de glóbulos blancos entre el PRP y la sangre roja). Si se altera, se verá como un remolino repentino de blanco en la pipeta de transferencia.
- Realice el recuento de células (consulte Recuento de plaquetas) para determinar el volumen de resuspensión para el siguiente paso de lavado.
- Dejar reposar durante 10 minutos a 37 °C.
- Con una punta de pipeta de corte biselado, tome una muestra para la citometría de flujo (consulte Citometría de flujo).
- Añadir 500 nM PGI2 y 0,02 U/mL de apirasa al PRP y mezclar invirtiendo suavemente una vez.
- Centrifugar durante 10 minutos a 1000 x g a 37 °C (aceleración:0 freno: 0). El pellet no es compacto y un freno repentino puede causar una remezcla.
- Durante la centrifugación, determine el volumen de resuspensión. Suponga una recuperación del 75%. Haga que la densidad celular sea de aproximadamente 3x105 células/μL.
- Aspire el sobrenadante con una pipeta de transferencia de plástico de diámetro ancho para el volumen a granel y una pipeta de 1 ml (punta sin cortar) para el resto del líquido cerca del pellet. Evite tocar el pellet en la parte inferior del tubo.
- Añadir 500 nM PGI2 y 0,02 U/mL de apirasa al tampón Tyrode modificado. Agregue lentamente la cantidad calculada de tampón del paso 16 deslizando por el costado del tubo cónico.
- Con una punta de corte biselado y una punta de pipeta de 1 ml, vuelva a suspender suavemente el pellet pipeteando suavemente hacia arriba y hacia abajo varias veces.
- Ajuste el volumen a 300 μL, presione el émbolo por completo mientras está por encima de la línea de líquido, luego coloque la pipeta debajo del líquido y suba a la primera parada. Esto permitirá al científico volver a suspender el pellet sin crear accidentalmente burbujas de aire que puedan activar las plaquetas.
- Ocasionalmente, hay un anillo de glóbulos rojos visibles en la parte inferior de la bolita. Evite volver a suspender esto.
- Una vez que se haya resuspendido el pellet, utilice una pipeta de transferencia de diámetro ancho para transferir el pellet resuspendido a un nuevo tubo cónico, dejando atrás los glóbulos rojos o las células visiblemente agrupadas.
- Repita los pasos 11 a 20. Asegúrese de añadir 500 nM PGI2 y 0,02 U/mL de una alícuota nueva al tampón Tyrode modificado (no reutilice el tampón Tyrode modificado del paso 18, PGI2 es demasiado inestable).
- Tome una muestra para un recuento de células. Ajuste la concentración de plaquetas según sea necesario con el tampón Tyrode modificado.
- Utilice una punta de pipeta de corte biselado para tomar una muestra para la citometría de flujo.
- Deje reposar las plaquetas durante 1 h a 37 °C para dar tiempo a que los inhibidores desaparezcan y permitir que las plaquetas activadas reversiblemente vuelvan a un estado de reposo.
- Mezclar suavemente con una pipeta de diámetro ancho. Toma de muestras para citometría de flujo.
- Las plaquetas lavadas y en reposo ya están listas para ser utilizadas para el análisis metabólico.
3. Recuento de plaquetas
- Las plaquetas se pueden contar utilizando un contador automático de células sanguíneas (siga las instrucciones del fabricante) o un hemocitómetro33.
4. Citometría de flujo
- Preparación
- Los protocolos detallados y las revisiones de las mejores prácticas para la configuración de mezclas de anticuerpos y la preparación del citómetro de flujo para medir la activación plaquetaria se pueden encontrar en otros lugares34,35.
- Muestreo
- Al tomar una muestra para citometría de flujo, recoja la suspensión de plaquetas con una punta de pipeta de corte biselado. Agregue lentamente esto al tubo de microcentrífuga con anticuerpos, luego agite suavemente para mezclar. Dejar incubar durante 30 s.
- Usando la punta de la pipeta de corte en bisel, transfiera la mezcla de suspensión de plaquetas/anticuerpos al pocillo apropiado en la placa de 96 pocillos.
- Agregue inmediatamente el fijador al pozo para fijar las células.
- Funcionamiento con citómetro de flujo dentro de las 8 h posteriores a la fijación.
- Pruebas de sensibilidad a los agonistas
- Después del lavado, reserve 2 tubos cónicos de 15 mL, uno para un control de reposo y otro para un control activado por trombina.
- Pipetear suavemente 100 μl de suspensión de plaquetas en cada tubo cónico con una punta de pipeta de corte biselado. Dejar reposar a 37 °C durante 1 h.
- Después de la hora de reposo, agregue 0,1 U/mL de trombina a un tubo (las instrucciones para la preparación de la trombina se pueden encontrar en el Archivo Suplementario 1) y el vehículo al otro. Incubar a 37 °C durante 15 min.
- Tome una muestra de citometría de flujo de cada tubo para determinar la sensibilidad de las plaquetas al agonista.
5. Muestreo para el análisis cuantitativo del flujo metabólico
- Apaga
NOTA: La extinción del metabolismo es un paso necesario para medir flujos metabólicos precisos. El enfriamiento rápido de las células y el mantenimiento de su temperatura a 4 °C o menos ralentiza el metabolismo lo suficiente como para que se pueda suponer que está esencialmente detenido para que las células muestreadas reflejen con precisión el metabolismo de las células a granel. Hay una variedad de métodos que se pueden usar, pero para equilibrar la necesidad de enfriamiento rápido y minimizar las fugas, use solución salina normal fría (-4 °C)36. Si la sal interfiere con el análisis posterior, se puede utilizar otro fluido (metanol/agua, etanol, etc.)Artículo 37.- Prepare y congele alícuotas de solución salina normal. Hacer cada alícuota salina a 6x el volumen de la muestra deseada.
NOTA: la receta de solución salina normal se puede encontrar en el Archivo Suplementario 1. - Preenfriar la microcentrífuga a 0 °C.
- Recoja la suspensión de plaquetas en solución salina normal parcialmente congelada (< -4 °C) en una proporción de 1:6 (p. ej., recoja 150 μL de suspensión de plaquetas en 750 μL de solución salina en tubos de microcentrífuga).
NOTA:No deje la solución plaquetaria/salina en hielo durante más de 15 minutos. - Centrifugar a 16.000 x g, 0 °C durante 10 min.
- Guarde el sobrenadante para el análisis de metabolitos externos y el pellet para la extracción y medición de metabolitos intracelulares. Almacene ambos a -20 °C hasta que estén listos para el análisis.
- Repita este proceso en el intervalo de tiempo deseado y en el número de puntos de tiempo de muestra.
- Prepare y congele alícuotas de solución salina normal. Hacer cada alícuota salina a 6x el volumen de la muestra deseada.
- Extracción de metabolitos intracelulares
- Añada 0,5 mL de agua de metanol 7:3 preenfriada a -20 °C al pellet enfriado. Vórtice vigorosamente durante 1 min.
- Congele en nitrógeno líquido, descongele a 0 °C, luego repita durante 2 ciclos más.
- Centrifugar las suspensiones a 16.000 x g durante 10 minutos a -4 °C.
- Recoja el sobrenadante en un nuevo tubo de microcentrífuga.
- Utilice el pellet del paso 3 y repita el protocolo de extracción (pasos 1-3) con metanol:agua 50:50. Agregue el segundo extracto recolectado al primero. Secar toda la noche.
- Vuelva a suspender el extracto seco en 150 μL de agua de grado LC-MS (u otro disolvente apropiado para el análisis previsto). Mezclar durante 15 minutos a 4 °C. Realice un vórtice breve y transfiéralo a tubos de microcentrífuga de 0,22 μm para eliminar los restos celulares. Centrifugar durante 5 minutos a 16.000 x g y 4 °C.
- Retirar de la centrífuga, pipetear 50 μL adicionales de agua optima en el filtro y volver a centrifugar (5 min, 16.000 x g y 4 °C) para enjuagar el filtro. Recopilar para su análisis.
Resultados
Los resultados representativos de la Figura 2 representan 6 donantes de sangre diferentes, incluidos 3 hombres y 3 mujeres. El rendimiento de plaquetas en relación con la sangre total se muestra en la Figura 2A. La recuperación final de plaquetas fue de un promedio de 52% ± 3% (desviación estándar, n = 6). El recuento final de plaquetas en comparación con la contaminación de glóbulos blancos se midió utilizando un analizador de hematología automatizado. Los recuentos de glóbulos blancos fueron inferiores al 0,1% del total de células (Figura 2B). Durante el proceso de lavado y la hora de reposo, las plaquetas mantuvieron una exposición baja a la P-selectina, pero respondieron fuertemente al tratamiento con trombina (Figura 2C). El fibrinógeno unido se dispara después de la primera tirada de 1000 x g, pero vuelve a estar por debajo del 5% después de la segunda tirada de 1000 x g. Al igual que la exposición a la P-selectina, el fibrinógeno unido aumenta drásticamente después del tratamiento con trombina después de una hora de descanso (Figura 2D). En la Figura 3A-C se muestran las compuertas representativas para el tamaño, los singletes y la positividad de CD42a. Los eventos que pasan estas puertas sucesivas se utilizan para buscar la exposición a la P-selectina y el fibrinógeno unido. En la Figura 3D-E se muestra la activación representativa de las plaquetas P-selectina positiva y fibrinógeno positivo. La figura 3D muestra una muestra de plaquetas tratada con control de vehículo y la figura 3E muestra una muestra de plaquetas 15 minutos después de haber añadido 0,1 U/mL de trombina.
Se utilizaron plaquetas lavadas para realizar un experimento cuantitativo de absorción y excreción, como se muestra en la Figura 4. Se lavaron las plaquetas y se añadieron 5 mmol/L de glucosa y 20 mmol/L de acetato a las suspensiones lavadas finales. Se añadió 0,1 U/mL de trombina o vehículo a las suspensiones plaquetarias lavadas después de una hora de reposo. Las muestras se recogieron y se apagaron cada 15 minutos después de la adición de trombina durante 30 minutos. Los sobrenadantes se utilizaron para medir los cambios en la concentración de lactato, glucosa y acetato extracelulares mediante ensayos fotométricos automatizados. El flujo se calculó tomando la pendiente de regresión de la concentración del metabolito a lo largo del tiempo. La Figura 4 muestra los flujos de metabolitos calculados para tres donantes representativos. Los flujos de lactato de todos los donantes fueron positivos, lo que indica que se estaba produciendo lactato, y los flujos de glucosa y acetato fueron negativos, lo que indica que se estaban consumiendo. Si bien hay variación en el cambio de pliegue, el tratamiento con trombina condujo a un aumento en la magnitud de los flujos en comparación con el reposo para cada donante.

Figura 2: (A) Porcentaje de plaquetas recuperadas en relación con la sangre total en cada paso del proceso de lavado. n = 6, las barras de error representan la desviación estándar. (B) Recuento de plaquetas y células leucocitarias al final del proceso de lavado. (C) Porcentaje de plaquetas positivas para la expresión de P-selectina, medido por citometría de flujo. n = 6, las barras de error representan la desviación estándar. (D) Porcentaje de plaquetas positivas para fibrinógeno, medido por citometría de flujo. n = 6, las barras de error representan la desviación estándar. . Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Activación representativa para citometría de flujo plaquetario. Las plaquetas están (A) compuertas para el tamaño con dispersión directa (FSC) y dispersión lateral (SSC), (B) luego se compuertas para células individuales con ancho FSC y altura FSC, y (C) compuertas para la positividad de CD42a. Los eventos que pasan por estas puertas sucesivas se utilizan para buscar marcadores de activación. (D) Expresión de P-selectina y fibrinógeno para una muestra de plaquetas de control en reposo. Los marcadores de activación medidos aquí son P-Selectina, PECy5 y FITC-Fibrinógeno. (E) Expresión de P-selectina y fibrinógeno para una muestra de plaquetas tratadas con trombina de 0,1 U/mL. Los marcadores de activación medidos aquí son P-Selectina, PECy5 y FITC-Fibrinógeno. Haga clic aquí para ver una versión más grande de esta figura.
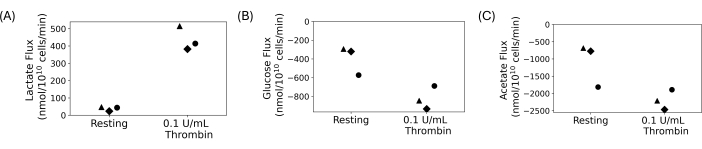
Figura 4: (A) Tasas de excreción de lactato para tres donantes diferentes para una condición de reposo y activada por trombina. (B) Tasas de absorción de glucosa para tres donantes diferentes para una condición de reposo y trombina activada. (C) Tasas de absorción de acetato para tres donantes diferentes para una condición de reposo y activada por trombina. Haga clic aquí para ver una versión más grande de esta figura.
Ficha complementaria 1: Recetas e instrucciones de preparación de tampones y reactivos. Haga clic aquí para descargar este archivo.
Discusión
Las plaquetas son muy sensibles a su entorno, incluyendo el estrés cortante y la presencia de agonistas38,39. Esto hace que las plaquetas sean difíciles de manipular y aislar, lo que hace que el uso de inhibidores y pipetas de diámetro anchosea crucial 40. El almacenamiento y la preparación adecuados del IGP2 son vitales, ya que si no se prepara el IGP2 en el SBP básico, se producirá una rápida degradación del IGP241. Para minimizar el riesgo de activación inducida por cizallamiento, utilice pipetas de diámetro ancho, puntas de pipeta de corte biselado y una aguja de flebotomía de calibre 19.
Inevitablemente, una porción de las plaquetas se perderá en cada paso del proceso de lavado (Figura 2A). No todas las plaquetas terminarán en la capa de plasma, y la recolección de plasma demasiado cerca de la capa de leucocemia corre el riesgo de contaminación de los glóbulos blancos. Además, una población de plaquetas se agrupa y se hunde hasta el fondo tras la resuspensión, lo que enfatiza la importancia de transferir el pellet resuspendido a un tubo limpio después de cada resuspensión. Observe en la Figura 2D, hay un aumento en la unión del fibrinógeno después del primer giro de 1000 x g que luego disminuye después del segundo giro de 1000 x g. Las muestras para citometría de flujo se recolectaron después de un período de descanso de 10 minutos en cada caso. Es posible que parte de esta población recupere su naturaleza inactiva, pero debido a que esta población está presente después del primer descanso de 10 minutos, parte de esta población activada puede agruparse y caer al fondo del tubo al ser resuspendida.
Si bien el uso de la citometría de flujo no es estrictamente necesario, es beneficioso monitorear si las plaquetas están quietas y pueden responder a los agonistas al final del proceso de lavado. Además, especialmente si una gran parte de las plaquetas parecen visualmente grumosas durante el lavado, realizar una citometría de flujo en cada paso puede ayudar a identificar dónde está surgiendo el problema. Aunque es poco frecuente, se debe excluir aproximadamente 1 de cada 20 experimentos con donantes debido a la activación espontánea de las plaquetas durante el período de descanso. El análisis por citometría de flujo de marcadores de activación plaquetaria es una herramienta valiosa para validar la quiescencia y la sensibilidad al agonista antes de los experimentos con plaquetas.
Para medir la respuesta de las plaquetas al agonista mediante citometría de flujo, algunos estudios permiten que las plaquetas se incuben en el cóctel de agonistas y anticuerpos durante 10-30 minutos a temperatura ambiente antes de fijarse 42,43,44. Después de la hora de reposo, una incubación de 20 minutos a temperatura ambiente antes de fijar las plaquetas de control en reposo da como resultado una sobreestimación de la activación. Esta activación no ocurre cuando las plaquetas se incuban durante 20 minutos a 37 °C, lo que sugiere que esta activación aparente ocurre porque los inhibidores han desaparecido y el cambio brusco de temperatura activa las plaquetas. Esperar 20 minutos para fijar durante el proceso de lavado tampoco induce esta activación artificial, que podría deberse a la atenuación de la acción de los inhibidores durante la hora de descanso. Para capturar el verdadero estado de activación de las plaquetas, se recomienda realizar la incubación a 37 °C o fijarlas después de una incubación corta (30 segundos) con anticuerpos.
Las plaquetas lavadas ofrecen una forma de estudiar las plaquetas sin la interferencia de otras células sanguíneas y componentes del plasma. Son ideales para estudios en los que se debe manipular el entorno extracelular, incluidos los estudios metabólicos. La densidad de la suspensión plaquetaria final es ajustable y puede controlarse para minimizar la variabilidad en los recuentos de plaquetas entre las personas. Para los estudios metabólicos, se pueden controlar las concentraciones personalizadas de sustratos de carbono plaquetario. Los resultados representativos que se muestran en la Figura 4 provienen de un experimento de absorción y excreción en el que se añadieron glucosa y acetato como sustratos de carbono, y se produjo lactato. Si bien existe variabilidad biológica entre los donantes en la Figura 4, la producción de lactato aumenta con el tratamiento con trombina, mientras que el consumo de glucosa y acetato aumenta. Esto concuerda con la literatura; Se sabe que las plaquetas aumentan su tasa de glucólisis aeróbica y fosforilación oxidativa tras la activación 13,14,15,45. Esta técnica se puede aplicar para estudiar las plaquetas bajo diferentes condiciones de nutrientes o con diferentes iones en la suspensión plaquetaria final.
Si bien los estudios de plaquetas lavadas son valiosos, es importante tener en cuenta que el entorno artificial no recapitula el entorno in vivo. Por lo tanto, las plaquetas lavadas deben usarse solo en situaciones en las que los investigadores estén interesados solo en la función plaquetaria. Al igual que con todos los estudios in vitro , los resultados deben interpretarse con cautela. Se recomienda que las plaquetas se resuspendan en tampón Tyrode modificado con una concentración de calcio de 2 mM después del lavado final. La expresión de unión de P-selectina y fibrinógeno solo se ha medido hasta 1,5 horas después del proceso de lavado (2,5 horas incluyendo la hora de descanso), por lo que se recomienda que el científico utilice la suspensión de plaquetas lavada dentro de esa ventana de tiempo, o de lo contrario valide la fidelidad de las plaquetas. Este estudio no midió otras métricas clásicas de la funcionalidad plaquetaria, como la agregación.
Las plaquetas lavadas preparadas con nuestro protocolo son inactivas, validadas por mediciones de citometría de flujo de P-selectina y fibrinógeno. Los sustratos metabólicos, las hormonas y los agonistas plaquetarios en el entorno extracelular se pueden controlar con precisión, lo que permite a los científicos estudiar el metabolismo de las plaquetas en un sistema de su elección.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que denunciar.
Agradecimientos
Los autores desean agradecer a la Dra. Emily Janus-Bell y Clarisse Mouriaux del laboratorio del Dr. Pierre Mangin y a Katrina Bark del laboratorio del Dr. Jorge DiPaola por su orientación y consejos.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Referencias
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados