Method Article
Preparazione di piastrine umane lavate per studi quantitativi sul flusso metabolico
In questo articolo
Riepilogo
Il metabolismo piastrinico è di interesse, in particolare per quanto riguarda il ruolo dell'iper- e dell'ipoattività piastrinica nel sanguinamento e nei disturbi trombotici. L'isolamento delle piastrine dal plasma è necessario per alcuni saggi metabolici; Qui viene presentato un metodo per isolare i metaboliti intracellulari dalle piastrine lavate.
Abstract
Le piastrine sono cellule del sangue che svolgono un ruolo fondamentale nell'emostasi e nella risposta immunitaria innata. L'iperattività e l'ipoattività piastrinica sono state implicate nei disturbi metabolici, aumentando il rischio sia di trombosi che di sanguinamento. L'attivazione piastrinica e il metabolismo sono strettamente collegati, con i numerosi metodi per misurare la prima ma relativamente pochi per il secondo. Per studiare il metabolismo piastrinico senza l'interferenza di altre cellule del sangue e componenti del plasma, le piastrine devono essere isolate, un processo che non è banale a causa della sensibilità al taglio piastrinico e della capacità di attivarsi irreversibilmente. Qui viene presentato un protocollo per l'isolamento piastrinico (lavaggio) che produce piastrine quiescenti sensibili alla stimolazione da parte degli agonisti piastrinici. Le fasi successive della centrifugazione vengono utilizzate con l'aggiunta di inibitori piastrinici per isolare le piastrine dal sangue intero e risospenderle in un tampone isosmotico controllato. Questo metodo produce in modo riproducibile un recupero del 30%-40% delle piastrine dal sangue intero con bassa attivazione, misurata dai marcatori di secrezione dei granuli e attività delle integrine. La conta piastrinica e la concentrazione del carburante possono essere controllate con precisione per consentire all'utente di sondare una varietà di situazioni metaboliche.
Introduzione
Le piastrine sono cellule anucleate di piccole dimensioni (2-4 μm di diametro) che svolgono un ruolo importante nell'emostasi, il processo strettamente regolato di formazione del coagulo1. Sebbene vitali per l'integrità vascolare, le piastrine sono anche implicate in eventi avversi per la salute. Le piastrine sono coinvolte nella trombosi venosa profonda (TVP) e nella trombosi arteriosa (AT), che sono coaguli che occludono i vasi sanguigni, portando a una diminuzione dell'afflusso di sangue a livello locale, oppure, se pezzi del coagulo si rompono (embolizzano), possono bloccare l'afflusso di sangue ai polmoni, al cuore o al cervello 2,3,4,5,6,7 . L'iperreattività piastrinica è una comorbilità di ipertensione, diabete e cancro, che porta ad un aumento dell'incidenza di TVP e AT 8,9,10. L'attivazione piastrinica e il metabolismo sono strettamente correlati11,12, portando a un aumento dell'interesse nel mirare al metabolismo piastrinico come strategia terapeutica13,14. C'è un dibattito sull'esatto ricablaggio metabolico che si verifica dopo l'attivazione, e questo è un campo di studio attivo15. Questo crescente interesse per la disfunzione piastrinica nella malattia e i suoi legami con il metabolismo sottolinea la necessità di un metodo ripetibile per isolare le piastrine e studiarne il metabolismo.
Le piastrine umane sono tipicamente ottenute mediante venipuntura e quindi isolate dal sangue intero. Le piastrine lavate vengono separate dal sangue intero attraverso le successive fasi di lavaggio e centrifugazione16. Questo è stato originariamente fatto dal gruppo17 di Mustard, e leggermente modificato dal gruppo18 di Cazenave. Un'altra alternativa sono le piastrine filtrate su gel, che possono essere ottenute dal plasma ricco di piastrine (PRP) mediante cromatografia ad esclusione dimensionale utilizzando una colonna impaccata di perle di gel di agarosio19. Esistono molti protocolli di lavaggio sia per il sangue umano che per quello dei roditori e sono ottimizzati per vari test 20,21,22,23, ma non per misurare il metabolismo piastrinico.
Le tecniche per studiare il metabolismo piastrinico includono misurazioni bioenergetiche tramite l'analizzatore Seahorse XF 11,24,25,26,27, misurazioni del flusso extracellulare 11,13,24, metabolomica 14,28 e analisi del flusso metabolico assistita da isotopi (13C-MFA)29. Negli studi metabolomici, l'obiettivo è tipicamente quello di determinare percorsi alterati tra due diverse condizioni (ad esempio, piastrine a riposo vs piastrine attivate14). Gli studi metabolomici prevedono l'uso della cromatografia liquida-spettrometria di massa (LC-MS). Questi studi possono essere condotti per metaboliti intra- o extracellulari e sono spesso associati all'analisi del percorso o all'analisi delle componenti principali (PCA)14,28. L'analisi del flusso metabolico isotopico assistito (13C-MFA) prevede l'alimentazione delle cellule di un substrato marcato noto come tracciante e la misurazione del modo in cui questo tracciante si propaga attraverso una rete di reazione con LC-MS. Questa tecnica consente il calcolo dei flussi attraverso le vie metaboliche con risoluzione del livello di reazione29,30. Nel sangue intero e nel plasma ricco di piastrine (PRP), la concentrazione di carburante (glucosio, glutammina, acetato, ecc.) è soggetta alla variabilità da donatore a donatore e l'albumina e la globulina legante gli ormoni sessuali presenti nel plasma possono alterare la concentrazione attiva di ormoni, farmaci e altre molecole biologicamente rilevanti31. Le piastrine lavate offrono un metodo per sospendere le piastrine in un mezzo definito dall'utente, comprese le concentrazioni di carburante note, compatibile con 13C-MFA32.
Qui descritto è un metodo per il lavaggio delle piastrine per produrre piastrine che possono essere utilizzate nei saggi metabolici. Il protocollo produce piastrine quiescenti con bassa contaminazione da globuli rossi e globuli bianchi. Lo stato di attivazione piastrinica è stato monitorato tramite citometria a flusso dei marcatori di attivazione piastrinica. Questo protocollo raggiunge in modo riproducibile almeno il 30%-40% di recupero piastrinico rispetto alla conta piastrinica nel sangue intero. Le piastrine lavate ottenute con questa tecnica sono adatte per le tecniche di analisi metabolica e il metodo di estrazione dei metaboliti intracellulari può essere adattato all'analisi a scelta dell'utente (LC-MS, GC-MS, saggio fotometrico, ecc.).
Protocollo
Lo studio ha ricevuto l'approvazione dell'Institutional Review Board dall'Università del Colorado Anschutz Medical Campus. Il consenso scritto è stato ottenuto da tutti i partecipanti allo studio. I partecipanti hanno riferito di non aver consumato alcol nelle precedenti 48 ore o farmaci antinfiammatori non steroidei (FANS) nei dieci giorni precedenti. Questo progetto è supportato dal National Heart, Lung, and Blood Institute del National Institutes of Health con il numero di premio R61HL141794.
1. Raccolta del sangue
- Predisposizione per il prelievo di sangue. Si raccomanda che la raccolta del sangue venga effettuata da un flebotomo qualificato.
- Eseguire la venipuntura sull'interno del braccio utilizzando un ago da 19 G.
- Raccogliere i primi ~2 mL in un vacutainer privo di additivi e smaltire. Questo serve a rimuovere le molecole di segnalazione chimica dalle cellule endoteliali danneggiate che possono attivare le piastrine. Dopo aver raccolto i 2 ml iniziali, rimuovere il laccio emostatico per ridurre lo sforzo di taglio sulle piastrine.
- Raccogliere il resto del sangue nei vacutainer antiocoagulanti citrato destrosio (ACD-A) in un rapporto di 14:3 (sangue:ACD-A). Capovolgere delicatamente ogni vacutainer dopo il prelievo di sangue per mescolare sangue e anticoagulante.
2. Lavaggio delle piastrine
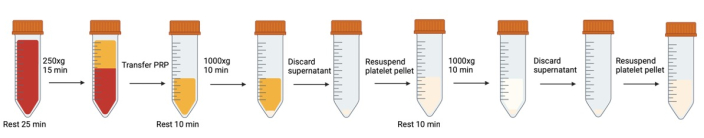
Figura 1: Fasi successive di centrifugazione e risospensione coinvolte nel lavaggio piastrinico. Fare clic qui per visualizzare una versione più grande di questa figura.
NOTA: Evitare la generazione di bolle d'aria. Utilizzare pipette di trasferimento per rimuovere le bolle quando si formano, soprattutto prima della centrifugazione. Ogni volta che le provette di sangue/piastrine vengono aperte/chiuse, si consiglia di respirare nella provetta prima di chiudere il tappo per aumentare il livello di CO2 .
- Preriscaldare la centrifuga a 37 °C per ridurre gli effetti della temperatura. Tra una fase di centrifugazione e l'altra del protocollo, mantenere la centrifuga a 37 °C.
- Preriscaldare il bagnomaria a 37 °C. Mettere il tampone di Tyrode modificato con il glucosio nel bagnomaria.
NOTA: la ricetta del buffer modificata di Tyrode può essere trovata nel File supplementare 1. - Combinare il sangue intero raccolto da tutti i vacutainer in provette coniche in polipropilene da 50 mL. Utilizzando una punta di pipetta con taglio smussato, tagliata con un angolo di 45°, prelevare il volume del campione appropriato per eseguire una conta delle cellule (vedere Conteggio delle cellule).
- Rimuovere eventuali bolle generate dall'aspirazione accurata con una pipetta di trasferimento a foro stretto.
- Lasciare riposare il sangue a bagnomaria per 25 minuti a 37 °C Ciò consente alle piastrine in uno stato attivato in modo reversibile (dall'essere rimosse dal corpo, trasferite da un tubo all'altro, ecc.) di tornare a uno stato di riposo.
- Per prevenire l'attivazione durante la centrifugazione, aggiungere 500 nM di prostaglandina I2 (PGI2) e 0,02 U/mL di apirasi al sangue intero e mescolare delicatamente capovolgendo una volta. Rimuovere eventuali bolle generate utilizzando una pipetta di trasferimento a foro stretto.
NOTA: Le istruzioni per la corretta ricetta di PGI2 e apirasi possono essere trovate nel File supplementare 1. - Centrifugare il sangue intero per ottenere plasma ricco di piastrine (PRP) (15 minuti a 250 x g per 42 ml di sangue intero) senza freni (37 °C).
- Raccogliere delicatamente il PRP (strato giallo superiore sopra il buffy coat e lo strato di sangue rosso) in una nuova provetta conica da 50 mL utilizzando una pipetta di trasferimento a foro largo.
- Durante il trasferimento, inclinare un tubo conico pulito e far scorrere delicatamente il PRP lungo il lato del tubo. Evitare le bolle d'aria.
- Lasciare circa 3 mm di PRP per evitare di disturbare il buffy coat (lo strato di globuli bianchi tra il PRP e il sangue rosso). Se disturbato, questo apparirà come un improvviso vortice di bianco nella pipetta di trasferimento.
- Effettuare il conteggio delle cellule (vedere Conteggio delle piastrine) per determinare il volume di risospensione per la fase di lavaggio successiva.
- Lasciare riposare per 10 minuti a 37 °C.
- Utilizzando una punta di pipetta con taglio smussato, prelevare il campione per la citometria a flusso (vedere Citometria a flusso).
- Aggiungere 500 nM di PGI2 e 0,02 U/mL di apirasi al PRP e mescolare capovolgendo delicatamente una volta.
- Centrifugare per 10 minuti a 1000 x g a 37 °C (accelerazione:0 freno: 0). Non utilizzare il freno. Il pellet non è compatto e una frenata improvvisa può causare il rimescolamento.
- Durante la centrifugazione, determinare il volume di risospensione. Supponiamo un recupero del 75%. Rendere la densità cellulare di circa 3x105 cellule/μL.
- Aspirare il surnatante utilizzando una pipetta di trasferimento in plastica a foro largo per il volume di massa e una pipetta da 1 ml (punta non tagliata) per il resto del liquido vicino al pellet. Evitare di toccare il pellet sul fondo del tubo.
- Aggiungere 500 nM di PGI2 e 0,02 U/mL di apirasi al tampone di Tyrode modificato. Aggiungere lentamente la quantità calcolata di tampone dal passaggio 16 facendo scorrere lungo il lato del tubo conico.
- Utilizzando un puntale con taglio smussato e un puntale per pipetta da 1 mL, risospendere delicatamente il pellet pipettandolo delicatamente su e giù più volte.
- Impostare il volume su 300 μl, premere completamente lo stantuffo mentre si trova sopra la linea del liquido, quindi posizionare la pipetta sotto il liquido e fermarsi per primo. Ciò consentirà allo scienziato di risospendere il pellet senza creare accidentalmente bolle d'aria che potrebbero attivare le piastrine.
- Occasionalmente, c'è un anello di globuli rossi visibili sul fondo del pellet. Evitare di risospendere questa operazione.
- Una volta che il pellet è stato risospeso, utilizzare una pipetta di trasferimento a foro largo per trasferire il pellet risospeso in un nuovo tubo conico, lasciando dietro di sé eventuali globuli rossi o cellule visibilmente raggruppate.
- Ripetere i passaggi da 11 a 20. Assicurarsi di aggiungere 500 nM di PGI2 e 0,02 U/mL da un'aliquota fresca al tampone di Tyrode modificato (non riutilizzare il tampone di Tyrode modificato dal passaggio 18, PGI2 è troppo instabile).
- Prelevare un campione per la conta delle cellule. Regolare la concentrazione piastrinica secondo necessità con il tampone di Tyrode modificato.
- Utilizzare una punta di pipetta con taglio smussato per prelevare un campione per la citometria a flusso.
- Lasciare riposare le piastrine per 1 ora a 37 °C per consentire agli inibitori di svanire e consentire alle piastrine attivate in modo reversibile di tornare a riposo.
- Mescolare delicatamente con una pipetta a foro largo. Prelevare campioni per la citometria a flusso.
- Le piastrine lavate e a riposo sono ora pronte per essere utilizzate per l'analisi metabolica.
3. Conteggio delle piastrine
- Le piastrine possono essere contate utilizzando un contatore automatico di cellule del sangue (seguire le istruzioni del produttore) o un emocitometro33.
4. Citometria a flusso
- Preparazione
- Protocolli dettagliati e revisioni delle migliori pratiche per l'impostazione di miscele di anticorpi e la preparazione del citometro a flusso per misurare l'attivazione piastrinica sono disponibili altrove34,35.
- Campionamento
- Quando si preleva un campione per la citometria a flusso, raccogliere la sospensione piastrinica utilizzando una punta di pipetta tagliata a smusso. Aggiungerlo lentamente alla provetta da microcentrifuga con gli anticorpi, quindi agitare delicatamente per mescolare. Lasciare incubare per 30 s.
- Utilizzando la punta della pipetta con taglio smussato, trasferire la sospensione piastrinica/la miscela di anticorpi in un pozzetto appropriato sulla piastra a 96 pozzetti.
- Aggiungere immediatamente il fissante al pozzetto per fissare le cellule.
- Eseguire il citometro a flusso entro 8 ore dalla fissazione.
- Test di sensibilità agli agonisti
- Dopo il lavaggio, mettere da parte 2 provette coniche da 15 mL, una per il controllo a riposo e una per il controllo attivato dalla trombina.
- Pipettare delicatamente 100 μl di sospensione piastrinica in ciascuna provetta conica utilizzando un puntale per pipetta tagliato a taglio smussato. Lasciare riposare a 37 °C per 1 ora.
- Dopo l'ora di riposo, aggiungere 0,1 U/mL di trombina in una provetta (le istruzioni per la preparazione della trombina sono disponibili nel File supplementare 1) e il veicolo nell'altra. Incubare a 37 °C per 15 min.
- Prelevare un campione di citometria a flusso di ciascuna provetta per determinare la sensibilità piastrinica all'agonista.
5. Campionamento per l'analisi quantitativa del flusso metabolico
- Tempra
NOTA: L'estinzione del metabolismo è un passaggio necessario per misurare con precisione i flussi metabolici. Il raffreddamento rapido delle cellule e il mantenimento della loro temperatura pari o inferiore a 4 °C rallenta il metabolismo in modo tale da poter presumere che sia sostanzialmente interrotto, in modo che le cellule campionate riflettano accuratamente il metabolismo delle cellule provenienti dalla massa. Esistono diversi metodi che possono essere utilizzati, ma per bilanciare la necessità di un raffreddamento rapido e ridurre al minimo le perdite, utilizzare soluzione fisiologica fredda (-4 °C)36. Se il sale interferisce con l'analisi successiva, è possibile utilizzare un altro fluido (metanolo/acqua, etanolo, ecc.)37.- Preparare e congelare aliquote di soluzione fisiologica. Effettuare ogni aliquota salina a 6 volte il volume del campione desiderato.
NOTA: la ricetta della soluzione salina normale si trova nel File supplementare 1. - Pre-raffreddare la microcentrifuga a 0 °C.
- Raccogliere la sospensione piastrinica in soluzione fisiologica normale parzialmente congelata (< -4 °C) in un rapporto 1:6 (p.es., raccogliere 150 μL di sospensione piastrinica in 750 μL di soluzione fisiologica in provette da microcentrifuga).
NOTA: Non lasciare la soluzione piastrinica/salina sul ghiaccio per più di 15 minuti. - Centrifugare a 16.000 x g, 0 °C per 10 min.
- Conservare il surnatante per l'analisi dei metaboliti esterni e il pellet per l'estrazione e la misurazione dei metaboliti intracellulari. Conservare entrambi a -20 °C fino al momento dell'analisi.
- Ripetere questo processo sull'intervallo di tempo desiderato e sul numero di punti temporali del campione.
- Preparare e congelare aliquote di soluzione fisiologica. Effettuare ogni aliquota salina a 6 volte il volume del campione desiderato.
- Estrazione intracellulare di metaboliti
- Aggiungere 0,5 mL di acqua metanolo 7:3 pre-raffreddata a -20 °C al pellet temprato. Agitare energicamente per 1 min.
- Congelare in azoto liquido, scongelare a 0 °C, quindi ripetere per altri 2 cicli.
- Centrifugare le sospensioni a 16.000 x g per 10 minuti a -4 °C.
- Raccogliere il surnatante in una nuova provetta per microcentrifuga.
- Utilizzare il pellet del passaggio 3 e ripetere il protocollo di estrazione (passaggi 1-3) con metanolo 50:50:acqua. Aggiungi il secondo estratto raccolto al primo. Asciugare per una notte.
- Risospendere l'estratto secco in 150 μl di acqua di grado LC-MS (o altro solvente appropriato per l'analisi prevista). Mescolare per 15 minuti a 4 °C. Agitare brevemente e trasferire in provette da microcentrifuga da 0,22 μm per rimuovere i detriti cellulari. Centrifugare per 5 minuti a 16.000 x g e 4 °C.
- Togliere dalla centrifuga, pipettare altri 50 μL di acqua optima sul filtro e centrifugare nuovamente (5 min, 16.000 x g e 4 °C) per risciacquare il filtro. Raccogli per l'analisi.
Risultati
I risultati rappresentativi nella Figura 2 rappresentano 6 diversi donatori di sangue, tra cui 3 maschi e 3 femmine. La resa piastrinica rispetto al sangue intero è mostrata nella Figura 2A. Il recupero piastrinico finale è stato in media del 52% ± del 3% (deviazione standard, n=6). La conta piastrinica finale rispetto alla contaminazione dei globuli bianchi è stata misurata utilizzando un analizzatore ematologico automatizzato. La conta dei globuli bianchi era inferiore allo 0,1% delle cellule totali (Figura 2B). Durante il processo di lavaggio e l'ora di riposo, le piastrine hanno mantenuto una bassa esposizione alla P-selectina, ma hanno risposto fortemente al trattamento con trombina (Figura 2C). Il fibrinogeno legato raggiunge un picco dopo il primo giro di 1000 x g, ma ritorna al di sotto del 5% dopo il secondo giro di 1000 x g. Come l'esposizione alla P-selectina, il fibrinogeno legato aumenta drasticamente dopo il trattamento con trombina dopo l'ora di riposo (Figura 2D). Il gating rappresentativo per dimensioni, singoletti e positività al CD42a è mostrato nella Figura 3A-C. Gli eventi che superano questi cancelli successivi vengono utilizzati per cercare l'esposizione alla P-selectina e il fibrinogeno legato. Il gating rappresentativo per le piastrine positive alla P-selectina e al fibrinogeno positivo è mostrato nella Figura 3D-E. La Figura 3D mostra un campione di piastrine trattato con il controllo del veicolo e la Figura 3E mostra un campione di piastrine 15 minuti dopo l'aggiunta di 0,1 U/mL di trombina.
Le piastrine lavate sono state utilizzate per condurre un esperimento quantitativo di captazione ed escrezione, mostrato nella Figura 4. Le piastrine sono state lavate e 5 mmol/L di glucosio e 20 mmol/L di acetato sono stati aggiunti alle sospensioni finali lavate. 0,1 U/mL di trombina o veicolo sono stati aggiunti alle sospensioni piastriniche lavate dopo un'ora di riposo. I campioni sono stati raccolti e spenti ogni 15 minuti dopo l'aggiunta di trombina per 30 minuti. I surnatanti sono stati utilizzati per misurare le variazioni della concentrazione di lattato extracellulare, glucosio e acetato utilizzando saggi fotometrici automatizzati. Il flusso è stato calcolato prendendo la pendenza di regressione della concentrazione del metabolita nel tempo. La Figura 4 mostra i flussi di metaboliti calcolati per tre donatori rappresentativi. I flussi di lattato per tutti i donatori erano positivi, indicando che il lattato veniva prodotto, e i flussi di glucosio e acetato erano negativi, indicando che venivano consumati. Sebbene vi sia una variazione nel cambiamento di piega, il trattamento con trombina ha portato ad un aumento dell'entità dei flussi rispetto al riposo per ciascun donatore.

Figura 2: (A) Percentuale di piastrine recuperate rispetto al sangue intero in ogni fase del processo di lavaggio. n=6, le barre di errore rappresentano la deviazione standard. (B) Conta delle piastrine e delle cellule leucocitarie al termine del processo di lavaggio. (C) Percentuale di piastrine positive per l'espressione della P-Selectina, misurata mediante citometria a flusso. n=6, le barre di errore rappresentano la deviazione standard. (D) Percentuale di piastrine positive per il fibrinogeno, misurata mediante citometria a flusso. n=6, le barre di errore rappresentano la deviazione standard. . Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Gating rappresentativo per la citometria a flusso piastrinico. Le piastrine sono (A) gated per dimensioni con diffusione diretta (FSC) e diffusione laterale (SSC), (B) quindi gated per singole cellule con larghezza e altezza FSC e (C) gated per la positività al CD42a. Gli eventi che superano questi cancelli successivi vengono utilizzati per cercare i marcatori di attivazione. (D) Espressione di P-selectina e fibrinogeno per un campione di piastrine di controllo a riposo. I marcatori di attivazione misurati qui sono P-Selectina, PECy5 e FITC-Fibrinogeno. (E) Espressione di P-selectina e fibrinogeno per un campione di piastrine trattato con trombina 0,1 U/mL. I marcatori di attivazione misurati qui sono P-Selectin, PECy5 e FITC-Fibrinogen. Clicca qui per visualizzare una versione più grande di questa figura.
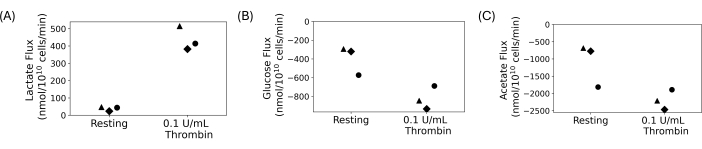
Figura 4: (A) Tassi di escrezione di lattato per tre diversi donatori per una condizione di riposo e di attivazione della trombina. (B) Tassi di assorbimento del glucosio per tre diversi donatori per una condizione di riposo e di attivazione della trombina. (C) Tassi di assorbimento dell'acetato per tre diversi donatori per una condizione di riposo e di attivazione della trombina. Clicca qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Ricette e istruzioni per la preparazione di tamponi e reagenti. Clicca qui per scaricare questo file.
Discussione
Le piastrine sono molto sensibili al loro ambiente, compreso lo stress da taglio e la presenza di agonisti38,39. Ciò rende le piastrine difficili da maneggiare e isolare, rendendo fondamentale l'uso di inibitori e pipette a foro largo40. La corretta conservazione e preparazione dell'IGP2 è fondamentale, poiché la mancata preparazione dell'IGP2 nel PBS di base comporterà una rapida degradazione dell'IGP241. Per ridurre al minimo il rischio di attivazione indotta dal taglio, utilizzare pipette a foro largo, puntali per pipette con taglio smussato e un ago per flebotomia calibro 19.
Inevitabilmente, una parte delle piastrine andrà persa ad ogni fase del processo di lavaggio (Figura 2A). Non tutte le piastrine finiranno nello strato di plasma e la raccolta del plasma troppo vicino allo strato di buffy coat rischia la contaminazione dei globuli bianchi. Inoltre, una popolazione di piastrine si aggrega e affonda sul fondo dopo la risospensione, sottolineando l'importanza di trasferire il pellet risospeso in un tubo pulito dopo ogni risospensione. Si noti che nella Figura 2D c'è un aumento del legame del fibrinogeno dopo il primo spin di 1000 x g che poi scende dopo il secondo spin di 1000 x g. I campioni per la citometria a flusso sono stati raccolti dopo un periodo di riposo di 10 minuti in ciascun caso. È possibile che una parte di questa popolazione recuperi la sua natura quiescente, ma poiché questa popolazione è presente dopo i primi 10 minuti di riposo, parte di questa popolazione attivata può aggregarsi e cadere sul fondo del tubo durante la risospensione.
Sebbene l'uso della citometria a flusso non sia strettamente necessario, è utile monitorare se le piastrine sono quiescenti e in grado di rispondere agli agonisti alla fine del processo di lavaggio. Inoltre, in particolare se gran parte delle piastrine appare visivamente grumosa durante il lavaggio, l'esecuzione della citometria a flusso in ogni fase può aiutare a identificare dove sta sorgendo il problema. Sebbene non comune, circa 1 su 20 esperimenti da donatore deve essere escluso a causa dell'attivazione spontanea delle piastrine durante il periodo di riposo. L'analisi in citometria a flusso dei marcatori di attivazione piastrinica è uno strumento prezioso per convalidare la quiescenza e la sensibilità all'agonista prima degli esperimenti che coinvolgono le piastrine.
Per misurare la risposta piastrinica all'agonista utilizzando la citometria a flusso, alcuni studi consentono alle piastrine di incubare nell'agonista e nel cocktail di anticorpi per 10-30 minuti a temperatura ambiente prima di fissare 42,43,44. Dopo l'ora di riposo, un'incubazione di 20 minuti a temperatura ambiente prima di fissare le piastrine di controllo a riposo determina una sovrastima dell'attivazione. Questa attivazione non si verifica quando le piastrine vengono incubate per 20 minuti a 37 °C, suggerendo che questa apparente attivazione si verifica perché gli inibitori sono svaniti e l'improvviso cambiamento di temperatura attiva le piastrine. Anche l'attesa di 20 minuti per la fissazione durante il processo di lavaggio non induce questa attivazione artificiale, che potrebbe essere dovuta all'attenuazione dell'azione degli inibitori durante l'ora di riposo. Per catturare il vero stato di attivazione delle piastrine, si consiglia di eseguire l'incubazione a 37 °C o di fissarle dopo solo una breve incubazione (30 secondi) con anticorpi.
Le piastrine lavate offrono un modo per studiare le piastrine senza l'interferenza di altre cellule del sangue e componenti del plasma. Sono ideali per gli studi in cui l'ambiente extracellulare deve essere manipolato, compresi gli studi metabolici. La densità della sospensione piastrinica finale è regolabile e può essere controllata per ridurre al minimo la variabilità della conta piastrinica tra le persone. Per gli studi metabolici, è possibile controllare le concentrazioni personalizzate di substrati di carbonio piastrinico. I risultati rappresentativi mostrati nella Figura 4 provengono da un esperimento di assorbimento ed escrezione in cui sono stati aggiunti glucosio e acetato come substrati di carbonio ed è stato prodotto lattato. Sebbene nella Figura 4 vi sia variabilità biologica tra i donatori, la produzione di lattato aumenta con il trattamento con trombina, mentre aumenta il consumo di glucosio e acetato. Questo concorda con la letteratura; È noto che le piastrine aumentano il loro tasso di glicolisi aerobica e fosforilazione ossidativa all'attivazione 13,14,15,45. Questa tecnica può essere applicata per studiare le piastrine in diverse condizioni nutrizionali o con diversi ioni nella sospensione piastrinica finale.
Sebbene gli studi sulle piastrine lavate siano preziosi, è importante tenere presente che l'ambiente artificiale non ricapitola l'ambiente in vivo. Pertanto, le piastrine lavate dovrebbero essere utilizzate solo in situazioni in cui gli investigatori sono interessati alla sola funzione piastrinica. Come per tutti gli studi in vitro , i risultati devono essere interpretati con cautela. Si raccomanda di risospendere le piastrine in un tampone di Tyrode modificato con una concentrazione di calcio di 2 mM dopo il lavaggio finale. L'espressione del legame tra P-selectina e fibrinogeno è stata misurata solo fino a 1,5 ore dopo il processo di lavaggio (2,5 ore inclusa l'ora di riposo), quindi si raccomanda allo scienziato di utilizzare la sospensione piastrinica lavata entro quella finestra temporale, o altrimenti convalidare la fedeltà delle piastrine. Questo studio non ha misurato altre metriche classiche della funzionalità piastrinica, come l'aggregazione.
Le piastrine lavate preparate con il nostro protocollo sono quiescenti, convalidate da misurazioni citofluorimetriche di P-selectina e fibrinogeno. I substrati metabolici, gli ormoni e gli agonisti piastrinici nell'ambiente extracellulare possono essere controllati con precisione, consentendo allo scienziato di studiare il metabolismo piastrinico in un sistema di sua scelta.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da segnalare.
Riconoscimenti
Gli autori ringraziano la dottoressa Emily Janus-Bell e Clarisse Mouriaux del laboratorio del dottor Pierre Mangin e Katrina Bark del laboratorio del dottor Jorge DiPaola per la loro guida e i loro consigli.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Riferimenti
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon