Method Article
הכנת טסיות דם אנושיות שטופות למחקרי שטף מטבולי כמותי
In This Article
Summary
חילוף החומרים של טסיות הדם מעניין, במיוחד בכל הנוגע לתפקיד של היפראקטיביות והיפראקטיביות של טסיות דם בדימום והפרעות פקקת. בידוד טסיות הדם מפלזמה הכרחי לכמה בדיקות מטבוליות; מוצגת כאן שיטה לבידוד מטבוליטים תוך-תאיים מטסיות דם שטופות.
Abstract
טסיות דם הן תאי דם הממלאים תפקיד אינטגרלי בהמוסטזיס ובתגובה החיסונית המולדת. יתר טסיות דם ותת פעילות היו מעורבים בהפרעות מטבוליות, מה שמגביר את הסיכון הן לפקקת והן לדימום. הפעלת טסיות הדם וחילוף החומרים קשורים קשר הדוק, עם השיטות הרבות למדידת הראשונות אך מעטות יחסית עבור האחרונה. כדי לחקור את חילוף החומרים של טסיות הדם ללא התערבות של תאי דם אחרים ורכיבי פלזמה, יש לבודד טסיות דם, תהליך שאינו טריוויאלי בגלל רגישות לגזירה של טסיות הדם ויכולתן לפעול באופן בלתי הפיך. מוצג כאן פרוטוקול לבידוד טסיות דם (שטיפה) המייצר טסיות רגועות הרגישות לגירוי על ידי אגוניסטים של טסיות דם. נעשה שימוש בשלבי צנטריפוגה עוקבים בתוספת מעכבי טסיות כדי לבודד טסיות דם מדם מלא ולהשעות אותן מחדש במאגר איזוסמוטי מבוקר. שיטה זו מייצרת התאוששות של 30%-40% של טסיות דם מדם מלא עם הפעלה נמוכה כפי שנמדד על ידי סמנים של הפרשת גרגירים ופעילות אינטגרין. ניתן לשלוט במדויק על ספירת טסיות הדם וריכוז הדלק כדי לאפשר למשתמש לחקור מגוון מצבים מטבוליים.
Introduction
טסיות הדם הן תאים קטנים (קוטר 2-4 מיקרומטר), א-גרעיניים הממלאים תפקיד חשוב בהמוסטזיס, התהליך המווסת היטב של היווצרות קרישים1. בעוד שטסיות הדם חיוניות לשלמות כלי הדם, הן מעורבות גם באירועים בריאותיים שליליים. טסיות מעורבות בפקקת ורידים עמוקים (DVT) ופקקת עורקים (AT), שהם קרישי דם שחוסמים את כלי הדם, מה שמוביל לירידה באספקת הדם באופן מקומי, או, אם חלקים מהקריש מתנתקים (מתאמבולים), הם יכולים לחסום את אספקת הדם לריאות, ללב או למוח 2,3,4,5,6,7 . תגובתיות יתר של טסיות היא תחלואה נלווית של יתר לחץ דם, סוכרת וסרטן, מה שמוביל לשכיחות מוגברת של DVT ו-AT 8,9,10. הפעלת טסיות הדם וחילוף החומרים קשורים קשר הדוק11,12, מה שמוביל לעניין מוגבר בהתמקדות במטבוליזם של טסיות הדם כאסטרטגיה טיפולית13,14. יש ויכוח על החיווט המטבולי המדויק המתרחש עם ההפעלה, וזהו תחום מחקר פעיל15. העניין המוגבר הזה בתפקוד לקוי של טסיות דם במחלות והקשרים שלו לחילוף החומרים מדגיש את הצורך בשיטה חוזרת לבידוד טסיות הדם ולחקר חילוף החומרים שלהן.
טסיות דם אנושיות מתקבלות בדרך כלל על ידי ניקור ורידים ולאחר מכן מבודדות מדם מלא. טסיות דם שטופות מופרדות מדם מלא באמצעות שלבי שטיפה וצנטריפוגה עוקבים16. זה נעשה במקור על ידי קבוצה17 של חרדל, ושונה מעט על ידי קבוצה18 של קזנב. חלופה נוספת היא טסיות דם מסוננות ג'ל, אותן ניתן להשיג מפלזמה עשירה בטסיות דם (PRP) על ידי כרומטוגרפיה של אי הכללת גודל באמצעות עמודה ארוזה של חרוזי ג'ל אגרוז19. פרוטוקולי שטיפה רבים קיימים הן לדם אנושי והן לדם מכרסמים, והם מותאמים לבדיקות שונות 20,21,22,23, אך לא למדידת חילוף חומרים של טסיות דם.
טכניקות לחקר חילוף החומרים של טסיות הדם כוללות מדידות ביו-אנרגטיות באמצעות מנתח Seahorse XF 11,24,25,26,27, מדידות שטף חוץ-תאי 11,13,24, מטבולומיקה 14,28 וניתוח שטף מטבולי בסיוע איזוטופים (13C-MFA)29. במחקרים מטבולומיים, המטרה היא בדרך כלל לקבוע מסלולים משתנים בין שני מצבים שונים (לדוגמה, טסיות מנוחה לעומת טסיות מופעלות14). מחקרים מטבולומיים כוללים שימוש בכרומטוגרפיה נוזלית-ספקטרומטריית מסה (LC-MS). מחקרים אלה יכולים להיעשות עבור מטבוליטים תוך-תאיים או חוץ-תאיים ולעתים קרובות הם משולבים עם ניתוח מסלול או ניתוח רכיבים עיקריים (PCA)14,28. ניתוח שטף מטבולי בסיוע איזוטופים (13C-MFA) כולל הזנת תאים במצע מסומן המכונה עוקב, ומדידת האופן שבו עוקב זה מתפשט דרך רשת תגובה עם LC-MS. טכניקה זו מאפשרת חישוב שטפים דרך מסלולים מטבוליים ברזולוציית רמת תגובה29,30. בפלזמה עשירה בדם מלא ובטסיות דם (PRP), ריכוז הדלק (גלוקוז, גלוטמין, אצטט וכו') נתון לשונות מתורם לתורם, וגלובולין קושר אלבומין והורמוני מין הקיים בפלזמה יכול לשנות את הריכוז הפעיל של הורמונים, תרופות ומולקולות רלוונטיות ביולוגית אחרות31. טסיות דם שטופות מציעות שיטה להשהיית טסיות דם בתווך המוגדר על ידי המשתמש, כולל ריכוזי דלק ידועים, התואם ל-13C-MFA32.
מתוארת כאן שיטה לשטיפת טסיות לייצור טסיות דם שניתן להשתמש בהן במבחנים מטבוליים. הפרוטוקול מייצר טסיות דם שקטות עם זיהום נמוך של תאי דם אדומים ותאי דם לבנים. מצב הפעלת הטסיות נוטר באמצעות זרימה ציטומטרית של סמני הפעלת טסיות דם. פרוטוקול זה משיג באופן חוזר לפחות 30%-40% התאוששות טסיות ביחס לספירת הטסיות בדם מלא. הטסיות השטופות המתקבלות בטכניקה זו מתאימות לטכניקות הניתוח המטבולי, וניתן להתאים את שיטת מיצוי המטבוליטים התוך תאיים לניתוח לבחירת המשתמש (LC-MS, GC-MS, בדיקה פוטומטרית וכו').
Protocol
המחקר קיבל את אישור מועצת הביקורת המוסדית מהקמפוס הרפואי של אוניברסיטת קולורדו אנשוץ. הסכמה בכתב התקבלה מכל משתתפי המחקר. המשתתפים דיווחו שהם לא צרכו אלכוהול במשך 48 השעות האחרונות או תרופות נוגדות דלקת לא סטרואידיות (NSAIDs) בעשרת הימים הקודמים. פרויקט זה נתמך על ידי המכון הלאומי ללב, ריאות ודם של המכונים הלאומיים לבריאות תחת פרס מספר R61HL141794.
1. איסוף דם
- הגדר ללקיחת דם. מומלץ איסוף דם מתבצע על ידי פלבוטומיסט מיומן.
- בצע ניקור ורידים בזרוע הפנימית באמצעות מחט 19 גרם.
- אוספים את ~2 המ"ל הראשונים לתוך שואב אבק ללא תוספים והשליכו. זאת כדי להסיר מולקולות איתות כימיות מתאי אנדותל פגומים שעלולים להפעיל טסיות דם. לאחר איסוף 2 מ"ל הראשוניים, הסר חוסם עורקים כדי להפחית את לחץ הגזירה על טסיות הדם.
- יש לאסוף את שאר הדם לתוך ואקוטיינרים נוגדי קרישה ציטראט דקסטרוז (ACD-A) ביחס של 14:3 (דם: ACD-A). הפוך בעדינות כל שואב אבק לאחר איסוף הדם כדי לערבב דם ונוגד קרישה.
2. שטיפת טסיות דם
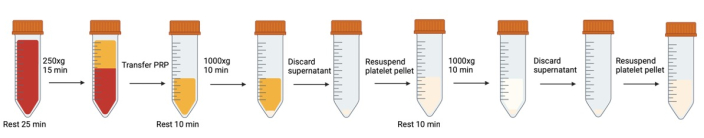
איור 1: צנטריפוגה עוקבת ושלבי השעיה מחדש המעורבים בשטיפת טסיות דם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
הערה: הימנע מיצירת בועות אוויר. השתמש בפיפטות העברה כדי להסיר בועות כאשר הן נוצרות, במיוחד לפני צנטריפוגה. בכל פעם שצינורות הדם/טסיות פתוחים/סגורים, מומלץ לנשום לתוך הצינור לפני סגירת הפקק כדי להעלות את רמתה-CO2 .
- מחממים מראש צנטריפוגה ל-37 מעלות צלזיוס כדי להפחית את השפעות הטמפרטורה. בין כל שלב צנטריפוגה בפרוטוקול, שמור על הצנטריפוגה ב-37 מעלות צלזיוס.
- מחממים את אמבט המים ל-37 מעלות צלזיוס. הניחו את המאגר של טירוד עם גלוקוז באמבט המים.
הערה: ניתן למצוא את מתכון המאגר של Tyrode שונה בקובץ משלים 1. - שלב דם מלא שנאסף מכל שואבי האבק לצינורות חרוטיים מפוליפרופילן בנפח 50 מ"ל. בעזרת קצה פיפטה חתוך בשיפוע שנחתך בזווית של 45°, קח דגימה מתאימה לנפח כדי לבצע ספירת תאים (ראה ספירת תאים).
- הסר את כל הבועות שנוצרו על ידי שאיבה בזהירות עם פיפטה להעברת קדח צרה.
- תנו לדם לנוח באמבט מים למשך 25 דקות בטמפרטורה של 37 מעלות צלזיוס זה מאפשר לטסיות במצב הפעלה הפיכה (מהוצאה מהגוף, העברה מצינור לצינור וכו') לחזור למצב מנוחה.
- כדי למנוע הפעלה במהלך צנטריפוגה, הוסף 500 ננומטר פרוסטגלנדין I2 (PGI2) ו-0.02 U/mL של אפיראז לדם מלא וערבב בעדינות על ידי היפוך פעם אחת. הסר את כל הבועות שנוצרו באמצעות פיפטת העברת קדח צרה.
הערה: הוראות למתכון PGI2 ואפיראז מתאים ניתן למצוא בקובץ משלים 1. - צנטריפוגה בדם מלא לקבלת פלזמה עשירה בטסיות דם (PRP) (15 דקות ב-250 x גרם עבור 42 מ"ל דם מלא) ללא בלם (37 מעלות צלזיוס).
- אסוף בעדינות את ה-PRP (השכבה הצהובה העליונה מעל מעיל האפי ושכבת הדם האדומה) לתוך צינור חרוטי חדש של 50 מ"ל באמצעות פיפטה להעברת קדח רחב.
- בעת ההעברה, הטה צינור חרוטי נקי והעביר בעדינות את ה-PRP לאורך צד הצינור. הימנע מבועות אוויר.
- השאירו כ-3 מ"מ של PRP מאחור כדי למנוע הפרעה למעיל הבאפי (שכבת תאי הדם הלבנים בין ה-PRP לדם האדום). אם מפריעים, זה ייראה כמו מערבולת פתאומית של לבן בפיפטה ההעברה.
- קח את ספירת התאים (ראה ספירת טסיות דם) כדי לקבוע את נפח ההשעיה לשלב הכביסה הבא.
- מניחים לנוח 10 דקות בחום של 37 מעלות צלזיוס.
- בעזרת קצה פיפטה חתוך משופע, קח דגימה לציטומטריית זרימה (ראה ציטומטריית זרימה).
- הוסף 500 ננומטר PGI2 ו-0.02 U/mL אפיראז ל-PRP וערבב על ידי היפוך עדין פעם אחת.
- צנטריפוגה למשך 10 דקות ב-1000 x גרם ב-37 מעלות צלזיוס (תאוצה: 0 בלם: 0). אין להשתמש בבלם. הגלולה אינה קומפקטית, ובלם פתאומי עלול לגרום לערבוב מחדש.
- בזמן הצנטריפוגה, קבע את נפח ההשעיה. נניח 75% התאוששות. הפוך את צפיפות התאים לכ-3x105 תאים/מיקרוליטר.
- שאפו סופרנטנט באמצעות פיפטה להעברת קדח רחב מפלסטיק לנפח בתפזורת ופיפטה של 1 מ"ל (קצה לא חתוך) לשארית הנוזל ליד הגלולה. הימנע מלגעת בגלולה בתחתית הצינור.
- הוסף 500 ננומטר PGI2 ו-0.02 U/mL של אפיראז למאגר של Tyrode שונה. הוסף לאט כמות מחושבת של מאגר משלב 16 על ידי טפטוף במורד הצד של הצינור החרוטי.
- בעזרת קצה חיתוך משופע וקצה פיפטה של 1 מ"ל, השעו בעדינות את הגלולה על ידי פיפטינג בעדינות למעלה ולמטה מספר פעמים.
- הגדר את הנפח ל-300 מיקרוליטר, לחץ על הבוכנה עד הסוף כשהוא מעל קו הנוזל, ואז הנח את הפיפטה מתחת לנוזל והגיע עד לעצירה הראשונה. זה יאפשר למדען להשעות מחדש את הגלולה מבלי ליצור בטעות בועות אוויר שעלולות להפעיל את טסיות הדם.
- מדי פעם, יש טבעת של כדוריות דם אדומות גלויות בתחתית הגלולה. הימנע מהשעיית זה.
- לאחר השעיית הגלולה, השתמש בפיפטה להעברת קדח רחב כדי להעביר את הגלולה המרחפת לצינור חרוטי חדש, ולהשאיר מאחור תאים אדומים או תאים גושים בעליל.
- חזור על שלבים 11-20. הקפד להוסיף 500 ננומטר PGI2 ו-0.02 U/mL ממנה חדשה למאגר של Tyrode שונה (אל תעשה שימוש חוזר במאגר של Tyrode ששונה משלב 18, PGI2 לא יציב מדי).
- קח דגימה לספירת תאים. התאימו את ריכוז הטסיות לפי הצורך עם המאגר של Tyrode שונה.
- השתמש בקצה פיפטה חתוך משופע כדי לקחת דגימה לציטומטריית זרימה.
- הניחו לטסיות לנוח במשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס כדי לאפשר זמן למעכבים להתפוגג ולאפשר לכל טסיות המופעלות באופן הפיך לחזור למצב מנוחה.
- מערבבים בעדינות עם פיפטה רחבה. קח דגימות לציטומטריית זרימה.
- הטסיות השטופות והמנוחה מוכנות כעת לשימוש לניתוח מטבולי.
3. ספירת טסיות דם
- ניתן לספור טסיות דם באמצעות מונה תאי דם אוטומטי (עקוב אחר הוראות היצרן) או המוציטומטר33.
4. ציטומטריית זרימה
- הכנה
- פרוטוקולים מפורטים וסקירות של שיטות עבודה מומלצות להגדרת תערובות נוגדנים והכנת ציטומטר הזרימה למדידת הפעלת טסיות הדם ניתן למצוא במקום אחר34,35.
- דגימה
- בעת לקיחת דגימה לציטומטריית זרימה, אסוף את תרחיף הטסיות באמצעות קצה פיפטה חתוך משופע. הוסיפו את זה לאט לצינור המיקרו-צנטריפוגה עם נוגדנים, ואז החליקו בעדינות כדי לערבב. מניחים לדגור למשך 30 שניות.
- בעזרת קצה פיפטה חתוך משופע, העבירו את תערובת מתלי הטסיות/נוגדנים לבאר מתאימה על צלחת 96 בארות.
- הוסף מיד מקבע לבאר כדי לתקן תאים.
- הפעל על ציטומטר זרימה תוך 8 שעות מרגע הקיבוע.
- בדיקות רגישות לאגוניסטים
- לאחר הכביסה, הניחו בצד 2 צינורות חרוטיים של 15 מ"ל, אחד לבקרת מנוחה ואחד כבקרה המופעלת על ידי תרומבין.
- פיפטה בעדינות 100 מיקרוליטר של תרחיף טסיות לתוך כל צינור חרוטי באמצעות קצה פיפטה חתוך משופע. מניחים לנוח בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- לאחר מנוחה של שעה, הוסף 0.1 U/mL של תרומבין לצינור אחד (הוראות להכנת טרומבין ניתן למצוא בקובץ משלים 1), ורכב לשני. דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 15 דקות.
- קח דגימת זרימה ציטומטרית של כל צינור כדי לקבוע את רגישות הטסיות לאגוניסט.
5. דגימה לניתוח שטף מטבולי כמותי
- מרווה
הערה: כיבוי חילוף החומרים הוא צעד הכרחי למדידת שטפים מטבוליים מדויקים. קירור מהיר של תאים ושמירה על הטמפרטורה שלהם ב-4 מעלות צלזיוס או מתחת לה מאט את חילוף החומרים עד כדי כך שניתן להניח שהוא נעצר כך שהתאים שנדגמו ישקפו במדויק את חילוף החומרים של התאים מהתפזורת. ישנן מגוון שיטות שניתן להשתמש בהן, אך כדי לאזן את הצורך בקירור מהיר ולמזער דליפה, השתמש במי מלח רגילים קרים (-4 מעלות צלזיוס)36. אם מלח יפריע לניתוח שלאחר מכן, ניתן להשתמש בנוזל אחר (מתנול/מים, אתנול וכו')37.- הכן והקפיא כמויות של מי מלח רגילים. הפוך כל תמיסת מלח למחיר פי 6 מנפח הדגימה הרצויה.
הערה: מתכון מי מלח רגיל ניתן למצוא בקובץ משלים 1. - מצננים מראש מיקרו-צנטריפוגה ל-0 מעלות צלזיוס.
- אסוף תרחיף טסיות במי מלח רגילים קפואים חלקית (< -4 מעלות צלזיוס) ביחס של 1:6 (למשל, אסוף 150 מיקרוליטר של תרחיף טסיות ל-750 מיקרוליטר של מי מלח בצינורות מיקרו-צנטריפוגה).
הערה: אין להשאיר את תמיסת טסיות הדם/מי מלח על הקרח למשך יותר מ-15 דקות. - צנטריפוגה בטמפרטורה של 16,000 x גרם, 0 מעלות צלזיוס למשך 10 דקות.
- שמור את הסופרנטנט לניתוח מטבוליט חיצוני, ואת הגלולה למיצוי ומדידה של מטבוליט תוך-תאי. אחסן את שניהם בטמפרטורה של -20 מעלות צלזיוס עד שמוכן לניתוח.
- חזור על תהליך זה על מרווח הזמן הרצוי ומספר נקודות הזמן לדוגמה.
- הכן והקפיא כמויות של מי מלח רגילים. הפוך כל תמיסת מלח למחיר פי 6 מנפח הדגימה הרצויה.
- מיצוי מטבוליט תוך-תאי
- הוסף 0.5 מ"ל של מי מתנול 7:3 מקוררים מראש ב-20 מעלות צלזיוס לגלולה המרווה. מערבולת נמרצת במשך דקה אחת.
- מקפיאים בחנקן נוזלי, מפשירים ב-0 מעלות צלזיוס, ואז חוזרים על הפעולה למשך 2 מחזורים נוספים.
- צנטריפוגה המתלים ב-16,000 x g למשך 10 דקות ב-4 מעלות צלזיוס.
- אספו את הסופרנטנט בצינור מיקרו-צנטריפוגה חדש.
- השתמש בגלולה משלב 3 וחזור על פרוטוקול המיצוי (שלבים 1-3) עם 50:50 מתנול: מים. הוסף את התמצית השנייה שנאספה לראשונה. יבש למשך הלילה.
- השהה מחדש את התמצית המיובשת ב-150 מיקרוליטר של מים בדרגת LC-MS (או ממס אחר המתאים לניתוח המיועד). מערבבים במשך 15 דקות בחום של 4 מעלות צלזיוס. מערבולת קצרה והעברה לצינורות מיקרו-צנטריפוגה של 0.22 מיקרומטר כדי להסיר פסולת תאים. צנטריפוגה למשך 5 דקות בחום של 16,000 x גרם ו-4 מעלות צלזיוס.
- יש להוציא מהצנטריפוגה, להוציא 50 מיקרוליטר מים אופטימיים נוספים על המסנן, ולצנטריפוגה שוב (5 דקות, 16,000 x g ו-4 °C) כדי לשטוף את המסנן. איסוף לניתוח.
תוצאות
התוצאות המייצגות באיור 2 מייצגות 6 תורמי דם שונים, כולל 3 גברים ו-3 נשים. תפוקת הטסיות ביחס לדם מלא מוצגת באיור 2A. ההתאוששות הסופית של טסיות הדם הייתה בממוצע 52% ±-3% (סטיית תקן, n=6). ספירת הטסיות הסופית בהשוואה לזיהום תאי דם לבנים נמדדה באמצעות מנתח המטולוגי אוטומטי. ספירת תאי הדם הלבנים הייתה פחות מ-0.1% מכלל התאים (איור 2B). במהלך תהליך השטיפה והמנוחה של השעה, טסיות הדם שמרו על חשיפה נמוכה ל-P-selectin, אך הגיבו חזק לטיפול בפטרומבין (איור 2C). פיברינוגן קשור עולה לאחר הסיבוב הראשון של 1000 x g, אך חוזר מתחת ל-5% לאחר הסיבוב השני של 1000 x g. בדומה לחשיפה ל-P-selectin, פיברינוגן קשור עולה באופן דרסטי לאחר טיפול בטרומבין לאחר מנוחה של שעה (איור 2D). שער מייצג לגודל, סינגלטים וחיוביות CD42a מוצגים באיור 3A-C. אירועים שעוברים את השערים העוקבים הללו משמשים לחיפוש חשיפה ל-P-selectin ופיברינוגן קשור. שער מייצג עבור טסיות חיוביות P-סלקטין ופיברינוגן חיוביות מוצג באיור 3D-E. איור 3D מציג דגימת טסיות שטופלה בבקרת רכב ואיור 3E מציג דגימת טסיות 15 דקות לאחר הוספת 0.1 U/mL של תרומבין.
טסיות דם שטופות שימשו לביצוע ניסוי קליטה והפרשה כמותית, המוצג באיור 4. טסיות הדם נשטפו, ו-5 ממול/ליטר גלוקוז ו-20 מילימול/ליטר אצטט נוספו לתרחיפים השטופים הסופיים. 0.1 U/mL של תרומבין או רכב נוספו למתלי טסיות דם שטופים לאחר מנוחה של שעה. הדגימות נאספו ורוו כל 15 דקות לאחר הוספת טרומבין למשך 30 דקות. הסופרנטנטים שימשו למדידת שינויים בריכוז הלקטט, הגלוקוז והאצטט החוץ-תאיים באמצעות מבחנים פוטומטריים אוטומטיים. השטף חושב על ידי לקיחת שיפוע הרגרסיה של ריכוז המטבוליט לאורך זמן. איור 4 מציג את שטפי המטבוליטים המחושבים עבור שלושה תורמים מייצגים. שטפי הלקטט עבור כל התורמים היו חיוביים, מה שמצביע על ייצור לקטט, ושטפי הגלוקוז והאצטט היו שליליים, מה שמעיד על צריכתם. אמנם יש שונות בשינוי הקפל, אך הטיפול בטרומבין הוביל לעלייה בעוצמת השטפים בהשוואה למנוחה עבור כל תורם.

איור 2: (A) אחוז הטסיות שהתאוששו ביחס לדם מלא בכל שלב בתהליך הכביסה. n=6, קווי שגיאה מייצגים סטיית תקן. (B) ספירת טסיות דם ותאי לויקוציטים בסוף תהליך הכביסה. (C) אחוז הטסיות החיוביות לביטוי P-Selectin, נמדד על ידי ציטומטריית זרימה. n=6, קווי שגיאה מייצגים סטיית תקן. (D) אחוז טסיות הדם החיוביות לפיברינוגן, נמדד על ידי ציטומטריית זרימה. n=6, קווי שגיאה מייצגים סטיית תקן. . אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: שער מייצג עבור ציטומטריית זרימת טסיות דם. טסיות הדם (A) מגודרות לגודל עם פיזור קדימה (FSC) ופיזור צדדי (SSC), (B) ואז מגודרות לתאים בודדים עם רוחב FSC וגובה FSC, ו-(C) מגודרות עבור חיובי CD42a. אירועים שעוברים את השערים העוקבים הללו משמשים לחיפוש סמני הפעלה. (D) ביטוי P-סלקטין ופיברינוגן עבור דגימת טסיות בקרה במנוחה. סמני ההפעלה הנמדדים כאן הם P-Selectin, PECy5 ו-FITC-Fibrinogen. (E) ביטוי P-סלקטין ופיברינוגן עבור דגימת טסיות דם שטופלה בטרומבין של 0.1 U/mL. סמני ההפעלה הנמדדים כאן הם P-Selectin, PECy5 ו-FITC-Fibrinogen.. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
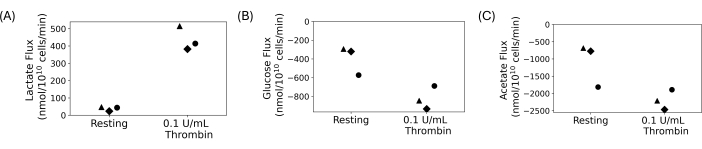
איור 4: (A) שיעורי הפרשת לקטט עבור שלושה תורמים שונים עבור מצב מנוחה ומופעל תרומבין. (B) שיעורי ספיגת גלוקוז עבור שלושה תורמים שונים עבור מצב מנוחה ומופעל על ידי טרומבין. (C) שיעורי ספיגת אצטט עבור שלושה תורמים שונים עבור מצב מנוחה ומופעל תרומבין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
קובץ משלים 1: מתכונים והוראות להכנת מאגר ומגיבים. אנא לחץ כאן להורדת קובץ זה.
Discussion
טסיות הדם רגישות מאוד לסביבתן, כולל מתח גזירה ונוכחות אגוניסטים38,39. זה הופך את טסיות הדם למאתגרות לטיפול ולבידוד, מה שהופך את השימוש במעכבים ופיפטות רחבות קידוח לקריטי40. אחסון והכנה נאותים של PGI2 הם חיוניים, שכן אי הכנת PGI2 ב-PBS בסיסי תגרום להתדרדרות מהירה של PGI241. כדי למזער את הסיכון להפעלה הנגרמת על ידי גזירה, השתמש בפיפטות רחבות, קצות פיפטות חתוכות בשיפוע ומחט פלבוטומיה בגודל 19.
באופן בלתי נמנע, חלק מהטסיות יאבד בכל שלב בתהליך הכביסה (איור 2A). לא כל הטסיות יגיעו לשכבת הפלזמה, ואיסוף פלזמה קרוב מדי לשכבת הפרווה של באפי מסתכן בזיהום תאי דם לבנים. בנוסף, אוכלוסיית טסיות הדם מתגבשת ושוקעת לקרקעית עם ההשעיה מחדש, מה שמדגיש את החשיבות של העברת הכדור המרחף לצינור נקי לאחר כל השעיה מחדש. שימו לב באיור 2D, יש עלייה בקשירת פיברינוגן כמו לאחר הספין הראשון של 1000 x g אשר יורד לאחר הסיבוב השני של 1000 x g. הדגימות לזרימה ציטומטרית נאספו לאחר תקופת מנוחה של 10 דקות בכל מקרה. ייתכן שחלק מאוכלוסייה זו חוזר לטבעו השקט, אך מכיוון שאוכלוסייה זו נוכחת לאחר 10 דקות המנוחה הראשונות, חלק מהאוכלוסייה המופעלת הזו עלול להתגבש וליפול לתחתית הצינור עם ההשעיה.
בעוד שהשימוש בזרימה ציטומטרית אינו הכרחי בהחלט, כדאי לעקוב אם טסיות הדם שקטות ומסוגלות להגיב לאגוניסטים בסוף תהליך הכביסה. בנוסף, במיוחד אם חלק גדול מהטסיות נראה גושי ויזואלית במהלך הכביסה, ביצוע ציטומטריית זרימה בכל שלב יכול לעזור לזהות היכן מתעוררת הבעיה. למרות שזה נדיר, יש לשלול כ-1 מתוך 20 ניסויים של תורמים בגלל הפעלה ספונטנית של טסיות דם במהלך תקופת המנוחה. ניתוח ציטומטריית זרימה של סמני הפעלת טסיות הוא כלי רב ערך לאימות השקט והרגישות לאגוניסט לפני ניסויים הכוללים טסיות דם.
כדי למדוד את תגובת הטסיות לאגוניסט באמצעות ציטומטריית זרימה, מחקרים מסוימים מאפשרים לטסיות לדגור בקוקטייל האגוניסט והנוגדנים למשך 10-30 דקות בטמפרטורת החדר לפני קיבוע 42,43,44. לאחר מנוחה של שעה, דגירה של 20 דקות בטמפרטורת החדר לפני קיבוע טסיות הבקרה במנוחה גורמת להערכת יתר של ההפעלה. הפעלה זו אינה מתרחשת כאשר טסיות הדם מודגרות במשך 20 דקות בטמפרטורה של 37 מעלות צלזיוס, מה שמרמז על כך שהפעלה לכאורה זו מתרחשת מכיוון שהמעכבים התפוגגו ושינוי הטמפרטורה הפתאומי מפעיל את טסיות הדם. המתנה של 20 דקות לתיקון במהלך תהליך הכביסה גם אינה גורמת להפעלה מלאכותית זו, שיכולה לנבוע מהפחתת פעולת המעכבים במהלך מנוחה של שעה. כדי ללכוד את מצב ההפעלה האמיתי של טסיות הדם, מומלץ לבצע את הדגירה ב-37 מעלות צלזיוס או לתקן אותן לאחר דגירה קצרה (30 שניות) בלבד עם נוגדנים.
טסיות דם שטופות מציעות דרך לחקור טסיות דם ללא הפרעה של תאי דם אחרים ורכיבי פלזמה. הם אידיאליים למחקרים בהם יש לתפעל את הסביבה החוץ-תאית, כולל מחקרים מטבוליים. הצפיפות של תרחיף הטסיות הסופי ניתנת לכוונון וניתנת לשליטה כדי למזער את השונות בספירת הטסיות בין אנשים. עבור מחקרים מטבוליים, ניתן לשלוט בריכוזים מותאמים אישית של מצעי פחמן טסיות דם. התוצאות המייצגות המוצגות באיור 4 הן מניסוי קליטה והפרשה שבו נוספו גלוקוז ואצטט כמצעי פחמן, והופק לקטט. בעוד שקיימת שונות ביולוגית בין התורמים באיור 4, ייצור הלקטט עולה עם הטיפול בטרומבין, בעוד שצריכת הגלוקוז והאצטט עולה. זה מסכים עם הספרות; טסיות דם ידועות כמגבירות את קצב הגליקוליזה האירובית והזרחון החמצוני שלהן עם ההפעלה 13,14,15,45. ניתן ליישם טכניקה זו לחקר טסיות דם בתנאי תזונה שונים או עם יונים שונים בתרחיף הטסיות הסופי.
בעוד שמחקרי טסיות דם שטופים הם בעלי ערך, חשוב לזכור שהסביבה המלאכותית אינה מסכמת את הסביבה in vivo. לכן, יש להשתמש בטסיות שטופות רק במצבים שבהם החוקרים מעוניינים בתפקוד הטסיות בלבד. כמו בכל מחקרי מבחנה , יש לפרש את התוצאות בזהירות. מומלץ להשהות מחדש את הטסיות במאגר Tyrode מותאם עם ריכוז סידן של 2 מ"מ לאחר השטיפה הסופית. ביטוי ה-P-סלקטין וביטוי הקישור של פיברינוגן נמדד רק עד 1.5 שעות לאחר תהליך הכביסה (2.5 שעות כולל שעת מנוחה), ולכן מומלץ למדען להשתמש בתרחיף הטסיות השטוף בתוך חלון הזמן הזה, או לאמת בדרך אחרת את נאמנות הטסיות. מחקר זה לא מדד מדדים קלאסיים אחרים של פונקציונליות טסיות דם, כגון צבירה.
טסיות דם שטופות שהוכנו עם הפרוטוקול שלנו הן שקטות ומאומתות על ידי מדידות זרימה ציטומטריות של P-סלקטין ופיברינוגן. ניתן לשלוט במדויק על המצעים המטבוליים, ההורמונים ואגוניסטים של טסיות הדם בסביבה החוץ-תאית, מה שמאפשר למדען לחקור את חילוף החומרים של טסיות הדם במערכת לבחירתו.
Disclosures
למחברים אין ניגוד אינטרסים לדווח.
Acknowledgements
המחברים מבקשים להודות לד"ר אמילי ג'אנוס-בל וקלריס מוריו ממעבדתם של ד"ר פייר מנגין וקתרינה ברק ממעבדתו של ד"ר חורחה דיפאולה על הדרכתם ועצתם.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
References
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved