Method Article
Vorbereitung von gewaschenen menschlichen Blutplättchen für quantitative Stoffwechselflussstudien
In diesem Artikel
Zusammenfassung
Der Thrombozytenstoffwechsel ist von Interesse, insbesondere da er sich auf die Rolle der Hyper- und Hypoaktivität von Blutplättchen bei Blutungen und thrombotischen Erkrankungen bezieht. Die Isolierung von Blutplättchen aus dem Plasma ist für einige metabolische Assays notwendig. Hier wird ein Verfahren zur Isolierung intrazellulärer Metaboliten aus gewaschenen Blutplättchen vorgestellt.
Zusammenfassung
Blutplättchen sind Blutzellen, die eine wesentliche Rolle bei der Blutstillung und der angeborenen Immunantwort spielen. Hyper- und Hypoaktivität von Blutplättchen wurde mit Stoffwechselstörungen in Verbindung gebracht, was das Risiko für Thrombosen und Blutungen erhöht. Die Aktivierung der Blutplättchen und der Stoffwechsel sind eng miteinander verknüpft, wobei es zahlreiche Methoden zur Messung der ersteren gibt, aber relativ wenige für die letzteren. Um den Thrombozytenstoffwechsel ohne die Interferenz anderer Blutzellen und Plasmabestandteile zu untersuchen, müssen Blutplättchen isoliert werden, ein Prozess, der aufgrund der Scherempfindlichkeit der Blutplättchen und der Fähigkeit, irreversibel zu aktivieren, nicht trivial ist. Hier wird ein Protokoll für die Thrombozytenisolierung (Waschen) vorgestellt, das ruhende Thrombozyten erzeugt, die empfindlich auf Stimulation durch Thrombozytenagonisten reagieren. In aufeinanderfolgenden Zentrifugationsschritten werden Thrombozyten unter Zugabe von Thrombozyteninhibitoren aus dem Vollblut isoliert und in einem kontrollierten, isosmotischen Puffer resuspendiert. Diese Methode führt reproduzierbar zu einer 30%-40%igen Rückgewinnung von Blutplättchen aus Vollblut mit geringer Aktivierung, gemessen anhand von Markern der Granulatsekretion und der Integrinaktivität. Die Thrombozytenzahl und die Kraftstoffkonzentration können präzise gesteuert werden, so dass der Benutzer eine Vielzahl von Stoffwechselsituationen untersuchen kann.
Einleitung
Blutplättchen sind kleine Zellen (2–4 μm Durchmesser), die eine wichtige Rolle bei der Blutstillung spielen, dem streng regulierten Prozess der Gerinnselbildung1. Blutplättchen sind zwar für die Gefäßintegrität von entscheidender Bedeutung, aber auch an unerwünschten gesundheitlichen Ereignissen beteiligt. Blutplättchen sind an tiefen Venenthrombosen (TVT) und arteriellen Thrombosen (AT) beteiligt, bei denen es sich um Blutgerinnsel handelt, die Blutgefäße verschließen und lokal zu einer verminderten Blutversorgung führen, oder, wenn Teile des Gerinnsels abbrechen (embolisieren), die Blutversorgung der Lunge, des Herzens oder des Gehirns blockierenkönnen 2,3,4,5,6,7 . Thrombozytenhyperreaktivität ist eine Komorbidität von Bluthochdruck, Diabetes und Krebs, die zu einer erhöhten Inzidenz von TVT und AT 8,9,10 führt. Die Thrombozytenaktivierung und der Metabolismus sind eng miteinander verknüpft11,12, was zu einem erhöhten Interesse an der Ausrichtung des Thrombozytenstoffwechsels als therapeutische Strategie führt13,14. Es gibt eine Debatte über die genaue metabolische Neuverdrahtung, die bei der Aktivierung stattfindet, und dies ist ein aktives Forschungsfeld15. Dieses gestiegene Interesse an der Thrombozytendysfunktion bei Krankheiten und ihren Verbindungen zum Stoffwechsel unterstreicht die Notwendigkeit einer wiederholbaren Methode zur Isolierung von Blutplättchen und zur Untersuchung ihres Stoffwechsels.
Menschliche Blutplättchen werden in der Regel durch Venenpunktion gewonnen und dann aus Vollblut isoliert. Gewaschene Blutplättchen werden durch aufeinanderfolgende Wasch- und Zentrifugationsschritte16 vom Vollblut getrennt. Dies wurde ursprünglich von Mustards Gruppe17 gemacht und von Cazenaves Gruppe18 leicht modifiziert. Eine weitere Alternative sind gelfiltrierte Blutplättchen, die aus plättchenreichem Plasma (PRP) durch Größenausschlusschromatographie unter Verwendung einer gepackten Säule von Agarose-Gelkügelchengewonnen werden können 19. Es gibt viele Waschprotokolle sowohl für menschliches als auch für Nagetierblut, die für verschiedene Assays optimiert sind 20,21,22,23, jedoch nicht für die Messung des Thrombozytenstoffwechsels.
Zu den Techniken zur Untersuchung des Thrombozytenstoffwechsels gehören bioenergetische Messungen mit dem Seahorse XF-Analysator 11,24,25,26,27, extrazelluläre Flussmessungen 11,13,24, Metabolomik 14,28 und isotopengestützte Stoffwechselflussanalyse (13C-MFA)29. In metabolomischen Studien besteht das Ziel typischerweise darin, veränderte Signalwege zwischen zwei verschiedenen Zuständen zu bestimmen (z. B. Ruhezustand vs. aktivierte Blutplättchen14). Metabolomische Studien beinhalten den Einsatz von Flüssigkeitschromatographie-Massenspektrometrie (LC-MS). Diese Studien können für intra- oder extrazelluläre Metaboliten durchgeführt werden und sind häufig mit einer Signalweganalyse oder einer Hauptkomponentenanalyse (PCA) gekoppelt14,28. Bei der isotopengestützten Stoffwechselflussanalyse (13C-MFA) werden Zellen mit einem markierten Substrat, einem sogenannten Tracer, füttert und gemessen, wie sich dieser Tracer durch ein Reaktionsnetzwerk mit LC-MS ausbreitet. Diese Technik ermöglicht die Berechnung von Flüssen durch Stoffwechselwege mit einer Auflösung auf Reaktionsebene 29,30. In Vollblut und plättchenreichem Plasma (PRP) unterliegt die Kraftstoffkonzentration (Glukose, Glutamin, Acetat usw.) einer Variabilität von Spender zu Spender, und das im Plasma vorhandene Albumin und Sexualhormon-bindendes Globulin kann die aktive Konzentration von Hormonen, Arzneimitteln und anderen biologisch relevanten Molekülen verändern31. Gewaschene Blutplättchen bieten ein Verfahren zur Suspendierung von Blutplättchen in einem benutzerdefinierten Medium, einschließlich bekannter Brennstoffkonzentrationen, das mit 13C-MFA32 kompatibel ist.
Hier wird ein Verfahren zur Thrombozytenwäsche beschrieben, um Blutplättchen herzustellen, die in Stoffwechselassays verwendet werden können. Das Protokoll produziert ruhende Blutplättchen mit geringer Kontamination der roten und weißen Blutkörperchen. Der Status der Thrombozytenaktivierung wurde mittels Durchflusszytometrie von Thrombozytenaktivierungsmarkern überwacht. Dieses Protokoll erreicht reproduzierbar eine Thrombozytenwiederherstellung von mindestens 30 % bis 40 % im Verhältnis zur Thrombozytenzahl im Vollblut. Die mit dieser Technik erhaltenen gewaschenen Blutplättchen eignen sich für die Stoffwechselanalysetechniken, und die Methode zur Extraktion intrazellulärer Metaboliten kann auf die Analyse nach Wahl des Benutzers zugeschnitten werden (LC-MS, GC-MS, photometrischer Assay usw.).
Protokoll
Die Studie wurde vom Institutional Review Board vom Anschutz Medical Campus der University of Colorado genehmigt. Von allen Studienteilnehmern wurde eine schriftliche Einwilligung eingeholt. Die Teilnehmer gaben an, in den letzten 48 Stunden keinen Alkohol oder in den letzten zehn Tagen nichtsteroidale Antirheumatika (NSAIDs) konsumiert zu haben. Dieses Projekt wird vom National Heart, Lung, and Blood Institute der National Institutes of Health unter der Fördernummer R61HL141794 unterstützt.
1. Blutentnahme
- Für die Blutabnahme einrichten. Es wird empfohlen, die Blutentnahme von einem ausgebildeten Phlebotomisten durchführen zu lassen.
- Führen Sie eine Venenpunktion am Innenarm mit einer 19 G Nadel durch.
- Sammeln Sie die ersten ~2 mL in einem zusatzstofffreien Vacutainer und entsorgen Sie sie. Dies dient dazu, chemische Signalmoleküle aus geschädigten Endothelzellen zu entfernen, die Blutplättchen aktivieren können. Nachdem die ersten 2 ml entnommen wurden, entfernen Sie das Tourniquet, um die Scherbelastung der Blutplättchen zu reduzieren.
- Sammeln Sie den Rest des Blutes in Antiokoagulenten-Citrat-Dextrose-Vakutainern (ACD-A) im Verhältnis 14:3 (Blut:ACD-A). Drehen Sie jeden Vacutainer nach der Blutentnahme vorsichtig um, um Blut und Antikoagulans zu mischen.
2. Waschen von Blutplättchen
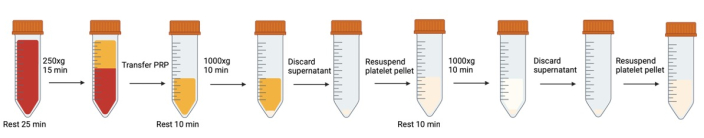
Abbildung 1: Aufeinanderfolgende Zentrifugations- und Resuspensionsschritte bei der Thrombozytenwaschung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Vermeiden Sie die Bildung von Luftblasen. Verwenden Sie Transferpipetten, um Blasen zu entfernen, wenn sie gebildet werden, insbesondere vor dem Zentrifugieren. Jedes Mal, wenn die Röhrchen mit Blut/Blutplättchen geöffnet/geschlossen werden, wird empfohlen, vor dem Schließen der Kappe in das Röhrchen zu atmen, um den CO2 - Gehalt zu erhöhen.
- Zentrifuge auf 37 °C vorheizen, um Temperatureffekte zu reduzieren. Zwischen den einzelnen Zentrifugationsschritten des Protokolls ist die Zentrifuge auf 37 °C zu halten.
- Das Wasserbad auf 37 °C vorheizen. Geben Sie den modifizierten Tyrode-Puffer mit Glukose in das Wasserbad.
HINWEIS: Das geänderte Pufferrezept von Tyrode finden Sie in der Zusatzdatei 1. - Kombinieren Sie das gesammelte Vollblut aus allen Vacutainern in konische 50-ml-Polypropylen-Röhrchen. Entnehmen Sie mit einer abgeschrägten Pipettenspitze, die in einem Winkel von 45° geschnitten ist, ein geeignetes Probenvolumen, um eine Zellzählung durchzuführen (siehe Zellzählung).
- Entfernen Sie alle Blasen, die durch vorsichtiges Absaugen mit einer Transferpipette mit schmaler Bohrung entstehen.
- Lassen Sie das Blut 25 Minuten lang bei 37 °C im Wasserbad ruhen. Dadurch können Blutplättchen in einem reversibel aktivierten Zustand (von der Entnahme aus dem Körper, der Übertragung von Tube zu Tube usw.) in einen Ruhezustand zurückkehren.
- Um eine Aktivierung während der Zentrifugation zu verhindern, geben Sie 500 nM Prostaglandin I2 (PGI2) und 0,02 U/ml Apyrase in das Vollblut und mischen Sie es vorsichtig, indem Sie es einmal invertieren. Entfernen Sie alle Blasen, die mit einer Transferpipette mit schmaler Bohrung entstanden sind.
HINWEIS: Eine Anleitung für das richtige Rezept fürg.g.g.A. 2 und Apyrase finden Sie in der Zusatzdatei 1. - Zentrifugieren Sie Vollblut, um plättchenreiches Plasma (PRP) zu erhalten (15 Minuten bei 250 x g für 42 ml Vollblut) ohne Bremse (37 °C).
- Sammeln Sie das PRP (obere gelbe Schicht über dem Buffy Coat und der roten Blutschicht) vorsichtig mit einer Transferpipette mit breiter Bohrung in ein neues konisches 50-ml-Röhrchen.
- Kippen Sie beim Übertragen ein sauberes konisches Rohr und führen Sie das PRP vorsichtig an der Seite des Rohrs entlang. Vermeiden Sie Luftblasen.
- Lassen Sie ca. 3 mm PRP zurück, um das Buffy Coat (die Schicht der weißen Blutkörperchen zwischen dem PRP und dem roten Blut) nicht zu stören. Wenn dies gestört wird, sieht es aus wie ein plötzlicher weißer Wirbel in der Transferpipette.
- Nehmen Sie die Zellzahl (siehe Zählen von Blutplättchen), um das Resuspensionsvolumen für den nächsten Waschschritt zu bestimmen.
- 10 Minuten bei 37 °C ruhen lassen.
- Entnehmen Sie mit einer abgeschrägten Pipettenspitze eine Probe für die Durchflusszytometrie (siehe Durchflusszytometrie).
- Geben Sie 500 nM PGI2 und 0,02 U/ml-Apyrase zu PRP und mischen Sie durch vorsichtiges Umdrehen.
- 10 Minuten bei 1000 x g bei 37 °C zentrifugieren (Beschleunigung:0 Bremse: 0). Bremse nicht verwenden. Das Pellet ist nicht kompakt und ein plötzliches Bremsen kann zu einer erneuten Vermischung führen.
- Während des Zentrifugierens das Resuspensionsvolumen bestimmen. Gehen Sie von einer Rückgewinnung von 75 % aus. Stellen Sie die Zelldichte auf ca. 3x105 Zellen/μl her.
- Der Überstand wird mit einer Kunststoffpipette mit breiter Bohrung für das Schüttvolumen und einer 1-ml-Pipette (ungeschnittene Spitze) für den Rest der Flüssigkeit in der Nähe des Pellets aspiriert. Vermeiden Sie es, die Pellets am Boden des Rohrs zu berühren.
- Geben Sie 500 nM PGI2 und 0,02 U/ml Apyrase zu modifiziertem Tyrode-Puffer. Fügen Sie langsam die berechnete Menge des Puffers aus Schritt 16 hinzu, indem Sie an der Seite des konischen Rohrs herunterrieseln.
- Verwenden Sie eine abgeschrägte Spitze und eine 1-ml-Pipettenspitze, indem Sie das Pellet vorsichtig mehrmals auf und ab pipettieren.
- Stellen Sie das Volumen auf 300 μl ein, drücken Sie den Kolben ganz durch, während Sie sich über der Flüssigkeitslinie befinden, platzieren Sie die Pipette unter der Flüssigkeit und kommen Sie bis zum ersten Anschlag. Auf diese Weise kann der Wissenschaftler das Pellet resuspendieren, ohne versehentlich Luftblasen zu erzeugen, die die Blutplättchen aktivieren können.
- Gelegentlich befindet sich am Boden des Pellets ein Ring aus sichtbaren roten Blutkörperchen. Vermeiden Sie es, dies erneut zu unterbrechen.
- Sobald das Pellet resuspendiert ist, verwenden Sie eine Transferpipette mit breiter Bohrung, um das resuspendierte Pellet in ein neues konisches Röhrchen zu übertragen, wobei alle roten Blutkörperchen oder sichtbar verklumpten Zellen zurückbleiben.
- Wiederholen Sie die Schritte 11-20. Stellen Sie sicher, dass Sie 500 nM PGI2 und 0,02 U/ml aus einem frischen Aliquot in den modifizierten Tyrode-Puffer geben (verwenden Sie den modifizierten Tyrode-Puffer aus Schritt 18 nicht wieder, PGI2 ist zu instabil).
- Entnehmen Sie eine Probe für eine Zellzählung. Passen Sie die Thrombozytenkonzentration nach Bedarf mit modifiziertem Tyrode-Puffer an.
- Verwenden Sie eine Pipettenspitze mit abgeschrägtem Schnitt, um eine Probe für die Durchflusszytometrie zu entnehmen.
- Lassen Sie die Blutplättchen 1 h bei 37 °C ruhen, damit die Inhibitoren nachlassen können und alle reversibel aktivierten Blutplättchen in einen Ruhezustand zurückkehren können.
- Vorsichtig mit einer Pipette mit breitem Durchgang mischen. Entnahme von Proben für die Durchflusszytometrie.
- Die gewaschenen, ruhenden Blutplättchen sind nun bereit, für die Stoffwechselanalyse verwendet zu werden.
3. Zählen von Blutplättchen
- Blutplättchen können entweder mit einem automatisierten Blutkörperchenzähler (befolgen Sie die Anweisungen des Herstellers) oder einem Hämozytometer33 gezählt werden.
4. Durchflusszytometrie
- Präparat
- Detaillierte Protokolle und Übersichten über Best Practices für die Einrichtung von Antikörpermischungen und die Vorbereitung des Durchflusszytometers zur Messung der Thrombozytenaktivierung finden Sie an anderer Stelle34,35.
- Probenahme
- Wenn Sie eine Probe für die Durchflusszytometrie entnehmen, entnehmen Sie die Thrombozytensuspension mit einer abgeschrägten Pipettenspitze. Geben Sie dies langsam in das Mikrozentrifugenröhrchen mit den Antikörpern und schnippen Sie dann vorsichtig zum Mischen. 30 s inkubieren lassen.
- Übertragen Sie die Thrombozytensuspension/Antikörpermischung mit einer abgeschrägten Pipettenspitze in die entsprechende Vertiefung auf der 96-Well-Platte.
- Geben Sie sofort Fixiermittel in die Vertiefung, um die Zellen zu fixieren.
- Innerhalb von 8 Stunden nach der Fixierung auf dem Durchflusszytometer laufen lassen.
- Empfindlichkeitstests für Agonisten
- Stellen Sie nach dem Waschen 2 konische Röhrchen zu 15 ml beiseite, eines für eine Ruhekontrolle und eines für eine Thrombin-aktivierte Kontrolle.
- Pipettieren Sie vorsichtig 100 μl Thrombozytensuspension mit einer abgeschrägten Pipettenspitze in jedes konische Röhrchen. Bei 37 °C 1 h ruhen lassen.
- Nach der einstündigen Pause geben Sie 0,1 U/ml Thrombin in ein Röhrchen (Anweisungen zur Thrombinvorbereitung finden Sie in der Zusatzdatei 1) und das Vehikel in das andere. Bei 37 °C 15 min inkubieren.
- Entnehmen Sie von jedem Röhrchen eine Durchflusszytometrie-Probe, um die Thrombozytenempfindlichkeit gegenüber Agonisten zu bestimmen.
5. Probenahme für die quantitative Stoffwechselflussanalyse
- Abschrecken
HINWEIS: Das Löschen des Stoffwechsels ist ein notwendiger Schritt zur Messung genauer Stoffwechselflüsse. Das schnelle Abkühlen der Zellen und das Halten ihrer Temperatur auf oder unter 4 °C verlangsamt den Stoffwechsel so sehr, dass davon ausgegangen werden kann, dass er im Wesentlichen gestoppt ist, so dass die beprobten Zellen den Stoffwechsel der Zellen aus der Masse genau widerspiegeln. Es gibt eine Vielzahl von Methoden, die verwendet werden können, aber um die Notwendigkeit einer schnellen Abkühlung und die Minimierung von Leckagen auszugleichen, verwenden Sie kalte (-4 °C) normale Kochsalzlösung36. Wenn Salz die anschließende Analyse beeinträchtigt, kann eine andere Flüssigkeit verwendet werden (Methanol/Wasser, Ethanol usw.)37. Urheberrecht- Aliquots von normaler Kochsalzlösung vorbereiten und einfrieren. Machen Sie jede Kochsalzlösung aliquot im 6-fachen Volumen der gewünschten Probe.
HINWEIS: Das normale Kochsalzrezept finden Sie in der Zusatzdatei 1. - Mikrozentrifuge auf 0 °C vorkühlen.
- Sammeln Sie Thrombozytensuspension in teilweise gefrorener normaler Kochsalzlösung (< -4 °C) im Verhältnis 1:6 (z. B. sammeln Sie 150 μl Thrombozytensuspension in 750 μl Kochsalzlösung in Mikrozentrifugenröhrchen).
HINWEIS:Lassen Sie die Thrombozyten-/Kochsalzlösung nicht länger als 15 Minuten auf Eis. - Zentrifugieren bei 16.000 x g, 0 °C für 10 min.
- Bewahren Sie den Überstand für die externe Metabolitenanalyse und das Pellet für die Extraktion und Messung intrazellulärer Metaboliten auf. Beide werden bis zur Analyse bei -20 °C gelagert.
- Wiederholen Sie diesen Vorgang über das gewünschte Zeitintervall und die gewünschte Anzahl von Abtastzeitpunkten.
- Aliquots von normaler Kochsalzlösung vorbereiten und einfrieren. Machen Sie jede Kochsalzlösung aliquot im 6-fachen Volumen der gewünschten Probe.
- Intrazelluläre Metaboliten-Extraktion
- Geben Sie 0,5 mL vorgekühltes 7:3 Methanol-Wasser bei -20 °C in das abgeschreckte Pellet. 1 Minute lang kräftig vortexen.
- In flüssigem Stickstoff einfrieren, bei 0 °C auftauen und dann für 2 weitere Zyklen wiederholen.
- Die Suspensionen werden bei 16.000 x g 10 Minuten lang bei -4 °C zentrifugiert.
- Sammeln Sie den Überstand in einem neuen Mikrozentrifugenröhrchen.
- Verwenden Sie das Pellet aus Schritt 3 und wiederholen Sie das Extraktionsprotokoll (Schritte 1-3) mit 50:50 Methanol:Wasser. Fügen Sie den zweiten gesammelten Extrakt zum ersten hinzu. Über Nacht trocknen.
- Resuspendieren Sie den getrockneten Extrakt in 150 μl Wasser der LC-MS-Qualität (oder einem anderen für die beabsichtigte Analyse geeigneten Lösungsmittel). 15 Minuten bei 4 °C mixen. Kurz vortexen und in 0,22 μm Mikrozentrifugenröhrchen umfüllen, um Zelltrümmer zu entfernen. 5 Minuten bei 16.000 x g und 4 °C zentrifugieren.
- Aus der Zentrifuge nehmen, weitere 50 μl Optima-Wasser auf den Filter pipettieren und erneut zentrifugieren (5 min, 16.000 x g und 4 °C), um den Filter zu spülen. Sammeln Sie für die Analyse.
Ergebnisse
Die repräsentativen Ergebnisse in Abbildung 2 repräsentieren 6 verschiedene Blutspender, darunter 3 Männer und 3 Frauen. Die Thrombozytenausbeute im Verhältnis zum Vollblut ist in Abbildung 2A dargestellt. Die endgültige Thrombozytenerholung betrug durchschnittlich 52 % ± 3 % (Standardabweichung, n=6). Die endgültige Thrombozytenzahl im Vergleich zur Kontamination der weißen Blutkörperchen wurde mit einem automatisierten Hämatologie-Analysator gemessen. Die Anzahl der weißen Blutkörperchen betrug weniger als 0,1 % der Gesamtzellen (Abbildung 2B). Während des Waschvorgangs und der einstündigen Ruhezeit behielten die Blutplättchen eine geringe P-Selektin-Exposition bei, sprachen aber stark auf die Thrombinbehandlung an (Abbildung 2C). Das gebundene Fibrinogen steigt nach dem ersten Spin von 1000 x g an, kehrt aber nach dem zweiten Spin von 1000 x g auf unter 5% zurück. Wie die P-Selektin-Exposition steigt auch das gebundene Fibrinogen nach der Thrombinbehandlung nach der einstündigen Ruhezeit drastisch an (Abbildung 2D). Repräsentative Gating für Größe, Einzelteile und CD42a-Positivität sind in Abbildung 3A-C dargestellt. Ereignisse, die diese aufeinanderfolgenden Gatter passieren, werden verwendet, um nach P-Selektin-Exposition und gebundenem Fibrinogen zu suchen. Repräsentative Gating für P-Selektin-positive und Fibrinogen-positive Thrombozyten sind in Abbildung 3D-E dargestellt. Abbildung 3D zeigt eine Thrombozytenprobe, die mit Vehikelkontrolle behandelt wurde, und Abbildung 3E zeigt eine Thrombozytenprobe 15 Minuten nach Zugabe von 0,1 U/ml Thrombin.
Gewaschene Blutplättchen wurden verwendet, um ein quantitatives Aufnahme- und Ausscheidungsexperiment durchzuführen, das in Abbildung 4 dargestellt ist. Die Blutplättchen wurden gewaschen und 5 mmol/l Glukose und 20 mmol/l Acetat wurden zu den endgewaschenen Suspensionen hinzugefügt. 0,1 U/ml Thrombin oder Vehikel wurden nach einer Stunde Pause zu gewaschenen Thrombozytensuspensionen gegeben. Die Proben wurden entnommen und alle 15 Minuten nach Thrombinzugabe für 30 Minuten abgeschreckt. Die Überstände wurden verwendet, um Änderungen der Konzentration von extrazellulärem Laktat, Glukose und Acetat mit automatisierten photometrischen Assays zu messen. Der Fluss wurde berechnet, indem die Regressionssteigung der Konzentration des Metaboliten über die Zeit genommen wurde. Abbildung 4 zeigt die berechneten Metabolitenflüsse für drei repräsentative Donatoren. Die Laktatflüsse für alle Spender waren positiv, was darauf hindeutet, dass Laktat produziert wurde, und die Glukose- und Acetatflüsse waren negativ, was darauf hindeutet, dass sie konsumiert wurden. Während es Unterschiede in der Faltenveränderung gibt, führte die Thrombinbehandlung bei jedem Spender zu einer Zunahme der Größe der Flussmittel im Vergleich zur Ruhe.

Abbildung 2: (A) Prozentsatz der wiedergewonnenen Blutplättchen im Verhältnis zum Vollblut bei jedem Schritt des Waschvorgangs. n=6, Fehlerbalken stellen die Standardabweichung dar. (B) Thrombozyten- und Leukozytenzellzahl am Ende des Waschvorgangs. (C) Prozentsatz der Thrombozyten, die positiv für die P-Selektin-Expression sind, gemessen durch Durchflusszytometrie. n=6, Fehlerbalken stellen die Standardabweichung dar. (D) Prozentsatz der Thrombozyten, die positiv auf Fibrinogen sind, gemessen durch Durchflusszytometrie. n=6, Fehlerbalken stellen die Standardabweichung dar. . Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentatives Gating für die Thrombozyten-Durchflusszytometrie. Die Thrombozyten sind (A) für die Größe mit Vorwärtsstreuung (FSC) und Seitenstreuung (SSC) begrenzt, (B) dann für einzelne Zellen mit FSC-Breite und FSC-Höhe und (C) für CD42a-Positivität begrenzt. Ereignisse, die diese aufeinanderfolgenden Gatter passieren, werden verwendet, um nach Aktivierungsmarkierungen zu suchen. (D) P-Selektin- und Fibrinogen-Expression für eine Thrombozytenprobe der Ruhekontrolle. Die hier gemessenen Aktivierungsmarker sind P-Selectin, PECy5 und FITC-Fibrinogen. (E) P-Selektin- und Fibrinogen-Expression für eine mit 0,1 U/ml Thrombin behandelte Thrombozytenprobe. Aktivierungsmarker, die hier gemessen werden, sind P-Selectin, PECy5 und FITC-Fibrinogen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
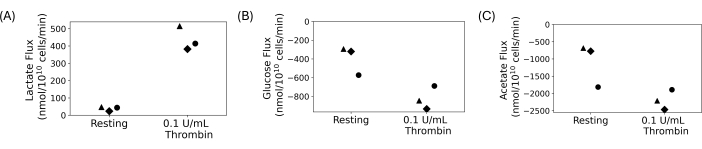
Abbildung 4: (A) Laktatausscheidungsraten für drei verschiedene Spender in einem ruhenden und thrombinaktivierten Zustand. (B) Glukoseaufnahmeraten für drei verschiedene Spender für einen ruhenden und thrombinaktivierten Zustand. (C) Acetat-Aufnahmeraten für drei verschiedene Spender für einen ruhenden und thrombinaktivierten Zustand. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei 1: Rezepte und Anweisungen zur Zubereitung von Puffern und Reagenzien. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Blutplättchen reagieren sehr empfindlich auf ihre Umgebung, einschließlich Scherspannung und Vorhandensein von Agonisten 38,39. Dies macht die Handhabung und Isolierung von Blutplättchen schwierig, so dass die Verwendung von Inhibitoren und Pipetten mit breitem Durchgang von entscheidender Bedeutungist 40. Die richtige Lagerung und Zubereitung von PGI2 ist von entscheidender Bedeutung, da die Nichtherstellung von PGI2 in basischem PBS zu einem schnellen Abbau von PGI241 führt. Um das Risiko einer scherinduzierten Aktivierung zu minimieren, verwenden Sie Pipetten mit breiter Bohrung, Pipettenspitzen mit Schrägschnitt und eine 19-Gauge-Phlebotomienadel.
Es ist unvermeidlich, dass bei jedem Schritt des Waschvorgangs ein Teil der Blutplättchen verloren geht (Abbildung 2A). Nicht alle Blutplättchen landen in der Plasmaschicht, und das Sammeln von Plasma zu nahe an der Buffy-Coat-Schicht riskiert eine Kontamination der weißen Blutkörperchen. Darüber hinaus verklumpt eine Population von Blutplättchen und sinkt bei der Resuspension zu Boden, was die Bedeutung des Transfers des resuspendierten Pellets in ein sauberes Röhrchen nach jeder Resuspension unterstreicht. Beachten Sie, dass in Abbildung 2D die Fibrinogenbindung nach dem ersten 1000 x g Spin zunimmt, der dann nach dem zweiten 1000 x g Spin abnimmt. Die Proben für die Durchflusszytometrie wurden jeweils nach einer 10-minütigen Ruhephase entnommen. Es ist möglich, dass ein Teil dieser Population seine Ruhenatur wiedererlangt, aber da diese Population nach der ersten 10-minütigen Pause vorhanden ist, kann ein Teil dieser aktivierten Population verklumpen und bei der Resuspension auf den Boden der Röhre fallen.
Obwohl der Einsatz von Durchflusszytometrie nicht unbedingt erforderlich ist, ist es von Vorteil, zu überwachen, ob die Blutplättchen ruhig sind und am Ende des Waschvorgangs auf Agonisten reagieren können. Insbesondere wenn ein großer Teil der Blutplättchen während des Waschens optisch verklumpt erscheint, kann die Durchführung einer Durchflusszytometrie bei jedem Schritt dabei helfen, festzustellen, wo das Problem auftritt. Obwohl dies ungewöhnlich ist, muss etwa 1 von 20 Spenderexperimenten aufgrund einer spontanen Thrombozytenaktivierung während der Ruhephase ausgeschlossen werden. Die durchflusszytometrische Analyse von Thrombozytenaktivierungsmarkern ist ein wertvolles Instrument, um die Ruhe und Empfindlichkeit gegenüber Agonisten vor Experimenten mit Blutplättchen zu validieren.
Um die Thrombozytenreaktion auf Agonisten mittels Durchflusszytometrie zu messen, lassen einige Studien die Blutplättchen 10-30 Minuten lang bei Raumtemperatur im Agonisten-Antikörper-Cocktail inkubieren, bevor sie fixieren 42,43,44. Nach der einstündigen Pause führt eine 20-minütige Inkubation bei Raumtemperatur vor dem Fixieren der Ruhekontrollplättchen zu einer Überschätzung der Aktivierung. Diese Aktivierung tritt nicht auf, wenn die Blutplättchen 20 Minuten lang bei 37 °C inkubiert werden, was darauf hindeutet, dass diese scheinbare Aktivierung auftritt, weil die Inhibitoren nachgelassen haben und die plötzliche Temperaturänderung die Blutplättchen aktiviert. Das Warten von 20 Minuten auf die Fixierung während des Waschvorgangs induziert auch nicht diese künstliche Aktivierung, was auf eine Abschwächung der Wirkung der Inhibitoren während der einstündigen Ruhezeit zurückzuführen sein könnte. Um den wahren Aktivierungszustand der Blutplättchen zu erfassen, wird empfohlen, die Inkubation bei 37 °C durchzuführen oder sie nach nur einer kurzen (30 Sekunden) Inkubation mit Antikörpern zu fixieren.
Gewaschene Blutplättchen bieten eine Möglichkeit, Blutplättchen ohne die Interferenz anderer Blutzellen und Plasmabestandteile zu untersuchen. Sie sind ideal für Studien, bei denen die extrazelluläre Umgebung manipuliert werden muss, einschließlich Stoffwechselstudien. Die Dichte der endgültigen Thrombozytensuspension ist einstellbar und kann kontrolliert werden, um die Variabilität der Thrombozytenzahl zwischen den Menschen zu minimieren. Für metabolische Studien können benutzerdefinierte Konzentrationen von Thrombozyten-Kohlenstoffsubstraten kontrolliert werden. Die repräsentativen Ergebnisse in Abbildung 4 stammen aus einem Aufnahme- und Ausscheidungsexperiment, bei dem Glukose und Acetat als Kohlenstoffsubstrate zugegeben und Laktat hergestellt wurde. Während es in Abbildung 4 eine biologische Variabilität zwischen den Spendern gibt, steigt die Laktatproduktion nach der Thrombinbehandlung, während der Glukose- und Acetatverbrauch zunimmt. Dies stimmt mit der Literatur überein; Es ist bekannt, dass Blutplättchen ihre Rate der aeroben Glykolyse und oxidativen Phosphorylierung nach Aktivierung erhöhen 13,14,15,45. Diese Technik kann angewendet werden, um Blutplättchen unter verschiedenen Nährstoffbedingungen oder mit unterschiedlichen Ionen in der endgültigen Thrombozytensuspension zu untersuchen.
Obwohl Studien an gewaschenen Blutplättchen wertvoll sind, ist es wichtig zu bedenken, dass die künstliche Umgebung die Umgebung in vivo nicht rekapituliert. Daher sollten gewaschene Blutplättchen nur in Situationen verwendet werden, in denen die Forscher nur an der Thrombozytenfunktion interessiert sind. Wie bei allen in vitro Studien müssen die Ergebnisse mit Vorsicht interpretiert werden. Es wird empfohlen, die Blutplättchen nach der letzten Wäsche in modifiziertem Tyrode-Puffer mit einer Kalziumkonzentration von 2 mM zu resuspendieren. Die P-Selektin- und Fibrinogen-Bindungsexpression wurde nur bis zu 1,5 Stunden nach dem Waschvorgang gemessen (2,5 Stunden einschließlich der einstündigen Pause), daher wird empfohlen, dass der Wissenschaftler die gewaschene Thrombozytensuspension innerhalb dieses Zeitfensters verwendet oder die Genauigkeit der Thrombozyten anderweitig validiert. In dieser Studie wurden andere klassische Metriken der Thrombozytenfunktionalität, wie z. B. die Aggregation, nicht gemessen.
Gewaschene Blutplättchen, die mit unserem Protokoll hergestellt wurden, sind ruhend und werden durch durchflusszytometrische Messungen von P-Selektin und Fibrinogen validiert. Die Stoffwechselsubstrate, Hormone und Thrombozytenagonisten in der extrazellulären Umgebung können präzise gesteuert werden, so dass der Wissenschaftler den Thrombozytenstoffwechsel in einem System seiner Wahl untersuchen kann.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt zu berichten.
Danksagungen
Die Autoren danken Dr. Emily Janus-Bell und Clarisse Mouriaux aus dem Labor von Dr. Pierre Mangin und Katrina Bark aus dem Labor von Dr. Jorge DiPaola für ihre Anleitung und ihren Rat.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Referenzen
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten