Method Article
ACT1-CUP1アッセイは、出芽酵母におけるスプライソソーム変異体の基質特異的感受性を決定
要約
銅成長アッセイであるACT1-CUP1アッセイは、前駆体メッセンジャーRNA(pre-mRNA)スプライシングと、変異体スプライシング因子がスプライソソーム機能に与える影響を迅速に読み取ることができます。この研究はプロトコルを提供し、関心のあるスプライシングの問題に対処するために可能なカスタマイズを強調しています。
要約
スプライソソームまたはその基質に導入された変異は、スプライソソーム機能の複雑さの理解に大きく貢献しています。疾患関連であろうと機能的に選択されたものであろうと、これらの変異の多くは、モデル生物 Saccharomyces cerevisiae (酵母)の成長アッセイを使用して研究されています。スプライシング特異的銅成長アッセイ(ACT1-CUP1アッセイ)は、表現型レベルでの変異の包括的な分析を提供します。ACT1-CUP1アッセイは、正しくスプライスされた場合に銅耐性を付与するレポーターを利用します。したがって、銅の存在下では、酵母の生存率の変化はスプライシングによるmRNA産生の変化と相関しています。典型的な実験では、酵母スプライソソームは、スプライシングに対する相乗的または反対の影響を検出するために、さまざまな非コンセンサスプライシングレポーターと目的のスプライシング因子変異に挑戦されます。ここでは、銅板の調製、酵母細胞のめっき、およびデータ評価の完全な説明が与えられます。ACT1-CUP1レポーターの多様性を強調する補完的な実験の選択が説明されています。ACT1-CUP1アッセイは、突然変異効果を直接読み出し、現場での継続的な使用による比較の可能性により、スプライシングツールボックスの便利なツールです。
概要
スプライソソームは、前駆体メッセンジャーRNA(pre-mRNA)のイントロン、非コード領域の除去を触媒する大型の生物学的機械です1,2。約100のタンパク質と5つのノンコーディングRNAのうちの1つにおけるシングルポイント変異体の効果を特徴付けることは、タンパク質またはRNAを単独で研究する場合、しばしば曖昧です。変異した成分の機能の変化は、完全に機能するスプライソソームとの関連でin vivoで最もよく評価できます。
ここで説明する銅成長アッセイは、 サッカロミセス・セレビシエ または出芽酵母におけるスプライシング効率の迅速な測定です。C.F. LesserとC. Guthrieによって開発され、1993年に発表されたこのアッセイは、単純なモデル生物での作業の容易さと細胞生存率の簡単な読み出しを兼ね備えています3。生存率は、これらの細胞のスプライソソームがレポーター転写物をどれだけうまく認識して接合できるかと相関しています。
この銅成長アッセイは、より一般的にはACT1-CUP1アッセイと呼ばれます。ACT1-CUP1という名前は、スプライシング効率のレポーターを作成するために融合された2つの遺伝子に由来しています。ACT1は酵母のアクチン遺伝子であり、高発現し、効率的にスプライスされたイントロン4,5を有する。Cup1pは、細胞内の銅を隔離して通常の細胞機能との干渉を防ぐ銅キレート剤です6,7,8。ACT1-CUP1レポーターには、ACT1のイントロンのプレmRNAスプライシングが発生した場合にのみ、CUP1が適切な読み取りフレームに入るように、これらの遺伝子が順番に含まれています(図1)。得られた融合タンパク質には、アクチンの最初の21アミノ酸と全長Cup1pタンパク質が含まれており、銅が豊富な環境で酵母の生存率を高めます3。したがって、レポーターのスプライシング量の増加は、Cup1pの濃度が高くなり、銅抵抗が高くなります(図1)。他のレポーター遺伝子と比較して、CUP1は低レベルでも細胞生存率に影響を与え、感度範囲が広く、スプライシング変異を直接選択するために使用できます3,6,7。さらに、CUP1は標準的な酵母の増殖に必須ではないため、このアッセイのセットアップ中に細胞の恒常性は影響を受けません。ACT1-CUP1は、欠失または温度増殖アッセイを補完するもので、最適な酵母増殖条件下でのスプライシングへの影響に関する情報を提供します。
スプライソソームは、5'スプライス部位(5' SS)、分岐部位(BS)、および3'スプライス部位(3' SS)の3つのイントロン配列を介してその基質を認識します。これらの部位では、非コンセンサス配列を含む多数のACT1-CUP1レポーターが生成されています。最も一般的なACT1-CUP1レポーターの選択を 図 1と 表1に示します。スプライソソームはスプライシングサイクルの異なる時点で各スプライス部位と一意に相互作用するため、スプライソソームの堅牢性は、どの非コンセンサスレポーターを使用するかに基づいて、異なるステップでテストできます。非コンセンサスレポーターは、イントロン内の突然変異した位置とそれが突然変異した塩基にちなんで名付けられます。例えば、A3cは、5'SS、具体的にはコンセンサスアデノシンからシトシンまでの3位に変異を有するレポーターである。このレポーターは、5' SSの選択と使用に影響を与えるスプライソソーム変異と強く相互作用します。彼らの最初の研究で、レッサーとガスリーはどの5'SS変異がスプライシングを阻害するかを決定しました3。同じ年の後半、3つのスプライスサイトすべての非コンセンサスレポーターが、ATPase Prp16p9の突然変異のサプレッサースクリーニングでバージェスとガスリーによって発表されました。コンセンサスを非コンセンサス報告者と比較すると、ACT1-CUP1アッセイは、酵母スプライソソームの堅牢性と選択性を理解し、他の真核生物のスプライソソームの機能を推測するための重要な鍵となっています。
非コンセンサスACT1-CUP1レポーターはスプライソソームをさらに摂動させるために感作するため、単一のスプライシング因子変異の影響は、それがプラスまたはマイナスの影響を与えるレポーターを通して特徴付けることができます。これは、さまざまな方法で研究課題のスプライシングに適用されています。まず、ACT1-CUP1アッセイは、スプライシング因子の変異の遺伝子スクリーニングとして使用でき、使用されています。例えば、最大のスプライシングタンパク質であるPrp8pは、スプライソソームのRNAコアがスプライシング反応を触媒するプラットフォームとして機能します。これは、Prp8p変異体が異なるACT1-CUP1レポーター10、11、12、13、14、15、16、17のスプライシングをどのように改善または減少させたかによって部分的に推測されました。スプライソソームの他のタンパク質成分も、Hsh155p、Cwc2p、Cef1p、およびEcm2p18、19、20、21、22、23、24、25を含むACT1-CUP1を使用して調べられています。スプライソソーム移行に関与するPrp16pおよび他の4つのATPアーゼのエネルギー閾値も、このアッセイ9、26、27、28、29、30で研究されています。低分子核RNA(snRNA)は、ACT1-CUP1を利用して、それらが配位するプレmRNA配列と、スプライシング中にsnRNAが受ける二次構造の変化を特定するために広く研究されています3,31,32,33,34,35,36,37。
ACT1-CUP1アッセイには、CUP1遺伝子のすべてのコピーがノックアウトされた酵母株が必要です。CUP1は高いコピー数6,38を有する可能性があるため、フルノックアウト株の調製には、複数回のラウンドまたは広範なスクリーニングが必要になる場合があります。その結果、cup1Δ酵母株は、報告者と同様に、ラボ間で共有されることがよくあります。
スプライシング因子の変異がプラスミドコピーから評価されている場合、この因子の野生型遺伝子をノックアウトする必要があります。さらに、酵母のバックグラウンドでは、ACT1-CUP1レポーターを含むプラスミド、歴史的にロイシン栄養選択プラスミドを含むプラスミド、および研究されるスプライシング機構の突然変異または摂動を含むプラスミドの少なくとも2つのプラスミドの選択を可能にする必要があります(図2)。通常、1回のアッセイで、それぞれがクエリスプライシング摂動(QSP)と異なるレポーターを運ぶ複数の酵母株が、スプライシングに対するクエリの影響をテストします。
ACT1-CUP1アッセイの独立変数により、研究者はQSPの重症度を評価することができます。これらの独立変数は、銅の濃度と複数の非コンセンサスプライシングレポーターの選択です。まず、酵母株が銅濃度の範囲を含むプレート上で増殖するため(図2)、アッセイの設定には、使用する濃度の勾配の選択が含まれます。研究では、コース銅濃度勾配を利用して生存率の初期測定値を取得し、次により細かい勾配でアッセイを繰り返して、微妙な生存率の違いを特定できます。2番目の変数は、テスト可能な広範囲のACT1-CUP1レポーターです(図 1および 表1)。QSPが非コンセンサスレポーターの存在下で野生型とで酵母の生存率に異なる影響を与える場合、QSPはスプライシングのステップまたはイントロンのその領域の認識または処理中に重要なスプライソソームの領域に影響を与えるという結論を下すことができます。
酵母ツールボックスは広範であり、ACT1-CUP1アッセイはスプライシング研究の不可欠な部分です。ACT1-CUP1アッセイは、QSPの影響に関するより詳細な遺伝的、構造的、および/または生化学的分析と並行して実行されることがよくあります。これらのより詳細な研究は一般的により長い手順および/またはより高い値札を持っているので、頻繁なアプローチは最初にACT1-CUP1を持つ興味深い変異体をスクリーニングすることです。
ここで提供されるのは、銅板調製を含むACT1-CUP1アッセイプロトコルです。このアッセイは、スプライシングに対するQSPの影響と、摂動の影響を最も受けるイントロニック領域に対する最初の答えを研究者に提供します。
プロトコル
1.酵母株の構築
- leu2およびcup1Δを含むバックグラウンドを持つS.cerevisiae株を生成または取得します。このバックグラウンドを生成するには、酢酸リチウムと一本鎖DNA39を使用する確立された酵母法を使用します。
注:一倍体酵母株には、CUP1 6,38の1つ、2つ、またはそれ以上のコピーが含まれている場合があります。CUP1遺伝子の位置に隣接するノックアウトプライマーを設計する際には、選択した酵母株のゲノム情報を参照してください。 - 酵母の形質転換を実行して、ゲノムの組み込みまたはプラスミドのいずれかを介してQSPを組み込みます。以前の研究40、41、42に記載されているような十分に確立されたプロトコルを使用してください。
- ステップ1.2で得られた菌株で酵母の形質転換を実行します。をクリックして、目的のACT1-CUP1レポータープラスミドを追加します。
注:この形質転換後のACT1-CUP1レポータープラスミドを確実に保持するために、細胞はロイシンドロップアウト(-Leu)プレートおよび培地上で維持する必要があります。 - 手順 1.2 を実行します。および1.3。試験される各QSPおよび各ACT1-CUP1レポータープラスミドについて、対照株を含む。
2.銅板の準備
- テストするレポーターに適した銅濃度範囲を選択します(頻繁に使用されるレポーターの致死率については 、表1 を参照してください)。
注:包括的な銅濃度範囲の例は、0 mM、0.025 mM、0.05 mM、0.075 mM、0.1 mM、0.15 mM、0.2 mM、0.25 mM、0.3 mM、0.35 mM、0.4 mM、0.45 mM、0.5 mM、0.6 mM、0.7 mM、0.8 mM、0.9 mM、1.0 mM、1.1 mM、1.2 mM、1.3 mMの30種類の銅濃度です。 1.4 mM、1.5 mM、1.6 mM、1.7 mM、1.8 mM、1.9 mM、2.0 mM、2.25 mM、および 2.5 mM Cu2+ - 1 M CuSO4 のストック溶液を作り、0.22 μm PES(ポリエーテルスルホン)滅菌フィルターを通して滅菌フィルターを通します。
- 所望の銅板につき、滅菌水中のCuSO4ストックの2mL希釈液を調製する。
注意: 0 mM Cu 2+のプレートは常に分析され、参照として画像化されるため、メッキステップの開始時と終了時に1つずつ、2つの0 mM Cu2+プレートを作成することをお勧めします(ステップ3.4)。- プレート容量の40 mLにおける最終的な所望の銅濃度のストック量を計算する(補足表1)。
- 計算した量の滅菌水と1 M CuSO4 ストックを滅菌済みの2 mLチューブに加えます。
- ACT1-CUP1アッセイ用のポアプレート。
注:以下のプロトコルに代わる方法は、最初に大きな容器で培地と寒天を混ぜ合わせ、オートクレーブ処理後に小さな容器にアリコートして、プレートごとに異なる銅濃度を達成することです。どちらの方法を使用する場合でも、それぞれが異なる銅濃度を持っているにもかかわらず、培地濃度がすべてのプレート間で一貫していることを確認することが重要です。- 注ぐ空のプレートごとに、含まれる最終的な銅濃度のラベルを付けます。テストする銅濃度ごとに少なくとも1つの正方形のプレートを準備します。
- テストする銅濃度ごとに100mLのボトルにラベルを付けます。
- 各ボトルに、790 mgの寒天(2%w / v寒天)と攪拌子を加えます。
- 大きなビーカーで、注ぐすべての銅板に-Leu成長培地を組み合わせます。プレートあたり、265 mgの酵母窒素塩基(YNB)と64 mgのドロップアウトミックスからロイシン(および細胞内のQSPプラスミドを維持するために必要なその他の栄養素)を34 mLの脱イオン水に溶解します。
- 34 mLの-Leu増殖培地溶液を、準備した各100 mLボトルおよびアルミホイルでキャップに加えます。目的の銅濃度でホイルにラベルを付けます。
- オートクレーブは、オートクレーブに推奨される液体サイクルを使用して寒天を滅菌および溶解します。
- できるだけ早く、4 mLの20%w / vグルコース(滅菌ろ過)を各ボトルに追加します。.
- ラベルを一致させ、CuSO4 の2 mL希釈液を目的のボトルに追加します。
注意: それぞれ濃度の異なる数十枚の銅板を同時に製造できるため、すべてのボトル、チューブ、プレートに目的の銅濃度を明確にラベル付けすることで、プレート注入時の混乱を防ぐことができます。 - 攪拌プレートを使用して~30秒間混合し、気泡を避けて35 mLをラベル付きプレートに注ぐかピペットで固定します。保管または使用する前に冷ましてください。
注:多くの場合、プレートはアッセイの1日または2日前に作成され、使用の数時間前まで4°Cで保存されます。プレートは、めっきを開始する前に室温(RT)である必要があります(ステップ3.4)。
3. ACT1-CUP1アッセイ
- -Leuプレート上の目的のひずみをストリークします。
注:クライオストックで作業する場合は、メッキする前に細胞が保管場所から十分に復活するように注意する必要があります。このための推奨される手順は、極低温ストックからストリークし、30°Cで3〜5日間成長させることです。 次に、小さな見本を並べ替え、30°Cでさらに2〜3日間成長させます。 - 10 mLの培地で一晩培養します。
- ステップ2.4.2で説明したのと同じ比率を使用して-Leu増殖培地を準備します。培地10 mLあたり、66 mgの酵母窒素塩基(YNB)と16 mgのドロップアウトミックスからロイシンを差し引いたものを9 mLの脱イオン水に加えます。0.22 μm PES滅菌フィルターを通過させます。
- 酵母株ごとに、9 mLの-Leu増殖培地と1 mLの20%w / vグルコース(滅菌ろ過)を滅菌50 mLコニカルチューブに追加します。
- 滅菌スティックまたはピペットチップを使用して、酵母の小さな(~1 mmラウンド)見本を集め、培地に接種します。
- すべての一晩培養物を180rpmおよび30°Cで振とうする。
注:可能であれば、シェーカーの代わりにローテーターを使用できます。
- 株を10%グリセロール中のOD600 0.5±0.05に希釈します。
- 1株あたり、900 μLの水を含むキュベットに100 μLの培養液を加えます。
- 分光光度計でOD600 を測定します。
- 最終容量2 mLでOD600 を0.5にするために必要な希釈率を計算します。
- 各菌株を10%グリセロール(滅菌)中のOD600 0.5に希釈する。
- OD600 を再測定して、セル密度が0.5±0.05の所望の範囲内にあることを確認します。
- 銅板にひずみをプレートします。
注:5〜10 μL容量のハンドピペッティング、リピートピペッターまたはマルチチャンネルピペッターの使用、ピンリプリケーターによるスタンピングなど、さまざまな方法を使用して菌株をプレート化できます。この最後の方法を以下に説明しますが、ほとんどの手順は方法に関係なく似ています。- 無菌の作業場所と火のついたブンゼンバーナーを設置します。
- 48ピンレプリケーターの場合、希釈した各株200 μLを96ウェルプレートの別々のウェルにピペットします。6 x 8グリッドの空きスペースを200 μLの10%グリセロール(滅菌済み)で満たします。
注:9つの酵母株のプレーティングスキームの例は、 補足表2にあります。 - レプリケーターを95%(v / v)エタノールと炎の浅い皿に浸して滅菌します。熱が細胞に熱衝撃を与えないように、炎が消えた後、少なくとも2分間冷まします。
- バーナーの近くに4枚のプレートを置き、蓋を外します。
- リプリケーターを96ウェルプレートに浸し、1回の素早い動きで持ち上げます。
- プレートにそっと置き、前後に軽く揺らして、うまく移動できるようにします。
- 1回の素早い動きで持ち上げ、96ウェルプレート内でまったく同じ向きに置きます。
- 最大3つの他のプレートについても繰り返します。レプリケーターをエタノールに浸し、炎上させて滅菌し、4枚ごとに冷却するのを待つプロセスを繰り返します。
- プレートがメッキされた後、滑らかな動きで横に移動しますが、それでも炎の滅菌傘内にあります。
注:炎の近くで酵母の希釈とメッキを行うことをお勧めします。プレートは乾燥中に簡単に汚染される可能性があります。 - 蓋をする前に、プレートを完全に乾かしてください(通常3〜5分)。
- プレートを30°Cで3日間インキュベートします。
4. データ収集と分析
- インキュベーターからプレートを取り出し、それらを目視検査する。
- 利用可能なカメラまたは他のデジタルイメージングシステムでプレートの画像を記録します。
- 各菌株について、目に見える成長が観察される最後の銅濃度の記録(またはスコア)。
注:細胞はスプライスすることができ、その濃度まで生存し続けることができます。一貫性を保つために、目で見るか、プレート画像から常に同じ方法を使用して、最後の実行可能な銅濃度をスコアリングします。非常に小さなコロニーは、目には見えることがありますが、画像には見えません。直接目視検査と画像からの記録の違いは小さく、通常はグラデーションのステップです。コロニーの画像は出版物でよく使用されるため、画像によるスコアリングをお勧めします。 - 同じ株の複数のACT1-CUP1アッセイのデータを組み合わせて、QSPがスプライシングにどのように影響するかについて結論を導き出します。
注:出版物の数字は、通常、0 mM Cu2+ 濃度、最後の生存可能な銅濃度、およびコロニーが死んだその後の濃度での酵母コロニーの画像を示しています。データは、反復間の標準偏差の誤差バーを含む棒グラフとして表示することもできます。データは正規化する必要はありませんが、WTスプライシング因子コントロールの生存率を1に設定し、導入された突然変異の効果を比較することによって正規化することができます。
結果
ACT1-CUP1のような増殖アッセイでは、複数のコロニーの視覚的比較評価が必要です。ここでは、各菌株を一晩飽和状態まで増殖させ、OD600 を0.5に希釈し、0 mMから1.1 mMCuSO4 の範囲の銅濃度を含む20枚のプレートに播種しました(図3)。この範囲は、以下で使用および説明するQSPおよびACT1-CUP1レポーターの影響を完全に評価できるため、プロトコルにリストされている範囲よりも小さくなっています。プレートを画像化し、スコアを付けた(図 3および 補足表3)。
この代表的な実験では、酵母のバックグラウンドには破壊された ADE2 遺伝子が含まれており、その結果、コロニーはさまざまな赤の色合いになります(図3A、B)。アデノシン産生経路におけるこの一般的な酵母の破壊は、アデノシンの赤色色素前駆体の蓄積を引き起こします。したがって、赤色は、酵母コロニーの成熟度(すなわち、存在する細胞の量および年齢)の指標である。ACT1-CUP1アッセイの目的のために、赤色は、白色または黄色の場合、真菌種を汚染する指標として役立ち得る。色は、より実行可能なコロニーがより深い赤い色合いになるため、銅耐性の二次的な確認になる可能性があります。
ピンリプリケータでめっきする場合、いくつかの一般的な収差があります。まず、レプリケータを左右に動かしながら持ち上げると楕円形のコロニーを作ることができる(図3B、オレンジ色の矢印)。さらに、ピンリプリケーターを斜めに持ち込んだり、プレートの上で振ったりすると、細胞溶液の小さな液滴からマイクロコロニーを形成することもあります(図3B、赤い矢印)。多くの場合、無害で、時折、マイクロコロニーは刻印されたコロニーと混合することがあり、これはそのコロニーの解釈を妨げる。その他のめっきの問題には、滅菌後、レプリケータピンが冷却されるまでの待ち時間が不十分であること、プレートとピンとの接触が不十分であるため、培地の移動が不十分であることなどがあります。どちらの場合も、野生型レポーターを含む対照株を含め、プレート上で増殖する細胞はあるとしてもほとんどありません。他の成長アッセイと同様に、プレーティングの方法に関係なく、ACT1-CUP1を3回に分けて実行して、結果が一貫して再現性があることを確認することが重要です。理想的には、これらの異なる反復は、再現性を確保するために異なる時間に調製された銅板上で実行する必要があります。
これらの代表的な実験では、追加のスプライソソーム摂動がない場合の銅耐性に対する非コンセンサス配列の影響を強調するためにA3cレポーターを選択しました。A3cは、スプライソソームが5' SS15を認識して利用する能力を乱すため、生成されるCUP1 mRNAの量を大幅に減少させます。A3cレポーターを含む酵母は0.15 mM Cu2+まで生存しましたが、野生型レポーター細胞は試験した銅濃度の範囲の終わりまで生存率を維持しました(図3C)。野生型レポーター含有細胞は、生存率に影響を与えることなく2.5mMCu2+に増殖する(データ示さず)。
U6 snRNAはスプライソソームの必須触媒成分です。複数の研究でACT1-CUP1を使用して、変異がこのRNA16,32,34に与える影響を研究しています。この研究のために複製して、3つのU6 snRNA配列、すなわち野生型配列(WT)、ウリジンからシトシンに置換された57位(U57c)、およびウリジンからアデノシンに置換された57位(U57a)が研究されました(図3および図4)。スプライシングにおける触媒ステップに影響を与えるACT1−CUP1レポーターと組み合わせると、U57cは第1の触媒ステップに有利であり、U57aは第2のステップへの進行に有利であると決定された16,32。
ACT1-CUP1アッセイ用にセットアップするために、U6 snRNAのゲノムコピーを削除し、プラスミドに含まれるU6 snRNA野生型または変異配列を含む株を作成しました。U6 snRNAは細胞の必須成分であるため、3つの別々の形質転換を使用して、細胞生存率を維持しながら最初にゲノムU6 snRNAをノックアウトし、続いて変異したU6 snRNAをプラスミドに導入し、最後にACT1-CUP1レポーターを追加しました。最初の形質転換では、cup1Δ酵母株をU6 snRNAのゲノムコピーのノックアウトに使用し、同時に生存率を維持するためにURA選択マーカープラスミドにWT U6 snRNAを添加しました。その後の形質転換により、野生型または変異したU6 snRNAのいずれかをTRP選択マーカープラスミド上に添加し、5-FOA選択を介してURAマーカーに対して選択した。このようにして、それぞれがU6 snRNA配列の1つ、すなわちWT、U57a、およびU57cを有する3つのcup1Δ酵母株が生成された。各株の最終的な酵母形質転換は、この実験で使用する3つの異なるACT1-CUP1レポータープラスミドのうちの1つを追加しました。選択されたレポーターは、野生型レポーターA3cと、分岐部位のアデノシンからグアニンへの変異(BS-G)でした。この実験のために合計9つの株が生成され、それぞれが1つのU6 snRNA配列と1つのACT1-CUP1レポーターを含む(補足表4および補足表5)。
結果は、U6 snRNA位置57の異なる塩基が、5' SSまたはBS変異と組み合わせてスプライソソームに独特の影響を与えることを示しました(図4)。A3cおよびBS−Gレポーターはいずれも、第1触媒ステップ立体構造14、15を安定化させることによってスプライシングを主に阻害する。したがって、U57cは、これらのレポーターのいずれかと組み合わせて銅耐性を低下させる相加変異である(図4B)。対照的に、U57aは第2ステップへの進行を促進するため、銅耐性を高めます(図4B)16,32。BS-Gレポーター株のU6 snRNA WTと比較してU57aによる銅耐性が低下したことは、スプライシング16の2番目のステップに対するBS-Gの二次的な影響の可能性を強調しています。
これらの結果はまた、このアッセイの定性的性質と、野生型のクエリおよびレポーター配列をテストする必要がある理由を強調しています。野生型U6 snRNAと比較して、これらのU6 snRNA変異の銅耐性の増加または減少の一般的なパターンは当てはまりますが、細胞が生存する銅の正確な濃度は研究間で異なる可能性があり(表1)、これらの代表的なデータと他の公開された結果との間で異なっていました。これは、 CUP1 欠失を含む菌株の背景による可能性がありますが、プレーティング前の菌株の一般的な健康状態(すなわち、クライオからの菌株またはレストリークの生成後どのくらいでアッセイが行われたか)、プレートの調製方法の違い、および異なるインキュベーター間のばらつきが原因である可能性もあります。文献43のPrp8クエリ変異についてもMayerleらでも同様の差異が認められた。したがって、銅耐性の傾向を比較することは、異なるACT1-CUP1アッセイに対して実行できますが、銅濃度の数値比較は、同じラボ内でのみ、場合によっては同じ銅プレートのセットを使用して行う必要があります。
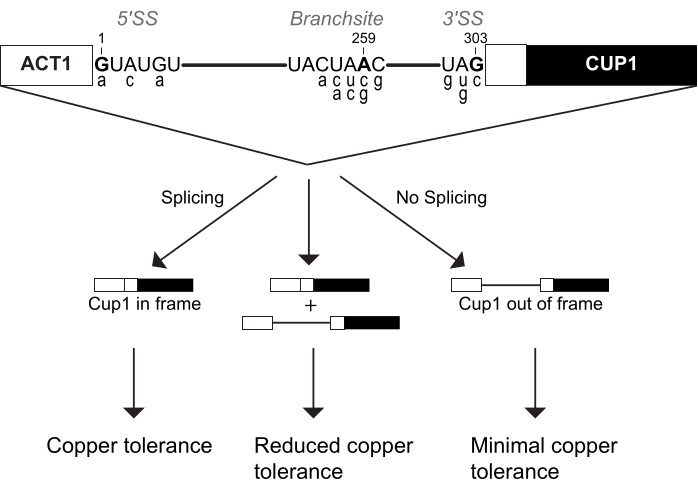
図 1: ACT1-CUP1 レポーターの設計。 スプライスされたレポーターの濃度は、酵母の銅耐性と直接相関しています。レポーターの図には、5' スプライス サイト(5' SS)、ブランチ サイト (BS)、および 3' スプライス サイト (3' SS) の 3 つのスプライス サイトが含まれています。これらの部位の酵母コンセンサス配列が示され、切断の標的となるものは太字で示され、イントロン内の位置に基づいて番号が付けられています。一般的に使用される非コンセンサスACT1-CUP1レポーター配列は、対応するコンセンサス配列位置の下の小文字で示され、 表1にリストされています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ACT1-CUP1アッセイワークフロー。このアッセイでは、酵母株はcup1Δ leu2であり、所望のACT1-CUP1レポータープラスミドおよびQSP遺伝子(図の標識遺伝子)を含む必要があります。QSP遺伝子は、ゲノム的に挿入されるか、プラスミド上に挿入されなければならない。ピンリプリケーターを使用するプロトコルには、酵母細胞を調製するための4つのステップが含まれます。ステップ1は、細胞を飽和まで成長させることです。工程2は、培養物のOD600を測定し、0.5のOD600に希釈する。ステップ3は、96ウェルプレート上に分配することです。ステップ4は、銅の濃度が増加しているプレートにプレートすることです(青色の増加で示されます)。ステップ1、ステップ2、およびステップ4は、ハンドピペッティングでも同じです。プレートをめっきしたら、プレートを30°Cで3日間インキュベートし、生存率についてスコアを付けます。この図の拡大版を表示するには、ここをクリックしてください。

図3:ACT1-CUP1データの代表的なビュー。この実験では、酵母スプライソソームに2つの異なるU6 snRNA変異を挑戦し、3人の非コンセンサスレポーターの存在下でテストします。このアッセイの3つの反復は、デモンストレーションの目的で同じプレート上に提示されます。このアッセイでは、別々のプレートと別々の日に反復を行うことをお勧めします。(A)20プレートにわたって0 mMから1.1 mMの銅勾配を有する完了したアッセイが示されています。銅濃度が増加するにつれて、スプライシングの低い株は、銅濃度が致命的になるポイントまでコンフルエンシーが低下します。酵母の背景は ade2であり、したがって、成熟したコロニーは赤色である。(B)ハンドヘルドカメラで画像化された0 mMおよび0.1 mM CuSO4 での同じプレートとデジタルイメージングシステムの比較。これは、多くの非コンセンサスレポーターを並べて、野生型のレポーターと比較する方法の例です。プレート上の一般的な観察には、ピンレプリケーターから落下した培養培地の偽の落下(赤い矢印)や、プレートの表面に沿ったピンのスライドまたは培養液滴が十分に乾燥する前にプレートが移動したことによるコロニーのわずかな楕円形(オレンジ色の矢印)が含まれます。(C)野生型レポーターと比較した細胞生存率に対するA3cレポーターの効果の例。(B)に示すような画像は、異なる銅濃度での成長の違いを強調するためにトリミングおよび整列されています。A3cレポーター株の銅耐性は、テストされた範囲の終わりまでの野生型レポーター株の生存率と比較して、0.15 mM Cu2+ に減少します。 この図の拡大版を表示するには、ここをクリックしてください。
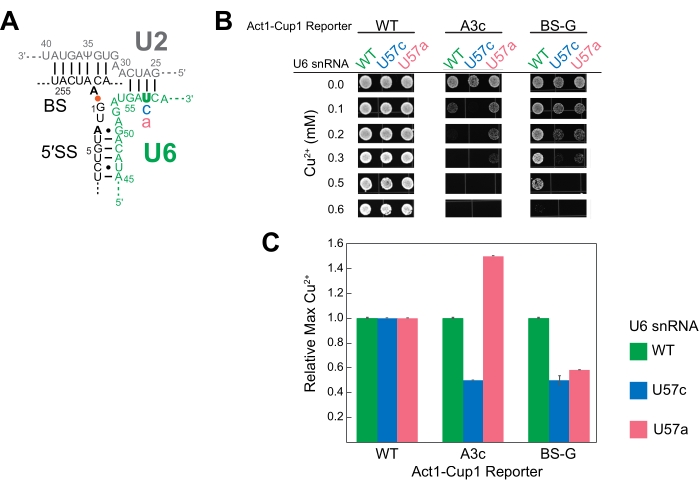
図4:代表的なACT1-CUP1は、スプライシング成分変異を有する酵母におけるスプライシングをモニタリングした結果 。 (a)第1触媒工程直後の活性部位のRNA成分の模式図。U2およびU6 snRNAは二重化されており、イントロンの5' SSとBSを近接させます。A259(BS)とG1(5' SS)の間のイントロニック結合はオレンジ色の点で示されます。この実験でテストしたACT1-CUP1レポーターにおける非コンセンサス配列置換の位置は、黒太字で示されています。U6 snRNA(U57)の変異位置は緑色で太字で、置換塩基は青色またはピンク色です。(B)出版物におけるACT1−CUP1データの提示のための1つの可能性は、関連するCu2+ 濃度からのコロニーのいくつかの画像を含む。WTレポーターは、照会された3つのU6 snRNA株すべてについてテストされた銅濃度を超えて生き残った。(C)レポーター当たりおよびU6 snRNA変異体当たりの効果を比較した棒グラフ。U6 snRNA WTの銅耐性を1に設定し、U57c変異とU57a変異の比率を計算することにより、各ACT1-CUP1レポーターについて正規化を行います。エラーバーは、3回の反復からの標準偏差を表します。 この図の拡大版を表示するには、ここをクリックしてください。
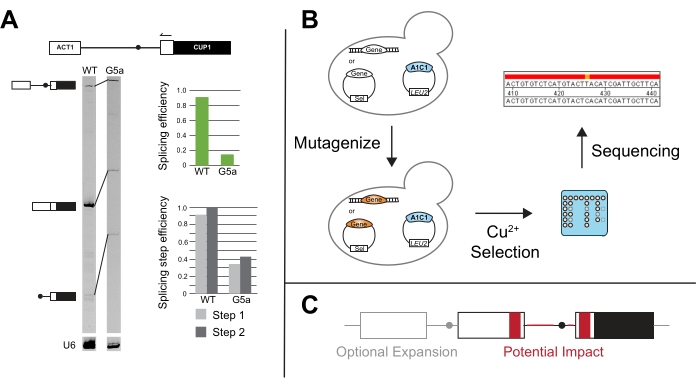
図5:ACT1-CUP1の結果を補完する追加の方法。 (A)プライマー伸長は、3'ACT1エクソンのプライマーアニーリングを介して行われ、その後イントロンに伸長されます。本実施例では、プライマーをIR700色素で末端標識し、20,21に記載のようにプライマー伸長を行った。U6 snRNAのプライマー伸長は、ローディングコントロールとして機能するのと同じ反応で行われる。7% 19:1 bis/アクリルアミド変性ゲルは、van der Feltzら22に記載されている近赤外ゲルイメージングデバイスを使用して、プライマー伸長後にプレmRNA、mRNA、およびラリアット生成物を分解します。異なるバンドの強度を使用して、全体的なスプライシング効率を測定し、ImageJ44または他のゲルバンド定量化ソフトウェアで定量化して、第1または第2ステップで発生するスプライシングの違いを区別することができます。スプライシング効率とスプライシングステップ効率の両方が、クエリとコナルスカ14で説明されているように計算されます。(B)ACT1-CUP1レポーターを用いた変異スクリーニングは、銅の選択を利用して、スプライシングに影響を与える変異体を特定することができます。次に、得られた株で目的の遺伝子を配列決定して、その遺伝子に突然変異が発生したかどうかを判断できます。(C)スプライス部位の外側のレポーターに変更を加えて、イントロン構造、エキソン配列、エクソン数、またはスプライスされていないRNAの核輸送に関連するスプライシングの変化を監視することができます。灰色の領域はレポーターに含めるオプションの拡張領域であり、赤色の領域は、ACT1-CUP1アッセイを使用してスプライシングに対する潜在的な影響について配列および構造変化をテストできる領域です。この図の拡大版を表示するには、ここをクリックしてください。
| 報告者名 | イントロニック領域 | 順序 | 最終生残量Cu2+ 濃度(mM) | |
| 重量 | 5' | グアウグ | > 2.5 | |
| G1a | 5ʹ | あるアウグ | 0.0133 または 0.0532 | |
| A3c | 5ʹ | グ・ク・ウグ | 0.15^,18 または 0.216 | |
| G5a | 5ʹ | グアウアウ | 0.303 または 0.259 | |
| 重量 | ブランチ サイト | UACUAAC | > 2.5 | |
| C256a | ブランチ サイト | UAaUAAC | 0.1526 または 0.1832 | |
| U257c/a | ブランチ サイト | UACc/aAAC | 0.226 または 0.332 または 0.545 | ±0.059.32 |
| A258c/u | ブランチ サイト | UACUc/uAC | 0.8%26% | 1.045 または 1.646 |
| BS-C | ブランチ サイト | UACUAcC | 0.153 または 0.1832,56 または 0.226 | |
| BS-G | ブランチ サイト | UACUAgC | 0.0516,32 または 0.625 または 0.846 | |
| C260g | ブランチ サイト | UACUAAg | 0.8%26% | |
| 重量 | 3' | ティッカー | > 2.5 | |
| U301g | 3ʹ | ティッカーティッカー | 0.15%18% | |
| A302g/u | 3' | Ug/ug | 0.0139 | 0.07516 または 0.18 24 |
| G303c | 3ʹ | UAc | ±0.0532 | |
表1:一般的な報告者のリストと報告されたCu2+濃度の致死性。レッサーとガスリー3の引用は100以上あります。これらの引用のごく一部が本表の作成に用いられたが、報告された銅生存率濃度における研究間のわずかな差から中程度の差の一般的な傾向が浮き彫りになった。ACT1-CUP1では、公表された濃度をガイドとして使用して、野生型のタンパク質またはRNAをすべて同じ酵母株バックグラウンドの変異体と比較することが重要ですが、観察された濃度が異なる可能性があることを予想します。図3(^)および以下の引用3、9、16、18、24、25、26、32、45、46によって注釈が付けられた複数の出版物から収集されたデータ。
補足表1:単一の銅板の内容と、1 M CuSO4ストックから0 mMから2.5 mMまでの銅希釈を達成するために行われた計算の例。この表をダウンロードするには、ここをクリックしてください。
補足表2:48ピンリプリケータのめっき方式の例。この表をダウンロードするには、ここをクリックしてください。
補足表3:30°Cで3日間インキュベートした銅板から得られた生存率の例。この表をダウンロードするには、ここをクリックしてください。
補足表4:代表的なデータを生成するために使用された酵母株のリスト。 この表をダウンロードするには、ここをクリックしてください。
補足表5:代表データの生成に用いたプラスミドのリスト。 U6 snRNAプラスミドが生成され、以前の研究で公開されました22,47。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ACT1-CUP1は増殖アッセイであり、観察された増殖差がスプライシング欠陥にのみ起因するように注意する必要があります。すべての菌株は、同様の長さとタイプの成長および保管条件を有することを含め、めっき前に同様の方法で取り扱うべきである。温度感受性株を使用する場合、ACT1-CUP1アッセイは、それらの株が野生型と同等に増殖する条件下でのみ実施する必要があります。関連して、QSPコンポーネントについては、結果の解釈を曇らせないように、QSP遺伝子の酵母の背景と発現レベルを同一にすることをお勧めします。使用するQSPとレポーターの数を考慮する場合、ピンリプリケーター法で一度に30株を超える株をアッセイすることはお勧めしません。各ステップを実行するための追加の時間で、細胞は沈降し、アッセイ結果は細胞の生存率の低下のために一貫性がなくなります。
ACT1-CUP1が増殖アッセイとして本質的に有する制限に加えて、QSPは、この方法で解決できるよりも複雑なスプライシングに影響を与える可能性があります。スプライシングは多段階のプロセスであり、因子はリサイクルされるため、観察された表現型は、摂動が複数のスプライシングステップに影響を与える可能性があります。これは、ACT1-CUP1をフォローアップできる後続の分析にも当てはまり、その一部を以下に説明します。データは、他のステップがスプライシング因子の機能の変化によって影響を受ける可能性がある場合でも、プロセスの最も摂動されたステップを強調します。
ACT1-CUP1レポーターのプライマー伸長は、レッサーとガスリーの元の論文で最初に使用され、ACT1-CUP1の結果が成長欠陥を示している場合によく実行されます3。このアッセイはレポーターを標的とし、PCR産物の長さを使用して、存在する非スプライスレポーター、部分スプライスレポーター、および完全スプライスレポーターの相対量を決定します(図5A)。全体的なスプライシング効率および欠陥が第1または第2の触媒ステップにより強く影響するかどうかは、PCR産物量14の比をとることによって計算される。たとえば、5' SSレポーターG5aは野生型レポーターと比較してスプライシングが減少していますが、その第1ステップと第2ステップの効率は野生型と同様のパターンに従います(図5A)。これは、両方の工程が同様に影響を受けるため、おそらくスプライソソームアセンブリにおける第1の触媒工程の前の欠陥を指し示している31。
標準的なACT1-CUP1アッセイから、他のスプライシング因子変異体および/または非コンセンサスプライシング配列の存在下でスプライシングを改善する変異体のスクリーニングなど、新規アッセイが開発されました(図5B)。例えば、ACT1-CUP1レポーターを含む酵母をUVにさらし、銅の存在下で選択すると、非コンセンサス配列のスプライシングを改善するPrp8およびHsh155変異体が得られました14,19。
CUP1の成長依存性は、スプライス部位と構成的スプライシング因子の影響の研究を超えて拡大し、複数のイントロンスプライシング、核輸出制御、およびUTRおよびその他の周辺配列がスプライシングに与える影響の研究に使用されてきました(図5C)。これらの研究のいくつかは、イントロン二次構造およびマルチイントロン転写産物スプライシングへの影響を研究するために、より複雑なスプライシングパターンを有することができるCUP1および他のイントロン含有酵母遺伝子を有するレポーターを作成した48,49,50,51,52。スプライシングと核輸出との関連は、フレーム53,54でCUP1をコードするスプライス転写物またはスプライスされていない転写物のいずれかを有することによって研究された。特定の要因によるピリミジントラックおよびスプライス部位選択の距離依存性の長さもテストされています20,55,56,57。これらの例および他の多くの例は、ACT1-CUP1および他のCUP1増殖アッセイの汎用性を強調しています。
ACT1-CUP1アッセイは、摂動を複雑な反応サイクルに結び付け、広い感度範囲で単純な成長表現型を実現します。このレガシーアッセイは、スプライシングサイクルの理解の基礎を築くために複数のラボで使用されています。最近では、ACT1-CUP1は、現在利用可能な豊富な構造データから生じる質問に答えるために使用されています21,22,25。非コンセンサス配列に結合したスプライソソームの構造研究をACT1-CUP1の結果と組み合わせて、構造の変化と機能の変化がどのように相関しているかを解釈することができます。ACT1-CUP1は、より複雑な解析を補完できるスプライシング変異の理想的なファーストスクリーンです。
開示事項
著者は開示するものは何もありません。
謝辞
ウィスコンシン大学マディソン校のアーロン・ホスキンスとホスキンス研究室のメンバーに、図3〜5の生成に酵母株と機器を使用していただきありがとうございます。Harpreet KaurとXingyang Fuさん、原稿に対する洞察に満ちたコメントに感謝します。この論文の執筆、編集、撮影中にノースウェスト大学の支援的な学生、スタッフ、および教員に感謝します。この方法の撮影を手伝ってくれたイザベルマラシガンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-129 | Or comparable item from a different manufacturer. |
| 2 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-138 | Or comparable item from a different manufacturer. |
| 50 mL sterile centrifuge tubes | Fisher Scientific | 07-201-332 | Or comparable item from a different manufacturer. |
| 96-well round bottom microplate | Fisher Scientific | 07-200-760 | Or comparable item from a different manufacturer. |
| 190 proof ethanol | Fisher Scientific | 22-032-600 | Or comparable item from a different manufacturer. |
| 500 mL Filter System (0.22 µm) | CellTreat Scientific Products | 229707 | Or comparable item from a different manufacturer. |
| Agar | Fisher Scientific | BP1423-500 | Any molecular grade agar will work. |
| Autoclave | Tuttnauer | 3870EA | Or comparable item from a different manufacturer. |
| Bunsen burner | Humboldt | PN6200.1 | Or comparable item from a different manufacturer. |
| Cell Density Meter | VWR | 490005-906 | Or other spectral device that can measure absorbance at 595 nm. |
| Copper sulfate Pentahydrate | Fisher Scientific | LC134051 | Or comparable item from a different manufacturer. |
| Digital imaging system | Cytiva | 29399481 | ImageQuant 4000 (used for Figure 3), Amersham ImageQuant 800, or comparable item from a different manufacturer. |
| Dropout mix (-Leu) | USBiological Life Sciences | D9525 | Use the appropriate drop out mix for your experiment. It is possible you will be using a yeast nutrient marker for your query perturbation also. In that case, the drop out mix should be for that marker and Leu |
| D-Glucose | Fisher Scientific | AAA1682836 | Or comparable item from a different manufacturer. |
| Gel band quantifying software | Cytiva | 29-0006-05 | ImageQuant TL v8.1 (used for figure 5A) or comparable item from a different manufacturer. |
| Hand held camera | Nikon | D3500 | Or comparable item from a different manufacturer. |
| Near infra-red gel imaging device | Cytiva | 29238583 | Amersham Typhoon NIR (used for Figure 5a) or comparable item from a different manufacturer. |
| Laboratory grade clamp | Fisher Scientific | 05-769-7Q | Or comparable item from a different manufacturer. |
| Laboratory grade stand and clamp | Fisher Scientific | 12-000-101 | Or comparable item from a different manufacturer. |
| Magnetic stir bars | Fisher Scientific | 14-513-51 | Or comparable item from a different manufacturer. |
| Pin replicator | VP Scientific | VP 407AH | |
| Semi-micro disposable cuvettes | VWR | 97000-590 | Or comparable item from a different manufacturer. |
| Shaker | JEIO Tech | IST-3075 | Or comparable item from a different manufacturer. |
| Spectrophotometer | Biowave | 80-3000-45 | Or any spectophotometer that can measure the absorbance at 600 nm. |
| Square plates | VWR | 102091-156 | Circular plates may also be used though are more challenging if using a pin replicator. |
| Stir plate | Fisher Scientific | 11-520-16S | Or comparable item from a different manufacturer. |
| Yeast nitrogen base | USBiological Life Sciences | Y2025 | Or comparable item from a different manufacturer. |
参考文献
- Wahl, M. C., Will, C. L., Luhrmann, R. The spliceosome: Design principles of a dynamic RNP machine. Cell. 136 (4), 701-718 (2009).
- Wilkinson, M. E., Charenton, C., Nagai, K. RNA splicing by the spliceosome. Annual Review of Biochemistry. 89, 359-388 (2020).
- Lesser, C. F., Guthrie, C. Mutational analysis of pre-mRNA splicing in Saccharomyces cerevisiae using a sensitive new reporter gene, CUP1. Genetics. 133 (4), 851-863 (1993).
- Ng, R., Abelson, J. Isolation and sequence of the gene for actin in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 77 (7), 3912-3916 (1980).
- Gallwitz, D., Sures, I. Structure of a split yeast gene: Complete nucleotide sequence of the actin gene in I. Proceedings of the National Academy of Sciences of the United States of America. 77 (5), 2546-2550 (1980).
- Fogel, S., Welch, J. W., Cathala, G., Karin, M. Gene amplification in yeast: CUP1 copy number regulates copper resistance. Current Genetics. 7 (5), 347-355 (1983).
- Hamer, D. H., Thiele, D. J., Lemontt, J. E. Function and autoregulation of yeast copperthionein. Science. 228 (4700), 685-690 (1985).
- Winge, D. R., Nielson, K. B., Gray, W. R., Hamer, D. H. Yeast metallothionein. Sequence and metal-binding properties. Journal of Biological Chemistry. 260 (27), 14464-14470 (1985).
- Burgess, S. M., Guthrie, C. A mechanism to enhance mRNA splicing fidelity: The RNA-dependent ATPase Prp16 governs usage of a discard pathway for aberrant lariat intermediates. Cell. 73 (7), 1377-1391 (1993).
- Collins, C. A., Guthrie, C. Allele-specific genetic interactions between Prp8 and RNA active site residues suggest a function for Prp8 at the catalytic core of the spliceosome. Genes & Development. 13 (15), 1970-1982 (1999).
- Siatecka, M., Reyes, J. L., Konarska, M. M. Functional interactions of Prp8 with both splice sites at the spliceosomal catalytic center. Genes & Development. 13 (15), 1983-1993 (1999).
- Umen, J. G., Guthrie, C. Mutagenesis of the yeast gene PRP8 reveals domains governing the specificity and fidelity of 3' splice site selection. Genetics. 143 (2), 723-739 (1996).
- Grainger, R. J., Beggs, J. D. Prp8 protein: At the heart of the spliceosome. RNA. 11 (5), 533-557 (2005).
- Query, C. C., Konarska, M. M. Suppression of multiple substrate mutations by spliceosomal prp8 alleles suggests functional correlations with ribosomal ambiguity mutants. Molecular Cell. 14 (3), 343-354 (2004).
- Konarska, M. M., Vilardell, J., Query, C. C. Repositioning of the reaction intermediate within the catalytic center of the spliceosome. Molecular Cell. 21 (4), 543-553 (2006).
- Liu, L., Query, C. C., Konarska, M. M. Opposing classes of prp8 alleles modulate the transition between the catalytic steps of pre-mRNA splicing. Nature Structural and Molecular Biology. 14 (6), 519-526 (2007).
- MacRae, A. J., et al. Prp8 positioning of U5 snRNA is linked to 5' splice site recognition. RNA. 24 (6), 769-777 (2018).
- Query, C. C., Konarska, M. M. CEF1/CDC5 alleles modulate transitions between catalytic conformations of the spliceosome. RNA. 18 (5), 1001-1013 (2012).
- Tang, Q., et al. SF3B1/Hsh155 HEAT motif mutations affect interaction with the spliceosomal ATPase Prp5, resulting in altered branch site selectivity in pre-mRNA splicing. Genes & Development. 30 (24), 2710-2723 (2016).
- Carrocci, T. J., Zoerner, D. M., Paulson, J. C., Hoskins, A. A. SF3b1 mutations associated with myelodysplastic syndromes alter the fidelity of branchsite selection in yeast. Nucleic Acids Research. 45 (8), 4837-4852 (2017).
- Kaur, H., Groubert, B., Paulson, J. C., McMillan, S., Hoskins, A. A. Impact of cancer-associated mutations in Hsh155/SF3b1 HEAT repeats 9-12 on pre-mRNA splicing in Saccharomyces cerevisiae. PLoS One. 15 (4), 0229315(2020).
- vander Feltz, C., et al. Saccharomyces cerevisiae Ecm2 modulates the catalytic steps of pre-mRNA splicing. RNA. 27 (5), 591-603 (2021).
- Carrocci, T. J., Paulson, J. C., Hoskins, A. A. Functional analysis of Hsh155/SF3b1 interactions with the U2 snRNA/branch site duplex. RNA. 24 (8), 1028-1040 (2018).
- Hogg, R., de Almeida, R. A., Ruckshanthi, J. P., O'Keefe, R. T. Remodeling of U2-U6 snRNA helix I during pre-mRNA splicing by Prp16 and the NineTeen Complex protein Cwc2. Nucleic Acids Research. 42 (12), 8008-8023 (2014).
- Hansen, S. R., Nikolai, B. J., Spreacker, P. J., Carrocci, T. J., Hoskins, A. A. Chemical inhibition of pre-mRNA splicing in living Saccharomyces cerevisiae. Cell Chemical Biology. 26 (3), 443-448 (2019).
- Xu, Y. Z., Query, C. C. Competition between the ATPase Prp5 and branch region-U2 snRNA pairing modulates the fidelity of spliceosome assembly. Molecular Cell. 28 (5), 838-849 (2007).
- Staley, J. P., Guthrie, C. An RNA switch at the 5' splice site requires ATP and the DEAD box protein Prp28p. Molecular Cell. 3 (1), 55-64 (1999).
- Bousquet-Antonelli, C., Presutti, C., Tollervey, D. Identification of a regulated pathway for nuclear pre-mRNA turnover. Cell. 102 (6), 765-775 (2000).
- Villa, T., Guthrie, C. The Isy1p component of the NineTeen complex interacts with the ATPase Prp16p to regulate the fidelity of pre-mRNA splicing. Genes & Development. 19 (16), 1894-1904 (2005).
- Mayas, R. M., Maita, H., Staley, J. P. Exon ligation is proofread by the DExD/H-box ATPase Prp22p. Nature Structure and Molecular Biology. 13 (6), 482-490 (2006).
- Lesser, C. F., Guthrie, C. Mutations in U6 snRNA that alter splice site specificity: Implications for the active site. Science. 262 (5142), 1982-1988 (1993).
- McPheeters, D. S. Interactions of the yeast U6 RNA with the pre-mRNA branch site. RNA. 2 (11), 1110-1123 (1996).
- Perriman, R. J., Ares, M. Rearrangement of competing U2 RNA helices within the spliceosome promotes multiple steps in splicing. Genes & Development. 21 (7), 811-820 (2007).
- Mefford, M. A., Staley, J. P. Evidence that U2/U6 helix I promotes both catalytic steps of pre-mRNA splicing and rearranges in between these steps. RNA. 15 (7), 1386-1397 (2009).
- Hilliker, A. K., Mefford, M. A., Staley, J. P. U2 toggles iteratively between the stem IIa and stem IIc conformations to promote pre-mRNA splicing. Genes & Development. 21 (7), 821-834 (2007).
- Wu, G., et al. Pseudouridines in U2 snRNA stimulate the ATPase activity of Prp5 during spliceosome assembly. EMBO Journal. 35 (6), 654-667 (2016).
- Crotti, L. B., Bacikova, D., Horowitz, D. S. The Prp18 protein stabilizes the interaction of both exons with the U5 snRNA during the second step of pre-mRNA splicing. Genes & Development. 21 (10), 1204-1216 (2007).
- Fogel, S., Welch, J. W. Tandem gene amplification mediates copper resistance in yeast. Proceedings of the National Academy of Sciences of the United States of America. 79 (17), 5342-5346 (1982).
- Gardner, J. M., Jaspersen, S. L. Manipulating the yeast genome: Deletion, mutation, and tagging by PCR. Methods Molecular Biology. 1205, 45-78 (2014).
- JoVE. Yeast Transformation and Cloning. In Biology I: yeast, Drosophila and C. Elegant. JoVE Science Education Database. , Cambridge, MA. (2021).
- Gietz, R. D., Woods, R. A. Yeast transformation by the LiAc/SS Carrier DNA/PEG method. Methods Molecular Biology. 313, 107-120 (2006).
- Gietz, R. D., Woods, R. A. Genetic transformation of yeast. Biotechniques. 30 (4), 816(2001).
- Mayerle, M., et al. Structural toggle in the RNaseH domain of Prp8 helps balance splicing fidelity and catalytic efficiency. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), 4739-4744 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Beier, D. H., et al. Dynamics of the DEAD-box ATPase Prp5 RecA-like domains provide a conformational switch during spliceosome assembly. Nucleic Acids Research. 47 (20), 10842-10851 (2019).
- vander Feltz, C., DeHaven, A. C., Hoskins, A. A. Stress-induced pseudouridylation alters the structural equilibrium of yeast U2 snRNA Stem II. Journal of Molecular Biology. 430 (4), 524-536 (2018).
- Rodgers, M. L., Didychuk, A. L., Butcher, S. E., Brow, D. A., Hoskins, A. A. A multi-step model for facilitated unwinding of the yeast U4/U6 RNA duplex. Nucleic Acids Research. 44 (22), 10912-10928 (2016).
- Stutz, F., Rosbash, M. A functional interaction between Rev and yeast pre-mRNA is related to splicing complex formation. EMBO Journal. 13 (17), 4096-4104 (1994).
- Libri, D., Lescure, A., Rosbash, M. Splicing enhancement in the yeast rp51b intron. RNA. 6 (3), 352-368 (2000).
- Libri, D., Stutz, F., McCarthy, T., Rosbash, M. RNA structural patterns and splicing: Molecular basis for an RNA-based enhancer. RNA. 1 (4), 425-436 (1995).
- Howe, K. J., Kane, C. M., Ares, M. Perturbation of transcription elongation influences the fidelity of internal exon inclusion in Saccharomyces cerevisiae. RNA. 9 (8), 993-1006 (2003).
- Cuenca-Bono, B., et al. SUS1 introns are required for efficient mRNA nuclear export in yeast. Nucleic Acids Research. 39 (19), 8599-8611 (2011).
- Scherrer, F. W., Spingola, M. A subset of Mer1p-dependent introns requires Bud13p for splicing activation and nuclear retention. RNA. 12 (7), 1361-1372 (2006).
- Hálová, M., et al. Nineteen complex-related factor Prp45 is required for the early stages of cotranscriptional spliceosome assembly. RNA. 23 (10), 1512-1524 (2017).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Crotti, L. B., Horowitz, D. S. Exon sequences at the splice junctions affect splicing fidelity and alternative splicing. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 18954-18959 (2009).
- Perriman, R., Ares, M. Invariant U2 snRNA nucleotides form a stem loop to recognize the intron early in splicing. Molecular Cell. 38 (3), 416-427 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved