Method Article
Les tests ACT1-CUP1 déterminent les sensibilités spécifiques au substrat des mutants splicéosomaux chez la levure bourgeonnante
Dans cet article
Résumé
Le test ACT1-CUP1, un test de croissance du cuivre, fournit une lecture rapide de l’épissage de l’ARN messager précurseur (pré-ARNm) et de l’impact des facteurs d’épissage mutant sur la fonction splicéosomale. Cette étude fournit un protocole et met en évidence la personnalisation possible pour répondre à la question d’épissage d’intérêt.
Résumé
Les mutations introduites dans le splicéosome ou son substrat ont contribué de manière significative à notre compréhension des subtilités de la fonction splicéosomale. Qu’elles soient liées à la maladie ou fonctionnellement sélectionnées, bon nombre de ces mutations ont été étudiées à l’aide de tests de croissance chez l’organisme modèle Saccharomyces cerevisiae (levure). Le test de croissance du cuivre spécifique à l’épissage, ou test ACT1-CUP1, fournit une analyse complète de la mutation au niveau phénotypique. Le test ACT1-CUP1 utilise des rapporteurs qui confèrent une tolérance au cuivre lorsqu’ils sont correctement épissés. Ainsi, en présence de cuivre, les changements dans la viabilité de la levure sont en corrélation avec les changements dans la production d’ARNm par épissage. Dans une expérience typique, le splicéosome de levure est mis au défi avec différents rapporteurs d’épissage non consensuels et la mutation du facteur d’épissage d’intérêt pour détecter tout impact synergique ou antithétique sur l’épissage. Ici, une description complète de la préparation des plaques de cuivre, du placage des cellules de levure et de l’évaluation des données est donnée. Une sélection d’expériences complémentaires est décrite, soulignant la polyvalence des rapporteurs ACT1-CUP1. Le test ACT1-CUP1 est un outil pratique dans la boîte à outils d’épissage grâce à la lecture directe des effets mutationnels et aux possibilités comparatives de l’utilisation continue sur le terrain.
Introduction
Le spliceosome est une grande machine biologique qui catalyse l’élimination des introns, régions non codantes dans l’ARN messager précurseur (pré-ARNm)1,2. Caractériser l’effet d’un mutant ponctuel unique dans 1 des près de 100 protéines et 5 ARN non codants est souvent ambigu lors de l’étude de la protéine ou de l’ARN isolément. Le changement dans la fonction du composant muté peut être mieux évalué in vivo dans le contexte du spliceosome complet et fonctionnel.
Le test de croissance du cuivre décrit ici est une mesure rapide de l’efficacité de l’épissage chez Saccharomyces cerevisiae ou levure bourgeonnante. Développé par C.F. Lesser et C. Guthrie et publié en 1993, ce test combine la facilité de travail avec un organisme modèle simple et la lecture directe de la viabilité cellulaire3. La viabilité est en corrélation avec la façon dont les splicéosomes dans ces cellules peuvent reconnaître et épisser la transcription du rapporteur.
Ce test de croissance du cuivre est plus communément appelé le test ACT1-CUP1. Le nom ACT1-CUP1 provient des deux gènes fusionnés pour créer un rapporteur d’efficacité d’épissage. ACT1 est le gène de l’actine de la levure, qui est fortement exprimé et a un intron efficacement épissé 4,5. Cup1p est un chélateur du cuivre qui séquestre le cuivre dans la cellule pour éviter les interférences avec les fonctions cellulaires régulières 6,7,8. Le rapporteur ACT1-CUP1 contient ces gènes dans l’ordre de telle sorte que CUP1 est dans le cadre de lecture approprié seulement si l’épissage pré-ARNm de l’intron d’ACT1 se produit (Figure 1). La protéine de fusion résultante contient les 21 premiers acides aminés de l’actine et la protéine Cup1p pleine longueur, ce qui augmente la viabilité de la levure dans un environnement riche en cuivre3. Ainsi, une augmentation de la quantité d’épissage du rapporteur entraîne une concentration plus élevée de Cup1p et une résistance au cuivre plus élevée (Figure 1). En comparaison avec d’autres gènes rapporteurs, CUP1 a un impact sur la viabilité cellulaire même à de faibles niveaux, a une large plage de sensibilité et peut être utilisé pour sélectionner directement pour l’épissage des mutations 3,6,7. De plus, CUP1 n’est pas essentiel pour la croissance standard des levures, et donc l’homéostasie cellulaire n’est pas affectée lors de la configuration de ce test. Complémentaire aux tests de délétion ou de croissance en température, ACT1-CUP1 fournit des informations sur les effets sur l’épissage dans des conditions de croissance de levure par ailleurs optimales.
Le splicéosome reconnaît son substrat à travers trois séquences introniques, à savoir le site d’épissure 5' (5' SS), le site ramifié (BS) et le site d’épissure 3' (3' SS). De nombreux rapporteurs ACT1-CUP1 ont été générés contenant des séquences non consensuelles sur ces sites. Une sélection des rapporteurs ACT1-CUP1 les plus courants est présentée à la figure 1 et au tableau 1. Comme le splicéosome interagit avec chaque site d’épissure de manière unique à différents moments du cycle d’épissage, la robustesse du splicéosome peut être testée à différentes étapes en fonction du rapporteur non consensuel utilisé. Les rapporteurs non consensuels sont nommés pour la position mutée dans l’intron et la base sur laquelle il a été muté. Par exemple, A3c est un rapporteur avec une mutation au niveau du 5' SS, en particulier la position 3 de l’adénosine consensuelle à une cytosine. Ce rapporteur interagira fortement avec les mutations des splicéosomes qui ont un impact sur la sélection et l’utilisation du 5' SS. Dans leur étude initiale, Lesser et Guthrie ont déterminé quelles mutations 5' SS inhibaient l’épissage3. Plus tard la même année, des rapporteurs non consensuels sur les trois sites d’épissage ont été publiés par Burgess et Guthrie dans un écran suppresseur de mutations dans l’ATPase Prp16p9. En comparant les rapporteurs de consensus à ceux qui ne le font pas, le test ACT1-CUP1 a été une clé importante pour comprendre la robustesse et la sélectivité du splicéosome de levure et pour déduire la fonction des splicéosomes d’autres eucaryotes.
Comme les rapporteurs ACT1-CUP1 non consensuels sensibilisent le spliceosome à une perturbation supplémentaire, l’impact d’une mutation du facteur d’épissage unique peut être caractérisé par les rapporteurs qu’elle impacte positivement ou négativement. Cela a été appliqué à l’épissage des questions de recherche de diverses façons. Tout d’abord, le test ACT1-CUP1 peut et a été utilisé comme criblage génétique des mutations dans les facteurs d’épissage. Par exemple, Prp8p, la plus grande protéine d’épissage, sert de plate-forme sur laquelle le noyau d’ARN du spliceosome catalyse la réaction d’épissage. Cela a été déduit, en partie, de la façon dont les mutants Prp8p ont amélioré ou réduit l’épissage de différents rapporteurs ACT1-CUP1 10,11,12,13,14,15,16,17. D’autres composants protéiques du spliceosome ont également été étudiés à l’aide d’ACT1-CUP1, notamment Hsh155p, Cwc2p, Cef1p et Ecm2p 18,19,20,21,22,23,24,25. Les seuils énergétiques de Prp16p et de quatre autres ATPases impliquées dans la transition splicéosomale ont également été étudiés avec ce test 9,26,27,28,29,30. Les petits ARN nucléaires (ARNsn) ont également été largement étudiés en utilisant ACT1-CUP1 pour identifier les séquences pré-ARNm qu’ils coordonnent et les changements dans la structure secondaire que les ARNn subissent pendant l’épissage 3,31,32,33,34,35,36,37.
Le test ACT1-CUP1 nécessite une souche de levure où toutes les copies du gène CUP1 ont été éliminées. Comme CUP1 peut avoir un numéro d’exemplaire élevé 6,38, la préparation d’une souche knock-out complète peut nécessiter plusieurs tours ou un dépistage approfondi. En conséquence, les souches de levure cup1Δ ont souvent été partagées entre les laboratoires, tout comme les journalistes.
Si une ou plusieurs mutations d’un facteur d’épissage sont évaluées à partir d’une copie plasmidique, le gène de type sauvage de ce facteur doit être éliminé. De plus, le fond de levure devrait permettre la sélection d’au moins deux plasmides, l’un contenant un rapporteur ACT1-CUP1, historiquement sur un plasmide de sélection de nutriments leucine, et l’autre contenant une mutation ou une perturbation dans la machinerie d’épissage qui sera étudiée (Figure 2). Habituellement, dans un seul essai, plusieurs souches de levure, chacune portant la perturbation d’épissage de requête (QSP) et un rapporteur différent, testeront l’impact de la requête sur l’épissage.
Les variables indépendantes du test ACT1-CUP1 permettent à un chercheur d’évaluer la gravité d’un QSP. Ces variables indépendantes sont la concentration de cuivre et la sélection de plusieurs rapporteurs d’épissage non consensuels. Tout d’abord, comme les souches de levure sont cultivées sur des plaques contenant une gamme de concentrations de cuivre (Figure 2), la mise en place du test comprend la sélection du gradient de concentrations utilisé. Les études peuvent utiliser un gradient de concentration de cuivre pour obtenir une lecture initiale de la viabilité, puis répéter l’essai avec un gradient plus fin pour identifier les différences subtiles de viabilité. La deuxième variable est la large gamme de rapporteurs ACT1-CUP1 qu’il est possible de tester (Figure 1 et Tableau 1). Si le QSP a un impact différent sur la viabilité de la levure en présence d’un rapporteur non consensuel par rapport à un type sauvage, on peut conclure que le QSP affecte une étape de l’épissage ou une région du spliceosome importante lors de la reconnaissance ou du traitement de cette région de l’intron.
La boîte à outils de levure est vaste et le test ACT1-CUP1 fait partie intégrante de la recherche sur l’épissage. Le test ACT1-CUP1 est souvent réalisé parallèlement à une analyse génétique, structurelle et/ou biochimique plus approfondie sur l’impact d’un QSP. Comme ces études plus détaillées ont généralement une procédure plus longue et / ou un prix plus élevé, une approche fréquente consiste à rechercher d’abord des mutants intéressants avec ACT1-CUP1.
Fourni ici est un protocole de dosage ACT1-CUP1, y compris la préparation sur plaque de cuivre. Ce test fournit aux chercheurs une réponse initiale à l’effet d’un QSP sur l’épissage et quelles régions introniques sont les plus touchées par la perturbation.
Protocole
1. Construction de souches de levure
- Générer ou obtenir une souche de S. cerevisiae dont le fond comprend leu2 et cup1Δ. Pour générer ce fond, utilisez la méthode de levure bien établie qui utilise de l’acétate de lithium et de l’ADN simple brin39.
NOTE: Les souches de levure haploïdes peuvent contenir une, deux ou plusieurs copies de CUP1 6,38. Se référer à l’information génomique pour la souche de levure sélectionnée lors de la conception d’amorces knock-out pour flanquer l’emplacement du gène CUP1. - Effectuer une transformation de levure pour incorporer le QSP soit par incorporation génomique, soit sur un plasmide. Utilisez un protocole bien établi tel que ceux décrits dans les recherches précédentes40,41,42.
- Effectuer une transformation de levure avec la ou les souches résultantes de l’étape 1.2. pour ajouter le plasmide rapporteur ACT1-CUP1 souhaité.
NOTE: Les cellules doivent être maintenues sur des plaques et des milieux de goutte de leucine (-Leu) pour assurer la rétention des plasmides rapporteurs ACT1-CUP1 après cette transformation. - Effectuez les étapes 1.2. et 1.3. pour chaque QSP et chaque plasmide rapporteur ACT1-CUP1 à tester, y compris les souches témoins.
2. Préparation de la plaque de cuivre
- Choisissez une plage de concentration de cuivre qui convient aux déclarants à tester (voir le tableau 1 pour connaître la létalité des déclarants fréquemment utilisés).
NOTA: Un exemple d’une plage complète de concentration de cuivre est 30 concentrations différentes de cuivre de 0 mM, 0,025 mM, 0,05 mM, 0,075 mM, 0,1 mM, 0,15 mM, 0,2 mM, 0,25 mM, 0,3 mM, 0,35 mM, 0,4 mM, 0,45 mM, 0,5 mM, 0,6 mM, 0,7 mM, 0,8 mM, 0,9 mM, 1,0 mM, 1,1 mM, 1,2 mM, 1,3 mM, 1,4 mM, 1,5 mM, 1,6 mM, 1,7 mM, 1,8 mM, 1,9 mM, 2,0 mM, 2,25 mM et 2,5 mM Cu2+. - Fabriquer une solution mère de 1 M CuSO4 et filtrer stérile à travers un filtre stérile PES (polyéthersulfone) de 0,22 μm.
- Par plaque de cuivre désirée, préparer une dilution de 2 mL du stock de CuSO4 dans de l’eau stérile.
NOTE: Comme la plaque avec 0 mM Cu 2+ sera toujours analysée et imagée comme référence, il est recommandé de faire deux plaques 0 mM Cu2+, une au début et une à la fin de l’étape de placage (étape 3.4.).- Calculer la quantité de stock pour la concentration finale de cuivre désirée dans 40 mL du volume de la plaque (tableau supplémentaire 1).
- Ajouter la quantité calculée d’eau stérile et 1 M de CuSO4 dans un tube stérile de 2 mL.
- Verser les plaques pour le test ACT1-CUP1.
NOTA : Une solution de rechange au protocole ci-dessous consiste à combiner d’abord le milieu et la gélose dans un grand récipient et l’aliquote après autoclavage dans des contenants plus petits pour obtenir des concentrations de cuivre différentes pour chaque plaque. Quelle que soit la méthode choisie, il est important de s’assurer que la concentration du milieu est cohérente entre toutes les plaques, même si chacune a une concentration de cuivre différente.- Étiquetez chaque plaque vide à verser avec la concentration finale de cuivre qu’elle contiendra. Préparer au moins une plaque carrée par concentration de cuivre à tester.
- Étiqueter une bouteille de 100 ml par concentration de cuivre à analyser.
- À chaque flacon, ajouter 790 mg de gélose (gélose 2 % p/v) et une barre à mélanger.
- Dans un grand bécher, mélanger le milieu de croissance -Leu pour toutes les plaques de cuivre à couler. Par plaque à préparer, dissoudre 265 mg de levure azotée base (YNB) et 64 mg de mélange de goutte moins la leucine (et tout autre nutriment qui peut être nécessaire pour maintenir le plasmide QSP dans les cellules) dans 34 mL d’eau désionisée.
- Ajouter 34 mL de la solution de milieu de croissance -Leu à chaque bouteille préparée de 100 ml et bouchon avec du papier d’aluminium. Étiqueter la feuille avec la concentration de cuivre prévue.
- Autoclave pour stériliser et dissoudre la gélose en utilisant le cycle liquide recommandé pour l’autoclave.
- Le plus rapidement possible, ajoutez 4 mL de glucose à 20 % p/v (filtré stérile) dans chaque flacon.
- Faire correspondre les étiquettes et ajouter les dilutions de 2 mL de CuSO4 dans le flacon prévu.
REMARQUE: Comme des dizaines de plaques de cuivre peuvent être fabriquées en même temps, chacune avec une concentration différente, étiqueter clairement toutes les bouteilles, tubes et plaques avec la concentration de cuivre prévue évitera toute confusion lors du coulage de la plaque. - Utilisez une plaque d’agitation pour mélanger pendant ~30 s et versez ou pipetez 35 ml dans la plaque étiquetée, en évitant les bulles. Laisser refroidir avant de stocker ou d’utiliser.
NOTE: Fréquemment, les plaques sont fabriquées 1 jour ou 2 jours avant le test et stockées à 4 ° C jusqu’à quelques heures avant utilisation. Les plaques doivent être à température ambiante (RT) avant le début du placage (étape 3.4.).
3. Test ACT1-CUP1
- Étaler les souches souhaitées sur des plaques -Leu.
REMARQUE: Si vous travaillez à partir de stocks cryogéniques, il faut veiller à ce que les cellules soient suffisamment revitalisées avant le placage. Une procédure recommandée pour cela est de strier à partir du stock cryogénique et de le laisser croître pendant 3-5 jours à 30 ° C. Ensuite, reprenez un petit échantillon et laissez-le pousser pendant encore 2-3 jours à 30 ° C. - Cultiver des cultures pendant la nuit dans 10 ml de média.
- Préparer les milieux de croissance -Leu en utilisant les mêmes ratios que ceux décrits à l’étape 2.4.2. Par 10 mL de milieu, ajouter 66 mg d’azote base de levure (YNB) et 16 mg de mélange d’abandon moins leucine à 9 mL d’eau désionisée. Passez à travers un filtre stérile PES de 0,22 μm.
- Par souche de levure, ajouter 9 mL de milieu de croissance -Leu et 1 mL de glucose à 20 % p/v (filtré stérile) dans un tube conique stérile de 50 mL.
- À l’aide d’un bâtonnet stérile ou d’un embout de pipette, recueillir un petit échantillon de levure (~1 mm rond) et inoculer le média.
- Secouer toutes les cultures pendant la nuit à 180 tr/min et 30 °C.
REMARQUE: Si disponible, les rotateurs peuvent être utilisés à la place d’un agitateur.
- Diluer les souches à une DO600 0,5 ± 0,05 dans 10% de glycérol.
- Par souche, ajouter 100 μL de culture dans une cuvette contenant 900 μL d’eau.
- Mesurez le OD600 avec un spectrophotomètre.
- Calculer la dilution requise à une DO600 de 0,5 dans un volume final de 2 mL.
- Diluer chaque souche à OD600 0,5 dans 10% de glycérol (stérile).
- Remesurez le OD600 pour confirmer que la densité de la cellule se situe dans la plage souhaitée de 0,5 ± 0,05.
- Plaquez les contraintes sur les plaques de cuivre.
REMARQUE: Une variété de méthodes peuvent être utilisées pour plaquer les déformations, y compris le pipetage manuel de volumes de 5 à 10 μL, l’utilisation d’un pipetor à répétition ou multicanal, ou l’estampage avec un réplicateur de broches. Cette dernière méthode est décrite ci-dessous, bien que la plupart des étapes soient similaires quelle que soit la méthode.- Installez un lieu de travail stérile et un brûleur Bunsen allumé.
- Pour un réplicateur à 48 broches, pipeter 200 μL de chaque souche diluée dans un puits séparé d’une plaque de 96 puits. Remplissez les espaces vides de la grille 6 x 8 avec 200 μL de glycérol à 10% (stérile).
NOTA : Un exemple de schéma de placage pour neuf souches de levure se trouve dans le tableau supplémentaire 2. - Trempez le réplicateur dans une boîte peu profonde d’éthanol à 95 % (v/v) et à la flamme pour stériliser. Laissez refroidir pendant au moins 2 minutes après l’extinction de la flamme pour éviter que la chaleur ne choque les cellules.
- Placez quatre plaques près du brûleur et retirez les couvercles.
- Trempez le réplicateur dans la plaque de 96 puits et soulevez-le d’un mouvement rapide.
- Placer doucement sur la plaque et balancer légèrement d’avant en arrière pour faciliter un bon transfert.
- Soulevez en un mouvement rapide et placez exactement dans la même orientation dans la plaque de 96 puits.
- Répétez l’opération jusqu’à trois autres plaques. Répétez le processus consistant à tremper le réplicateur dans de l’éthanol, à le brûler pour stériliser et à attendre de refroidir toutes les quatre plaques.
- Une fois qu’une plaque a été plaquée, déplacez-vous d’un mouvement doux sur le côté, mais toujours dans le parapluie de stérilisation de la flamme.
NOTE: Il est recommandé de faire les dilutions de levure et le placage près d’une flamme. Les plaques peuvent facilement être contaminées pendant le séchage. - Laissez les assiettes sécher complètement avant de placer les couvercles, généralement 3-5 min.
- Incuber les assiettes pendant 3 jours à 30 °C.
4. Collecte et analyse des données
- Retirez les plaques de l’incubateur et inspectez-les visuellement.
- Enregistrez les images des plaques avec un appareil photo disponible ou un autre système d’imagerie numérique.
- Enregistrer (ou score) pour chaque souche la dernière concentration de cuivre croissance visible est observée.
REMARQUE: Les cellules sont capables de s’épisser et de rester viables jusqu’à cette concentration. Pour plus de cohérence, utilisez toujours la même méthode, à l’œil nu ou à partir des images sur plaque, pour obtenir la dernière concentration de cuivre viable. De très petites colonies sont parfois visibles à l’œil nu mais pas sur l’image. La différence entre l’inspection visuelle directe ou l’enregistrement à partir d’images est faible, généralement une étape dans le gradient. Comme les images des colonies sont souvent utilisées dans les publications, il est recommandé de noter les images. - Combinez les données de plusieurs tests ACT1-CUP1 pour la même souche afin de tirer des conclusions sur la façon dont le QSP affecte l’épissage.
NOTE: Les chiffres de publication montrent habituellement des images des colonies de levure à une concentration de 0 mM Cu2+ , la dernière concentration de cuivre viable et la concentration subséquente où la colonie est morte. Les données peuvent également être affichées sous forme de graphique à barres avec des barres d’erreur pour l’écart type entre les réplications. Les données n’ont pas besoin d’être normalisées, mais peuvent l’être en réglant la viabilité du contrôle du facteur d’épissage WT à 1 et en comparant l’effet de la ou des mutations introduites.
Résultats
Les tests de croissance, comme ACT1-CUP1, nécessitent l’évaluation visuelle et comparative de plusieurs colonies. Ici, chaque souche a été cultivée jusqu’à saturation pendant une nuit, diluée à une DO600 de 0,5 et plaquée sur 20 plaques contenant une gamme de concentrations de cuivre de 0 mM à 1,1 mM CuSO4 (figure 3). Cette fourchette est inférieure à celle indiquée dans le protocole, car elle a permis l’évaluation complète de l’impact des rapporteurs QSP et ACT1-CUP1 utilisés et décrits ci-dessous. Les plaques ont été imagées et notées (figure 3 et tableau supplémentaire 3).
Pour cette expérience représentative, le fond de levure comprend un gène ADE2 perturbé, ce qui fait que les colonies sont différentes nuances de rouge (Figure 3A,B). Cette perturbation commune de la levure dans la voie de production de l’adénosine provoque une accumulation d’un précurseur pigmenté rouge de l’adénosine. Ainsi, la couleur rouge est un indicateur de la maturité de la colonie de levure (c’est-à-dire la quantité et l’âge des cellules présentes). Pour les besoins d’un test ACT1-CUP1, la couleur rouge peut servir d’indicateur d’espèces fongiques contaminantes si elle est de couleur blanche ou jaune. La couleur peut être une confirmation secondaire de la tolérance au cuivre car les colonies plus viables seront une nuance rouge plus profonde.
Lors du placage avec un réplicateur de broches, il existe plusieurs aberrations courantes. Tout d’abord, il est possible de créer des colonies de forme ovale si le réplicateur est soulevé en se déplaçant à gauche ou à droite (Figure 3B, flèche orange). De plus, des microcolonies peuvent également se former à partir de petites gouttelettes de solution cellulaire si le réplicateur de broches est introduit en angle ou s’il est secoué au-dessus de la plaque (figure 3B, flèche rouge). Souvent inoffensives, les microcolonies peuvent parfois se mélanger à une colonie estampée, ce qui empêche l’interprétation de cette colonie. Parmi les autres problèmes de placage, mentionnons le temps d’attente insuffisant après la stérilisation pour que les broches du réplicateur refroidissent et un contact insuffisant entre la plaque et les broches, de sorte qu’un mauvais transfert du milieu de culture se produit. Dans les deux cas, peu de cellules, voire aucune, se développeront sur la plaque, y compris pour les souches témoins contenant le rapporteur de type sauvage. Comme pour tout test de croissance, quelle que soit la méthode de placage, il est important d’effectuer l’ACT1-CUP1 en triple exemplaire pour confirmer que les résultats sont cohérents et reproductibles. Idéalement, ces différentes répétitions devraient être réalisées sur des plaques de cuivre préparées à des moments différents pour assurer la reproductibilité.
Pour ces expériences représentatives, le rapporteur A3c a été sélectionné pour mettre en évidence l’impact d’une séquence non consensuelle sur la tolérance au cuivre en l’absence de perturbations supplémentaires des splicéosomes. A3c réduit considérablement la quantité d’ARNm CUP1 produite car il perturbe la capacité du spliceosome à reconnaître et à utiliser le 5' SS15. La levure avec le rapporteur A3c a survécu jusqu’à 0,15 mM Cu2+, tandis que les cellules rapporteures de type sauvage ont maintenu leur viabilité jusqu’à la fin de la plage de concentrations de cuivre testées (Figure 3C). Le rapporteur de type sauvage contenant des cellules atteint 2,5 mM Cu2+ sans impact sur la viabilité (données non présentées).
L’ARNn U6 est un composant catalytique essentiel du splicéosome. Plusieurs études ont utilisé ACT1-CUP1 pour étudier l’effet que les mutations peuvent avoir sur cet ARN 16,32,34. Dupliquées pour cette étude, trois séquences d’ARNn U6 ont été étudiées, à savoir la séquence de type sauvage (WT), la position 57 substituée d’une uridine à une cytosine (U57c) et la position 57 substituée d’une uridine à une adénosine (U57a) (Figure 3 et Figure 4). Combiné avec les rapporteurs ACT1-CUP1 qui ont un impact sur les étapes catalytiques de l’épissage, il a été déterminé que U57c favorise la première étape catalytique, et U57a favorise la progression vers la deuxième étape16,32.
Pour mettre en place le test ACT1-CUP1, une souche a été créée avec la copie génomique de l’ARNn U6 supprimée et les séquences de type sauvage ou muté de l’ARNn U6 incluses sur les plasmides. Comme l’ARNn U6 est un composant essentiel de la cellule, trois transformations distinctes ont été utilisées pour d’abord éliminer l’ARNn U6 génomique tout en maintenant la viabilité cellulaire, introduire ensuite des ARNs U6 mutés sur les plasmides et, enfin, ajouter les rapporteurs ACT1-CUP1. Pour la première transformation, une souche de levure cup1Δ a été utilisée dans l’élimination de la copie génomique de l’ARNn U6 tout en ajoutant simultanément l’ARNn WT U6 sur un plasmide marqueur de sélection URA pour maintenir la viabilité. Une transformation ultérieure a ajouté un ARNn U6 de type sauvage ou muté sur un plasmide marqueur de sélection TRP, en sélectionnant par rapport au marqueur URA via la sélection 5-FOA. Ainsi, trois souches de levure cup1Δ ont été générées, chacune avec l’une des séquences d’ARNn U6, à savoir WT, U57a et U57c. Une transformation finale de levure pour chaque souche a ajouté l’un des trois plasmides rapporteurs ACT1-CUP1 différents à utiliser dans cette expérience. Les rapporteurs sélectionnés étaient le rapporteur de type sauvage, A3c, et une mutation de l’adénosine du site de la branche en guanine (BS-G). Au total, neuf souches ont été générées pour cette expérience, chacune contenant une séquence d’ARNn U6 et un rapporteur ACT1-CUP1 (tableau supplémentaire 4 et tableau supplémentaire 5).
Les résultats ont montré que les différentes bases à la position 57 de l’ARNn U6 ont des impacts uniques sur le splicéosome en combinaison avec une mutation 5' SS ou BS (Figure 4). Les rapporteurs A3c et BS-G inhibent principalement l’épissage en stabilisant la conformation de la première étape catalytique14,15. Ainsi, U57c est une mutation additive diminuant la tolérance au cuivre en combinaison avec l’un ou l’autre de ces rapporteurs (Figure 4B). En revanche, U57a augmente la tolérance au cuivre car il favorise la progression vers la deuxième étape (Figure 4B)16,32. La diminution de la tolérance au cuivre de la souche rapporteur BS-G avec U57a par rapport à U6 snRNA WT met en évidence un impact secondaire probable de BS-G sur la deuxième étape de l’épissage16.
Ces résultats soulignent également la nature qualitative de ce test et les raisons pour lesquelles les séquences de requête et de rapporteur de type sauvage devraient être testées. Bien que le schéma général d’augmentation ou de diminution de la tolérance au cuivre soit vrai pour ces mutations de l’ARNn U6 par rapport à l’ARNn U6 de type sauvage, la concentration exacte de cuivre à laquelle les cellules survivent peut différer d’une étude à l’autre (tableau 1) et différait entre ces données représentatives et d’autres résultats publiés. Cela est probablement dû au contexte de la souche contenant la délétion CUP1 , mais peut également être dû à l’état de santé général des souches avant le placage (c.-à-d. combien de temps après la génération de la souche ou du reak cryogénique l’essai a été effectué), aux différences dans la façon dont les plaques sont préparées et à la variabilité entre les différents incubateurs. Une variance similaire a été notée dans Mayerle et al. pour les mutations de requête Prp8 dans la littérature43. Ainsi, la comparaison des tendances de tolérance au cuivre peut être effectuée pour différents dosages ACT1-CUP1, mais la comparaison numérique des concentrations de cuivre ne doit être effectuée que dans le même laboratoire et, parfois, avec le même ensemble de plaques de cuivre.
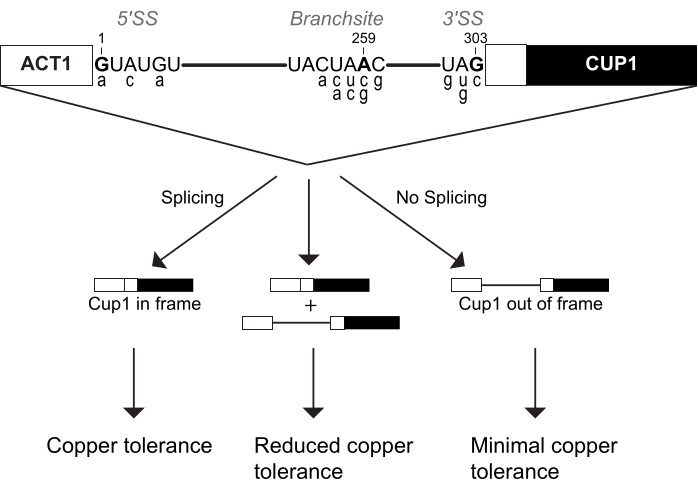
Figure 1 : Conception du rapporteur ACT1-CUP1. La concentration de rapporteur épissé est directement corrélée à la tolérance au cuivre de levure. Le diagramme du rapporteur comprend les trois sites d’épissage du site d’épissage de 5' (5' SS), du site de branche (BS) et du site d’épissage 3' (3' SS). Les séquences consensuelles de levure pour ces sites sont montrées, avec ceux ciblés pour le clivage indiqués en gras et numérotés en fonction de leur emplacement dans l’intron. Les séquences rapporteures ACT1-CUP1 non consensuelles couramment utilisées sont indiquées en minuscules sous leurs emplacements de séquence de consensus correspondants et sont répertoriées dans le tableau 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Flux de travail du test ACT1-CUP1. Pour ce test, une souche de levure doit être cup1Δ leu2 et contenir le plasmide rapporteur ACT1-CUP1 souhaité et le gène QSP, étiqueté gène dans la figure. Le gène QSP doit être inséré génomiquement ou sur un plasmide. Le protocole utilisant un réplicateur de broches implique quatre étapes pour préparer les cellules de levure. L’étape 1 consiste à développer les cellules jusqu’à saturation. L’étape 2 consiste à mesurer la DO 600 de la culture et à la diluer à une DO600 de 0,5. L’étape 3 consiste à répartir sur une plaque de 96 puits. L’étape 4 consiste à plaquer sur des plaques contenant des concentrations croissantes de cuivre (indiquées avec une couleur bleue croissante). Les étapes 1, 2 et 4 seraient identiques pour le pipetage manuel. Une fois plaquées, les plaques sont incubées pendant 3 jours à 30 °C, puis marquées pour leur viabilité. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Vues représentatives des données ACT1-CUP1. Pour cette expérience, les splicéosomes de levure sont mis au défi avec deux mutations différentes de l’ARNn U6 et testés en présence de trois rapporteurs non consensuels. Trois répliques de ce test sont présentées sur les mêmes plaques à des fins de démonstration. Il est recommandé pour ce test de faire des répétitions sur des plaques séparées et à des jours différents. (A) Un essai complet avec un gradient de cuivre de 0 mM à 1,1 mM sur 20 plaques est présenté. À mesure que la concentration de cuivre augmente, les souches à épissage plus faible montrent une confluence réduite au point où la concentration de cuivre devient mortelle. Le fond de levure était ade2 et, par conséquent, les colonies matures sont de couleur rouge. (B) Comparaison des mêmes plaques à 0 mM et 0,1 mM CuSO4 imagées avec une caméra portative par rapport à un système d’imagerie numérique. C’est un exemple de la façon dont un certain nombre de rapporteurs non consensuels peuvent être comparés côte à côte et avec le journaliste de type sauvage. Les observations courantes sur les plaques comprennent une fausse goutte de milieu de culture qui est tombée du réplicateur d’épingles (flèche rouge) et un léger ovale des colonies dû au glissement de la goupille le long de la surface de la plaque ou au mouvement de la plaque avant que la goutte de culture ait suffisamment séché (flèche orange). (C) Exemple de l’effet du rapporteur A3c sur la viabilité cellulaire par rapport au rapporteur de type sauvage. Les images telles que celles montrées en (B) sont recadrées et alignées pour mettre en évidence les différences de croissance à différentes concentrations de cuivre. La tolérance au cuivre de la souche rapporteur A3c diminue à 0,15 mM Cu2+ par rapport à la viabilité de la souche rapporteur de type sauvage jusqu’à la fin de la plage testée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
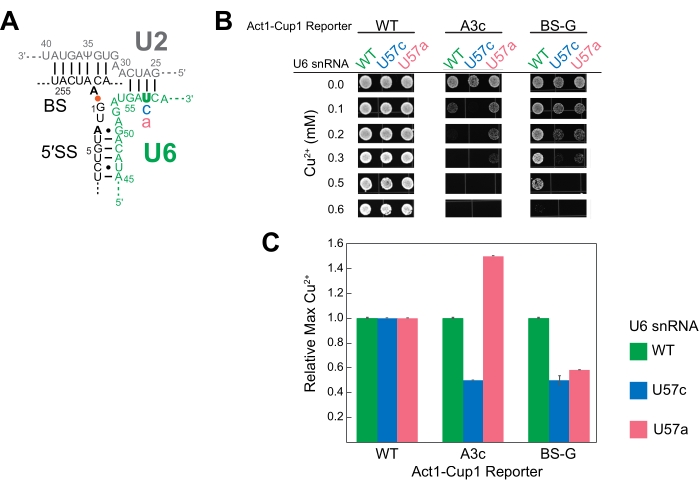
Figure 4 : Résultats représentatifs ACT1-CUP1 de surveillance de l’épissage chez la levure avec des mutations des composants d’épissage. (A) Schéma des composants ARN du site actif immédiatement après la première étape catalytique. Les ARNn U2 et U6 sont duplexés, amenant les 5' SS et BS de l’intron à proximité. La liaison intronique entre A259 (BS) et G1 (5' SS) est indiquée par le point orange. Les emplacements des substitutions de séquences non consensuelles dans le rapporteur ACT1-CUP1 testé dans cette expérience sont indiqués en gras noir. La position mutée dans l’ARNn U6 (U57) est en vert gras, et les bases substituées sont en bleu ou en rose. (B) Une possibilité de présentation des données ACT1-CUP1 dans une publication comprend plusieurs images de colonies à partir de concentrations pertinentes de Cu2+. Le rapporteur de WT a survécu au-delà de la concentration de cuivre testée pour les trois souches d’ARNn U6 interrogées. (C) Un diagramme à barres comparant les effets par rapporteur et par mutant d’ARNn U6. La normalisation est effectuée pour chaque rapporteur ACT1-CUP1 en réglant la tolérance au cuivre de l’ARNn U6 WT à 1 et en calculant le rapport pour les mutations U57c et U57a. Les barres d’erreur représentent l’écart-type de trois répétitions. Veuillez cliquer ici pour voir une version agrandie de cette figure.
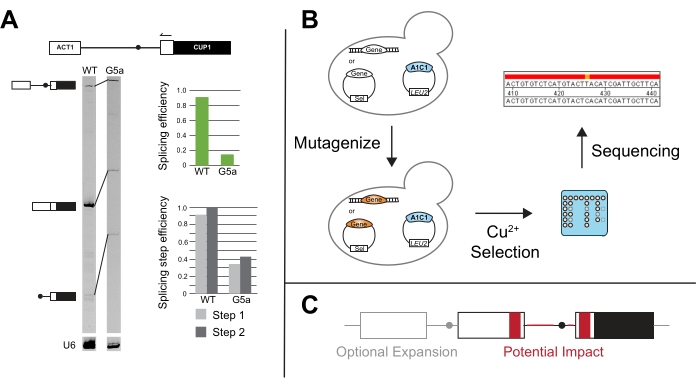
Figure 5 : Méthodes supplémentaires pour compléter les résultats ACT1-CUP1. (A) L’extension de l’amorce est réalisée par un recuit d’amorce dans l’exon 3' ACT1, puis allongement dans l’intron. Dans cet exemple, l’apprêt est marqué avec un colorant IR700, et l’extension de l’apprêt a été réalisée comme décrit dans 20,21. L’extension de l’amorce de l’ARNn U6 est réalisée dans la même réaction pour servir de contrôle de charge. Le gel dénaturant 19:1 bis/acrylamide à 7% résout les produits pré-ARNm, ARNm et lariat après extension de l’amorce à l’aide d’un dispositif d’imagerie sur gel proche infrarouge tel que décrit dans van der Feltz et coll.22. L’intensité des différentes bandes peut être utilisée pour mesurer globalement l’efficacité d’épissage ainsi que pour distinguer les différences d’épissage qui se produisent à la première ou à la deuxième étape, telles que quantifiées avec ImageJ44 ou un autre logiciel de quantification de bande de gel. L’efficacité de l’épissage et l’efficacité de l’étape d’épissage sont calculées comme décrit dans Query et Konarska14. (B) Les cribles mutationnels avec des rapporteurs ACT1-CUP1 peuvent utiliser la sélection du cuivre pour identifier les mutants qui ont un impact sur l’épissage. Le ou les gènes d’intérêt peuvent ensuite être séquencés dans les souches résultantes pour déterminer si la mutation s’est produite dans ce gène. (C) Des modifications peuvent être apportées au rapporteur à l’extérieur des sites d’épissage pour surveiller les changements d’épissage en relation avec la structure des introns, les séquences exoniques, le nombre d’exons ou l’exportation nucléaire d’ARN non épissé. Les régions en gris sont des régions d’expansion facultatives à inclure dans un rapport, et les zones en rouge sont des régions dans lesquelles la séquence et les changements structurels pourraient être testés pour leur impact potentiel sur l’épissage à l’aide du test ACT1-CUP1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nom du journaliste | Région Intronic | Séquence | Dernière concentration viable de Cu2+ (mM) | |
| WT | 5' | GUAUGU | > 2,5 | |
| G1a | 5ʹ | un UAUGU | 0,0133 ou 0,0532 | |
| A3c | 5ʹ | GUcUGU | 0,15^,18 ou 0,216 | |
| G5a | 5ʹ | GUAUaU | 0,303 ou 0,259 | |
| WT | Succursale-site | UACUAAC | > 2,5 | |
| C256a | Succursale-site | UAaUAAC | 0,1526 ou 0,1832 | |
| U257c/a | Succursale-site | UACc/aAAC | 0,226 ou 0,332 ou 0,545 | 0,059,32 |
| A258c/u | Succursale-site | UACUc/uAC | 0,826 | 1,045 ou 1,646 |
| BS-C | Succursale-site | UACUAcC | 0,153 ou 0,1832,56 ou 0,2 26 | |
| BS-G | Succursale-site | UACUAgC | 0,0516,32 ou 0,625 ou 0,846 | |
| C260g | Succursale-site | UACUAAg | 0,826 | |
| WT | 3' | UAG | > 2,5 | |
| U301g | 3ʹ | G AG | 0,1518 | |
| A302g/u | 3' | Ug/uG | 0,0139 | 0,07516 ou 0,1824 |
| G303c | 3ʹ | UAc | 0,0532 | |
Tableau 1 : Liste des déclarants courants et létalité de concentration de Cu2+ signalée. Il y a plus de 100 citations de Lesser et Guthrie3. Bien qu’une petite sélection de ces citations ait été utilisée pour créer ce tableau, elles mettent en évidence la tendance générale des différences légères à modérées entre les études dans les concentrations de viabilité du cuivre déclarées. Dans ACT1-CUP1, il est important de comparer la protéine ou l’ARN de type sauvage aux mutants ayant tous le même fond de souche de levure en utilisant les concentrations publiées comme guide, mais en anticipant que les concentrations observées peuvent différer. Données recueillies à partir de la figure 3 (^) et de multiples publications annotées par les citations suivantes 3,9,16,18,24,25,26,32,45,46.
Tableau supplémentaire 1 : Contenu d’une seule plaque de cuivre et exemple de calculs effectués pour obtenir des dilutions de cuivre de 0 mM à 2,5 mM à partir d’une souche CuSO4 de 1 M. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 2 : Exemple de schéma de placage pour le réplicateur à 48 broches. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 3 : Exemple de viabilité obtenue à partir de plaques de cuivre incubées pendant 3 jours à 30 °C. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 4 : Liste des souches de levure utilisées pour produire les données représentatives. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 5 : Liste des plasmides utilisés pour générer les données représentatives. Plasmides d’ARNn U6 générés et publiés dans des recherches antérieures22,47. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
ACT1-CUP1 est un test de croissance, et il faut veiller à ce que les différences de croissance observées ne puissent être attribuées qu’à des défauts d’épissage. Toutes les souches doivent être manipulées de la même manière avant le placage, y compris avec une longueur et un type de croissance et des conditions d’entreposage similaires. Si vous utilisez des souches sensibles à la température, les dosages ACT1-CUP1 ne doivent être effectués que dans des conditions où ces souches se développent de manière comparable à celle de type sauvage. Dans le même ordre d’idées, pour le composant QSP, il est conseillé d’avoir des fonds de levure et des niveaux d’expression identiques de gènes QSP afin de ne pas brouiller l’interprétation des résultats. Lorsque l’on considère le nombre de QSP et de rapporteurs à utiliser, il n’est pas conseillé de doser plus de 30 souches à la fois avec la méthode du réplicateur de broches. Avec le temps supplémentaire pour effectuer chaque étape, les cellules se déposeront et les résultats du test seront incohérents en raison de la diminution de la viabilité cellulaire.
En plus des limitations inhérentes à ACT1-CUP1 en tant que test de croissance, un QSP peut avoir un impact plus complexe sur l’épissage que ce qui peut être résolu avec cette méthode. Comme l’épissage est un processus en plusieurs étapes et que les facteurs sont recyclés, le phénotype observé peut entraîner la perturbation affectant plus d’une étape d’épissage. Cela est vrai même pour les analyses ultérieures qui peuvent suivre ACT1-CUP1, dont certaines sont décrites ci-dessous. Les données mettront en évidence l’étape la plus perturbée du processus, même si d’autres étapes peuvent être affectées par la fonction altérée du facteur d’épissage.
L’extension d’amorce des rapporteurs ACT1-CUP1 a été utilisée pour la première fois dans l’article original de Lesser et Guthrie et est souvent effectuée si les résultats ACT1-CUP1 montrent un défaut de croissance3. Ce test cible le déclarant et utilise la longueur des produits de PCR pour déterminer les quantités relatives de déclarant non épissé, partiellement épissé et entièrement épissé présent (Figure 5A). L’efficacité globale de l’épissage et si le défaut a un impact plus important sur la première ou la deuxième étape catalytique sont calculées en prenant les ratios des quantités de produit PCR14. Par exemple, le rapporteur 5' SS G5a a réduit l’épissage par rapport au rapporteur de type wild, mais son efficacité de première et deuxième étape suit un schéma similaire à celui du type sauvage (Figure 5A). Cela indique un défaut avant la première étape catalytique, éventuellement dans l’assemblage des spliceosomes, car les deux étapes sont affectées de manière similaire31.
De nouveaux tests ont été développés à partir du test canonique ACT1-CUP1, tels que le criblage de mutants qui améliorent l’épissage en présence d’autres mutants du facteur d’épissage et/ou de séquences d’épissage non consensuelles (Figure 5B). Par exemple, l’exposition de levures contenant le rapporteur ACT1-CUP1 aux UV puis la sélection en présence de cuivre ont donné des mutants Prp8 et Hsh155 qui ont amélioré l’épissage des séquences non consensuelles14,19.
Au-delà de l’étude de l’effet des sites d’épissage et des facteurs constitutifs d’épissage, la dépendance à la croissance de CUP1 a été utilisée pour étudier l’épissage multiple des introns, le contrôle des exportations nucléaires et l’impact de l’UTR et d’autres séquences périphériques sur l’épissage (Figure 5C). Certaines de ces études ont créé des rapporteurs avec CUP1 et d’autres gènes de levure contenant des introns qui peuvent avoir des modèles d’épissage plus complexes pour étudier l’effet sur la structure secondaire intronique et l’épissage du transcrit multi-intron 48,49,50,51,52. Le lien entre l’épissage et l’exportation nucléaire a été étudié en ayant des transcriptions épissées ou non épissées codant CUP1 dans l’image53,54. La longueur de la piste de pyrimidine et la dépendance de la sélection du site d’épissure due à des facteurs spécifiques ont également été testées 20,55,56,57. Ces exemples et bien d’autres mettent en évidence la polyvalence des tests de croissance ACT1-CUP1 et d’autres tests de croissance CUP1.
Le test ACT1-CUP1 relie les perturbations à un cycle de réaction complexe avec un phénotype de croissance simple avec une large plage de sensibilité. Ce test hérité a été utilisé par plusieurs laboratoires pour jeter les bases de la compréhension du cycle d’épissage. Plus récemment, ACT1-CUP1 a été utilisé pour répondre à des questions qui découlent de la richesse des données structurelles maintenant disponibles21,22,25. Les études structurales des splicéosomes liés à des séquences non consensuelles pourraient être jumelées aux résultats ACT1-CUP1 pour interpréter la corrélation entre la structure altérée et la fonction altérée. ACT1-CUP1 est un premier criblage idéal pour l’épissage de mutations qui peuvent compléter une analyse plus complexe.
Déclarations de divulgation
L’auteur n’a rien à divulguer.
Remerciements
Merci à Aaron Hoskins et aux membres du laboratoire Hoskins de l’Université du Wisconsin-Madison pour l’utilisation de souches et d’équipements de levure dans la génération des figures 3 à 5. Merci à Harpreet Kaur et Xingyang Fu pour leurs commentaires perspicaces sur le manuscrit. Merci aux étudiants, au personnel et aux professeurs de l’Université Northwest qui ont soutenu la rédaction, le montage et le tournage de cet article. Merci à Isabelle Marasigan pour son aide dans le tournage de cette méthode.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-129 | Or comparable item from a different manufacturer. |
| 2 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-138 | Or comparable item from a different manufacturer. |
| 50 mL sterile centrifuge tubes | Fisher Scientific | 07-201-332 | Or comparable item from a different manufacturer. |
| 96-well round bottom microplate | Fisher Scientific | 07-200-760 | Or comparable item from a different manufacturer. |
| 190 proof ethanol | Fisher Scientific | 22-032-600 | Or comparable item from a different manufacturer. |
| 500 mL Filter System (0.22 µm) | CellTreat Scientific Products | 229707 | Or comparable item from a different manufacturer. |
| Agar | Fisher Scientific | BP1423-500 | Any molecular grade agar will work. |
| Autoclave | Tuttnauer | 3870EA | Or comparable item from a different manufacturer. |
| Bunsen burner | Humboldt | PN6200.1 | Or comparable item from a different manufacturer. |
| Cell Density Meter | VWR | 490005-906 | Or other spectral device that can measure absorbance at 595 nm. |
| Copper sulfate Pentahydrate | Fisher Scientific | LC134051 | Or comparable item from a different manufacturer. |
| Digital imaging system | Cytiva | 29399481 | ImageQuant 4000 (used for Figure 3), Amersham ImageQuant 800, or comparable item from a different manufacturer. |
| Dropout mix (-Leu) | USBiological Life Sciences | D9525 | Use the appropriate drop out mix for your experiment. It is possible you will be using a yeast nutrient marker for your query perturbation also. In that case, the drop out mix should be for that marker and Leu |
| D-Glucose | Fisher Scientific | AAA1682836 | Or comparable item from a different manufacturer. |
| Gel band quantifying software | Cytiva | 29-0006-05 | ImageQuant TL v8.1 (used for figure 5A) or comparable item from a different manufacturer. |
| Hand held camera | Nikon | D3500 | Or comparable item from a different manufacturer. |
| Near infra-red gel imaging device | Cytiva | 29238583 | Amersham Typhoon NIR (used for Figure 5a) or comparable item from a different manufacturer. |
| Laboratory grade clamp | Fisher Scientific | 05-769-7Q | Or comparable item from a different manufacturer. |
| Laboratory grade stand and clamp | Fisher Scientific | 12-000-101 | Or comparable item from a different manufacturer. |
| Magnetic stir bars | Fisher Scientific | 14-513-51 | Or comparable item from a different manufacturer. |
| Pin replicator | VP Scientific | VP 407AH | |
| Semi-micro disposable cuvettes | VWR | 97000-590 | Or comparable item from a different manufacturer. |
| Shaker | JEIO Tech | IST-3075 | Or comparable item from a different manufacturer. |
| Spectrophotometer | Biowave | 80-3000-45 | Or any spectophotometer that can measure the absorbance at 600 nm. |
| Square plates | VWR | 102091-156 | Circular plates may also be used though are more challenging if using a pin replicator. |
| Stir plate | Fisher Scientific | 11-520-16S | Or comparable item from a different manufacturer. |
| Yeast nitrogen base | USBiological Life Sciences | Y2025 | Or comparable item from a different manufacturer. |
Références
- Wahl, M. C., Will, C. L., Luhrmann, R. The spliceosome: Design principles of a dynamic RNP machine. Cell. 136 (4), 701-718 (2009).
- Wilkinson, M. E., Charenton, C., Nagai, K. RNA splicing by the spliceosome. Annual Review of Biochemistry. 89, 359-388 (2020).
- Lesser, C. F., Guthrie, C. Mutational analysis of pre-mRNA splicing in Saccharomyces cerevisiae using a sensitive new reporter gene, CUP1. Genetics. 133 (4), 851-863 (1993).
- Ng, R., Abelson, J. Isolation and sequence of the gene for actin in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 77 (7), 3912-3916 (1980).
- Gallwitz, D., Sures, I. Structure of a split yeast gene: Complete nucleotide sequence of the actin gene in I. Proceedings of the National Academy of Sciences of the United States of America. 77 (5), 2546-2550 (1980).
- Fogel, S., Welch, J. W., Cathala, G., Karin, M. Gene amplification in yeast: CUP1 copy number regulates copper resistance. Current Genetics. 7 (5), 347-355 (1983).
- Hamer, D. H., Thiele, D. J., Lemontt, J. E. Function and autoregulation of yeast copperthionein. Science. 228 (4700), 685-690 (1985).
- Winge, D. R., Nielson, K. B., Gray, W. R., Hamer, D. H. Yeast metallothionein. Sequence and metal-binding properties. Journal of Biological Chemistry. 260 (27), 14464-14470 (1985).
- Burgess, S. M., Guthrie, C. A mechanism to enhance mRNA splicing fidelity: The RNA-dependent ATPase Prp16 governs usage of a discard pathway for aberrant lariat intermediates. Cell. 73 (7), 1377-1391 (1993).
- Collins, C. A., Guthrie, C. Allele-specific genetic interactions between Prp8 and RNA active site residues suggest a function for Prp8 at the catalytic core of the spliceosome. Genes & Development. 13 (15), 1970-1982 (1999).
- Siatecka, M., Reyes, J. L., Konarska, M. M. Functional interactions of Prp8 with both splice sites at the spliceosomal catalytic center. Genes & Development. 13 (15), 1983-1993 (1999).
- Umen, J. G., Guthrie, C. Mutagenesis of the yeast gene PRP8 reveals domains governing the specificity and fidelity of 3' splice site selection. Genetics. 143 (2), 723-739 (1996).
- Grainger, R. J., Beggs, J. D. Prp8 protein: At the heart of the spliceosome. RNA. 11 (5), 533-557 (2005).
- Query, C. C., Konarska, M. M. Suppression of multiple substrate mutations by spliceosomal prp8 alleles suggests functional correlations with ribosomal ambiguity mutants. Molecular Cell. 14 (3), 343-354 (2004).
- Konarska, M. M., Vilardell, J., Query, C. C. Repositioning of the reaction intermediate within the catalytic center of the spliceosome. Molecular Cell. 21 (4), 543-553 (2006).
- Liu, L., Query, C. C., Konarska, M. M. Opposing classes of prp8 alleles modulate the transition between the catalytic steps of pre-mRNA splicing. Nature Structural and Molecular Biology. 14 (6), 519-526 (2007).
- MacRae, A. J., et al. Prp8 positioning of U5 snRNA is linked to 5' splice site recognition. RNA. 24 (6), 769-777 (2018).
- Query, C. C., Konarska, M. M. CEF1/CDC5 alleles modulate transitions between catalytic conformations of the spliceosome. RNA. 18 (5), 1001-1013 (2012).
- Tang, Q., et al. SF3B1/Hsh155 HEAT motif mutations affect interaction with the spliceosomal ATPase Prp5, resulting in altered branch site selectivity in pre-mRNA splicing. Genes & Development. 30 (24), 2710-2723 (2016).
- Carrocci, T. J., Zoerner, D. M., Paulson, J. C., Hoskins, A. A. SF3b1 mutations associated with myelodysplastic syndromes alter the fidelity of branchsite selection in yeast. Nucleic Acids Research. 45 (8), 4837-4852 (2017).
- Kaur, H., Groubert, B., Paulson, J. C., McMillan, S., Hoskins, A. A. Impact of cancer-associated mutations in Hsh155/SF3b1 HEAT repeats 9-12 on pre-mRNA splicing in Saccharomyces cerevisiae. PLoS One. 15 (4), 0229315(2020).
- vander Feltz, C., et al. Saccharomyces cerevisiae Ecm2 modulates the catalytic steps of pre-mRNA splicing. RNA. 27 (5), 591-603 (2021).
- Carrocci, T. J., Paulson, J. C., Hoskins, A. A. Functional analysis of Hsh155/SF3b1 interactions with the U2 snRNA/branch site duplex. RNA. 24 (8), 1028-1040 (2018).
- Hogg, R., de Almeida, R. A., Ruckshanthi, J. P., O'Keefe, R. T. Remodeling of U2-U6 snRNA helix I during pre-mRNA splicing by Prp16 and the NineTeen Complex protein Cwc2. Nucleic Acids Research. 42 (12), 8008-8023 (2014).
- Hansen, S. R., Nikolai, B. J., Spreacker, P. J., Carrocci, T. J., Hoskins, A. A. Chemical inhibition of pre-mRNA splicing in living Saccharomyces cerevisiae. Cell Chemical Biology. 26 (3), 443-448 (2019).
- Xu, Y. Z., Query, C. C. Competition between the ATPase Prp5 and branch region-U2 snRNA pairing modulates the fidelity of spliceosome assembly. Molecular Cell. 28 (5), 838-849 (2007).
- Staley, J. P., Guthrie, C. An RNA switch at the 5' splice site requires ATP and the DEAD box protein Prp28p. Molecular Cell. 3 (1), 55-64 (1999).
- Bousquet-Antonelli, C., Presutti, C., Tollervey, D. Identification of a regulated pathway for nuclear pre-mRNA turnover. Cell. 102 (6), 765-775 (2000).
- Villa, T., Guthrie, C. The Isy1p component of the NineTeen complex interacts with the ATPase Prp16p to regulate the fidelity of pre-mRNA splicing. Genes & Development. 19 (16), 1894-1904 (2005).
- Mayas, R. M., Maita, H., Staley, J. P. Exon ligation is proofread by the DExD/H-box ATPase Prp22p. Nature Structure and Molecular Biology. 13 (6), 482-490 (2006).
- Lesser, C. F., Guthrie, C. Mutations in U6 snRNA that alter splice site specificity: Implications for the active site. Science. 262 (5142), 1982-1988 (1993).
- McPheeters, D. S. Interactions of the yeast U6 RNA with the pre-mRNA branch site. RNA. 2 (11), 1110-1123 (1996).
- Perriman, R. J., Ares, M. Rearrangement of competing U2 RNA helices within the spliceosome promotes multiple steps in splicing. Genes & Development. 21 (7), 811-820 (2007).
- Mefford, M. A., Staley, J. P. Evidence that U2/U6 helix I promotes both catalytic steps of pre-mRNA splicing and rearranges in between these steps. RNA. 15 (7), 1386-1397 (2009).
- Hilliker, A. K., Mefford, M. A., Staley, J. P. U2 toggles iteratively between the stem IIa and stem IIc conformations to promote pre-mRNA splicing. Genes & Development. 21 (7), 821-834 (2007).
- Wu, G., et al. Pseudouridines in U2 snRNA stimulate the ATPase activity of Prp5 during spliceosome assembly. EMBO Journal. 35 (6), 654-667 (2016).
- Crotti, L. B., Bacikova, D., Horowitz, D. S. The Prp18 protein stabilizes the interaction of both exons with the U5 snRNA during the second step of pre-mRNA splicing. Genes & Development. 21 (10), 1204-1216 (2007).
- Fogel, S., Welch, J. W. Tandem gene amplification mediates copper resistance in yeast. Proceedings of the National Academy of Sciences of the United States of America. 79 (17), 5342-5346 (1982).
- Gardner, J. M., Jaspersen, S. L. Manipulating the yeast genome: Deletion, mutation, and tagging by PCR. Methods Molecular Biology. 1205, 45-78 (2014).
- JoVE. Yeast Transformation and Cloning. In Biology I: yeast, Drosophila and C. Elegant. JoVE Science Education Database. , Cambridge, MA. (2021).
- Gietz, R. D., Woods, R. A. Yeast transformation by the LiAc/SS Carrier DNA/PEG method. Methods Molecular Biology. 313, 107-120 (2006).
- Gietz, R. D., Woods, R. A. Genetic transformation of yeast. Biotechniques. 30 (4), 816(2001).
- Mayerle, M., et al. Structural toggle in the RNaseH domain of Prp8 helps balance splicing fidelity and catalytic efficiency. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), 4739-4744 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Beier, D. H., et al. Dynamics of the DEAD-box ATPase Prp5 RecA-like domains provide a conformational switch during spliceosome assembly. Nucleic Acids Research. 47 (20), 10842-10851 (2019).
- vander Feltz, C., DeHaven, A. C., Hoskins, A. A. Stress-induced pseudouridylation alters the structural equilibrium of yeast U2 snRNA Stem II. Journal of Molecular Biology. 430 (4), 524-536 (2018).
- Rodgers, M. L., Didychuk, A. L., Butcher, S. E., Brow, D. A., Hoskins, A. A. A multi-step model for facilitated unwinding of the yeast U4/U6 RNA duplex. Nucleic Acids Research. 44 (22), 10912-10928 (2016).
- Stutz, F., Rosbash, M. A functional interaction between Rev and yeast pre-mRNA is related to splicing complex formation. EMBO Journal. 13 (17), 4096-4104 (1994).
- Libri, D., Lescure, A., Rosbash, M. Splicing enhancement in the yeast rp51b intron. RNA. 6 (3), 352-368 (2000).
- Libri, D., Stutz, F., McCarthy, T., Rosbash, M. RNA structural patterns and splicing: Molecular basis for an RNA-based enhancer. RNA. 1 (4), 425-436 (1995).
- Howe, K. J., Kane, C. M., Ares, M. Perturbation of transcription elongation influences the fidelity of internal exon inclusion in Saccharomyces cerevisiae. RNA. 9 (8), 993-1006 (2003).
- Cuenca-Bono, B., et al. SUS1 introns are required for efficient mRNA nuclear export in yeast. Nucleic Acids Research. 39 (19), 8599-8611 (2011).
- Scherrer, F. W., Spingola, M. A subset of Mer1p-dependent introns requires Bud13p for splicing activation and nuclear retention. RNA. 12 (7), 1361-1372 (2006).
- Hálová, M., et al. Nineteen complex-related factor Prp45 is required for the early stages of cotranscriptional spliceosome assembly. RNA. 23 (10), 1512-1524 (2017).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Crotti, L. B., Horowitz, D. S. Exon sequences at the splice junctions affect splicing fidelity and alternative splicing. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 18954-18959 (2009).
- Perriman, R., Ares, M. Invariant U2 snRNA nucleotides form a stem loop to recognize the intron early in splicing. Molecular Cell. 38 (3), 416-427 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon