Method Article
ACT1-CUP1-Assays bestimmen die substratspezifischen Sensitivitäten von spleißeosomalen Mutanten in knospender Hefe
In diesem Artikel
Zusammenfassung
Der ACT1-CUP1-Assay, ein Kupferwachstumsassay, ermöglicht eine schnelle Ablesung des Precursor-Messenger-RNA-Spleißens (pre-mRNA) und des Einflusses mutierter Spleißfaktoren auf die spleißöosomale Funktion. Diese Studie bietet ein Protokoll und hebt die Anpassungsmöglichkeiten hervor, um die interessierende Spleißfrage zu beantworten.
Zusammenfassung
Mutationen, die in das Spleißosom oder sein Substrat eingebracht wurden, haben wesentlich zum Verständnis der Feinheiten der spleißeosomalen Funktion beigetragen. Ob krankheitsbedingt oder funktionell selektiert, viele dieser Mutationen wurden mit Wachstumstests im Modellorganismus Saccharomyces cerevisiae (Hefe) untersucht. Der spleißspezifische Kupferwachstumsassay oder ACT1-CUP1-Assay bietet eine umfassende Analyse der Mutation auf phänotypischer Ebene. Der ACT1-CUP1-Assay verwendet Reporter, die bei korrektem Spleißen Kupfertoleranz verleihen. In Gegenwart von Kupfer korrelieren also Veränderungen der Hefelebensfähigkeit mit Veränderungen der mRNA-Produktion durch Spleißen. In einem typischen Experiment wird das Hefespleißosom mit verschiedenen Nicht-Konsens-Spleißreportern und der interessierenden Spleißfaktor-Mutation herausgefordert, um synergetische oder antithetische Auswirkungen auf das Spleißen nachzuweisen. Hier wird eine vollständige Beschreibung der Kupferplattenherstellung, der Beschichtung von Hefezellen und der Datenauswertung gegeben. Eine Auswahl ergänzender Experimente wird beschrieben, die die Vielseitigkeit der ACT1-CUP1-Reporter hervorheben. Der ACT1-CUP1-Assay ist dank des direkten Auslesens von Mutationseffekten und der Vergleichsmöglichkeiten aus der fortgesetzten Verwendung im Feld ein praktisches Werkzeug in der Spleiß-Toolbox.
Einleitung
Das Spleißosom ist eine große, biologische Maschine, die die Entfernung von Introns, nicht-kodierenden Regionen in der Vorläufer-Boten-RNA (pre-mRNA)1,2, katalysiert. Die Charakterisierung der Wirkung einer Einzelpunktmutante in 1 der fast 100 Proteine und 5 nicht-kodierenden RNAs ist oft mehrdeutig, wenn das Protein oder die RNA isoliert untersucht wird. Die Veränderung der Funktion der mutierten Komponente kann am besten in vivo im Kontext des vollen, funktionierenden Spleißosoms beurteilt werden.
Der hier beschriebene Kupferwachstumstest ist ein schnelles Maß für die Spleißeffizienz in Saccharomyces cerevisiae oder Knospungshefe. Dieser von C.F. Lesser und C. Guthrie entwickelte und 1993 veröffentlichte Assay kombiniert die einfache Arbeit mit einem einfachen Modellorganismus und dem einfachen Auslesen der Zelllebensfähigkeit3. Die Lebensfähigkeit korreliert damit, wie gut die Spleißosomen in diesen Zellen das Reportertranskript erkennen und spleißen können.
Dieser Kupferwachstumstest wird häufiger als ACT1-CUP1-Assay bezeichnet. Der Name ACT1-CUP1 stammt von den beiden Genen, die fusioniert wurden, um einen Reporter der Spleißeffizienz zu schaffen. ACT1 ist das Aktin-Gen der Hefe, das stark exprimiert wird und ein effizient gespleißtes Intron 4,5 aufweist. Cup1p ist ein Kupferchelator, der Kupfer in der Zelle sequestriert, um Störungen mit regulären Zellfunktionenzu verhindern 6,7,8. Der ACT1-CUP1-Reporter enthält diese Gene sequenziell, so dass CUP1 nur dann im richtigen Leserahmen ist, wenn das Intron von ACT1 vor der mRNA gespleißt wird (Abbildung 1). Das resultierende Fusionsprotein enthält die ersten 21 Aminosäuren des Aktins und das Cup1p-Protein in voller Länge, was die Lebensfähigkeit der Hefe in einer kupferreichen Umgebung erhöht3. So führt eine Erhöhung der Spleißmenge des Reporters zu einer höheren Konzentration von Cup1p und einer höheren Kupferbeständigkeit (Abbildung 1). Im Vergleich zu anderen Reportergenen beeinflusst CUP1 die Zelllebensfähigkeit bereits bei niedrigen Konzentrationen, hat einen großen Sensitivitätsbereich und kann verwendet werden, um Mutationen 3,6,7 direkt für das Spleißenauszuwählen. Darüber hinaus ist CUP1 für das Standard-Hefewachstum nicht essentiell, so dass die zelluläre Homöostase während des Aufbaus für diesen Assay nicht beeinflusst wird. Ergänzend zu Deletions- oder Temperaturwachstumsassays liefert ACT1-CUP1 Informationen über die Auswirkungen auf das Spleißen unter ansonsten optimalen Hefewachstumsbedingungen.
Das Spleißosom erkennt sein Substrat durch drei intronische Sequenzen, nämlich die 5'-Spleißstelle (5' SS), die Zweigstelle (BS) und die 3'-Spleißstelle (3' SS). Zahlreiche ACT1-CUP1-Reporter wurden an diesen Standorten generiert, die Nicht-Konsens-Sequenzen enthalten. Eine Auswahl der häufigsten ACT1-CUP1-Reporter ist in Abbildung 1 und Tabelle 1 dargestellt. Da das Spleißosom mit jeder Spleißstelle an verschiedenen Punkten des Spleißzyklus einzigartig interagiert, kann die Robustheit des Spleißosoms in verschiedenen Schritten getestet werden, je nachdem, welcher Nicht-Konsens-Reporter verwendet wird. Nicht-Konsens-Reporter werden nach der mutierten Position innerhalb des Introns und der Basis, zu der es mutiert wurde, benannt. Zum Beispiel ist A3c ein Reporter mit einer Mutation am 5' SS, insbesondere Position 3 vom Konsensadenosin zu einem Cytosin. Dieser Reporter wird stark mit Spleißosomenmutationen interagieren, die die 5'-SS-Selektion und -Verwendung beeinflussen. In ihrer ersten Studie bestimmten Lesser und Guthrie, welche 5'-SS-Mutationen das Spleißen hemmten3. Später im selben Jahr wurden Nicht-Konsens-Reporter an allen drei Spleißstellen von Burgess und Guthrie in einem Suppressor-Screening von Mutationen in der ATPase Prp16p9 veröffentlicht. Der ACT1-CUP1-Assay war ein wichtiger Schlüssel zum Verständnis der Robustheit und Selektivität des Hefespleißosoms und zur Ableitung der Funktion der Spleißosomen anderer Eukaryoten.
Da ACT1-CUP1-Reporter ohne Konsens das Spleißosom für weitere Störungen sensibilisieren, kann der Einfluss einer einzelnen Spleißfaktormutation durch die Reporter charakterisiert werden, die sie positiv oder negativ beeinflusst. Dies wurde auf vielfältige Weise auf das Spleißen von Forschungsfragen angewendet. Erstens kann und wurde der ACT1-CUP1-Assay als genetischer Screen für Mutationen in Spleißfaktoren verwendet. So dient beispielsweise Prp8p, das größte Spleißprotein, als Plattform, auf der der RNA-Kern des Spleißosoms die Spleißreaktion katalysiert. Dies wurde zum Teil dadurch abgeleitet, wie Prp8p-Mutanten das Spleißen verschiedener ACT1-CUP1-Reporter verbesserten oder reduzierten 10,11,12,13,14,15,16,17. Andere Proteinkomponenten des Spleißosoms wurden ebenfalls mit ACT1-CUP1 untersucht, darunter Hsh155p, Cwc2p, Cef1p und Ecm2p 18,19,20,21,22,23,24,25. Die energetischen Schwellenwerte für Prp16p und vier weitere ATPasen, die am spleißeosomalen Übergang beteiligt sind, wurden ebenfalls mit diesem Assay 9,26,27,28,29,30 untersucht. Die kleinen nukleären RNAs (snRNAs) wurden ebenfalls umfassend unter Verwendung von ACT1-CUP1 untersucht, um die von ihnen koordinierten prä-mRNA-Sequenzen und die Veränderungen in der Sekundärstruktur der snRNAs während des Spleißens zu identifizieren 3,31,32,33,34,35,36,37.
Der ACT1-CUP1-Assay erfordert einen Hefestamm, bei dem alle Kopien des CUP1-Gens ausgeschaltet wurden. Da CUP1 eine hohe Exemplarzahl 6,38 haben kann, kann die Vorbereitung eines vollständigen Knock-out-Stammes mehrere Runden oder ein umfangreiches Screening erfordern. Infolgedessen wurden Cup1Δ-Hefestämme oft zwischen Laboren geteilt, ebenso wie die Reporter.
Wenn Mutation(en) in einem Spleißfaktor anhand einer Plasmidkopie beurteilt werden, sollte das Wildtyp-Gen für diesen Faktor ausgeschaltet werden. Darüber hinaus sollte der Hefehintergrund die Auswahl von mindestens zwei Plasmiden ermöglichen, von denen eines einen ACT1-CUP1-Reporter enthält, das historisch auf einem Leucin-Nährstoffselektionsplasmid basiert, und eines, das eine Mutation oder Störung in der zu untersuchenden Spleißmaschinerie enthält (Abbildung 2). In der Regel testen in einem einzigen Assay mehrere Hefestämme, von denen jeder die QSP (Query Splicing Perturbation) trägt, und ein anderer Reporter die Auswirkungen der Abfrage auf das Spleißen.
Die unabhängigen Variablen im ACT1-CUP1-Assay ermöglichen es einem Forscher, den Schweregrad eines QSP zu beurteilen. Diese unabhängigen Variablen sind die Konzentration von Kupfer und die Auswahl mehrerer Nicht-Konsens-Spleißreporter. Erstens, da die Hefestämme auf Platten gezüchtet werden, die eine Reihe von Kupferkonzentrationen enthalten (Abbildung 2), beinhaltet die Erstellung des Assays die Auswahl des verwendeten Konzentrationsgradienten. Studien können einen Kupferkonzentrationsgradienten verwenden, um eine erste Anzeige der Lebensfähigkeit zu erhalten, und dann den Assay mit einem feineren Gradienten wiederholen, um subtile Rentabilitätsunterschiede zu identifizieren. Die zweite Variable ist die große Auswahl an ACT1-CUP1-Reportern, die getestet werden können (Abbildung 1 und Tabelle 1). Wenn der QSP die Lebensfähigkeit der Hefe in Gegenwart eines Nicht-Konsens-Reporters anders beeinflusst als der Wildtyp, kann der Schluss gezogen werden, dass der QSP einen Schritt beim Spleißen oder einen Bereich des Spleißosoms beeinflusst, der während der Erkennung oder Verarbeitung dieser Region des Introns wichtig ist.
Die Hefe-Toolbox ist umfangreich und der ACT1-CUP1-Assay ist ein integraler Bestandteil der Spleißforschung. Der ACT1-CUP1-Assay wird häufig zusammen mit einer eingehenderen genetischen, strukturellen und/oder biochemischen Analyse auf die Auswirkungen eines QSP durchgeführt. Da diese detaillierteren Studien in der Regel ein längeres Verfahren und/oder einen höheren Preis haben, ist ein häufiger Ansatz, zuerst mit ACT1-CUP1 nach interessanten Mutanten zu suchen.
Hier wird ein ACT1-CUP1-Assay-Protokoll einschließlich Kupferplattenvorbereitung bereitgestellt. Dieser Assay liefert den Forschern eine erste Antwort auf die Wirkung eines QSP auf das Spleißen und welche intronischen Regionen am stärksten von der Störung betroffen sind.
Protokoll
1. Hefestammkonstruktion
- Erzeugen oder erhalten Sie einen S. cerevisiae-Stamm , dessen Hintergrund leu2 und cup1Δ umfasst. Um diesen Hintergrund zu erzeugen, verwenden Sie die etablierte Hefemethode, die Lithiumacetat und einzelsträngige DNA39 verwendet.
HINWEIS: Haploide Hefestämme können eine, zwei oder mehr Kopien von CUP1 6,38 enthalten. Beziehen Sie sich auf genomische Informationen für den ausgewählten Hefestamm, wenn Sie Knock-out-Primer entwerfen, die die CUP1-Genorte flankieren. - Führen Sie eine Hefetransformation durch, um das QSP entweder durch genomische Inkorporation oder auf einem Plasmid einzubauen. Verwenden Sie ein etabliertes Protokoll, wie es in früheren Forschungen 40,41,42 beschrieben wurde.
- Führen Sie eine Hefeumwandlung mit den resultierenden Stämmen aus Schritt 1.2 durch. , um das gewünschte ACT1-CUP1-Reporterplasmid hinzuzufügen.
HINWEIS: Die Zellen müssen auf Leucin-Drop-out-Platten (-Leu) und -Medien gehalten werden, um die Retention der ACT1-CUP1-Reporterplasmide nach dieser Transformation sicherzustellen. - Führen Sie die Schritte 1.2 aus. und 1.3. für jedes zu testende QSP- und jedes ACT1-CUP1-Reporterplasmid, einschließlich Kontrollstämme.
2. Kupferplattenvorbereitung
- Wählen Sie einen Kupferkonzentrationsbereich, der zu den zu testenden Reportern geeignet ist (siehe Tabelle 1 für die Letalität häufig verwendeter Reporter).
HINWEIS: Ein Beispiel für einen umfassenden Kupferkonzentrationsbereich sind 30 verschiedene Kupferkonzentrationen von 0 mM, 0,025 mM, 0,05 mM, 0,075 mM, 0,1 mM, 0,15 mM, 0,2 mM, 0,25 mM, 0,3 mM, 0,35 mM, 0,4 mM, 0,45 mM, 0,5 mM, 0,6 mM, 0,7 mM, 0,8 mM, 0,9 mM, 1,0 mM, 1,1 mM, 1,2 mM, 1,3 mM, 1,4 mM, 1,5 mM, 1,6 mM, 1,7 mM, 1,8 mM, 1,9 mM, 2,0 mM, 2,25 mM und 2,5 mM Cu2+. - Stellen Sie eine Stammlösung aus 1 MCuSO4 und einen sterilen Filter durch einen 0,22 μm PES (Polyethersulfon) Sterilfilter her.
- Bereiten Sie pro gewünschter Kupferplatte eine 2 ml Verdünnung der CuSO4-Brühe in sterilem Wasser vor.
HINWEIS: Da die Platte mit 0 mM Cu 2+ immer als Referenz analysiert und abgebildet wird, wird empfohlen, zwei 0 mM Cu2+ Platten herzustellen, eine am Anfang und eine am Ende des Galvanisierungsschritts (Schritt 3.4.).- Berechnen Sie die Lagermenge für die gewünschte Kupferendkonzentration in 40 ml des Plattenvolumens (Zusatztabelle 1).
- Die berechnete Menge steriles Wasser und 1 M CuSO4 Schaft in ein steriles 2 ml Röhrchen geben.
- Gießen Sie Platten für den ACT1-CUP1-Assay.
HINWEIS: Eine Alternative zum folgenden Protokoll besteht darin, die Medien und Agar zunächst in einem großen Behälter zu kombinieren und nach dem Autoklavieren in kleinere Behälter aliquot zu machen, um unterschiedliche Kupferkonzentrationen für jede Platte zu erreichen. Unabhängig davon, welche Methode gewählt wird, ist es wichtig sicherzustellen, dass die Medienkonzentration zwischen allen Platten konsistent ist, obwohl jede eine andere Kupferkonzentration aufweist.- Beschriften Sie jede leere Platte, die gegossen werden soll, mit der endgültigen Kupferkonzentration, die sie enthält. Bereiten Sie mindestens eine quadratische Platte pro zu prüfender Kupferkonzentration vor.
- Kennzeichnen Sie eine 100-ml-Flasche pro zu testender Kupferkonzentration.
- Zu jeder Flasche fügen Sie 790 mg Agar (2% w/v Agar) und einen Rührriegel hinzu.
- In einem großen Becherglas das -Leu-Wachstumsmedium für alle zu gießenden Kupferplatten vermischen. Pro herzustellender Platte werden 265 mg Hefestickstoffbase (YNB) und 64 mg Drop-out-Mischung minus Leucin (und alle anderen Nährstoffe, die zur Aufrechterhaltung des QSP-Plasmids in den Zellen erforderlich sind) in 34 ml entionisiertem Wasser gelöst.
- Zu jeder vorbereiteten 100-ml-Flasche 34 mL der -Leu-Wachstumsmedienlösung geben und mit Aluminiumfolie verschließen. Beschriften Sie die Folie mit der vorgesehenen Kupferkonzentration.
- Autoklav zum Sterilisieren und Auflösen des Agars unter Verwendung des empfohlenen Flüssigkeitszyklus für den Autoklaven.
- Geben Sie so schnell wie möglich 4 ml 20% w/v Glukose (steril gefiltert) in jede Flasche.
- Passen Sie die Etiketten an und fügen Sie die 2-ml-Verdünnungen von CuSO4 in die beabsichtigte Flasche hinzu.
HINWEIS: Da Dutzende von Kupferplatten gleichzeitig hergestellt werden können, jede mit einer anderen Konzentration, verhindert das Kennzeichnen aller Flaschen, Röhrchen und Platten deutlich mit der beabsichtigten Kupferkonzentration Verwechslungen beim Gießen der Platte. - Verwenden Sie eine Rührplatte, um ~ 30 s zu mischen und gießen oder pipeten Sie 35 ml in die beschriftete Platte, um Blasen zu vermeiden. Vor der Lagerung oder Verwendung abkühlen lassen.
HINWEIS: Häufig werden die Platten 1 Tag oder 2 Tage vor dem Test hergestellt und bei 4 °C bis einige Stunden vor Gebrauch gelagert. Die Platten sollten Raumtemperatur (RT) haben, bevor die Beschichtung beginnt (Schritt 3.4.).
3. ACT1-CUP1 Assay
- Streifen Sie die gewünschten Stämme auf -Leu-Platten aus.
HINWEIS: Wenn Sie mit Kryobeständen arbeiten, sollte darauf geachtet werden, dass die Zellen vor der Beschichtung ausreichend aus der Lagerung wiederbelebt werden. Ein empfohlenes Verfahren hierfür ist es, aus dem kryogenen Bestand zu streifen und ihn 3-5 Tage bei 30 °C wachsen zu lassen. Dann ein kleines Muster umwerfen und weitere 2-3 Tage bei 30 °C wachsen lassen. - Züchten Sie über Nacht Kulturen in 10 ml Medien.
- Die -Leu-Wachstumsmedien werden mit den gleichen Verhältnissen wie in Schritt 2.4.2 beschrieben hergestellt. Pro 10 ml Medium werden 66 mg Hefestickstoffbase (YNB) und 16 mg Drop-out-Mischung minus Leucin zu 9 ml entionisiertem Wasser gegeben. Durch einen 0,22 μm PES-Sterilfilter geleitet.
- Pro Hefestamm werden 9 ml -Leu-Wachstumsmedien und 1 ml 20% w/v-Glucose (steril gefiltert) in ein steriles 50-ml-konisches Röhrchen gegeben.
- Sammeln Sie mit einem sterilen Stab oder einer Pipetenspitze ein kleines (~ 1 mm rundes) Hefemuster und impfen Sie das Medium.
- Alle Nachtkulturen bei 180 U/min und 30 °C schütteln.
HINWEIS: Falls verfügbar, können Rotatoren anstelle eines Shakers verwendet werden.
- Die Stämme werden auf einen OD600 0,5 ± 0,05 in 10% Glycerin verdünnt.
- Pro Stamm 100 μL Kultur in eine Küvette mit 900 μL Wasser geben.
- Messen Sie den OD600 mit einem Spektralphotometer.
- Berechnen Sie die erforderliche Verdünnung bei einem OD600 von 0,5 in einem Endvolumen von 2 ml.
- Verdünnen Sie jeden Stamm auf OD600 0,5 in 10% Glycerin (steril).
- Messen Sie den OD600 erneut, um zu bestätigen, dass die Zelldichte im gewünschten Bereich von 0,5 ± 0,05 liegt.
- Platten Sie die Dehnungen auf den Kupferplatten.
HINWEIS: Eine Vielzahl von Methoden kann verwendet werden, um die Stämme zu beschichten, einschließlich Handpipettieren von 5-10 μL-Volumina, Verwendung eines Wiederholungs- oder Mehrkanalpipettors oder Stanzen mit einem Pin-Replikator. Diese letzte Methode wird unten beschrieben, obwohl die meisten Schritte unabhängig von der Methode ähnlich sind.- Richten Sie einen sterilen Arbeitsplatz und einen brennenden Bunsenbrenner ein.
- Bei einem 48-poligen Replikator pipieren Sie 200 μL jedes verdünnten Stammes in eine separate Vertiefung einer 96-Well-Platte. Füllen Sie die leeren Räume im 6 x 8 Raster mit 200 μL 10% Glycerin (steril).
HINWEIS: Ein Beispiel für ein Beschichtungsschema für neun Hefestämme ist in Zusatztabelle 2 enthalten. - Tauchen Sie den Replikator in eine flache Schale mit 95% (v / v) Ethanol und flammen Sie zur Sterilisation. Lassen Sie es mindestens 2 Minuten abkühlen, nachdem die Flamme erloschen ist, um einen Hitzeschock der Zellen zu vermeiden.
- Stellen Sie vier Teller in die Nähe des Brenners und entfernen Sie die Deckel.
- Tauchen Sie den Replikator in die 96-Well-Platte und heben Sie ihn in einer schnellen Bewegung an.
- Vorsichtig auf den Teller legen und leicht hin und her schaukeln, um einen guten Transfer zu erleichtern.
- Mit einer schnellen Bewegung anheben und in genau der gleichen Ausrichtung in die 96-Well-Platte legen.
- Wiederholen Sie diesen Vorgang für bis zu drei weitere Platten. Wiederholen Sie den Vorgang, indem Sie den Replikator in Ethanol tauchen, brennen, um zu sterilisieren, und warten, um alle vier Platten abzukühlen.
- Nachdem eine Platte beschichtet wurde, bewegen Sie sich mit einer sanften Bewegung zur Seite, aber immer noch innerhalb des Sterilisationsschirms der Flamme.
HINWEIS: Es wird empfohlen, die Hefeverdünnungen und -beschichtungen in der Nähe einer Flamme durchzuführen. Die Platten können beim Trocknen leicht verunreinigen. - Lassen Sie die Teller vollständig trocknen, bevor Sie die Deckel aufsetzen, normalerweise 3-5 min.
- Die Platten 3 Tage bei 30 °C inkubieren.
4. Datenerhebung und -analyse
- Nehmen Sie die Platten aus dem Inkubator und prüfen Sie sie visuell.
- Nehmen Sie die Bilder der Platten mit einer verfügbaren Kamera oder einem anderen digitalen Bildgebungssystem auf.
- Aufzeichnung (oder Punktzahl) für jede Sorte wird das letzte sichtbare Wachstum der Kupferkonzentration beobachtet.
HINWEIS: Die Zellen sind in der Lage, sich zu spleißen und bis zu dieser Konzentration lebensfähig zu bleiben. Verwenden Sie aus Gründen der Konsistenz immer die gleiche Methode, entweder mit dem Auge oder anhand der Plattenbilder, um die letzte lebensfähige Kupferkonzentration zu ermitteln. Sehr kleine Kolonien sind manchmal mit dem Auge sichtbar, aber nicht auf dem Bild. Der Unterschied zwischen direkter visueller Inspektion oder Aufzeichnung von Bildern ist gering, normalerweise ein Schritt im Farbverlauf. Da Bilder der Kolonien häufig in Publikationen verwendet werden, wird eine Bewertung anhand der Bilder empfohlen. - Kombinieren Sie Daten aus mehreren ACT1-CUP1-Assays für denselben Stamm, um Rückschlüsse darauf zu ziehen, wie sich der QSP auf das Spleißen auswirkt.
HINWEIS: Die Veröffentlichungszahlen zeigen üblicherweise Bilder der Hefekolonien bei 0 mM Cu2+ Konzentration, der letzten lebensfähigen Kupferkonzentration und der nachfolgenden Konzentration, in der die Kolonie gestorben ist. Daten können auch als Balkendiagramm mit Fehlerbalken für die Standardabweichung zwischen Replikaten angezeigt werden. Die Daten müssen nicht normalisiert werden, sondern können durch Setzen der Lebensfähigkeit der WT-Spleißfaktorkontrolle auf 1 und Vergleich der Wirkung der eingeführten Mutation(en) erfolgen.
Ergebnisse
Wachstumsassays wie ACT1-CUP1 erfordern die visuelle, vergleichende Beurteilung mehrerer Kolonien. Hier wurde jeder Stamm über Nacht bis zur Sättigung gezüchtet, auf einen OD600 von 0,5 verdünnt und auf 20 Platten mit einem Bereich von Kupferkonzentrationen von 0 mM bis 1,1 mM CuSO4 plattiert (Abbildung 3). Dieser Bereich ist kleiner als der im Protokoll aufgeführte, da er eine vollständige Bewertung der Auswirkungen der verwendeten und unten beschriebenen QSPs und ACT1-CUP1-Reporter ermöglichte. Die Platten wurden abgebildet und bewertet (Abbildung 3 und Zusatztabelle 3).
Für dieses repräsentative Experiment enthält der Hefehintergrund ein gestörtes ADE2-Gen , was dazu führt, dass die Kolonien unterschiedliche Rottöne aufweisen (Abbildung 3A, B). Diese häufige Hefestörung im Adenosinproduktionsweg verursacht eine Anhäufung eines rot pigmentierten Vorläufers für Adenosin. Daher ist die rote Farbe ein Indikator für die Reife der Hefekolonie (dh die Menge und das Alter der vorhandenen Zellen). Für die Zwecke eines ACT1-CUP1-Assays kann die rote Farbe als Indikator für die Kontamination von Pilzarten dienen, wenn sie weiß oder gelb gefärbt ist. Die Farbe kann eine sekundäre Bestätigung der Kupfertoleranz sein, da lebensfähigere Kolonien einen tieferen Rotton haben.
Bei der Beschichtung mit einem Pin-Replikator gibt es mehrere häufige Aberrationen. Erstens ist es möglich, ovale Kolonien zu erzeugen, wenn der Replikator angehoben wird, während er sich nach links oder rechts bewegt (Abbildung 3B, orangefarbener Pfeil). Darüber hinaus können sich Mikrokolonien auch aus kleinen Tröpfchen der Zelllösung bilden, wenn der Pin-Replikator schräg eingebracht oder über der Platte geschüttelt wird (Abbildung 3B, roter Pfeil). Oft harmlos, gelegentlich können sich die Mikrokolonien mit einer gestempelten Kolonie vermischen, was die Interpretation dieser Kolonie verhindert. Weitere Probleme bei der Beschichtung sind eine unzureichende Wartezeit nach der Sterilisation, bis die Replikatorstifte abkühlen, und ein unzureichender Kontakt zwischen der Platte und den Stiften, so dass eine schlechte Übertragung der Kulturmedien auftritt. In beiden Fällen wachsen nur wenige, wenn überhaupt, Zellen auf der Platte, auch für die Kontrollstämme, die den Wildtyp-Reporter enthalten. Wie bei jedem Wachstumstest ist es unabhängig von der Beschichtungsmethode wichtig, den ACT1-CUP1 dreifach durchzuführen, um zu bestätigen, dass die Ergebnisse konsistent und wiederholbar sind. Idealerweise sollten diese verschiedenen Replikate auf Kupferplatten durchgeführt werden, die zu unterschiedlichen Zeiten hergestellt wurden, um die Reproduzierbarkeit zu gewährleisten.
Für diese repräsentativen Experimente wurde der A3c-Reporter ausgewählt, um den Einfluss einer Nicht-Konsens-Sequenz auf die Kupfertoleranz in Abwesenheit zusätzlicher Spleißsomenstörungen hervorzuheben. A3c reduziert signifikant die Menge der produzierten CUP1-mRNA , da es die Fähigkeit des Spleißosoms stört, das 5' SS15 zu erkennen und zu nutzen. Hefe mit dem A3c-Reporter überlebte bis 0,15 mM Cu2+, während die Wildtyp-Reporterzellen bis zum Ende des getesteten Kupferkonzentrationsbereichs lebensfähig blieben (Abbildung 3C). Die Wildtyp-Reporterzellen wachsen auf 2,5 mM Cu2+ ohne Auswirkungen auf die Lebensfähigkeit (Daten nicht gezeigt).
U6 snRNA ist eine wesentliche katalytische Komponente des Spleißosoms. Mehrere Studien haben ACT1-CUP1 verwendet, um die Wirkung von Mutationen auf diese RNA 16,32,34 zu untersuchen. Für diese Studie wurden drei U6-snRNA-Sequenzen untersucht, nämlich die Wildtyp-Sequenz (WT), Position 57 substituiert von einem Uridin zu einem Cytosin (U57c) und Position 57 substituiert von einem Uridin zu einem Adenosin (U57a) (Abbildung 3 und Abbildung 4). In Kombination mit ACT1-CUP1-Reportern, die die katalytischen Schritte beim Spleißen beeinflussen, wurde festgestellt, dass U57c den ersten katalytischen Schritt und U57a den Fortschritt zum zweiten Schritt bevorzugt16,32.
Um den ACT1-CUP1-Assay einzurichten, wurde ein Stamm erstellt, bei dem die genomische Kopie der U6-snRNA gelöscht und die U6-snRNA-Wildtyp- oder mutierten Sequenzen auf Plasmiden enthalten waren. Da U6-snRNA ein wesentlicher Bestandteil der Zelle ist, wurden drei separate Transformationen verwendet, um zuerst die genomische U6-snRNA unter Beibehaltung der Zelllebensfähigkeit auszuschalten, anschließend mutierte U6-snRNAs auf Plasmiden einzuführen und schließlich die ACT1-CUP1-Reporter hinzuzufügen. Für die erste Transformation wurde ein Cup1Δ-Hefestamm beim Knock-out der genomischen Kopie von U6-snRNA verwendet, während gleichzeitig WT U6 snRNA auf einem URA-Auswahlmarker-Plasmid hinzugefügt wurde, um die Lebensfähigkeit zu erhalten. Eine nachfolgende Transformation fügte entweder Wildtyp- oder mutierte U6-snRNA auf einem TRP-Selektionsmarker-Plasmid hinzu und selektierte gegen den URA-Marker über 5-FOA-Selektion. So wurden drei Cup1Δ-Hefestämme mit jeweils einer der U6-snRNA-Sequenzen, nämlich WT, U57a und U57c, erzeugt. Eine abschließende Hefetransformation für jeden Stamm fügte eines der drei verschiedenen ACT1-CUP1-Reporterplasmide hinzu, die in diesem Experiment verwendet werden sollten. Die ausgewählten Reporter waren der Wildtyp-Reporter A3c und eine Mutation des Adenosins zu Guanin (BS-G). Für dieses Experiment wurden insgesamt neun Stämme erzeugt, die jeweils eine U6-snRNA-Sequenz und einen ACT1-CUP1-Reporter enthielten (Zusatztabelle 4 und Zusatztabelle 5).
Die Ergebnisse zeigten, dass die verschiedenen Basen an der U6-snRNA-Position 57 in Kombination mit einer 5'-SS- oder BS-Mutation einzigartige Auswirkungen auf das Spleißosom haben (Abbildung 4). Sowohl die A3c- als auch die BS-G-Reporter hemmen das Spleißen in erster Linie, indem sie die erste katalytische Schrittkonformationstabilisieren 14,15. Somit ist U57c eine additive Mutation, die die Kupfertoleranz in Kombination mit einem dieser Reporter verringert (Abbildung 4B). Im Gegensatz dazu erhöht U57a die Kupfertoleranz, da es die Progression zur zweiten Stufe fördert (Abbildung 4B)16,32. Die verringerte Kupfertoleranz des BS-G-Reporterstamms mit U57a im Vergleich zu U6 snRNA WT unterstreicht einen wahrscheinlichen sekundären Einfluss von BS-G auf den zweiten Schritt des Spleißens16.
Diese Ergebnisse unterstreichen auch den qualitativen Charakter dieses Assays und warum Wildtyp-Abfrage- und Reportersequenzen getestet werden sollten. Während das allgemeine Muster der erhöhten oder verringerten Kupfertoleranz für diese U6-snRNA-Mutationen im Vergleich zu Wildtyp-U6-snRNA gilt, kann die genaue Kupferkonzentration, bis zu der die Zellen überleben, zwischen Studien variieren (Tabelle 1) und unterschied sich zwischen diesen repräsentativen Daten und anderen veröffentlichten Ergebnissen. Dies ist wahrscheinlich auf den Hintergrund des Stammes zurückzuführen, der die CUP1-Deletion enthält, kann aber auch auf den allgemeinen Zustand der Stämme vor der Beschichtung zurückzuführen sein (dh wie schnell nach der Erzeugung des Stammes oder Restreak aus Kryo der Assay durchgeführt wurde), Unterschiede in der Herstellung der Platten und Variabilität zwischen verschiedenen Inkubatoren. Eine ähnliche Varianz wurde in Mayerle et al. für Prp8-Abfragemutationen in der Literatur43 festgestellt. Daher kann der Vergleich der Kupfertoleranztrends für verschiedene ACT1-CUP1-Assays durchgeführt werden, aber der numerische Vergleich der Kupferkonzentrationen sollte nur innerhalb desselben Labors und manchmal mit demselben Satz von Kupferplatten durchgeführt werden.
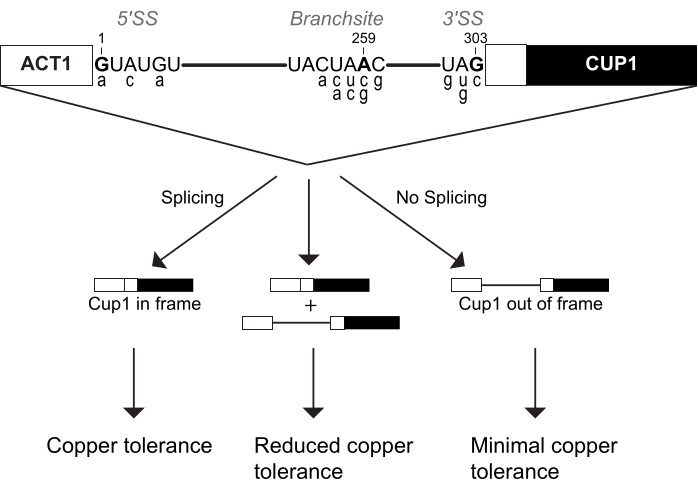
Abbildung 1: Das ACT1-CUP1-Reporterdesign. Die Konzentration des gespleißten Reporters korreliert direkt mit der Hefekupfertoleranz. Das Diagramm des Reporters enthält die drei Spleißstellen der 5'-Spleißstelle (5' SS), der Zweigstelle (BS) und der 3'-Spleißstelle (3' SS). Die Hefekonsensussequenzen für diese Stellen sind dargestellt, wobei diejenigen, die für die Spaltung bestimmt sind, fett gedruckt und basierend auf ihrer Position im Intron nummeriert sind. Häufig verwendete Nicht-Konsensus-ACT1-CUP1-Reportersequenzen werden in Kleinbuchstaben unter ihren entsprechenden Konsensussequenzpositionen angezeigt und sind in Tabelle 1 aufgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: ACT1-CUP1-Assay-Workflow. Für diesen Assay muss ein Hefestamm cup1Δ leu2 sein und das gewünschte ACT1-CUP1-Reporterplasmid und das QSP-Gen, in der Abbildung als Gen bezeichnet, enthalten. Das QSP-Gen muss entweder genomisch oder auf einem Plasmid eingefügt werden. Das Protokoll mit einem Pin-Replikator umfasst vier Schritte zur Vorbereitung der Hefezellen. Schritt 1 besteht darin, die Zellen bis zur Sättigung wachsen zu lassen. Schritt 2 besteht darin, den OD 600 der Kultur zu messen und auf einen OD600 von 0,5 zu verdünnen. Schritt 3 besteht darin, über eine 96-Well-Platte zu verteilen. Schritt 4 besteht darin, auf Platten zu platten, die steigende Kupferkonzentrationen enthalten (mit zunehmender blauer Farbe gekennzeichnet). Schritt 1, Schritt 2 und Schritt 4 wären für das Handpipettieren identisch. Nach der Beschichtung werden die Platten 3 Tage lang bei 30 °C inkubiert und dann auf Lebensfähigkeit geritzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Repräsentative Ansichten der ACT1-CUP1-Daten. Für dieses Experiment werden Hefe-Spleißosomen mit zwei verschiedenen U6-snRNA-Mutationen herausgefordert und in Anwesenheit von drei Nicht-Konsensus-Reportern getestet. Drei Replikate dieses Assays werden zu Demonstrationszwecken auf denselben Platten präsentiert. Es wird empfohlen, für diesen Assay Replikationen auf separaten Platten und an verschiedenen Tagen durchzuführen. (A) Ein abgeschlossener Assay mit einem Kupfergradienten von 0 mM bis 1,1 mM über 20 Platten wird gezeigt. Wenn die Kupferkonzentration zunimmt, zeigen Stämme mit geringerem Spleißen eine verminderte Konfluenz bis zu dem Punkt, an dem die Kupferkonzentration tödlich wird. Der Hefehintergrund war ade2, und daher sind reife Kolonien rot gefärbt. (B) Vergleich der gleichen Platten bei 0 mM und 0,1 mM CuSO4 , aufgenommen mit einer Handkamera mit einem digitalen Bildgebungssystem. Dies ist ein Beispiel dafür, wie eine Reihe von Nicht-Konsens-Reportern Seite an Seite und mit dem Wildtyp-Reporter verglichen werden können. Häufige Beobachtungen auf Platten sind ein unechter Tropfen von Kulturmedien, der vom Pin-Replikator fiel (roter Pfeil) und leichte Ovalierung der Kolonien durch Gleiten des Pins entlang der Oberfläche der Platte oder Bewegung der Platte, bevor der Kulturtropfen ausreichend getrocknet ist (orangefarbener Pfeil). (C) Beispiel für die Wirkung des A3c-Reporters auf die Zelllebensfähigkeit im Vergleich zum Wildtyp-Reporter. Bilder wie die in (B) gezeigten werden beschnitten und ausgerichtet, um die Wachstumsunterschiede bei verschiedenen Kupferkonzentrationen hervorzuheben. Die Kupfertoleranz des A3c-Reporterstamms sinkt auf 0,15 mM Cu2+ im Vergleich zur Lebensfähigkeit des Wildtyp-Reporterstamms bis zum Ende des getesteten Bereichs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
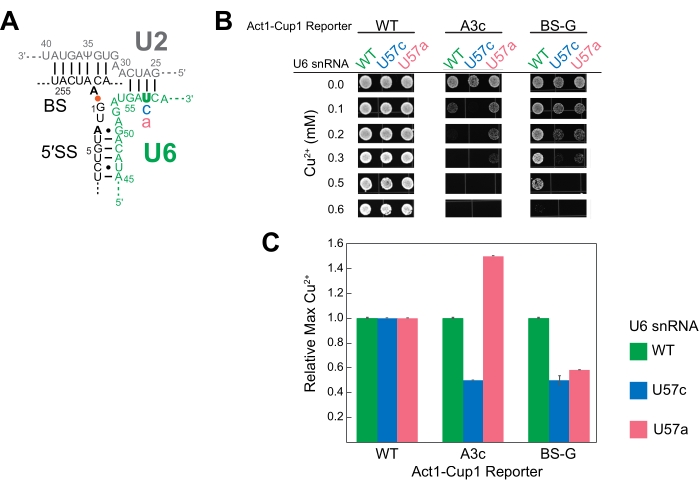
Abbildung 4: Repräsentative ACT1-CUP1-Ergebnisse zur Überwachung des Spleißens in Hefe mit Mutationen der Spleißkomponenten . (A) Schematische Darstellung der RNA-Komponenten des aktiven Zentrums unmittelbar nach dem ersten katalytischen Schritt. Die U2- und U6-snRNAs sind duplexiert, wodurch die 5'-SS und BS des Introns in unmittelbarer Nähe kommen. Die intronische Verbindung zwischen A259 (BS) und G1 (5' SS) wird durch den orangefarbenen Punkt angezeigt. Die Positionen der Nicht-Konsens-Sequenzsubstitutionen im ACT1-CUP1-Reporter, der in diesem Experiment getestet wurde, sind fett schwarz markiert. Die mutierte Position in U6 snRNA (U57) ist fett grün und die substituierten Basen sind entweder blau oder rosa. (B) Eine Möglichkeit für die Darstellung von ACT1-CUP1-Daten in einer Publikation umfasst mehrere Bilder von Kolonien aus relevanten Cu2+ Konzentrationen. Der WT-Reporter überlebte die Kupferkonzentration, die für alle drei abgefragten U6-snRNA-Stämme getestet wurde. (C) Ein Balkendiagramm, das die Effekte pro Reporter und pro U6-snRNA-Mutante vergleicht. Die Normalisierung wird für jeden ACT1-CUP1-Reporter durchgeführt, indem die Kupfertoleranz der U6-snRNA WT auf 1 gesetzt und das Verhältnis für die U57c- und U57a-Mutationen berechnet wird. Fehlerindikatoren stellen die Standardabweichung von drei Replikaten dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
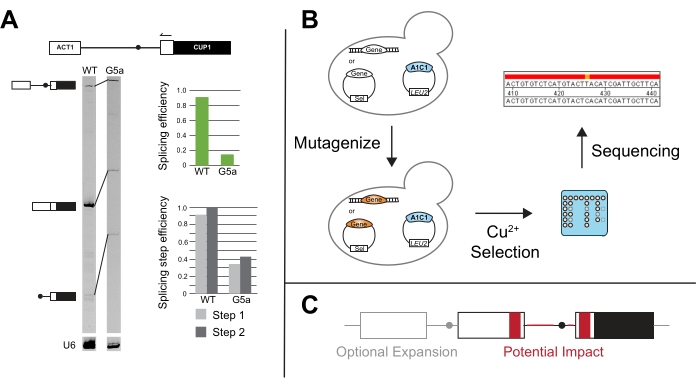
Abbildung 5: Zusätzliche Methoden zur Ergänzung der ACT1-CUP1-Ergebnisse. (A) Die Primerverlängerung erfolgt durch ein Primerglühen im 3' ACT1-Exon und dann durch Verlängerung in das Intron. In diesem Beispiel wird der Primer mit IR700-Farbstoff endmarkiert, und die Primerverlängerung wurde wie in 20,21 beschrieben durchgeführt. Die Primer-Extension von U6 snRNA wird in der gleichen Reaktion durchgeführt, um als Belastungskontrolle zu dienen. Das 7% 19:1 Bis/Acrylamid-Denaturierungsgel löst die prä-mRNA-, mRNA- und Lariat-Produkte nach Primer-Extension unter Verwendung eines Nahinfrarot-Gel-Bildgebungsgeräts auf, wie in van der Feltz et al.22 beschrieben. Die Intensität der verschiedenen Banden kann verwendet werden, um die Gesamtspleißeffizienz zu messen und die Spleißunterschiede zu unterscheiden, die im ersten oder zweiten Schritt auftreten, wie mit ImageJ44 oder einer anderen Gelband-Quantifizierungssoftware quantifiziert. Sowohl die Spleißeffizienz als auch die Spleißschritteffizienz werden wie in Query und Konarska14 beschrieben berechnet. (B) Mutationsscreens mit ACT1-CUP1-Reportern können die Kupferauswahl verwenden, um Mutanten zu identifizieren, die das Spleißen beeinflussen. Die interessierenden Gene können dann in den resultierenden Stämmen sequenziert werden, um festzustellen, ob die Mutation in diesem Gen aufgetreten ist. (C) Änderungen können am Reporter außerhalb der Spleißstellen vorgenommen werden, um Spleißänderungen in Bezug auf Intronstruktur, exonische Sequenzen, Anzahl der Exons oder Kernexport von nicht gespleißter RNA zu überwachen. Regionen in Grau sind optionale Erweiterungsregionen, die in einen Reporter aufgenommen werden können, und Bereiche in Rot sind Regionen, in denen die Sequenz und strukturelle Veränderungen mit dem ACT1-CUP1-Assay auf ihre potenziellen Auswirkungen auf das Spleißen getestet werden könnten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Name des Reporters | Intronic Region | Reihenfolge | Letzte lebensfähige Cu2+ Konzentration (mM) | |
| WT | 5' | GUAUGU | > 2,5 | |
| G1a | 5ʹ | ein UAUGU | 0,0133 oder 0,0532 | |
| A3c | 5ʹ | GUcUGU | 0.15^,18 oder 0.216 | |
| G5a | 5ʹ | GUAUaU | 0,303 oder 0,259 | |
| WT | Zweigstelle | UACUAAC | > 2,5 | |
| C256a | Zweigstelle | UAaUAAC | 0,1526 oder 0,1832 | |
| U257c/a | Zweigstelle | UACc/aAAC | 0,226 oder 0,332 oder 0,545 | 0.059,32 |
| A258c/u | Zweigstelle | UACUc/uAC | 0,826 | 1,045 oder 1,646 |
| BS-C | Zweigstelle | UACUAcC | 0.153 oder 0.1832,56 oder 0.226 | |
| BS-G | Zweigstelle | UACUAgC | 0,0516,32 oder 0,625 oder 0,846 | |
| C260g | Zweigstelle | UACUAAg | 0,826 | |
| WT | 3' | UAG | > 2,5 | |
| U301g | 3ʹ | G AG | 0,1518 | |
| A302g/u | 3' | Ug/uG | 0,0139 | 0,07516 oder 0,1824 |
| G303c | 3ʹ | UAc | 0,0532 | |
Tabelle 1: Liste der gängigen Reporter und die gemeldete Cu2+-Konzentration Letalität. Es gibt über 100 Zitate von Lesser und Guthrie3. Während eine kleine Auswahl dieser Zitate verwendet wurde, um diese Tabelle zu erstellen, heben sie den allgemeinen Trend von leichten bis moderaten Unterschieden zwischen Studien in den berichteten Kupferlebensfähigkeitskonzentrationen hervor. In ACT1-CUP1 ist es wichtig, Wildtyp-Protein oder RNA mit den Mutanten zu vergleichen, die alle den gleichen Hefestamm-Hintergrund haben, wobei die veröffentlichten Konzentrationen als Leitfaden verwendet werden, aber davon auszugehen ist, dass die beobachteten Konzentrationen abweichen können. Daten aus Abbildung 3 (^) und mehreren Veröffentlichungen, die mit den folgenden Zitaten 3,9,16,18,24,25,26,32,45,46 kommentiert sind.
Ergänzende Tabelle 1: Inhalt einer einzelnen Kupferplatte und ein Beispiel für Berechnungen zur Erzielung von Kupferverdünnungen von 0 mM bis 2,5 mM aus einem 1 M CuSO4-Bestand . Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 2: Beispiel für ein Beschichtungsschema für den 48-poligen Replikator. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Zusatztabelle 3: Beispiel für die Lebensfähigkeit von Kupferplatten, die 3 Tage lang bei 30 °C inkubiert wurden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Zusatztabelle 4: Liste der Hefestämme, die zur Generierung der repräsentativen Daten verwendet wurden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Zusatztabelle 5: Liste der zur Generierung der repräsentativen Daten verwendeten Plasmide. U6 snRNA-Plasmide generiert und veröffentlicht in früheren Forschungen22,47. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
ACT1-CUP1 ist ein Wachstumstest, und es muss darauf geachtet werden, dass beobachtete Wachstumsunterschiede nur auf Spleißfehler zurückzuführen sind. Alle Stämme sollten vor der Beschichtung auf ähnliche Weise gehandhabt werden, einschließlich einer ähnlichen Länge und Art von Wachstums- und Lagerbedingungen. Bei Verwendung temperaturempfindlicher Stämme sollten ACT1-CUP1-Assays nur unter Bedingungen durchgeführt werden, unter denen diese Stämme vergleichbar mit Wildtypen wachsen. In diesem Zusammenhang wird für die QSP-Komponente empfohlen, identische Hefehintergründe und Expressionsniveaus von QSP-Genen zu haben, um die Interpretation der Ergebnisse nicht zu trüben. Bei der Betrachtung der Anzahl der zu verwendenden QSPs und Reporter wird nicht empfohlen, mehr als 30 Stämme gleichzeitig mit der Pin-Replikator-Methode zu untersuchen. Mit der zusätzlichen Zeit, um jeden Schritt durchzuführen, werden sich die Zellen absetzen, und die Assay-Ergebnisse werden aufgrund der verminderten Zelllebensfähigkeit inkonsistent sein.
Zusätzlich zu den Einschränkungen, die ACT1-CUP1 inhärent als Wachstumstest hat, kann ein QSP einen komplexeren Einfluss auf das Spleißen haben, als mit dieser Methode gelöst werden kann. Da das Spleißen ein mehrstufiger Prozess ist und Faktoren recycelt werden, kann der beobachtete Phänotyp dazu führen, dass die Störung mehr als einen Spleißschritt betrifft. Dies gilt auch für die nachfolgenden Analysen, die ACT1-CUP1 anschließen können, von denen einige im Folgenden beschrieben werden. Die Daten heben den am stärksten gestörten Schritt des Prozesses hervor, auch wenn andere Schritte durch die veränderte Funktion des Spleißfaktors beeinflusst werden können.
Die Primer-Erweiterung von ACT1-CUP1-Reportern wurde erstmals in der Originalarbeit von Lesser und Guthrie verwendet und wird häufig durchgeführt, wenn die ACT1-CUP1-Ergebnisse einen Wachstumsdefektzeigen 3. Dieser Assay zielt auf den Reporter ab und verwendet die Länge der PCR-Produkte, um die relativen Mengen des vorhandenen nicht gespleißten, teilweise gespleißten und vollständig gespleißten Reporters zu bestimmen (Abbildung 5A). Die Gesamtspleißeffizienz und ob der Defekt den ersten oder zweiten katalytischen Schritt stärker beeinflusst, werden anhand der Verhältnisse der PCR-Produktmengen14 berechnet. Zum Beispiel hat der 5'-SS-Reporter G5a das Spleißen im Vergleich zum Wildtyp-Reporter reduziert, aber seine Effizienz im ersten und zweiten Schritt folgt einem ähnlichen Muster wie der Wildtyp-Reporter (Abbildung 5A). Dies deutet auf einen Defekt vor dem ersten katalytischen Schritt hin, möglicherweise in der Spleißsomenanordnung, da beide Schritte ähnlich betroffen sind31.
Aus dem kanonischen ACT1-CUP1-Assay wurden neuartige Assays entwickelt, wie z.B. das Screening auf Mutanten, die das Spleißen in Gegenwart anderer Spleißfaktormutanten und/oder Nicht-Konsens-Spleißsequenzen verbessern (Abbildung 5B). Zum Beispiel ergab die Exposition von Hefe, die den ACT1-CUP1-Reporter enthielt, UV-Strahlung und die anschließende Selektion in Gegenwart von Kupfer Prp8- und Hsh155-Mutanten, die das Spleißen von Nicht-Konsens-Sequenzen14,19 verbesserten.
Über die Untersuchung der Wirkung von Spleißstellen und konstitutiven Spleißfaktoren hinaus wurde die CUP1-Wachstumsabhängigkeit verwendet, um das multiple Intron-Spleißen, die nukleare Exportkontrolle und die Auswirkungen von UTR und anderen peripheren Sequenzen auf das Spleißen zu untersuchen (Abbildung 5C). Einige dieser Studien haben Reporter mit CUP1 und anderen intronhaltigen Hefegenen geschaffen, die komplexere Spleißmuster aufweisen können, um die Wirkung auf die intronische Sekundärstruktur und das Multi-Intron-Transkript-Spleißen zu untersuchen 48,49,50,51,52. Der Zusammenhang zwischen Spleißen und nuklearem Export wurde untersucht, indem entweder gespleißte oder nicht gespleißte Transkripte verwendet wurden, die CUP1 im Rahmen53,54 kodieren. Die Länge der Pyrimidinspur und die Entfernungsabhängigkeit der Spleißstelle aufgrund spezifischer Faktoren wurden ebenfalls getestet 20,55,56,57. Diese und viele andere Beispiele unterstreichen die Vielseitigkeit von ACT1-CUP1 und anderen CUP1-Wachstumsassays.
Der ACT1-CUP1-Assay verbindet Störungen mit einem komplexen Reaktionszyklus mit einem einfachen Wachstumsphänotyp und einem breiten Empfindlichkeitsbereich. Dieser Legacy-Assay wurde von mehreren Laboren verwendet, um die Grundlage für das Verständnis des Spleißzyklus zu legen. In jüngerer Zeit wurde ACT1-CUP1 verwendet, um Fragen zu beantworten, die sich aus der Fülle der jetzt verfügbaren Strukturdaten ergeben21,22,25. Strukturstudien von Spleißosomen, die an Nicht-Konsens-Sequenzen gebunden sind, könnten mit ACT1-CUP1-Ergebnissen gepaart werden, um zu interpretieren, wie veränderte Struktur und veränderte Funktion korrelieren. ACT1-CUP1 ist ein ideales erstes Screening für das Spleißen von Mutationen, das komplexere Analysen ergänzen kann.
Offenlegungen
Der Autor hat nichts offenzulegen.
Danksagungen
Vielen Dank an Aaron Hoskins und die Hoskins-Labormitglieder an der University of Wisconsin-Madison für die Verwendung von Hefestämmen und Geräten bei der Generierung der Abbildungen 3-5. Vielen Dank an Harpreet Kaur und Xingyang Fu für ihre aufschlussreichen Kommentare zum Manuskript. Vielen Dank an die unterstützenden Studenten, Mitarbeiter und Dozenten der Northwest University beim Schreiben, Bearbeiten und Filmen dieses Papiers. Vielen Dank an Isabelle Marasigan für die Hilfe beim Filmen dieser Methode.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-129 | Or comparable item from a different manufacturer. |
| 2 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-138 | Or comparable item from a different manufacturer. |
| 50 mL sterile centrifuge tubes | Fisher Scientific | 07-201-332 | Or comparable item from a different manufacturer. |
| 96-well round bottom microplate | Fisher Scientific | 07-200-760 | Or comparable item from a different manufacturer. |
| 190 proof ethanol | Fisher Scientific | 22-032-600 | Or comparable item from a different manufacturer. |
| 500 mL Filter System (0.22 µm) | CellTreat Scientific Products | 229707 | Or comparable item from a different manufacturer. |
| Agar | Fisher Scientific | BP1423-500 | Any molecular grade agar will work. |
| Autoclave | Tuttnauer | 3870EA | Or comparable item from a different manufacturer. |
| Bunsen burner | Humboldt | PN6200.1 | Or comparable item from a different manufacturer. |
| Cell Density Meter | VWR | 490005-906 | Or other spectral device that can measure absorbance at 595 nm. |
| Copper sulfate Pentahydrate | Fisher Scientific | LC134051 | Or comparable item from a different manufacturer. |
| Digital imaging system | Cytiva | 29399481 | ImageQuant 4000 (used for Figure 3), Amersham ImageQuant 800, or comparable item from a different manufacturer. |
| Dropout mix (-Leu) | USBiological Life Sciences | D9525 | Use the appropriate drop out mix for your experiment. It is possible you will be using a yeast nutrient marker for your query perturbation also. In that case, the drop out mix should be for that marker and Leu |
| D-Glucose | Fisher Scientific | AAA1682836 | Or comparable item from a different manufacturer. |
| Gel band quantifying software | Cytiva | 29-0006-05 | ImageQuant TL v8.1 (used for figure 5A) or comparable item from a different manufacturer. |
| Hand held camera | Nikon | D3500 | Or comparable item from a different manufacturer. |
| Near infra-red gel imaging device | Cytiva | 29238583 | Amersham Typhoon NIR (used for Figure 5a) or comparable item from a different manufacturer. |
| Laboratory grade clamp | Fisher Scientific | 05-769-7Q | Or comparable item from a different manufacturer. |
| Laboratory grade stand and clamp | Fisher Scientific | 12-000-101 | Or comparable item from a different manufacturer. |
| Magnetic stir bars | Fisher Scientific | 14-513-51 | Or comparable item from a different manufacturer. |
| Pin replicator | VP Scientific | VP 407AH | |
| Semi-micro disposable cuvettes | VWR | 97000-590 | Or comparable item from a different manufacturer. |
| Shaker | JEIO Tech | IST-3075 | Or comparable item from a different manufacturer. |
| Spectrophotometer | Biowave | 80-3000-45 | Or any spectophotometer that can measure the absorbance at 600 nm. |
| Square plates | VWR | 102091-156 | Circular plates may also be used though are more challenging if using a pin replicator. |
| Stir plate | Fisher Scientific | 11-520-16S | Or comparable item from a different manufacturer. |
| Yeast nitrogen base | USBiological Life Sciences | Y2025 | Or comparable item from a different manufacturer. |
Referenzen
- Wahl, M. C., Will, C. L., Luhrmann, R. The spliceosome: Design principles of a dynamic RNP machine. Cell. 136 (4), 701-718 (2009).
- Wilkinson, M. E., Charenton, C., Nagai, K. RNA splicing by the spliceosome. Annual Review of Biochemistry. 89, 359-388 (2020).
- Lesser, C. F., Guthrie, C. Mutational analysis of pre-mRNA splicing in Saccharomyces cerevisiae using a sensitive new reporter gene, CUP1. Genetics. 133 (4), 851-863 (1993).
- Ng, R., Abelson, J. Isolation and sequence of the gene for actin in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 77 (7), 3912-3916 (1980).
- Gallwitz, D., Sures, I. Structure of a split yeast gene: Complete nucleotide sequence of the actin gene in I. Proceedings of the National Academy of Sciences of the United States of America. 77 (5), 2546-2550 (1980).
- Fogel, S., Welch, J. W., Cathala, G., Karin, M. Gene amplification in yeast: CUP1 copy number regulates copper resistance. Current Genetics. 7 (5), 347-355 (1983).
- Hamer, D. H., Thiele, D. J., Lemontt, J. E. Function and autoregulation of yeast copperthionein. Science. 228 (4700), 685-690 (1985).
- Winge, D. R., Nielson, K. B., Gray, W. R., Hamer, D. H. Yeast metallothionein. Sequence and metal-binding properties. Journal of Biological Chemistry. 260 (27), 14464-14470 (1985).
- Burgess, S. M., Guthrie, C. A mechanism to enhance mRNA splicing fidelity: The RNA-dependent ATPase Prp16 governs usage of a discard pathway for aberrant lariat intermediates. Cell. 73 (7), 1377-1391 (1993).
- Collins, C. A., Guthrie, C. Allele-specific genetic interactions between Prp8 and RNA active site residues suggest a function for Prp8 at the catalytic core of the spliceosome. Genes & Development. 13 (15), 1970-1982 (1999).
- Siatecka, M., Reyes, J. L., Konarska, M. M. Functional interactions of Prp8 with both splice sites at the spliceosomal catalytic center. Genes & Development. 13 (15), 1983-1993 (1999).
- Umen, J. G., Guthrie, C. Mutagenesis of the yeast gene PRP8 reveals domains governing the specificity and fidelity of 3' splice site selection. Genetics. 143 (2), 723-739 (1996).
- Grainger, R. J., Beggs, J. D. Prp8 protein: At the heart of the spliceosome. RNA. 11 (5), 533-557 (2005).
- Query, C. C., Konarska, M. M. Suppression of multiple substrate mutations by spliceosomal prp8 alleles suggests functional correlations with ribosomal ambiguity mutants. Molecular Cell. 14 (3), 343-354 (2004).
- Konarska, M. M., Vilardell, J., Query, C. C. Repositioning of the reaction intermediate within the catalytic center of the spliceosome. Molecular Cell. 21 (4), 543-553 (2006).
- Liu, L., Query, C. C., Konarska, M. M. Opposing classes of prp8 alleles modulate the transition between the catalytic steps of pre-mRNA splicing. Nature Structural and Molecular Biology. 14 (6), 519-526 (2007).
- MacRae, A. J., et al. Prp8 positioning of U5 snRNA is linked to 5' splice site recognition. RNA. 24 (6), 769-777 (2018).
- Query, C. C., Konarska, M. M. CEF1/CDC5 alleles modulate transitions between catalytic conformations of the spliceosome. RNA. 18 (5), 1001-1013 (2012).
- Tang, Q., et al. SF3B1/Hsh155 HEAT motif mutations affect interaction with the spliceosomal ATPase Prp5, resulting in altered branch site selectivity in pre-mRNA splicing. Genes & Development. 30 (24), 2710-2723 (2016).
- Carrocci, T. J., Zoerner, D. M., Paulson, J. C., Hoskins, A. A. SF3b1 mutations associated with myelodysplastic syndromes alter the fidelity of branchsite selection in yeast. Nucleic Acids Research. 45 (8), 4837-4852 (2017).
- Kaur, H., Groubert, B., Paulson, J. C., McMillan, S., Hoskins, A. A. Impact of cancer-associated mutations in Hsh155/SF3b1 HEAT repeats 9-12 on pre-mRNA splicing in Saccharomyces cerevisiae. PLoS One. 15 (4), 0229315(2020).
- vander Feltz, C., et al. Saccharomyces cerevisiae Ecm2 modulates the catalytic steps of pre-mRNA splicing. RNA. 27 (5), 591-603 (2021).
- Carrocci, T. J., Paulson, J. C., Hoskins, A. A. Functional analysis of Hsh155/SF3b1 interactions with the U2 snRNA/branch site duplex. RNA. 24 (8), 1028-1040 (2018).
- Hogg, R., de Almeida, R. A., Ruckshanthi, J. P., O'Keefe, R. T. Remodeling of U2-U6 snRNA helix I during pre-mRNA splicing by Prp16 and the NineTeen Complex protein Cwc2. Nucleic Acids Research. 42 (12), 8008-8023 (2014).
- Hansen, S. R., Nikolai, B. J., Spreacker, P. J., Carrocci, T. J., Hoskins, A. A. Chemical inhibition of pre-mRNA splicing in living Saccharomyces cerevisiae. Cell Chemical Biology. 26 (3), 443-448 (2019).
- Xu, Y. Z., Query, C. C. Competition between the ATPase Prp5 and branch region-U2 snRNA pairing modulates the fidelity of spliceosome assembly. Molecular Cell. 28 (5), 838-849 (2007).
- Staley, J. P., Guthrie, C. An RNA switch at the 5' splice site requires ATP and the DEAD box protein Prp28p. Molecular Cell. 3 (1), 55-64 (1999).
- Bousquet-Antonelli, C., Presutti, C., Tollervey, D. Identification of a regulated pathway for nuclear pre-mRNA turnover. Cell. 102 (6), 765-775 (2000).
- Villa, T., Guthrie, C. The Isy1p component of the NineTeen complex interacts with the ATPase Prp16p to regulate the fidelity of pre-mRNA splicing. Genes & Development. 19 (16), 1894-1904 (2005).
- Mayas, R. M., Maita, H., Staley, J. P. Exon ligation is proofread by the DExD/H-box ATPase Prp22p. Nature Structure and Molecular Biology. 13 (6), 482-490 (2006).
- Lesser, C. F., Guthrie, C. Mutations in U6 snRNA that alter splice site specificity: Implications for the active site. Science. 262 (5142), 1982-1988 (1993).
- McPheeters, D. S. Interactions of the yeast U6 RNA with the pre-mRNA branch site. RNA. 2 (11), 1110-1123 (1996).
- Perriman, R. J., Ares, M. Rearrangement of competing U2 RNA helices within the spliceosome promotes multiple steps in splicing. Genes & Development. 21 (7), 811-820 (2007).
- Mefford, M. A., Staley, J. P. Evidence that U2/U6 helix I promotes both catalytic steps of pre-mRNA splicing and rearranges in between these steps. RNA. 15 (7), 1386-1397 (2009).
- Hilliker, A. K., Mefford, M. A., Staley, J. P. U2 toggles iteratively between the stem IIa and stem IIc conformations to promote pre-mRNA splicing. Genes & Development. 21 (7), 821-834 (2007).
- Wu, G., et al. Pseudouridines in U2 snRNA stimulate the ATPase activity of Prp5 during spliceosome assembly. EMBO Journal. 35 (6), 654-667 (2016).
- Crotti, L. B., Bacikova, D., Horowitz, D. S. The Prp18 protein stabilizes the interaction of both exons with the U5 snRNA during the second step of pre-mRNA splicing. Genes & Development. 21 (10), 1204-1216 (2007).
- Fogel, S., Welch, J. W. Tandem gene amplification mediates copper resistance in yeast. Proceedings of the National Academy of Sciences of the United States of America. 79 (17), 5342-5346 (1982).
- Gardner, J. M., Jaspersen, S. L. Manipulating the yeast genome: Deletion, mutation, and tagging by PCR. Methods Molecular Biology. 1205, 45-78 (2014).
- JoVE. Yeast Transformation and Cloning. In Biology I: yeast, Drosophila and C. Elegant. JoVE Science Education Database. , Cambridge, MA. (2021).
- Gietz, R. D., Woods, R. A. Yeast transformation by the LiAc/SS Carrier DNA/PEG method. Methods Molecular Biology. 313, 107-120 (2006).
- Gietz, R. D., Woods, R. A. Genetic transformation of yeast. Biotechniques. 30 (4), 816(2001).
- Mayerle, M., et al. Structural toggle in the RNaseH domain of Prp8 helps balance splicing fidelity and catalytic efficiency. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), 4739-4744 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Beier, D. H., et al. Dynamics of the DEAD-box ATPase Prp5 RecA-like domains provide a conformational switch during spliceosome assembly. Nucleic Acids Research. 47 (20), 10842-10851 (2019).
- vander Feltz, C., DeHaven, A. C., Hoskins, A. A. Stress-induced pseudouridylation alters the structural equilibrium of yeast U2 snRNA Stem II. Journal of Molecular Biology. 430 (4), 524-536 (2018).
- Rodgers, M. L., Didychuk, A. L., Butcher, S. E., Brow, D. A., Hoskins, A. A. A multi-step model for facilitated unwinding of the yeast U4/U6 RNA duplex. Nucleic Acids Research. 44 (22), 10912-10928 (2016).
- Stutz, F., Rosbash, M. A functional interaction between Rev and yeast pre-mRNA is related to splicing complex formation. EMBO Journal. 13 (17), 4096-4104 (1994).
- Libri, D., Lescure, A., Rosbash, M. Splicing enhancement in the yeast rp51b intron. RNA. 6 (3), 352-368 (2000).
- Libri, D., Stutz, F., McCarthy, T., Rosbash, M. RNA structural patterns and splicing: Molecular basis for an RNA-based enhancer. RNA. 1 (4), 425-436 (1995).
- Howe, K. J., Kane, C. M., Ares, M. Perturbation of transcription elongation influences the fidelity of internal exon inclusion in Saccharomyces cerevisiae. RNA. 9 (8), 993-1006 (2003).
- Cuenca-Bono, B., et al. SUS1 introns are required for efficient mRNA nuclear export in yeast. Nucleic Acids Research. 39 (19), 8599-8611 (2011).
- Scherrer, F. W., Spingola, M. A subset of Mer1p-dependent introns requires Bud13p for splicing activation and nuclear retention. RNA. 12 (7), 1361-1372 (2006).
- Hálová, M., et al. Nineteen complex-related factor Prp45 is required for the early stages of cotranscriptional spliceosome assembly. RNA. 23 (10), 1512-1524 (2017).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Crotti, L. B., Horowitz, D. S. Exon sequences at the splice junctions affect splicing fidelity and alternative splicing. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 18954-18959 (2009).
- Perriman, R., Ares, M. Invariant U2 snRNA nucleotides form a stem loop to recognize the intron early in splicing. Molecular Cell. 38 (3), 416-427 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten