Method Article
تحدد فحوصات ACT1-CUP1 الحساسيات الخاصة بالركيزة للمتحولات spliceosomal في الخميرة الناشئة
In This Article
Summary
يوفر اختبار ACT1-CUP1 ، وهو فحص نمو النحاس ، قراءة سريعة لربط الحمض النووي الريبي رسول السلائف (pre-mRNA) وتأثير عوامل الربط الطافرة على وظيفة spliceosomal. توفر هذه الدراسة بروتوكولا وتسلط الضوء على التخصيص الممكن لمعالجة مسألة الربط ذات الأهمية.
Abstract
ساهمت الطفرات التي أدخلت في spliceosome أو ركيزته بشكل كبير في فهمنا لتعقيدات وظيفة spliceosomal. سواء كانت مرتبطة بالمرض أو مختارة وظيفيا ، فقد تمت دراسة العديد من هذه الطفرات باستخدام مقايسات النمو في الكائن الحي النموذجي Saccharomyces cerevisiae (الخميرة). يوفر مقايسة نمو النحاس الخاصة بالربط ، أو مقايسة ACT1-CUP1 ، تحليلا شاملا للطفرة على مستوى النمط الظاهري. يستخدم اختبار ACT1-CUP1 المراسلين الذين يمنحون تحمل النحاس عند تقطيعه بشكل صحيح. وهكذا ، في وجود النحاس ، ترتبط التغيرات في صلاحية الخميرة بالتغيرات في إنتاج mRNA من خلال الربط. في تجربة نموذجية ، يتم تحدي spliceosome الخميرة مع مراسلي الربط غير التوافقيين المختلفين وطفرة عامل الربط ذات الأهمية للكشف عن أي تأثير تآزري أو مضاد على الربط. هنا يتم تقديم وصف كامل لإعداد الألواح النحاسية ، وطلاء خلايا الخميرة ، وتقييم البيانات. يتم وصف مجموعة مختارة من التجارب المجانية ، مع تسليط الضوء على تنوع مراسلي ACT1-CUP1. يعد اختبار ACT1-CUP1 أداة مفيدة في صندوق أدوات الربط بفضل القراءة المباشرة للتأثير (التأثيرات) الطفرية والإمكانيات النسبية من الاستخدام المستمر في هذا المجال.
Introduction
ال spliceosome هو آلة بيولوجية كبيرة تحفز إزالة الإنترونات ، المناطق غير المشفرة في الحمض النووي الريبي رسول السلائف (pre-mRNA)1,2. غالبا ما يكون توصيف تأثير طفرة نقطة واحدة في 1 من ما يقرب من 100 بروتين و 5 RNAs غير مشفرة غامضا عند دراسة البروتين أو الحمض النووي الريبي بمعزل عن غيره. يمكن تقييم التغيير في وظيفة المكون المتحور بشكل أفضل في الجسم الحي في سياق spliceosome الكامل والفعال.
مقايسة نمو النحاس الموصوفة هنا هي مقياس سريع لكفاءة الربط في Saccharomyces cerevisiae أو الخميرة الناشئة. تم تطوير هذا الفحص بواسطة C.F. Lesser و C. Guthrie ونشر في عام 1993 ، ويجمع بين سهولة العمل مع كائن نموذجي بسيط والقراءة المباشرة لصلاحية الخلية3. ترتبط الجدوى بمدى قدرة spliceosomes في هذه الخلايا على التعرف على نص المراسل ولصقه.
يطلق على مقايسة نمو النحاس هذه بشكل أكثر شيوعا مقايسة ACT1-CUP1. ينشأ اسم ACT1-CUP1 من الجينين المندمجين لإنشاء مراسل لكفاءة الربط. ACT1 هو جين الأكتين في الخميرة ، والذي يتم التعبير عنه بشكل كبير ويحتوي على إنترونمقسم بكفاءة 4,5. Cup1p هو مخلب نحاسي يعزل النحاس في الخلية لمنع التداخل مع الوظائف الخلوية العادية6،7،8. يحتوي مراسل ACT1-CUP1 على هذه الجينات بالتسلسل بحيث يكون CUP1 في إطار القراءة المناسب فقط في حالة حدوث الربط قبل mRNA لإنترون ACT1 (الشكل 1). يحتوي بروتين الاندماج الناتج على أول 21 حمضا أمينيا من الأكتين وبروتين Cup1p كامل الطول ، مما يزيد من صلاحية الخميرة في بيئة غنية بالنحاس3. وبالتالي ، فإن الزيادة في كمية الربط للمراسل تؤدي إلى تركيز أعلى من Cup1p ومقاومة أعلى للنحاس (الشكل 1). بالمقارنة مع جينات المراسل الأخرى ، يؤثر CUP1 على بقاء الخلية حتى عند المستويات المنخفضة ، وله نطاق حساسية واسع ، ويمكن استخدامه للاختيار المباشر لطفرات الربط3،6،7. بالإضافة إلى ذلك ، CUP1 غير ضروري لنمو الخميرة القياسي ، وبالتالي لا يتأثر التوازن الخلوي أثناء الإعداد لهذا الفحص. مكملا لمقايسات الحذف أو نمو درجة الحرارة ، يوفر ACT1-CUP1 معلومات حول التأثيرات على الربط في ظل ظروف نمو الخميرة المثلى.
يتعرف spliceosome على ركيزته من خلال ثلاثة تسلسلات intronic ، وهي موقع لصق 5 '(5' SS) ، وموقع الفرع (BS) ، وموقع لصق 3 '(3' SS). تم إنشاء العديد من مراسلي ACT1-CUP1 الذين يحتويون على تسلسلات غير توافقية في هذه المواقع. يتم عرض مجموعة مختارة من مراسلي ACT1-CUP1 الأكثر شيوعا في الشكل 1 والجدول 1. نظرا لأن spliceosome يتفاعل مع كل موقع لصق بشكل فريد في نقاط مختلفة في دورة الربط ، يمكن اختبار متانة spliceosome في خطوات مختلفة بناء على استخدام المراسل غير الإجماعي. يتم تسمية المراسلين غير التوافقيين على الموقع المتحور داخل intron والقاعدة التي تم تحويرها إليها. على سبيل المثال ، A3c هو مراسل لديه طفرة في 5 'SS ، وتحديدا الموضع 3 من الأدينوزين بالإجماع إلى السيتوزين. سيتفاعل هذا المراسل بقوة مع طفرات spliceosome التي تؤثر على اختيار واستخدام SS 5 '. في دراستهم الأولية ، حدد Lesser و Guthrie أي طفرات SS 5 'تمنع الربط3. في وقت لاحق من نفس العام ، تم نشر مراسلين غير متفقين عليهم في جميع مواقع لصق الثلاثة بواسطة Burgess و Guthrie في شاشة مثبطة للطفرات في ATPase Prp16p9. بمقارنة الإجماع مع المراسلين غير التوافقيين ، كان اختبار ACT1-CUP1 مفتاحا مهما لفهم متانة وانتقائية spliceosome الخميرة واستنتاج وظيفة spliceosomes حقيقيات النوى الأخرى.
نظرا لأن مراسلي ACT1-CUP1 غير المتفق عليهم يقومون بتوعية الجسيم لمزيد من الاضطراب ، يمكن وصف تأثير طفرة عامل الربط الفردي من خلال المراسلين الذين يؤثر عليهم بشكل إيجابي أو سلبي. تم تطبيق هذا على ربط أسئلة البحث بعدة طرق. أولا ، يمكن استخدام اختبار ACT1-CUP1 كفحص جيني للطفرات في عوامل الربط. على سبيل المثال ، يعمل Prp8p ، أكبر بروتين ربط ، كمنصة يحفز عليها قلب الحمض النووي الريبي ل spliceosome تفاعل الربط. تم استنتاج ذلك ، جزئيا ، من خلال كيفية تحسين أو تقليل طفرات Prp8p من الربط بين مراسلي ACT1-CUP1 المختلفين10،11،12،13،14،15،16،17. كما تم فحص مكونات البروتين الأخرى من spliceosome باستخدام ACT1-CUP1 ، بما في ذلك Hsh155p و Cwc2p و Cef1p و Ecm2p18،19،20،21،22،23،24،25. كما تمت دراسة العتبات النشطة ل Prp16p وأربعة ATPases أخرى تشارك في الانتقال spliceosomal مع هذا الفحص9،26،27،28،29،30. كما تمت دراسة الحمض النووي الريبي الصغير (snRNAs) على نطاق واسع باستخدام ACT1-CUP1 لتحديد تسلسلات ما قبل mRNA التي تنسقها والتغيرات في البنية الثانوية التي تمر بها snRNAs أثناء الربط3،31،32،33،34،35،36،37.
يتطلب اختبار ACT1-CUP1 سلالة خميرة حيث تم التخلص من جميع نسخ جين CUP1. نظرا لأن CUP1 يمكن أن يكون له رقم نسخة مرتفع 6,38 ، فإن التحضير لسلالة خروج المغلوب الكاملة يمكن أن يتطلب جولات متعددة أو فحصا مكثفا. نتيجة لذلك ، غالبا ما يتم مشاركة سلالات خميرة cup1Δ بين المختبرات ، كما فعل الصحفيون.
إذا تم تقييم الطفرة (الطفرات) في عامل الربط من نسخة بلازميد ، فيجب التخلص من الجين من النوع البري لهذا العامل. بالإضافة إلى ذلك ، يجب أن تسمح خلفية الخميرة باختيار اثنين على الأقل من البلازميدات ، أحدهما يحتوي على مراسل ACT1-CUP1 ، تاريخيا على بلازميد اختيار المغذيات الليوسين ، والآخر يحتوي على طفرة أو اضطراب في آلية الربط التي ستتم دراستها (الشكل 2). عادة ، في فحص واحد ، ستختبر سلالات الخميرة المتعددة ، كل منها يحمل اضطراب ربط الاستعلام (QSP) ومراسل مختلف ، تأثير الاستعلام على الربط.
تسمح المتغيرات المستقلة في اختبار ACT1-CUP1 للباحث بتقييم شدة QSP. هذه المتغيرات المستقلة هي تركيز النحاس واختيار العديد من مراسلي الربط غير المتفق عليهم. أولا ، نظرا لأن سلالات الخميرة تزرع على ألواح تحتوي على مجموعة من تركيزات النحاس (الشكل 2) ، فإن إعداد الفحص يتضمن اختيار تدرج التركيزات المستخدمة. يمكن للدراسات استخدام تدرج تركيز النحاس للدورة للحصول على قراءة أولية للجدوى ثم تكرار الفحص بتدرج أدق لتحديد الاختلافات الدقيقة في الجدوى. المتغير الثاني هو النطاق الواسع لمراسلي ACT1-CUP1 الذين يمكن اختبارهم (الشكل 1 والجدول 1). إذا كان QSP يؤثر على صلاحية الخميرة بشكل مختلف في وجود مراسل غير توافقي مقابل النوع البري ، فيمكن التوصل إلى استنتاج مفاده أن QSP يؤثر على خطوة في الربط أو منطقة من spliceosome مهمة أثناء التعرف على أو معالجة تلك المنطقة من الإنترون.
صندوق أدوات الخميرة واسع النطاق ، واختبار ACT1-CUP1 هو جزء لا يتجزأ من أبحاث الربط. غالبا ما يتم إجراء اختبار ACT1-CUP1 جنبا إلى جنب مع تحليل جيني وهيكلي و / أو كيميائي حيوي أكثر تعمقا حول تأثير QSP. نظرا لأن هذه الدراسات الأكثر تفصيلا لها عموما إجراء أطول و / أو سعر أعلى ، فإن النهج المتكرر هو فحص المسوخ المثيرة للاهتمام باستخدام ACT1-CUP1 أولا.
يتم توفيره هنا بروتوكول فحص ACT1-CUP1 ، بما في ذلك تحضير الألواح النحاسية. يوفر هذا الفحص للباحثين إجابة أولية لتأثير QSP على الربط والمناطق الداخلية الأكثر تأثرا بالاضطراب.
Protocol
1. بناء سلالة الخميرة
- توليد أو الحصول على سلالة S. cerevisiae التي تشمل خلفيتها leu2 و cup1Δ. لتوليد هذه الخلفية ، استخدم طريقة الخميرة الراسخة التي تستخدم أسيتات الليثيوم والحمض النووي39 الذي تقطعت به السبل.
ملاحظة: قد تحتوي سلالات الخميرة أحادية الصيغة الصبغية على نسخة واحدة أو نسختين أو أكثر من CUP1 6,38. ارجع إلى المعلومات الجينومية لسلالة الخميرة المختارة عند تصميم بادئات خروج المغلوب لإحاطة موقع (مواقع) جين CUP1. - قم بإجراء تحويل الخميرة لدمج QSP إما عن طريق الدمج الجيني أو على البلازميد. استخدم بروتوكولا راسخا مثل تلك الموصوفة في البحث السابق40،41،42.
- قم بإجراء تحويل الخميرة مع السلالة (السلالات) الناتجة من الخطوة 1.2. لإضافة بلازميد مراسل ACT1-CUP1 المطلوب.
ملاحظة: يجب الحفاظ على الخلايا على لوحات ووسائط تسرب الليوسين (-Leu) لضمان الاحتفاظ ببلازميدات مراسل ACT1-CUP1 بعد هذا التحول. - نفذ الخطوات 1.2. و 1.3. لكل QSP وكل بلازميد مراسل ACT1-CUP1 ليتم اختباره ، بما في ذلك سلالات التحكم.
2. إعداد لوحة النحاس
- حدد نطاق تركيز النحاس الذي يناسب المراسلين المراد اختبارهم (انظر الجدول 1 لمعرفة فتك المراسلين الذين يستخدمون بشكل متكرر).
ملاحظة: مثال على نطاق تركيز النحاس الشامل هو 30 تركيزا مختلفا للنحاس من 0 mM، 0.025 mM، 0.05 mM، 0.075 mM، 0.1 mM، 0.15 mM، 0.2 mM، 0.25 mM، 0.3 mM، 0.35 mM، 0.4 mM، 0.45 mM، 0.5 mM، 0.6 mM، 0.7 mM، 0.8 mM، 0.9 mM، 1.0 mM، 1.1 mM، 1.2 mM، 1.3 mM، 1.4 مليM، 1.5 mM، 1.6 mM، 1.7 mM، 1.8 mM، 1.9 mM، 2.0 mM، 2.25 mM، و 2.5 mM Cu2+. - اصنع محلول مخزون من 1 M CuSO4 ومرشح معقم من خلال مرشح معقم PES (polyethersulfone) 0.22 ميكرومتر.
- لكل صفيحة نحاسية مرغوبة ، قم بإعداد تخفيف 2 مل من مخزون CuSO4 في ماء معقم.
ملاحظة: نظرا لأن اللوحة التي تحتوي على 0 mM Cu 2+ سيتم دائما تحليلها وتصويرها كمرجع ، فمن المستحسن عمل لوحين 0 mM Cu2+ ، أحدهما في البداية والآخر في نهاية خطوة الطلاء (الخطوة 3.4.).- احسب كمية المخزون لتركيز النحاس النهائي المطلوب في 40 مل من حجم اللوحة (الجدول التكميلي 1).
- أضف الكمية المحسوبة من الماء المعقم ومخزون 1 M CuSO4 إلى أنبوب معقم سعة 2 مل.
- صب لوحات لفحص ACT1-CUP1.
ملاحظة: بديل للبروتوكول أدناه هو الجمع بين الوسائط والأجار في البداية في حاوية كبيرة والقسمة بعد التعقيم في حاويات أصغر لتحقيق تركيزات نحاسية مختلفة لكل لوحة. أيا كانت الطريقة المتبعة ، من المهم التأكد من أن تركيز الوسائط متسق بين جميع الألواح على الرغم من أن لكل منها تركيز نحاسي مختلف.- قم بتسمية كل طبق فارغ ليتم سكبه بتركيز النحاس النهائي الذي سيحتوي عليه. قم بإعداد لوحة مربعة واحدة على الأقل لكل تركيز نحاسي ليتم اختبارها.
- قم بتسمية زجاجة 100 مل لكل تركيز نحاسي ليتم اختبارها.
- أضف إلى كل زجاجة 790 مجم من أجار (2٪ وزن / وزن أجار) وقضيب تقليب.
- في دورق كبير ، امزج وسائط النمو -Leu لصب جميع الألواح النحاسية. لكل طبق يتم صنعه ، قم بإذابة 265 مجم من قاعدة نيتروجين الخميرة (YNB) و 64 مجم من مزيج التسرب ناقص الليوسين (وأي مغذيات أخرى قد تكون مطلوبة للحفاظ على بلازميد QSP في الخلايا) في 34 مل من الماء منزوع الأيونات.
- أضف 34 مل من محلول وسائط النمو -Leu إلى كل زجاجة سعة 100 مل معدة وغطاء بورق الألمنيوم. قم بتسمية الرقاقة بتركيز النحاس المقصود.
- الأوتوكلاف لتعقيم وحل أجار باستخدام دورة السائل الموصى بها للأوتوكلاف.
- في أسرع وقت ممكن ، أضف 4 مل من 20٪ وزن / فولت جلوكوز (معقم مصفى) إلى كل زجاجة.
- قم بمطابقة الملصقات وأضف التخفيفات 2 مل من CuSO4 إلى الزجاجة المقصودة.
ملاحظة: نظرا لأنه يمكن تصنيع عشرات الألواح النحاسية في نفس الوقت ، ولكل منها تركيز مختلف ، فإن وضع علامات على جميع الزجاجات والأنابيب والألواح بوضوح بتركيز النحاس المقصود سيمنع الارتباك أثناء صب اللوحة. - استخدم صفيحة تقليب للخلط لمدة ~ 30 ثانية وصب أو ماصة 35 مل في اللوحة المصنفة ، وتجنب الفقاعات. اتركيه ليبرد قبل التخزين أو الاستخدام.
ملاحظة: في كثير من الأحيان ، تصنع لوحات 1 يوم أو 2 أيام قبل الفحص وتخزينها في 4 °C حتى بضع ساعات قبل الاستخدام. يجب أن تكون الألواح في درجة حرارة الغرفة (RT) قبل بدء الطلاء (الخطوة 3.4.).
3. مقايسة ACT1-CUP1
- قم بإخراج السلالات المرغوبة على ألواح -Leu.
ملاحظة: في حالة العمل من مخزون التبريد ، يجب توخي الحذر لضمان إحياء الخلايا بشكل كاف من التخزين قبل الطلاء. الإجراء الموصى به لذلك هو الخروج من المخزون المبرد والسماح له بالنمو لمدة 3-5 أيام عند 30 درجة مئوية. بعد ذلك ، أعد وضع حامل صغير واتركه ينمو لمدة 2-3 أيام أخرى عند 30 درجة مئوية. - قم بتنمية الثقافات الليلية في 10 مل من الوسائط.
- قم بإعداد وسائط نمو -Leu باستخدام نفس النسب الموضحة في الخطوة 2.4.2. لكل 10 مل من الوسائط ، أضف 66 مجم من قاعدة نيتروجين الخميرة (YNB) و 16 مجم من مزيج التسرب ناقص الليوسين إلى 9 مل من الماء منزوع الأيونات. تمر عبر مرشح معقم PES 0.22 ميكرومتر.
- لكل سلالة خميرة ، أضف 9 مل من وسائط نمو -Leu و 1 مل من 20٪ وزن / فولت جلوكوز (معقم مصفى) إلى أنبوب مخروطي معقم سعة 50 مل.
- باستخدام عصا معقمة أو طرف ماصة ، اجمع عينة صغيرة (~ 1 مم) من الخميرة وقم بتلقيح الوسائط.
- هز جميع الثقافات الليلية عند 180 دورة في الدقيقة و 30 درجة مئوية.
ملاحظة: إذا كانت متوفرة، يمكن استخدام الدوارات بدلا من الاهتزاز.
- تمييع السلالات إلى OD600 0.5 ± 0.05 في 10 ٪ الجلسرين.
- لكل سلالة ، أضف 100 ميكرولتر من الثقافة إلى كوفيت يحتوي على 900 ميكرولتر من الماء.
- قم بقياس OD600 باستخدام مقياس الطيف الضوئي.
- احسب التخفيف المطلوب ليكون عندOD 600 من 0.5 في الحجم النهائي 2 مل.
- تمييع كل سلالة إلى OD600 0.5 في 10 ٪ الجلسرين (معقمة).
- أعد قياس OD600 للتأكد من أن كثافة الخلية ضمن النطاق المطلوب من 0.5 ± 0.05.
- لوحة السلالات على لوحات النحاس.
ملاحظة: يمكن استخدام مجموعة متنوعة من الطرق لطلاء السلالات ، بما في ذلك السحب اليدوي لأحجام 5-10 ميكرولتر ، باستخدام ماصة متكررة أو متعددة القنوات ، أو الختم باستخدام مكرر دبوس. يتم وصف هذه الطريقة الأخيرة أدناه ، على الرغم من أن معظم الخطوات ستكون متشابهة بغض النظر عن الطريقة.- قم بإعداد موقع عمل معقم وموقد بنسن مضاء.
- بالنسبة لجهاز النسخ المتماثل المكون من 48 سنا ، ماصة 200 ميكرولتر من كل سلالة مخففة في بئر منفصل من لوحة 96 بئر. املأ المساحات الفارغة في الشبكة 6 × 8 ب 200 ميكرولتر من 10٪ من الجلسرين (معقم).
ملاحظة: يوجد مثال على مخطط الطلاء لتسع سلالات خميرة في الجدول التكميلي 2. - اغمس جهاز النسخ المتماثل في طبق ضحل من الإيثانول بنسبة 95٪ (v / v) واللهب لتعقيمه. اتركه يبرد لمدة 2 دقيقة على الأقل بعد إطفاء اللهب لتجنب الحرارة التي تصدم الخلايا.
- ضع أربع لوحات بالقرب من الموقد وأزل الأغطية.
- اغمس جهاز النسخ المتماثل في لوحة 96 بئرا وارفعه لأعلى بحركة واحدة سريعة.
- ضعه برفق على الطبق وصخر برفق ذهابا وإيابا لتسهيل النقل الجيد.
- ارفع لأعلى بحركة سريعة واحدة وضعها في نفس الاتجاه بالضبط في لوحة 96 بئر.
- كرر لما يصل إلى ثلاث لوحات أخرى. كرر عملية غمس جهاز النسخ المتماثل في الإيثانول ، واللهب للتعقيم ، والانتظار لتبرد كل أربع أطباق.
- بعد طلاء الصفيحة ، تحرك بحركة سلسة إلى الجانب ولكن لا يزال داخل مظلة التعقيم للهب.
ملاحظة: يوصى بعمل تخفيفات الخميرة والطلاء بالقرب من اللهب. يمكن أن تتلوث الألواح بسهولة أثناء التجفيف. - اترك الأطباق تجف تماما قبل وضع الأغطية ، عادة 3-5 دقائق.
- احتضان الأطباق لمدة 3 أيام عند 30 درجة مئوية.
4. جمع البيانات وتحليلها
- قم بإزالة الألواح من الحاضنة وافحصها بصريا.
- سجل صور اللوحات باستخدام كاميرا متاحة أو نظام تصوير رقمي آخر.
- سجل (أو يسجل) لكل سلالة لوحظ آخر نمو مرئي لتركيز النحاس.
ملاحظة: الخلايا قادرة على لصق وتبقى قابلة للحياة حتى هذا التركيز. من أجل الاتساق ، استخدم دائما نفس الطريقة ، إما بالعين أو من صور اللوحة ، لتسجيل آخر تركيز نحاسي قابل للتطبيق. المستعمرات الصغيرة جدا مرئية في بعض الأحيان بالعين ولكن ليس على الصورة. الفرق بين الفحص البصري المباشر أو التسجيل من الصور صغير ، وعادة ما يكون خطوة في التدرج. نظرا لأن صور المستعمرات غالبا ما تستخدم في المنشورات ، يوصى بالتسجيل بواسطة الصور. - اجمع البيانات من مقايسات ACT1-CUP1 المتعددة لنفس السلالة لاستخلاص استنتاجات حول كيفية تأثير QSP على الربط.
ملاحظة: تظهر أرقام النشر عادة صورا لمستعمرات الخميرة بتركيز 0 mM Cu2+ ، وآخر تركيز نحاسي قابل للحياة ، والتركيز اللاحق حيث ماتت المستعمرة. يمكن أيضا عرض البيانات كرسم بياني شريطي مع أشرطة خطأ للانحراف المعياري بين النسخ المتماثلة. لا تحتاج البيانات إلى التطبيع ولكن يمكن أن تكون عن طريق تحديد صلاحية التحكم في عامل الربط WT إلى 1 ومقارنة تأثير الطفرة (الطفرات) المقدمة.
النتائج
تتطلب فحوصات النمو ، مثل ACT1-CUP1 ، تقييما بصريا ومقارنا لمستعمرات متعددة. هنا ، نمت كل سلالة إلى التشبع بين عشية وضحاها ، وتم تخفيفها إلى OD600 من 0.5 ، ومطلية على 20 لوحة تحتوي على مجموعة من تركيزات النحاس من 0 mM إلى 1.1 mM CuSO4 (الشكل 3). هذا النطاق أصغر من النطاق المدرج في البروتوكول لأنه سمح بالتقييم الكامل لتأثير QSPs ومراسلي ACT1-CUP1 المستخدمين والموصوفين أدناه. تم تصوير اللوحات وتسجيلها (الشكل 3 والجدول التكميلي 3).
بالنسبة لهذه التجربة التمثيلية ، تتضمن خلفية الخميرة جين ADE2 المعطل ، مما يؤدي إلى أن تكون المستعمرات درجات متفاوتة من اللون الأحمر (الشكل 3 أ ، ب). يتسبب هذا الاضطراب الشائع في الخميرة في مسار إنتاج الأدينوزين في تراكم سلائف حمراء اللون للأدينوزين. وبالتالي ، فإن اللون الأحمر هو مؤشر على نضج مستعمرة الخميرة (أي كمية وعمر الخلايا الموجودة). لأغراض فحص ACT1-CUP1 ، يمكن أن يكون اللون الأحمر بمثابة مؤشر على تلويث الأنواع الفطرية إذا كان لونها أبيض أو أصفر. يمكن أن يكون اللون تأكيدا ثانويا لتحمل النحاس لأن المستعمرات الأكثر قابلية للحياة ستكون ظلا أحمر أعمق.
عند الطلاء باستخدام مكرر دبوس ، هناك العديد من الانحرافات الشائعة. أولا ، من الممكن إنشاء مستعمرات بيضاوية الشكل إذا تم رفع جهاز النسخ المتماثل أثناء التحرك يسارا أو يمينا (الشكل 3B ، السهم البرتقالي). بالإضافة إلى ذلك ، يمكن أن تتشكل المستعمرات الدقيقة أيضا من قطرات صغيرة من محلول الخلية إذا تم إحضار مكرر الدبوس بزاوية أو إذا اهتز فوق اللوحة (الشكل 3 ب ، السهم الأحمر). في كثير من الأحيان غير ضارة ، في بعض الأحيان ، يمكن أن تختلط المستعمرات الدقيقة مع مستعمرة مختومة ، وهذا يمنع تفسير تلك المستعمرة. تشمل مشكلات الطلاء الإضافية عدم كفاية وقت الانتظار بعد التعقيم حتى تبرد دبابيس النسخ المتماثل وعدم كفاية الاتصال بين اللوحة والدبابيس بحيث يحدث نقل ضعيف لوسائط الاستزراع. في كلتا الحالتين ، ستنمو خلايا قليلة ، إن وجدت ، على الصفيحة ، بما في ذلك سلالات التحكم التي تحتوي على المراسل من النوع البري. كما هو الحال مع أي اختبار نمو ، بغض النظر عن طريقة الطلاء ، من المهم إجراء ACT1-CUP1 في ثلاث نسخ للتأكد من أن النتائج متسقة وقابلة للتكرار. من الناحية المثالية ، يجب إجراء هذه النسخ المتماثلة المختلفة على ألواح نحاسية معدة في أوقات مختلفة لضمان قابلية التكاثر.
بالنسبة لهذه التجارب التمثيلية ، تم اختيار مراسل A3c لتسليط الضوء على تأثير تسلسل غير توافقي على تحمل النحاس في حالة عدم وجود اضطرابات إضافية في spliceosome. يقلل A3c بشكل كبير من كمية CUP1 mRNA المنتجة لأنه يزعج قدرة spliceosome على التعرف على 5 'SS15 واستخدامه. نجت الخميرة مع مراسل A3c إلى 0.15 mM Cu2+ ، بينما حافظت خلايا المراسل من النوع البري على صلاحيتها حتى نهاية نطاق تركيزات النحاس التي تم اختبارها (الشكل 3C). ينمو المراسل البري الذي يحتوي على خلايا إلى 2.5 mM Cu2+ دون تأثير على الجدوى (البيانات غير معروضة).
U6 snRNA هو مكون تحفيزي أساسي في spliceosome. استخدمت دراسات متعددة ACT1-CUP1 لدراسة التأثير الذي يمكن أن تحدثه الطفرات على هذا الحمض النووي الريبي16،32،34. مكررة لهذه الدراسة ، تمت دراسة ثلاثة تسلسلات U6 snRNA ، وهي تسلسل النوع البري (WT) ، وموضع 57 المستبدل من يوريدين إلى سيتوزين (U57c) ، وموضع 57 مستبدل من يوريدين إلى أدينوزين (U57a) (الشكل 3 والشكل 4). جنبا إلى جنب مع مراسلي ACT1-CUP1 الذين يؤثرون على الخطوات التحفيزية في الربط ، تم تحديد أن U57c تفضل الخطوة التحفيزية الأولى ، و U57a تفضل التقدم إلى الخطوة الثانية16,32.
لإعداد اختبار ACT1-CUP1 ، تم إنشاء سلالة مع حذف النسخة الجينومية من U6 snRNA وتسلسل U6 snRNA البري أو المتحور المتضمن في البلازميدات. نظرا لأن U6 snRNA هو مكون أساسي للخلية ، فقد تم استخدام ثلاثة تحولات منفصلة لضرب U6 snRNA الجينومي أولا مع الحفاظ على صلاحية الخلية ، ثم إدخال U6 snRNAs المتحورة على البلازميدات ، وأخيرا ، إضافة مراسلي ACT1-CUP1. بالنسبة للتحول الأول ، تم استخدام سلالة خميرة cup1Δ في خروج النسخة الجينومية من U6 snRNA مع إضافة WT U6 snRNA في نفس الوقت على بلازميد علامة اختيار URA للحفاظ على الجدوى. أضاف التحول اللاحق إما من النوع البري أو المتحور U6 snRNA على بلازميد علامة اختيار TRP ، والاختيار مقابل علامة URA عبر اختيار 5-FOA. وهكذا ، تم إنشاء ثلاث سلالات خميرة cup1Δ ، لكل منها أحد تسلسلات U6 snRNA ، وهي WT و U57a و U57c. أضاف تحويل الخميرة النهائي لكل سلالة واحدة من بلازميدات مراسل ACT1-CUP1 الثلاثة المختلفة لاستخدامها في هذه التجربة. كان المراسلون المختارون هم المراسل من النوع البري ، A3c ، وطفرة في الأدينوزين في موقع الفرع إلى جوانين (BS-G). تم إنشاء ما مجموعه تسع سلالات لهذه التجربة ، تحتوي كل منها على تسلسل U6 snRNA واحد ومراسل ACT1-CUP1 واحد (الجدول التكميلي 4 والجدول التكميلي 5).
أظهرت النتائج أن القواعد المختلفة في موقع U6 snRNA 57 لها تأثيرات فريدة على spliceosome بالاشتراك مع طفرة 5 'SS أو BS (الشكل 4). يمنع كل من مراسلي A3c و BS-G الربط بشكل أساسي عن طريق تثبيت أول تشكيل خطوة تحفيزية14,15. وبالتالي ، فإن U57c عبارة عن طفرة مضافة تقلل من تحمل النحاس بالاشتراك مع أي من هؤلاء المراسلين (الشكل 4 ب). في المقابل ، يزيد U57a من تحمل النحاس لأنه يعزز التقدم إلى الخطوة الثانية (الشكل 4 ب) 16،32. يسلط انخفاض تحمل النحاس لسلالة BS-G مع U57a مقارنة ب U6 snRNA WT الضوء على التأثير الثانوي المحتمل ل BS-G على الخطوة الثانية من الربط16.
تسلط هذه النتائج الضوء أيضا على الطبيعة النوعية لهذا الفحص ولماذا يجب اختبار تسلسل الاستعلام والمراسل من النوع البري. في حين أن النمط العام لزيادة أو انخفاض تحمل النحاس ينطبق على طفرات U6 snRNA مقارنة بالنوع البري U6 snRNA ، فإن التركيز الدقيق للنحاس الذي تعيش عليه الخلايا يمكن أن يختلف بين الدراسات (الجدول 1) ويختلف بين هذه البيانات التمثيلية والنتائج المنشورة الأخرى. من المحتمل أن يكون هذا بسبب خلفية السلالة التي تحتوي على حذف CUP1 ولكن يمكن أن يكون أيضا بسبب الصحة العامة للسلالات قبل الطلاء (أي مدى تم إجراء الفحص بعد توليد السلالة أو الراحة من التبريد) ، والاختلافات في كيفية تحضير الألواح ، والتباين بين الحاضنات المختلفة. لوحظ تباين مماثل في Mayerle et al. لطفرات استعلام Prp8 في الأدبيات43. وبالتالي ، يمكن إجراء مقارنة اتجاهات تحمل النحاس لمقايسات ACT1-CUP1 المختلفة ، ولكن يجب إجراء المقارنة الرقمية لتركيزات النحاس فقط داخل نفس المختبر ، وفي بعض الأحيان ، مع نفس مجموعة الألواح النحاسية.
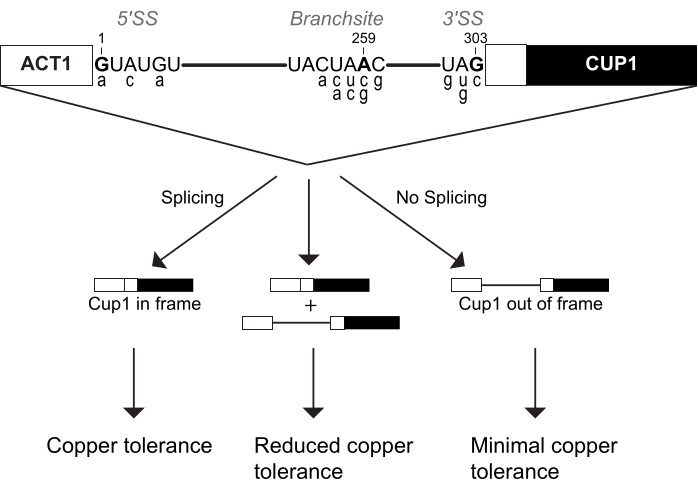
الشكل 1: تصميم مراسل ACT1-CUP1. يرتبط تركيز المراسل المقسم ارتباطا مباشرا بتحمل الخميرة النحاسية. يتضمن الرسم البياني للمراسل مواقع لصق الثلاثة لموقع لصق 5 '(5' SS) ، وموقع الفرع (BS) ، وموقع لصق 3 '(3' SS). يتم عرض تسلسل إجماع الخميرة لهذه المواقع ، مع الإشارة إلى تلك المستهدفة للانقسام بالخط العريض والمرقمة بناء على موقعها في الإنترون. يتم عرض تسلسلات مراسل ACT1-CUP1 غير المتفق عليها شائعة الاستخدام في الأحرف الصغيرة أسفل مواقع تسلسل الإجماع المقابلة لها وهي مدرجة في الجدول 1. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: سير عمل فحص ACT1-CUP1. لهذا الفحص ، يجب أن تكون سلالة الخميرة cup1Δ leu2 وتحتوي على بلازميد مراسل ACT1-CUP1 المطلوب وجين QSP ، المسمى الجين في الشكل. يجب إدخال جين QSP إما جينوم أو على بلازميد. يتضمن البروتوكول الذي يستخدم مضاعف الدبوس أربع خطوات لتحضير خلايا الخميرة. الخطوة 1 هي نمو الخلايا إلى التشبع. الخطوة 2 هي قياس OD 600 للثقافة وتخفيفها إلىOD 600 من 0.5. الخطوة 3 هي التوزيع على لوحة 96 بئر. الخطوة 4 هي لوحة على لوحات تحتوي على تركيزات متزايدة من النحاس (يشار إليها بزيادة اللون الأزرق). ستكون الخطوة 1 والخطوة 2 والخطوة 4 متطابقة للسحب اليدوي. بمجرد الطلاء ، يتم تحضين الألواح لمدة 3 أيام عند 30 درجة مئوية ثم يتم تسجيلها للتأكد من صلاحيتها. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: وجهات نظر تمثيلية لبيانات ACT1-CUP1. في هذه التجربة ، يتم تحدي spliceosomes الخميرة مع اثنين من طفرات مختلفة U6 snRNA واختبارها في وجود ثلاثة مراسلين غير الإجماع. يتم تقديم ثلاث نسخ طبق الأصل من هذا الفحص على نفس اللوحات لأغراض العرض التوضيحي. يوصى لهذا الفحص بإجراء نسخ متماثلة على لوحات منفصلة وفي أيام منفصلة. (أ) مقايسة مكتملة بتدرج نحاسي من 0 mM إلى 1.1 mM على 20 لوحة. مع زيادة تركيز النحاس ، تظهر السلالات ذات الربط المنخفض انخفاضا في الالتقاء إلى النقطة التي يصبح فيها تركيز النحاس قاتلا. كانت خلفية الخميرة ade2 ، وبالتالي ، فإن المستعمرات الناضجة حمراء اللون. (B) مقارنة نفس اللوحات عند 0 mM و 0.1 mM CuSO4 المصورة بكاميرا محمولة باليد مقابل نظام التصوير الرقمي. هذا مثال على كيفية مقارنة عدد من المراسلين غير التوافقيين جنبا إلى جنب ومع المراسل الجامح. تشمل الملاحظات الشائعة على الصفائح قطرة زائفة من وسائط الاستزراع التي سقطت من مكرر الدبوس (السهم الأحمر) وبيضاوية طفيفة للمستعمرات بسبب انزلاق الدبوس على طول سطح اللوحة أو حركة اللوحة قبل أن تجف قطرة الثقافة بشكل كاف (السهم البرتقالي). (ج) مثال على تأثير مراسل A3c على صلاحية الخلية مقارنة بالمراسل من النوع البري. يتم اقتصاص الصور مثل تلك الموضحة في (ب) ومحاذاتها لإبراز اختلافات النمو عند تركيزات النحاس المختلفة. ينخفض تحمل النحاس لسلالة مراسل A3c إلى 0.15 mM Cu2+ مقارنة بصلاحية سلالة المراسل من النوع البري حتى نهاية النطاق الذي تم اختباره. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
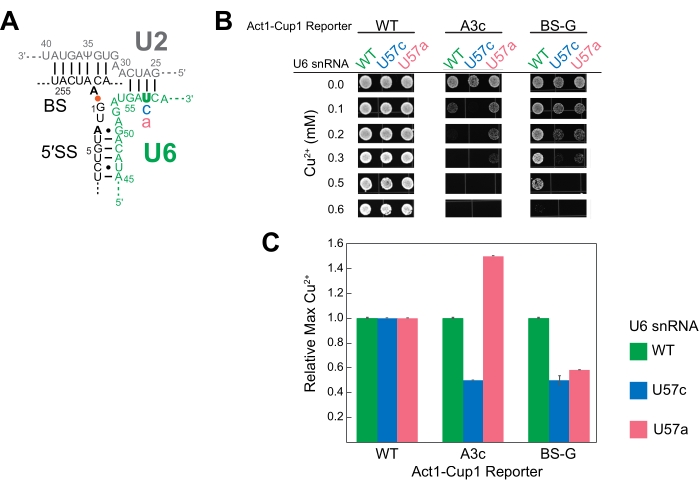
الشكل 4: نتائج ACT1-CUP1 التمثيلية التي تراقب الربط في الخميرة مع طفرات مكونات الربط . (أ) رسم تخطيطي لمكونات الحمض النووي الريبي للموقع النشط مباشرة بعد الخطوة التحفيزية الأولى. يتم ازدواج U2 و U6 snRNAs ، مما يجعل 5 'SS و BS من intron على مقربة. يشار إلى الرابطة الداخلية بين A259 (BS) و G1 (5 'SS) بالنقطة البرتقالية. يشار إلى مواقع بدائل التسلسل غير المتفق عليها في مراسل ACT1-CUP1 الذي تم اختباره في هذه التجربة باللون الأسود الغامق. الموضع المتحور في U6 snRNA (U57) باللون الأخضر الغامق ، والقواعد المستبدلة إما باللون الأزرق أو الوردي. (ب) تتضمن إحدى إمكانيات عرض بيانات ACT1-CUP1 في منشور عدة صور للمستعمرات من تركيزات Cu2+ ذات الصلة. نجا مراسل WT بعد تركيز النحاس الذي تم اختباره لجميع سلالات U6 snRNA الثلاثة التي تم الاستفسار عنها. (ج) رسم بياني بالأعمدة يقارن التأثيرات لكل مراسل ولكل متحولة U6 snRNA. يتم إجراء التطبيع لكل مراسل ACT1-CUP1 عن طريق ضبط تحمل النحاس ل U6 snRNA WT إلى 1 وحساب النسبة لطفرات U57c و U57a. تمثل أشرطة الخطأ الانحراف المعياري عن ثلاث نسخ متماثلة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
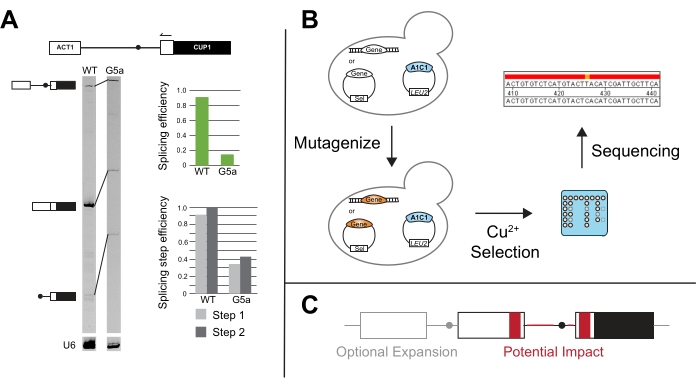
الشكل 5: طرق إضافية لتكملة نتائج ACT1-CUP1 . (أ) يتم إجراء تمديد التمهيدي عن طريق التلدين التمهيدي في 3 ' ACT1 exon ثم استطالة في intron. في هذا المثال ، يتم تسمية التمهيدي بصبغة IR700 ، وتم تنفيذ امتداد التمهيدي كما هو موضح في 20،21. يتم تنفيذ تمديد التمهيدي من U6 snRNA في نفس التفاعل ليكون بمثابة التحكم في التحميل. 7٪ 19: 1 مكرر / أكريلاميد ، جل تغيير طبيعة يحل منتجات ما قبل mRNA و mRNA و lariat بعد تمديد التمهيدي باستخدام جهاز تصوير جل قريب من الأشعة تحت الحمراء كما هو موضح في van der Feltz et al.22. يمكن استخدام شدة النطاقات المختلفة لقياس كفاءة الربط بشكل عام بالإضافة إلى التمييز بين اختلافات الربط التي تحدث في الخطوة الأولى أو الثانية ، كما تم قياسها باستخدام ImageJ44 أو أي برنامج آخر لتحديد نطاق الهلام. يتم حساب كل من كفاءة الربط وكفاءة خطوة الربط كما هو موضح في Query و Konarska14. (ب) يمكن للشاشات الطفرية مع مراسلي ACT1-CUP1 استخدام اختيار النحاس لتحديد الطفرات التي تؤثر على الربط. يمكن بعد ذلك تسلسل الجين (الجينات) محل الاهتمام في السلالات الناتجة لتحديد ما إذا كانت الطفرة قد حدثت في هذا الجين. (ج) يمكن إجراء تعديلات على المراسل خارج مواقع لصق لمراقبة تغيرات الربط فيما يتعلق ببنية intron أو التسلسلات الخارجية أو عدد الإكسونات أو التصدير النووي للحمض النووي الريبي غير المقسم. المناطق باللون الرمادي هي مناطق توسع اختيارية لتضمينها في المراسل ، والمناطق باللون الأحمر هي المناطق التي يمكن فيها اختبار التسلسل والتغييرات الهيكلية لتأثيرها المحتمل على الربط باستخدام مقايسة ACT1-CUP1. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| اسم المراسل | منطقة إنترونيك | تسلسل | آخر تركيز Cu2+ قابل للتطبيق (mM) | |
| بالوزن | 5' | غواوغو | > 2.5 | |
| جي 1 أ | 5ʹ | أ أوجو | 0.0133 أو 0.0532 | |
| أ 3 ج | 5ʹ | غوجأوغو | 0.15 ^ ، 18 أو 0.216 | |
| جي 5 أ | 5ʹ | غواواو | 0.303 أو 0.259 | |
| بالوزن | موقع الفرع | أوكواك | > 2.5 | |
| C256a | موقع الفرع | UAأUAAC | 0.1526 أو 0.1832 | |
| U257c/a | موقع الفرع | UACc / aAAC | 0.226 أو 0.332 أو 0.545 | 0.059,32 |
| A258c/u | موقع الفرع | UACUج / شAC | 0.826 | 1.045 أو 1.646 |
| بكالوريوس-ج | موقع الفرع | أوكوا جج | 0.153 أو 0.1832,56 أو 0.226 | |
| بي اس-جي | موقع الفرع | أوكوازج | 0.0516,32 أو 0.625 أو 0.846 | |
| سي ٢٦٠ غرام | موقع الفرع | أوكواز | 0.826 | |
| بالوزن | 3' | UAG | > 2.5 | |
| U301g | 3ʹ | جي أ ج | 0.1518 | |
| A302g/u | 3' | ش ز/ ش ز | 0.0139 | 0.07516 أو 0.1824 |
| جي 303 سي | 3ʹ | أج | 0.0532 | |
الجدول 1: قائمة المراسلين العاديين وفتك تركيز Cu2+ المبلغ عنه. هناك أكثر من 100 اقتباس من Lesser و Guthrie3. في حين تم استخدام مجموعة صغيرة من هذه الاستشهادات لإنشاء هذا الجدول ، فإنها تسلط الضوء على الاتجاه العام للاختلافات الطفيفة إلى المتوسطة بين الدراسات في تركيزات صلاحية النحاس المبلغ عنها. في ACT1-CUP1 ، من المهم مقارنة البروتين من النوع البري أو الحمض النووي الريبي بالطفرات التي لها نفس خلفية سلالة الخميرة باستخدام التركيزات المنشورة كدليل ولكن مع توقع أن التركيزات المرصودة قد تختلف. البيانات التي تم جمعها من الشكل 3 (^) والمنشورات المتعددة المشروحة بالاستشهادات التالية3،9،16،18،24،25،26،32،45،46.
الجدول التكميلي 1: محتويات صفيحة نحاسية واحدة ومثال على الحسابات التي أجريت لتحقيق تخفيفات النحاس من 0 mM إلى 2.5 mM من مخزون 1 M CuSO4 . الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 2: مثال على مخطط الطلاء لجهاز النسخ المتماثل المكون من 48 سنا. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 3: مثال على الجدوى المسجلة من الألواح النحاسية المحتضنة لمدة 3 أيام عند 30 درجة مئوية. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 4: قائمة سلالات الخميرة المستخدمة لتوليد البيانات التمثيلية. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 5: قائمة البلازميدات المستخدمة لتوليد البيانات التمثيلية. بلازميدات U6 snRNA المتولدة والمنشورة في الأبحاث السابقة 22,47. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
ACT1-CUP1 هو اختبار نمو ، ويجب توخي الحذر للتأكد من أن اختلافات النمو الملحوظة لا يمكن أن تعزى إلا إلى عيوب الربط. يجب التعامل مع جميع السلالات بطريقة مماثلة قبل الطلاء ، بما في ذلك وجود نفس الطول والنوع من ظروف النمو والتخزين. في حالة استخدام سلالات حساسة لدرجة الحرارة ، يجب إجراء فحوصات ACT1-CUP1 فقط في ظل ظروف تنمو فيها هذه السلالات بشكل مشابه للنوع البري. وفي سياق متصل، بالنسبة لمكون QSP، ينصح بأن يكون لديك خلفيات خميرة متطابقة ومستويات تعبير لجين (جينات) QSP حتى لا تحجب تفسير النتائج. عند النظر في عدد QSPs والمراسلين الذين يجب استخدامهم ، لا ينصح بفحص أكثر من 30 سلالة في وقت واحد باستخدام طريقة مكرر الدبوس. مع الوقت الإضافي لأداء كل خطوة ، ستستقر الخلايا ، وستكون نتائج الفحص غير متسقة بسبب انخفاض صلاحية الخلية.
بالإضافة إلى القيود التي يمتلكها ACT1-CUP1 بطبيعتها كاختبار للنمو ، قد يكون ل QSP تأثير أكثر تعقيدا على الربط مما يمكن حله بهذه الطريقة. نظرا لأن الربط هو عملية متعددة الخطوات ويتم إعادة تدوير العوامل ، يمكن أن يؤدي النمط الظاهري المرصود إلى الاضطراب الذي يؤثر على أكثر من خطوة ربط واحدة. هذا صحيح حتى بالنسبة للتحليلات اللاحقة التي يمكن أن تتبع ACT1-CUP1 ، وبعضها موضح أدناه. ستسلط البيانات الضوء على الخطوة الأكثر اضطرابا في العملية ، على الرغم من أن الخطوات الأخرى قد تتأثر بالوظيفة المتغيرة لعامل الربط.
تم استخدام التمديد التمهيدي لمراسلي ACT1-CUP1 لأول مرة في ورقة Lesser and Guthrie الأصلية وغالبا ما يتم إجراؤه إذا أظهرت نتائج ACT1-CUP1 عيبا في النمو3. يستهدف هذا الفحص المراسل ويستخدم طول منتجات تفاعل البوليميراز المتسلسل لتحديد الكميات النسبية للمراسل غير المقسم والمقسم جزئيا والمقسم بالكامل (الشكل 5 أ). يتم حساب كفاءة الربط الإجمالية وما إذا كان العيب يؤثر بقوة أكبر على الخطوة التحفيزية الأولى أو الثانية عن طريق أخذ نسب من كميات منتج PCR14. على سبيل المثال ، قلل مراسل SS G5a مقاس 5 بوصات من الربط مقارنة بالمراسل من النوع البري ، لكن كفاءاته الأولى والثانية تتبع نمطا مشابها للنوع البري (الشكل 5 أ). يشير هذا إلى وجود عيب قبل الخطوة التحفيزية الأولى ، ربما في تجميع spliceosome ، لأن كلتا الخطوتين تتأثران بالمثل31.
تم تطوير فحوصات جديدة من مقايسة ACT1-CUP1 المتعارف عليها ، مثل فحص الطفرات التي تعمل على تحسين الربط في وجود طفرات عامل الربط الأخرى و / أو تسلسلات الربط غير المتفق عليها (الشكل 5 ب). على سبيل المثال ، أدى تعريض الخميرة التي تحتوي على مراسل ACT1-CUP1 للأشعة فوق البنفسجية ثم الاختيار في وجود النحاس إلى إنتاج طفرات Prp8 و Hsh155 التي حسنت الربط بين التسلسلات غير المتفق عليها14,19.
بالتوسع في دراسة تأثير مواقع لصق وعوامل الربط التأسيسية ، تم استخدام اعتماد نمو CUP1 لدراسة الربط المتعدد intron ، ومراقبة الصادرات النووية ، وتأثير UTR والتسلسلات المحيطية الأخرى على الربط (الشكل 5C). خلقت بعض هذه الدراسات مراسلين مع CUP1 وجينات الخميرة الأخرى المحتوية على الإنترون والتي يمكن أن يكون لها أنماط ربط أكثر تعقيدا لدراسة التأثير على البنية الثانوية intronic والربط متعدد النسخ48،49،50،51،52. تمت دراسة العلاقة بين الربط والتصدير النووي من خلال وجود نسخ مقسمة أو غير مقسمة تشفر CUP1 في الإطار53,54. كما تم اختبار طول مسار البيريميدين واعتماد مسافة اختيار موقع لصق بسبب عوامل محددة20،55،56،57. تسلط هذه الأمثلة وغيرها الكثير الضوء على تعدد استخدامات ACT1-CUP1 ومقايسات نمو CUP1 الأخرى.
يربط اختبار ACT1-CUP1 الاضطرابات بدورة تفاعل معقدة مع نمط ظاهري نمو مباشر مع نطاق حساسية واسع. تم استخدام هذا الاختبار القديم من قبل مختبرات متعددة لوضع الأساس لفهم دورة الربط. في الآونة الأخيرة ، تم استخدام ACT1-CUP1 للإجابة على الأسئلة التي تنشأ من ثروة البيانات الهيكلية المتاحة الآن21،22،25. يمكن إقران الدراسات الهيكلية للجسيمات المرتبطة بتسلسلات غير توافقية مع نتائج ACT1-CUP1 لتفسير كيفية ارتباط البنية المتغيرة والوظيفة المتغيرة. ACT1-CUP1 هي الشاشة الأولى المثالية لطفرات الربط التي يمكن أن تكمل التحليل الأكثر تعقيدا.
Disclosures
ليس لدى المؤلف ما يكشف عنه.
Acknowledgements
شكرا لآرون هوسكينز وأعضاء مختبر هوسكينز في جامعة ويسكونسن ماديسون لاستخدام سلالات الخميرة والمعدات في توليد الأشكال 3-5. شكرا لهاربريت كور وشينغيانغ فو على تعليقاتهما الثاقبة على المخطوطة. شكرا للطلاب والموظفين وأعضاء هيئة التدريس الداعمين في جامعة نورث ويست أثناء كتابة هذه الورقة وتحريرها وتصويرها. شكرا لإيزابيل ماراسيغان للمساعدة في تصوير هذه الطريقة.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-129 | Or comparable item from a different manufacturer. |
| 2 mL sterile microcentrifuge tubes | Fisher Scientific | 05-408-138 | Or comparable item from a different manufacturer. |
| 50 mL sterile centrifuge tubes | Fisher Scientific | 07-201-332 | Or comparable item from a different manufacturer. |
| 96-well round bottom microplate | Fisher Scientific | 07-200-760 | Or comparable item from a different manufacturer. |
| 190 proof ethanol | Fisher Scientific | 22-032-600 | Or comparable item from a different manufacturer. |
| 500 mL Filter System (0.22 µm) | CellTreat Scientific Products | 229707 | Or comparable item from a different manufacturer. |
| Agar | Fisher Scientific | BP1423-500 | Any molecular grade agar will work. |
| Autoclave | Tuttnauer | 3870EA | Or comparable item from a different manufacturer. |
| Bunsen burner | Humboldt | PN6200.1 | Or comparable item from a different manufacturer. |
| Cell Density Meter | VWR | 490005-906 | Or other spectral device that can measure absorbance at 595 nm. |
| Copper sulfate Pentahydrate | Fisher Scientific | LC134051 | Or comparable item from a different manufacturer. |
| Digital imaging system | Cytiva | 29399481 | ImageQuant 4000 (used for Figure 3), Amersham ImageQuant 800, or comparable item from a different manufacturer. |
| Dropout mix (-Leu) | USBiological Life Sciences | D9525 | Use the appropriate drop out mix for your experiment. It is possible you will be using a yeast nutrient marker for your query perturbation also. In that case, the drop out mix should be for that marker and Leu |
| D-Glucose | Fisher Scientific | AAA1682836 | Or comparable item from a different manufacturer. |
| Gel band quantifying software | Cytiva | 29-0006-05 | ImageQuant TL v8.1 (used for figure 5A) or comparable item from a different manufacturer. |
| Hand held camera | Nikon | D3500 | Or comparable item from a different manufacturer. |
| Near infra-red gel imaging device | Cytiva | 29238583 | Amersham Typhoon NIR (used for Figure 5a) or comparable item from a different manufacturer. |
| Laboratory grade clamp | Fisher Scientific | 05-769-7Q | Or comparable item from a different manufacturer. |
| Laboratory grade stand and clamp | Fisher Scientific | 12-000-101 | Or comparable item from a different manufacturer. |
| Magnetic stir bars | Fisher Scientific | 14-513-51 | Or comparable item from a different manufacturer. |
| Pin replicator | VP Scientific | VP 407AH | |
| Semi-micro disposable cuvettes | VWR | 97000-590 | Or comparable item from a different manufacturer. |
| Shaker | JEIO Tech | IST-3075 | Or comparable item from a different manufacturer. |
| Spectrophotometer | Biowave | 80-3000-45 | Or any spectophotometer that can measure the absorbance at 600 nm. |
| Square plates | VWR | 102091-156 | Circular plates may also be used though are more challenging if using a pin replicator. |
| Stir plate | Fisher Scientific | 11-520-16S | Or comparable item from a different manufacturer. |
| Yeast nitrogen base | USBiological Life Sciences | Y2025 | Or comparable item from a different manufacturer. |
References
- Wahl, M. C., Will, C. L., Luhrmann, R. The spliceosome: Design principles of a dynamic RNP machine. Cell. 136 (4), 701-718 (2009).
- Wilkinson, M. E., Charenton, C., Nagai, K. RNA splicing by the spliceosome. Annual Review of Biochemistry. 89, 359-388 (2020).
- Lesser, C. F., Guthrie, C. Mutational analysis of pre-mRNA splicing in Saccharomyces cerevisiae using a sensitive new reporter gene, CUP1. Genetics. 133 (4), 851-863 (1993).
- Ng, R., Abelson, J. Isolation and sequence of the gene for actin in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 77 (7), 3912-3916 (1980).
- Gallwitz, D., Sures, I. Structure of a split yeast gene: Complete nucleotide sequence of the actin gene in I. Proceedings of the National Academy of Sciences of the United States of America. 77 (5), 2546-2550 (1980).
- Fogel, S., Welch, J. W., Cathala, G., Karin, M. Gene amplification in yeast: CUP1 copy number regulates copper resistance. Current Genetics. 7 (5), 347-355 (1983).
- Hamer, D. H., Thiele, D. J., Lemontt, J. E. Function and autoregulation of yeast copperthionein. Science. 228 (4700), 685-690 (1985).
- Winge, D. R., Nielson, K. B., Gray, W. R., Hamer, D. H. Yeast metallothionein. Sequence and metal-binding properties. Journal of Biological Chemistry. 260 (27), 14464-14470 (1985).
- Burgess, S. M., Guthrie, C. A mechanism to enhance mRNA splicing fidelity: The RNA-dependent ATPase Prp16 governs usage of a discard pathway for aberrant lariat intermediates. Cell. 73 (7), 1377-1391 (1993).
- Collins, C. A., Guthrie, C. Allele-specific genetic interactions between Prp8 and RNA active site residues suggest a function for Prp8 at the catalytic core of the spliceosome. Genes & Development. 13 (15), 1970-1982 (1999).
- Siatecka, M., Reyes, J. L., Konarska, M. M. Functional interactions of Prp8 with both splice sites at the spliceosomal catalytic center. Genes & Development. 13 (15), 1983-1993 (1999).
- Umen, J. G., Guthrie, C. Mutagenesis of the yeast gene PRP8 reveals domains governing the specificity and fidelity of 3' splice site selection. Genetics. 143 (2), 723-739 (1996).
- Grainger, R. J., Beggs, J. D. Prp8 protein: At the heart of the spliceosome. RNA. 11 (5), 533-557 (2005).
- Query, C. C., Konarska, M. M. Suppression of multiple substrate mutations by spliceosomal prp8 alleles suggests functional correlations with ribosomal ambiguity mutants. Molecular Cell. 14 (3), 343-354 (2004).
- Konarska, M. M., Vilardell, J., Query, C. C. Repositioning of the reaction intermediate within the catalytic center of the spliceosome. Molecular Cell. 21 (4), 543-553 (2006).
- Liu, L., Query, C. C., Konarska, M. M. Opposing classes of prp8 alleles modulate the transition between the catalytic steps of pre-mRNA splicing. Nature Structural and Molecular Biology. 14 (6), 519-526 (2007).
- MacRae, A. J., et al. Prp8 positioning of U5 snRNA is linked to 5' splice site recognition. RNA. 24 (6), 769-777 (2018).
- Query, C. C., Konarska, M. M. CEF1/CDC5 alleles modulate transitions between catalytic conformations of the spliceosome. RNA. 18 (5), 1001-1013 (2012).
- Tang, Q., et al. SF3B1/Hsh155 HEAT motif mutations affect interaction with the spliceosomal ATPase Prp5, resulting in altered branch site selectivity in pre-mRNA splicing. Genes & Development. 30 (24), 2710-2723 (2016).
- Carrocci, T. J., Zoerner, D. M., Paulson, J. C., Hoskins, A. A. SF3b1 mutations associated with myelodysplastic syndromes alter the fidelity of branchsite selection in yeast. Nucleic Acids Research. 45 (8), 4837-4852 (2017).
- Kaur, H., Groubert, B., Paulson, J. C., McMillan, S., Hoskins, A. A. Impact of cancer-associated mutations in Hsh155/SF3b1 HEAT repeats 9-12 on pre-mRNA splicing in Saccharomyces cerevisiae. PLoS One. 15 (4), 0229315(2020).
- vander Feltz, C., et al. Saccharomyces cerevisiae Ecm2 modulates the catalytic steps of pre-mRNA splicing. RNA. 27 (5), 591-603 (2021).
- Carrocci, T. J., Paulson, J. C., Hoskins, A. A. Functional analysis of Hsh155/SF3b1 interactions with the U2 snRNA/branch site duplex. RNA. 24 (8), 1028-1040 (2018).
- Hogg, R., de Almeida, R. A., Ruckshanthi, J. P., O'Keefe, R. T. Remodeling of U2-U6 snRNA helix I during pre-mRNA splicing by Prp16 and the NineTeen Complex protein Cwc2. Nucleic Acids Research. 42 (12), 8008-8023 (2014).
- Hansen, S. R., Nikolai, B. J., Spreacker, P. J., Carrocci, T. J., Hoskins, A. A. Chemical inhibition of pre-mRNA splicing in living Saccharomyces cerevisiae. Cell Chemical Biology. 26 (3), 443-448 (2019).
- Xu, Y. Z., Query, C. C. Competition between the ATPase Prp5 and branch region-U2 snRNA pairing modulates the fidelity of spliceosome assembly. Molecular Cell. 28 (5), 838-849 (2007).
- Staley, J. P., Guthrie, C. An RNA switch at the 5' splice site requires ATP and the DEAD box protein Prp28p. Molecular Cell. 3 (1), 55-64 (1999).
- Bousquet-Antonelli, C., Presutti, C., Tollervey, D. Identification of a regulated pathway for nuclear pre-mRNA turnover. Cell. 102 (6), 765-775 (2000).
- Villa, T., Guthrie, C. The Isy1p component of the NineTeen complex interacts with the ATPase Prp16p to regulate the fidelity of pre-mRNA splicing. Genes & Development. 19 (16), 1894-1904 (2005).
- Mayas, R. M., Maita, H., Staley, J. P. Exon ligation is proofread by the DExD/H-box ATPase Prp22p. Nature Structure and Molecular Biology. 13 (6), 482-490 (2006).
- Lesser, C. F., Guthrie, C. Mutations in U6 snRNA that alter splice site specificity: Implications for the active site. Science. 262 (5142), 1982-1988 (1993).
- McPheeters, D. S. Interactions of the yeast U6 RNA with the pre-mRNA branch site. RNA. 2 (11), 1110-1123 (1996).
- Perriman, R. J., Ares, M. Rearrangement of competing U2 RNA helices within the spliceosome promotes multiple steps in splicing. Genes & Development. 21 (7), 811-820 (2007).
- Mefford, M. A., Staley, J. P. Evidence that U2/U6 helix I promotes both catalytic steps of pre-mRNA splicing and rearranges in between these steps. RNA. 15 (7), 1386-1397 (2009).
- Hilliker, A. K., Mefford, M. A., Staley, J. P. U2 toggles iteratively between the stem IIa and stem IIc conformations to promote pre-mRNA splicing. Genes & Development. 21 (7), 821-834 (2007).
- Wu, G., et al. Pseudouridines in U2 snRNA stimulate the ATPase activity of Prp5 during spliceosome assembly. EMBO Journal. 35 (6), 654-667 (2016).
- Crotti, L. B., Bacikova, D., Horowitz, D. S. The Prp18 protein stabilizes the interaction of both exons with the U5 snRNA during the second step of pre-mRNA splicing. Genes & Development. 21 (10), 1204-1216 (2007).
- Fogel, S., Welch, J. W. Tandem gene amplification mediates copper resistance in yeast. Proceedings of the National Academy of Sciences of the United States of America. 79 (17), 5342-5346 (1982).
- Gardner, J. M., Jaspersen, S. L. Manipulating the yeast genome: Deletion, mutation, and tagging by PCR. Methods Molecular Biology. 1205, 45-78 (2014).
- JoVE. Yeast Transformation and Cloning. In Biology I: yeast, Drosophila and C. Elegant. JoVE Science Education Database. , Cambridge, MA. (2021).
- Gietz, R. D., Woods, R. A. Yeast transformation by the LiAc/SS Carrier DNA/PEG method. Methods Molecular Biology. 313, 107-120 (2006).
- Gietz, R. D., Woods, R. A. Genetic transformation of yeast. Biotechniques. 30 (4), 816(2001).
- Mayerle, M., et al. Structural toggle in the RNaseH domain of Prp8 helps balance splicing fidelity and catalytic efficiency. Proceedings of the National Academy of Sciences of the United States of America. 114 (18), 4739-4744 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Beier, D. H., et al. Dynamics of the DEAD-box ATPase Prp5 RecA-like domains provide a conformational switch during spliceosome assembly. Nucleic Acids Research. 47 (20), 10842-10851 (2019).
- vander Feltz, C., DeHaven, A. C., Hoskins, A. A. Stress-induced pseudouridylation alters the structural equilibrium of yeast U2 snRNA Stem II. Journal of Molecular Biology. 430 (4), 524-536 (2018).
- Rodgers, M. L., Didychuk, A. L., Butcher, S. E., Brow, D. A., Hoskins, A. A. A multi-step model for facilitated unwinding of the yeast U4/U6 RNA duplex. Nucleic Acids Research. 44 (22), 10912-10928 (2016).
- Stutz, F., Rosbash, M. A functional interaction between Rev and yeast pre-mRNA is related to splicing complex formation. EMBO Journal. 13 (17), 4096-4104 (1994).
- Libri, D., Lescure, A., Rosbash, M. Splicing enhancement in the yeast rp51b intron. RNA. 6 (3), 352-368 (2000).
- Libri, D., Stutz, F., McCarthy, T., Rosbash, M. RNA structural patterns and splicing: Molecular basis for an RNA-based enhancer. RNA. 1 (4), 425-436 (1995).
- Howe, K. J., Kane, C. M., Ares, M. Perturbation of transcription elongation influences the fidelity of internal exon inclusion in Saccharomyces cerevisiae. RNA. 9 (8), 993-1006 (2003).
- Cuenca-Bono, B., et al. SUS1 introns are required for efficient mRNA nuclear export in yeast. Nucleic Acids Research. 39 (19), 8599-8611 (2011).
- Scherrer, F. W., Spingola, M. A subset of Mer1p-dependent introns requires Bud13p for splicing activation and nuclear retention. RNA. 12 (7), 1361-1372 (2006).
- Hálová, M., et al. Nineteen complex-related factor Prp45 is required for the early stages of cotranscriptional spliceosome assembly. RNA. 23 (10), 1512-1524 (2017).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Crotti, L. B., Horowitz, D. S. Exon sequences at the splice junctions affect splicing fidelity and alternative splicing. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 18954-18959 (2009).
- Perriman, R., Ares, M. Invariant U2 snRNA nucleotides form a stem loop to recognize the intron early in splicing. Molecular Cell. 38 (3), 416-427 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved