Method Article
サイトカイン分化型ヒト初代T細胞におけるミトコンドリア呼吸のリアルタイムモニタリング
* これらの著者は同等に貢献しました
要約
代謝適応は、分化、持続性、および細胞毒性を決定するため、T細胞にとって基本的である。ここでは、サイトカイン分化型ヒト初代T細胞の エクスビボ でミトコンドリア呼吸をモニタリングするための最適化されたプロトコールが提示される。
要約
活性化の間、T細胞の代謝は、その運命に影響を与える変化に適応する。ミトコンドリア酸化的リン酸化の増加はT細胞活性化に不可欠であり、メモリーT細胞の生存はミトコンドリアのリモデリングに依存している。その結果、これは癌免疫療法の長期的な臨床転帰に影響を及ぼす。T細胞品質の変化は、多くの場合、よく知られている表面マーカーを用いたフローサイトメトリーによって研究され、代謝状態によって直接研究されるわけではない。これは、細胞外フラックスアナライザーと、T細胞代謝に異なる影響を与えるサイトカインIL-2およびIL-15を使用して、初代ヒトT細胞のリアルタイムミトコンドリア呼吸を測定するための最適化されたプロトコルです。T細胞の代謝状態は、代謝経路における重要な複合体を阻害する際の酸素消費量を測定することによって明確に区別することができ、これらの測定の精度は最適な阻害剤濃度および阻害剤注入戦略に大きく依存することが示されている。この標準化されたプロトコルは、がん免疫療法のモニタリングおよび研究におけるT細胞適合性の標準としてミトコンドリア呼吸を実装するのに役立ちます。
概要
正しいT細胞の発生と機能は、免疫系が抗原を認識して応答する能力に不可欠です。ミトコンドリア酸化リン酸化(OxPhos)は、T細胞の状態に応じて変化する。ナイーブT細胞は主にATPを生成するためにOxPhosを使用しますが、活性化T細胞は解糖系が優勢になる代謝遷移を経験します1。エフェクター期の後、メモリーT細胞のわずかに残ったサブセットは、OxPhos2,3によって支配される代謝状態に戻る。OxPhosの変化は、T細胞のサブセットでさえも、それらの特異的なOxPhos特性によって分化することができる程度までT細胞の分化に続く1。逆に、OxPhosはT細胞の機能にとって重要であり、OxPhosの阻害はT細胞の増殖およびサイトカイン産生をブロックすることが実証されている4。したがって、T細胞OxPhosの特性を正確かつ再現性のある方法で定量化する能力は、T細胞を扱う人にとって強力なツールです。
このプロトコールでは、T細胞OxPhosの特性は、細胞外フラックス分析装置を用いて測定される。この分析装置のコア機能は、分析対象の細胞の増殖培地中の酸素含有量を連続的に測定することである。増殖培地から除去された酸素は、細胞によって取り込まれると仮定される。細胞を様々なOxPhos阻害剤または修飾剤で処理することによって、酸素取り込みの低下が阻害または調節された機能に関連する。例えば、ATP合成酵素の阻害は、酸化的リン酸化によってATPを生成するために使用されるであろう酸素の細胞取り込みの減少をもたらすであろう。クラーク電極やオロボロス装置を含む他の装置は、同様の機能を提供し、各装置には異なる長所と短所があります。これらの装置では、幅広い細胞型を研究に使用できますが、特に困難な細胞型の1つはヒト初代Tリンパ球5です。その小さなサイズ、 生体外での生存率の悪さ、および非接着特性のために、ヒト初代T細胞は研究が困難な場合があります。
これは、細胞外分析装置によるヒト初代T細胞のミトコンドリア呼吸を研究するためのプロトコールである。プロトコルは最適化ランに分割され、ウェルあたりの細胞数の最適濃度、ならびにオリゴマイシンおよびFCCPの最適濃度が決定される。さらに、最適化された条件が使用されるアッセイラン。
血液由来のヒトPBMCおよび エキソビボ 初代T細胞培養物を用いて、このプロトコールは、最適な阻害剤濃度の重要性と、感受性細胞型を扱う際にミトコンドリア阻害剤の逐次注射の代わりに別個を使用することの関連性を実証する。最後に、このアッセイがサイトカインIL-2およびIL-15による分極時のミトコンドリア呼吸の微妙な違いを堅牢に検出できることが実証された。
プロトコル
実験は、ヘルレフ病院とデンマークの首都圏のガイドラインの下で実施されました。
メモ: このプロトコルには、最適化実行とアッセイ実行の両方の手順が含まれています。これは、命令が最適化実行またはアッセイ実行の場合、テキストに明確に書かれています。アッセイの実行を続行する前に最適化の実行を実行します。
1. バフィーコートからのヒト末梢血単核球(PBMC)単離
- PBMC の分離
- 適切な施設からバフィーコートを収集します(採血バッグに集めます)。バフィーコートは健康なドナーに由来します。最近鎮痛剤を使用したドナーを除外する。
- バフィーコートの入った採血管に70%エタノールをスプレーしてから、層流キャビネットに移します。すべてのステップで常に滅菌技術と滅菌ハードウェアを使用してください
注: ヒト血液サンプルの取り扱いに関する正しい許可が取得されていることを確認してください。 - 血液を滅菌50mL遠沈管に移す。
- 血液を非添加RPMI 1640で少なくとも10%希釈する。
- 20 mL の好ましい密度勾配培地を 50 mL 遠沈管に注ぎます。
- 希釈した血液25mLを血清学的ピペットに吸引する。電動ピペットコントローラを最低速度に設定します。
- 密度勾配培地を含むチューブを45°の角度で保持し、血清学的ピペットチップを50mL遠心チューブの内側に置きます。血清学的ピペットから希釈血液25mLをゆっくりと放出する。
- 希釈した血液と密度勾配培地が混ざっていないことを確認してください。希釈した血液が密度勾配培地の上に載っていることを確認してください。
- すべての希釈血液が処理されるまで、後続の密度勾配培地チューブでこれを繰り返す。
- チューブを遠心分離機に慎重に移動し、室温(RT)のスイングアウトローターで1000 x g で30分間遠心分離機を使用します。加速度とブレークが最小限であることを確認します。
注:遠心分離後、さまざまな層が見えるはずです。上部の透明なピンクからオレンジ色の層は、血漿および血小板からなる。中央の白色層はPBMCsからなり、続いて密度勾配培地からなる透明な層、最後に赤色血球を有する下部の濃い赤色層からなる。 - 滅菌パスツールピペットを使用して、PBMC含有白色層を50mL遠沈管に注意深く吸引する。
注:密度勾配媒体は下流の精製に影響するため、転送しないでください。過剰な血漿は結果に影響を与えません。 - 回収したすべてのPBMCを同じ50 mL遠沈管にプールし、RPMI 1640で50 mLまで補充します。
- RT で 5 分間、細胞を 500 x g で遠心分離します (特に指定のない限り、残りの遠心分離手順はこの設定で行います)。
- 上清を吸引し、細胞を30mLのRPMI 1640に再懸濁する。血球計数器または自動細胞カウンターを使用して細胞を計数する。
- 凍結保存のために、凍結培地1mLあたり最大3,000万個の細胞を再懸濁する。
- 細胞を凍結チューブに移し、速度制御された凍結容器(毎分−1°C)を用いて−80°Cまで凍結する。長期保存の場合は、PBMC を -140 °C に移動します。
メモ: RTでセルが凍結培地に入っている時間を制限してください。RTでは、DMSOは細胞に対して非常に有毒です。
2. 活性化ヒト初代Tリンパ球の培養
- 細胞の融解(1日目)
- 1サンプルあたり10mLのRPMI 1640を約37°Cまで予め加温する。
- 希望数の細胞アンプルを取り、ドライアイスに一時的に保管します。
- 凍結細胞を10mLの予め加温したRPMI 1640に再懸濁する。
- RTで500 x g で細胞を5分間遠心分離します。
- 上清を捨て、2.1.4に記載されるように10mLのRPMI 1640および遠心分離機に再懸濁することによって細胞を再び洗浄する。
- 上清を捨て、X-VIVO 15培地+5%ヒト血清(以下、T細胞培地)の1mLあたり2 x 106 細胞で細胞を再懸濁する。
- プレート1ウェルあたり2 mLの細胞を24ウェル細胞培養プレートに、37°Cおよび5%CO2で一晩インキュベートした。
- 細胞の活性化(0日目)
- 100万細胞あたり12.5 μLのビーズを微量遠心管に移して、CD3/CD28ビーズを洗浄します。ビーズ12.5 μLあたり12.5 μLのPBSを加える。
注:使用前にビーズのバイアルを渦巻くことが重要です。 - 微量遠心チューブを適切な磁石の上に1分間置きます。
- バッファーを破棄し、ビーズを元の容量の T 細胞培地 (元の容量のビーズの 12.5 μL あたり 12.5 μL の T 細胞培地) に再懸濁します。
- 1:2の比率に対応する100万個の細胞あたり12.5μLのビーズを加える(ビーズ:細胞)。
- 細胞を2つの条件に分割し、それぞれに約500万個の細胞を入れます。
- 正しい量のサイトカインを 表1に記載した条件に加える。
- 細胞を37°Cおよび5%CO2で3日間インキュベートする。
- 100万細胞あたり12.5 μLのビーズを微量遠心管に移して、CD3/CD28ビーズを洗浄します。ビーズ12.5 μLあたり12.5 μLのPBSを加える。
- 細胞の培養(3日目と5日目)
- 細胞を再懸濁し、各ウェルから新しいウェルに体積の半分を移すことによって細胞を分割する。同じ量の新鮮なT細胞培地を各ウェルに加える。
- 表1に記載されているように、各条件に新しいサイトカインを追加します。
3. 細胞外フラックスアッセイ
- センサーカートリッジの水分補給(0日目)
- センサーカートリッジを開梱し、ユーティリティプレートからセンサーカートリッジを慎重に取り外します。
- センサーカートリッジを逆さまに置き、センサープローブに触れないように注意してください。
- ユーティリティプレートに200 μLのキャリバータント(詳細については 材料表 を参照)を入れ、センサーカートリッジをユーティリティプレートに慎重に交換します。
- あるいは、気泡形成を排除するために、センサーカートリッジを滅菌超純水中で一晩インキュベートし、アッセイの朝に予め温めたキャリブラントと交換する。
- センサーカートリッジプレートを非CO2調整加熱キャビネットで37°Cで一晩インキュベートします。
メモ:過剰なCO2はセンサーカートリッジに影響を与えるため、CO2規制されていないキャビネットを使用することは非常に重要です。フラックス分析装置(詳細は材料表を参照)が使用の少なくとも1日前にオンになっていることを確認し、37°Cまで温めてください。
- 細胞コーティングとミトコンドリア阻害剤の調製(1日目)
- NaHCO3(pH 8.3, 0.1 M, 1128 μL)、Cell-Tak(1 mg/mL, 48 μL)、NaOH(1.0 M, 24 μL)を含むコーティング溶液(材料表参照)を調製する。
注:コーティング溶液は、常に新鮮に作られ、使用する必要があります。 - 新鮮なXF細胞培養プレートを開き、新たに調製したコーティング溶液12 μLを各ウェルに加える。すべてのウェルの底にコーティング溶液が均一に分布することを確認します。
- 蓋をした状態でプレートをRTで30分間インキュベートし、残りの液体溶液をすべてのウェルから廃棄します。
- プレートを200 μLの滅菌水で洗浄し、液体を捨てる。
- プレートを200 μLの細胞培養グレードの滅菌PBSで洗浄し、液体を捨てる。
- プレートをRTのままにし、少なくとも30分間乾燥させます。
- NaHCO3(pH 8.3, 0.1 M, 1128 μL)、Cell-Tak(1 mg/mL, 48 μL)、NaOH(1.0 M, 24 μL)を含むコーティング溶液(材料表参照)を調製する。
- XF細胞培養プレート中のプレートT細胞(1日目)
- 実験セットアップに従って、適切なXF RPMI培地をグルコース、ピルビン酸、およびグルタミンと混合することによって、50mLのアッセイ培地を調製する(推奨レベル:4mMグルコース、1mMピルビン酸および3mMグルタミン)。
- 非CO2 規制インキュベーターで37°Cに加熱し、pHを7.4に設定します。細胞をメッキし、オリゴマイシンおよびFCCP溶液を調製するための十分な培地があることを確認してください(セクション3.4)。
- 最適化ランまたはアッセイランのために、ウェルあたりの細胞数を増やしてプレートレイアウトを設計します。バックグラウンド測定には、培地で満たされ、培地を注入した4つの4ウェルを使用します。
- セクション2.3で調製したT細胞をカウントし(好ましい方法による)、コーティング溶液でコーティングしたXF細胞培養プレートの各ウェルに正しい細胞数をピペットし、プレートレイアウトに従った。
注:各井戸の最終体積は異なる場合がありますが、井戸の底を覆うのに十分でなければなりません。 - XF細胞培養プレートをRTで1000 x g で10分間遠心分離し、コーティング面にT細胞を接着させた。
- 200 μL のアッセイ培地で細胞を洗浄し、培地を捨てて 180 μL のアッセイ培地を加えます。
メモ: 倒立光学顕微鏡を使用してウェルを目視で検査し、細胞がウェル表面に取り付けられ、均等に分布していることを確認します。 - XF細胞培養プレートを非CO2 調整加熱キャビネットに30分間インキュベートして、プレートの温度が37°Cであることを確認します。
- 最適化実行のためのオリゴマイシンとFCCPを含むセンサーカートリッジの装填(1日目)
注:オリゴマイシンおよびFCCP濃度がすでに最適化されている場合は、セクション3.5に進みます。- オリゴマイシンおよびFCCPの作業溶液を、ステップ3.4.2および3.4.3に記載されているようにアッセイ培地(ステップ3.3.1で調製)中に調製する。
- オリゴマイシン作動溶液:5 μM溶液(アッセイ培地2 mL + 1 mMオリゴマイシンストック10 μL)および3 μM溶液(アッセイ培地8 mL + 1 mMオリゴマイシンストック24 μL)を調製する。
- FCCP 作業溶液: 2 μM 溶液 (アッセイ培地 2 mL + 300 μM FCCP ストック 13.2 μL) と 1.3 μM 溶液 (アッセイ培地 8 ml + 300 μM FCCP ストック 34.6 μL) を調製します。
- オリゴマイシンまたはFCCPのいずれかの作動溶液をセンサーカートリッジの注入口にロードします(表2)。
手記。噴射口に空気のみが含まれないことが重要です。何らかの理由で、すべての注入ポートが使用されるわけではない場合、空のポートをアッセイ媒体で満たす必要があります。 - テーブル上のプレートの端を軽くノックして、噴射ポート内の潜在的な気泡を除去します。
- アッセイ実行のためのオリゴマイシン、FCCP、およびアンチマイシンAを含むローディングセンサーカートリッジ(1日目)
- オリゴマイシンの溶液を調製し、アッセイ培地中のFCCPを、以前の最適化実行で同定された最適濃度に従って調製する(ステップ3.3.1で調製)。また、20μMアンチマイシンA液を調製する。
- オリゴマイシンまたはFCCPのいずれか20μLをプレートレイアウトに従ってセンサーカートリッジの注入口Aにロードする。22 μL の 20 μM アンチマイシン A をすべてのウェルの注入口 B に加えます。得られたアンチマイシンAの濃度は、ウェルに一度注入されると2μMとなる。
- フラックス分析ソフトウェアで実験プロトコルを設定する。
- プレートレイアウトごとに各条件のグループとプレートマップを割り当てます。
- 注入戦略に従ってプロトコルを設計します (表 3 および 図 1)。
注: アッセイの実行時、注射 C および D は省略できます。 - アッセイのセットアップを保存し、アッセイに含める必要がある情報を入力して、 開始を押します。
- フラックス分析器は、セクション3.5で準備したセンサーカートリッジを要求します。蓋を取り外し、分析装置の指示に従ってセンサーカートリッジを挿入します。
注:アッセイは、チェックマークで示されたセンサーを較正およびチェックします。較正が成功すると、分析装置はセクション3.3で調製したXF細胞培養プレートを要求します。ユーティリティプレートを分析装置から吐出し、XF細胞培養プレートと交換してアッセイを開始する。
結果
OxPhosの特性を正しく決定することは、T細胞を研究する際に不可欠なツールです。しかしながら、アッセイ条件が最適化されていない場合、誤解を招くまたは誤った結果が生じる実質的なリスクがある。このプロトコルでは、使用するオリゴマイシンおよびFCCPのウェルおよび濃度当たりの細胞数の最適化に強い焦点がある。記載されたセットアップでは、オリゴマイシンおよびFCCPが同じウェルに漸進的に添加され、ミトコンドリアモジュレーターの濃度が増加する。オリゴマイシンおよびFCCPの最適濃度は、プラトーに達する濃度としてウェルの結果生じるOCR曲線から決定することができる。
代表的なランでは、オリゴマイシンが増大濃度で添加され、ATP合成酵素(電子輸送鎖の複合体V)を阻害し、ミトコンドリア呼吸の減少をもたらす。OCRのプラトーは、ウェルの累積濃度が1μMに達した後に達する。この濃度および増加濃度からOCRはさらに減少しなかった(図1A)。漸進的な濃度のアンカプラFCCPで処理したウェルについて、OCRレベルは、0.2μMのFCCPが添加された後プラトーに達するまで予想どおりに増加し、この濃度で完全なアンカップリングが得られたことを示している(図1B)。ウェルごとに播種された細胞の最適化は、正確で再現性のあるアッセイにとって重要です。使用される細胞数が低すぎる場合、細胞によってアッセイ培地から除去される酸素のレベルは、分析器によって正しく測定するには低すぎる。一方、ウェルあたりの細胞数が多すぎると、細胞の酸素消費量が非常に多くなり、各測定後にアッセイ培地の酸素レベルを補充できなくなり、ますます低酸素環境になり、誤ったOxPhos特性評価につながります。
代表的なランでは、細胞を1ウェルあたり200,000および400,000細胞の密度で播種した(図2A〜C)。200,000細胞のランの場合、最初のOCRは、ウェルあたり400,000セルのランの約半分です。FCCP治療の場合、最大OCRは61.6 pmol/分(200,000細胞)対190,4 pmol/分(400,000細胞)です。オリゴマイシン処理後、200,000個の細胞を含むラン中のOCRは、1桁のOCR(6.4pmol/分)に崩壊する。これは、ランのOCRよりも低く、オリゴマイシンで処理したウェルあたり400,000細胞(それぞれ25.8pmol/分)を有する。
したがって、最適化の実行から、1 μM オリゴマイシンと 0.2 μM FCCP を使用した将来のアッセイでは、ウェルあたり 400,000 個の細胞数が必要であることが明らかになりました。製造業者によって推奨される古典的なセットアップでは、オリゴマイシンおよびFCCPは、アンチマイシンAの最終添加と共に順次添加される。T細胞の場合、これはオリゴマイシン処理として最適なアプローチではなく、FCCP処理後の脱共役を制限することがわかる(図3A、B)。この提示された方法では、各条件を重複ウェルで実行し、一方のウェルをオリゴマイシンで、もう一方のウェルをFCCPで処理し、両方のウェルにアンチマイシンAを最終的に添加することが推奨される。このアプローチを使用することにより、オリゴマイシン治療はFCCP治療後のOCRに影響を及ぼさない。このアプローチにより、薬物が順番に添加される古典的なセットアップと同じミトコンドリア特性を決定することができます(図3C)
最後に、サイトカインIL-2およびIL-15の効果が、ex vivo培養ヒト初代T細胞の代謝に分化し得るかどうかを調べた。実際、IL-15培養細胞は、前に示したように、より高い最大呼吸数および予備呼吸能力を有していた1(図4A-E)。基礎呼吸およびATP産生は影響を受けなかった。まとめると、このデータは、エクスビボ培養ヒト初代T細胞のミトコンドリア呼吸を細胞外フラックス分析装置を用いて首尾よく分析できることを示している。

図1:エキソビボ培養ヒト初代T細胞におけるインヒビターオリゴマイシンおよびFCCPの滴定中に測定された酸素消費速度(OCR)。(b)OCRは、最終濃度0〜0.5 μMのFCCPの段階的滴定時。この図の拡大版を表示するには、ここをクリックしてください。

図2:ex vivo培養ヒト初代T細胞におけるOCR測定に対する細胞濃度の影響。(A)FCCPまたは(B)オリゴマイシンのいずれかの注射後のウェル当たり200,000または400,000細胞と共にエキソビボ培養ヒト初代T細胞のOCR測定。(c)1ウェル当たり200,000または400,000細胞を用いたヒト初代T細胞の基礎呼吸、最大呼吸、ATP産生、および予備呼吸能力。3つの独立した実験の代表。この図の拡大版を表示するには、ここをクリックしてください。
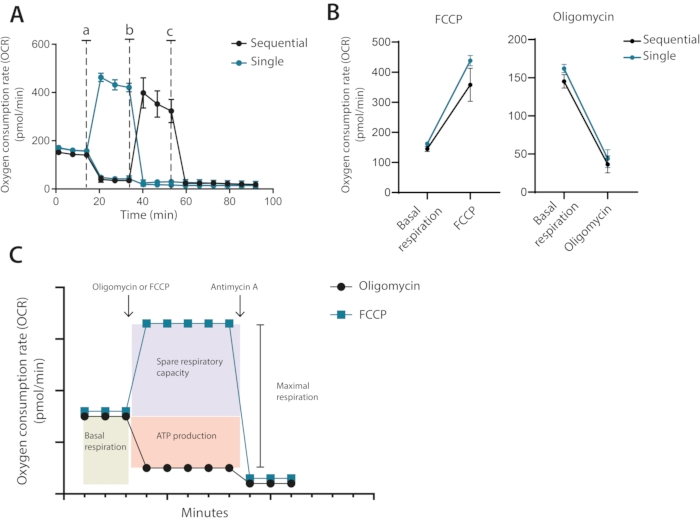
図3:ミトコンドリアモジュレーターの単回または逐次注射。 (A)オリゴマイシンおよびFCCP(a,b)、またはアンチマイシンA(c)のベースライン中および注射後の代表的なOCR測定を、単回個別注射として、または逐次注射として。(b)注射前(基礎呼吸)またはオリゴマイシンまたはFCCPを単回注射または逐次注射として注射した後のOCR値。(C)注入および測定戦略の概略図。1つの独立した実験の代表 この図の拡大版を見るにはここをクリックしてください。
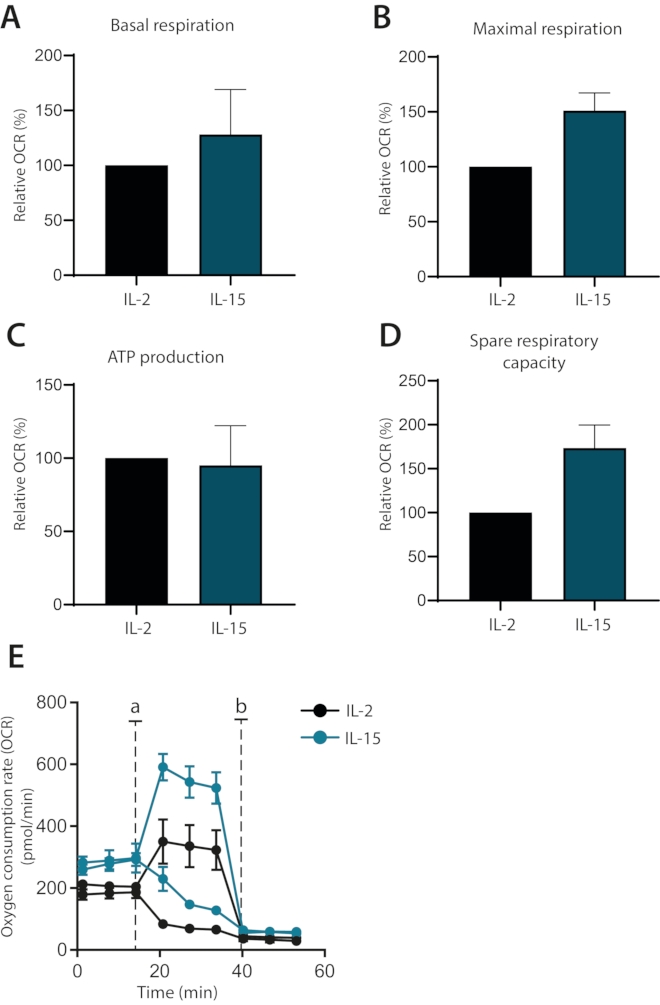
図4:サイトカイン分化型ヒト初代T細胞におけるミトコンドリア呼吸の違い。 (A-D)基礎呼吸、最大呼吸、ATP産生、およびIL−2またはIL−15と共に7日間培養したヒト初代T細胞の予備呼吸能力(n=3)。(e)(A−D)の代表的なプロットは、オリゴマイシンまたはFCCPの注射(a)またはアンチマイシンA(b)を用いた。この図の拡大版を表示するには、ここをクリックしてください。
| サイトカイン | [在庫] | 希釈係数 | [ファイナル] | |
| 条件1 | IL-2 | 3 x 106 U/mL | 30,000 | 100 U/mL |
| 条件2 | IL-15 | 2 x 105 U/mL | 2,000 | 100 U/mL |
表1:T細胞の代謝変化を導くために使用されるサイトカイン培養物の調製。
| オリゴマイシン | ティッカー | |||||
| 作業ソル。 | 最終的なコンク。 | 巻 | 作業ソル。 | 最終的なコンク。 | 巻 | |
| ポート A | 5.0 μM | 0.50 μM | 20 μL | 2.0 μM | 0.2 μM | 20 μL |
| ポート B | 3.0 μM | 0.75 μM | 22 μL | 1.30 μM | 0.3 μM | 22 μL |
| ポート C | 3.0 μM | 1.0 μM | 24 μL | 1.30 μM | 0.4 μM | 24 μL |
| ポート D | 3.0 μM | 1.25 μM | 27 μL | 1.30 μM | 0.5 μM | 27 μL |
表2:ミトコンドリア阻害剤およびモジュレーターの調製のための戦略。 最適化実行の準備濃度、作業濃度、および注入戦略。
| アクション | 細部 | 測定の詳細 |
| ベースライン | ベースライン測定 | 3回の測定 |
| 注射 | ポート A インジェクション | 3回の測定 |
| 注射 | ポート B インジェクション | 3回の測定 |
| 注射 | ポート C インジェクション | 3回の測定 |
| 注射 | ポート D インジェクション | 3回の測定 |
| 測る | 追加の測定 | 随意 |
表3:ミトコンドリア阻害剤およびモジュレーターを4回の注射でそれぞれ3回測定した滴定による最適化実行のプロトコル設計。
| ミトコンドリア酸化リン酸化の要素 | 説明 | ||
| 基礎呼吸 | 基礎呼吸は、ミトコンドリア阻害剤を添加する前に刺激されたT細胞によって消費される酸素の速度のベースライン尺度である。これは、ミトコンドリアプロトン漏れに起因する細胞ATP需要を満たすために使用される酸素消費量の尺度である。そのようにして、ATP合成およびプロトンリークを供給するために生成されるプロトン電流の概要を提供する。しかしながら、それはまた、成長培地中に存在する基質、アッセイ前の細胞の刺激および他の外因性因子に応じて変化させることができる尺度でもある。したがって、基礎呼吸は、細胞の細胞代謝状態に影響を与えると考えられる2つ以上の異なる細胞型および/または異なる治療を比較するために使用される尺度である。 基礎呼吸は、ミトコンドリアモジュレーター(オリゴマイシンまたはFCCP)を添加する前とアンチマイシンAを添加する後のOCRの差として計算されます。 | ||
| 最大呼吸数 | この測定値は、酸化的リン酸化のために消費され得る酸素の最大速度である。酸化的リン酸化によって消費される酸素の速度は、電子輸送鎖がミトコンドリア内膜を横切ってプロトンをポンプする能力と、プロトン勾配を使用してADPからATPをリン酸化するATP合成酵素の能力の両方によって決定される。ATP合成酵素の速度は、遊離ADP基質によって、そしてそれによって細胞の一般的なエネルギー状態によって制限される。ミトコンドリア結合解除剤FCCPで細胞を処理する場合、プロトンはミトコンドリア内膜を横切って自由に横断することができます。これは、細胞が飽和エネルギー需要を経験し、したがって最大呼吸が電子輸送連鎖によって消費され得る酸素の最大速度の尺度である状況を模倣する。 最大呼吸は、FCCPで処理した細胞とアンチマイシンAで処理した細胞のOCRの差として計算されます。 | ||
| ATP の売上高 | ATP結合呼吸は、オリゴマイシンを用いたATP合成酵素の阻害後のOCRの差として測定される。酸化的リン酸化によるADPのリン酸化のために消費されるはずの酸素は、このプロセスが停止されるので、もはや使用されなくなる。したがって、ATP結合呼吸は、酸化的リン酸化によって産生されるATPに対して相対的である。AT結合呼吸の変化は、細胞のATP要求の変化に対するミトコンドリアの応答である。 ATP結合呼吸は、ミトコンドリアモジュレーター(オリゴマイシンまたはFCCP)を添加する前とオリゴマイシンを添加した後のOCRの差として計算されます。 | ||
| 予備の呼吸能力 | 予備の呼吸能力は、増加したエネルギー需要への応答としてATPを生成するための理論的な追加容量の尺度である。これは、基礎呼吸と最大呼吸の違いとして定義されます。予備の呼吸能力の変化は、ミトコンドリアおよび細胞の適応度および柔軟性の指標となり得る。 | ||
表4:フラックス分析装置を用いて研究されるミトコンドリア呼吸の様々な成分の説明
ディスカッション
酸化的リン酸化の詳細な正確な定量化は、T細胞のエネルギー状態を記述する際に不可欠なツールである。ミトコンドリア適合度の状態は、T細胞の活性化能、生存率、分化に直接関係している可能性があります1,5。このプロトコールにより、酸化的リン酸化の様々な特性を決定することができる(詳細な説明については表4を参照されたい)。酸化的リン酸化のこれらの特性の正確な定量化は、T細胞のエネルギー状態に関する詳細な洞察を提供する。ただし、信頼性の高い結果を得るには、実験の設定に細心の注意を払わなければなりません。
このプロトコルでは、次の 3 つの最適化ステップが、まずセル番号の最適化をお勧めします。酸素濃度を正しく測定するフラックス分析装置の能力は、シグモイド曲線に従います。酸素の変化が小さすぎたり大きすぎたりすると、機械の動作間隔外になり、正しく測定されません。これには、実験全体を通して使用する細胞数の最適化が必要です。アッセイされる細胞が少なすぎると、酸素消費量の変化が小さすぎて正しく測定できません。細胞が多すぎると、アッセイ培地中の酸素枯渇の危険性がある。したがって、ウェルあたり100,000〜400,000細胞の範囲の細胞数で、最初の実行が推奨されます。細胞数と基礎呼吸をプロットする場合、最適な細胞数は曲線の線形範囲になります。セットアップを最適化するときは、休止細胞と活性化細胞の間にミトコンドリア活性に指数関数的な違いがある可能性があるため、それに応じて最適化する必要があることに注意してください。
第二に、阻害剤濃度の滴定。細胞をオリゴマイシンおよびFCCPで処理する場合、使用する阻害剤の最適濃度を特定することが重要である。濃度が低すぎると、最適でない阻害とミトコンドリア呼吸の誤った測定が発生します。人々が完全な阻害が得られることを保証するために、阻害剤の最高推奨濃度を使用することは一般的である。これは、阻害剤の濃度が高すぎると多面的効果を有する可能性があるため、これも問題である。FCCPのようなアンカプラーは、ミトコンドリア以外の膜にもその効果を発揮し、原形質膜脱分極、ミトコンドリア阻害、および細胞毒性を含む様々な望ましくない効果をもたらす。このプロトコルでは、オリゴマイシンおよびFCCPの滴定は、細胞数の最適化と同時に行われる。最適化の実行中に、オリゴマイシンまたはFCCPの濃度の増加が、4つの利用可能な基質ポートを使用して追加される。得られたOCR図において、最適濃度は、OCRが定常プラトーに達する濃度として視覚的に決定することができる。オリゴマイシンおよびFCCPの濃度が滴定されると、これらの濃度は実験全体を通して使用される。
第3に、インヒビターの逐次対単一個体添加。古典的なタツノオトシゴアッセイは、典型的には、最初のオリゴマイシンの逐次添加に続いてFCCPを添加することによって実施される。T細胞および他の感受性細胞において、このような逐次的付加は、最大呼吸の誤った定量をもたらし得る。次に、測定された予備呼吸能力のレベルは、それらよりも低いと報告されます。これの重大な例には、負の予備呼吸能力の値が含まれます。これは、もちろん、生物学的に不可能であり、オリゴマイシン治療によるミトコンドリアの事前感作によって引き起こされる。このプロトコールでは、代わりに、細胞をオリゴマイシンまたはFCCPのいずれかでのみ処理することが推奨されます(例示的な比較については 図3C を参照)。
最後に、この最適化されたプロトコルは、IL-15補充ヒト初代T細胞培養物が、ミトコンドリア呼吸に基づいてIL-2補充細胞とどのように明確に区別され得るかを示すために使用される。IL-15培養細胞は、より高い最大呼吸数と予備呼吸能力を有し、記憶T細胞と結びついた代謝状態である1,6。これらの観察結果は、IL-15をメモリーT細胞サブセットに結びつける以前の研究と一致しています8。また、IL-2培養細胞と比較するとATP産生にはないが基礎呼吸に差は認められなかった。これは、これらの細胞が、より分化した細胞に関連する経路である基礎代謝要求を遵守するために解糖系能力を使用することを示している。 まとめると、IL−15補充を使用することによってヒトメモリーT細胞モデルをインビトロで確立できることが示される。IL-15に富む環境を使用して記憶細胞の発達を促進することは以前に実証されており、この知見をさらに裏付けています8。
この方法では、オリゴマイシン、FCCP、およびアンチマイシンAがOxPhosの特性を定量するために使用されてきた。同様の効果を有する他の化合物が存在し、これは潜在的にT細胞により適しているであろう。一例は、FCCPの代わりにアンカプラBAM15を使用して、ミトコンドリア膜の脱分極を減少させ、細胞毒性を回避することです9。この方法では、オリゴマイシン、FCCP、およびアンチマイシンAが過去10年間、タツノオトシゴ実験に推奨されるミトコンドリアモジュレーターであったため、これらの化合物は考慮されていません。したがって、これらの化合物の使用は、OxPhosと協力している査読者や他の研究者によって認識されています。Seahorse flux analyzerのより経験豊富なユーザーは、これらの代替化合物を使用することをお勧めしますが、これらの使用はこの論文の範囲外です。
ミトコンドリアOxPhosのモニタリングは、T細胞機能を理解し、がん免疫療法を改善するために不可欠なツールです。前述のように、IL-15拡張細胞(分化性の低い記憶表現型を有する)は、疲労が少なく、抗腫瘍活性が増加したため、CAR T細胞療法に対する応答を改善することが示された10。この最適化されたプロトコルは、前臨床および臨床環境の両方でT細胞の品質を研究するための効果的なツールとなり得る。結論として、このプロトコルは、代謝アッセイにおける エキソビボ 培養ヒト初代T細胞の使用のための細胞数および阻害剤濃度を最適化するためのステップを実施する。
開示事項
著者らは利益相反がないと宣言しています。
謝辞
Kasper MølgaardとAnne Rahbechは、Tømmermester Jørgen Holm og Hustru Elisa f. Hansens Mindelegatから助成金を受けました。Kasper MølgaardもBørnecancerfondenから助成金を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
参考文献
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved