Method Article
实时监测细胞因子分化人原代T细胞中的线粒体呼吸
* 这些作者具有相同的贡献
摘要
代谢适应是 T 细胞的基础,因为它决定了分化、持久性和细胞毒性。本文介绍了一种用于监测 离体 细胞因子分化的人原代T细胞中线粒体呼吸的优化方案。
摘要
在激活过程中,T细胞的新陈代谢适应影响其命运的变化。线粒体氧化磷酸化的增加对于T细胞活化是必不可少的,而记忆T细胞的存活取决于线粒体重塑。因此,这会影响癌症免疫疗法的长期临床结果。T细胞质量的变化通常通过使用众所周知的表面标志物的流式细胞术进行研究,而不是直接通过其代谢状态进行研究。这是一种优化的方案,用于使用细胞外通量分析仪和细胞因子IL-2和IL-15测量原代人T细胞的实时线粒体呼吸,它们对T细胞代谢的影响不同。结果表明,通过测量抑制代谢途径中关键复合物时的耗氧量可以清楚地区分T细胞的代谢状态,并且这些测量的准确性高度依赖于最佳抑制剂浓度和抑制剂注射策略。这种标准化方案将有助于实施线粒体呼吸作为监测和研究癌症免疫疗法中T细胞适应性的标准。
引言
正确的T细胞发育和功能对于免疫系统识别和响应抗原的能力至关重要。线粒体氧化磷酸化(OxPhos)根据T细胞的状态而变化。幼稚T细胞主要使用OxPhos产生ATP,而活化的T细胞经历代谢转变,其中糖酵解成为主导1。在效应阶段之后,记忆T细胞的一小部分剩余子集恢复到由OxPhos2,3主导的代谢状态。OxPhos的变化跟随T细胞的分化到这样的程度,甚至T细胞的亚群也可以通过其特异性OxPhos特性来分化1。相反,OxPhos对T细胞的功能很重要,并且已经证明对OxPhos的抑制可以阻断T细胞的增殖和细胞因子产生4。因此,以精确和可重复的方式量化T细胞OxPhos特性的能力对于任何使用T细胞的人来说都是一个强大的工具。
在该协议中,使用细胞外通量分析仪测量T细胞OxPhos的性质。该分析仪的核心功能是连续测量待分析细胞生长培养基的氧含量。从生长培养基中除去的氧气被细胞吸收。通过用各种OxPhos抑制剂或修饰剂处理细胞,摄氧量的下降与抑制或调节的功能有关。例如,抑制ATP合酶将导致细胞对氧气的摄取减少,否则这些摄取将用于通过氧化磷酸化产生ATP。其他设备,包括Clark电极和Oroboros仪器,提供类似的功能,每种仪器都有不同的优点和缺点。多种细胞类型可用于这些设备的研究,但一种特别具有挑战性的细胞类型是人类原发性T淋巴细胞5。由于它们的体积小, 离体存活率差,并且不粘附特性,人类原代T细胞的研究可能具有挑战性。
这是通过细胞外分析仪研究人类原代T细胞线粒体呼吸的方案。该协议分为优化运行,其中确定每孔细胞数的最佳浓度以及寡霉素和FCCP的最佳浓度。此外,使用优化条件的测定运行。
使用血源性人 PBMC 和 离体 原代 T 细胞培养物,该协议证明了最佳抑制剂浓度的重要性,以及在处理敏感细胞类型时使用单独而不是顺序注射线粒体抑制剂的相关性。最后,证明该测定可以稳健地检测细胞因子IL-2和IL-15极化时线粒体呼吸的细微差异。
研究方案
实验是在Herlev医院和丹麦首都地区的指导下进行的。
注意:此实验方案包含优化运行和检测运行的说明。当指令用于优化运行或检测运行时,它清楚地写在文本中。先运行优化运行,然后再继续检测运行
1. 人外周血单核(PBMC)从黄褐色皮毛中分离
- PBMC 隔离
- 从适当的机构收集buffy外套(收集在采血袋中)。巴菲外套来自健康的捐赠者。排除最近使用过止痛药的捐赠者。
- 在转移到层流柜之前,用70%乙醇喷洒含有黄褐色外套的血液收集袋。始终使用无菌技术和无菌硬件进行所有步骤
注意:确保获得处理人体血液样本的正确授权。 - 将血液转移到无菌的50 mL离心管中。
- 用未补充的RPMI 1640稀释血液至少10%。
- 将20mL优选的密度梯度培养基倒入50mL离心管中。
- 将25 mL稀释的血液吸入血清学移液管中。将电动移液器控制器设置为最低速度。
- 将密度梯度培养基的试管以45°角固定,并将血清学移液器吸头放在50 mL离心管的内侧。从血清学移液管中缓慢释放25mL稀释的血液。
- 确保稀释后的血液和密度梯度培养基不混合。确保稀释后的血液停留在密度梯度培养基的顶部。
- 用随后的密度梯度培养基管重复此操作,直到处理所有稀释的血液。
- 小心地将管移动到离心机中,并在室温(RT)下在外摆转转子中以1000× g 离心30分钟。确保加速度和断裂处于最低限度。
注意:离心后,各种层应可见。顶部,透明的粉红色至橙色层由血浆和血小板组成。中间的白色层由PBMC组成,然后是由密度梯度介质组成的透明层,最后是底部的暗红色层,带有红细胞。 - 使用无菌巴斯德移液器,小心地将含PBMC的白层吸入50 mL离心管中。
注意:确保不要转移密度梯度培养基,因为这会影响下游纯化。过量的血浆不会影响结果。 - 将所有收集的 PBMC 汇集在同一个 50 mL 离心管中,并使用 RPMI 1640 加注至 50 mL。
- 在室温下以500× g 离心细胞5分钟(除非另有说明,否则在此设置下执行剩余的离心步骤)。
- 吸出上清液并将细胞重悬于30 mL的RPMI 1640中。使用血细胞计数器或自动细胞计数器计数细胞。
- 对于冷冻保存,每1mL冷冻培养基最多重悬3000万个细胞。
- 将细胞转移到冷冻管中,并使用速率控制的冷冻容器(每分钟-1°C)冷冻至-80°C。对于长期储存,将PMC移至-140°C。
注意:限制细胞在室温下在冷冻培养基中的时间。在RT中,DMSO对细胞具有剧毒。
2. 活化人原代T淋巴细胞的培养
- 细胞解冻(第1天)
- 将每个样品 10 mL RPMI 1640 预热至约 37 °C。
- 取所需数量的细胞安瓿,并暂时储存在干冰上。
- 将冷冻细胞重悬于10 mL预热的RPMI 1640中。
- 在室温下以500× g 离心细胞5分钟。
- 弃去上清液,通过重悬于10mL的RPMI 1640并按照2.1.4中所述离心再次洗涤细胞。
- 弃去上清液,将细胞重悬在每mL X-VIVO 15培养基+ 5%人血清(以下简称:T细胞培养基)2×10 6 个细胞中。
- 在24孔细胞培养板中每孔将2mL细胞板加入2mL,并在37°C和5%CO 2下孵育过夜。
- 细胞活化(第0天)
- 通过将每100万个细胞中12.5μL微珠转移到微量离心管中来洗涤CD3 / CD28微珠。每12.5μL微珠加入12.5μLPBS。
注意:使用前涡旋珠瓶很重要。 - 将微量离心管放在合适的磁铁上1分钟。
- 弃去缓冲液并将磁珠重悬于原始体积的T细胞培养基中(每12.5μL原始体积的磁珠12.5μLT细胞培养基)。
- 每百万个细胞加入12.5μL微珠,比例为1:2(微球:细胞)。
- 将细胞分为两种情况,每种条件中约有500万个细胞。
- 将正确体积的细胞因子添加到 表1中提到的条件中。
- 将细胞在37°C和5%CO 2下孵育3天。
- 通过将每100万个细胞中12.5μL微珠转移到微量离心管中来洗涤CD3 / CD28微珠。每12.5μL微珠加入12.5μLPBS。
- 细胞培养(第3天和第5天)
- 重悬细胞,通过将每个孔的一半体积转移到新孔中来拆分它们。向每个孔中加入相同体积的新鲜T细胞培养基。
- 如 表1所述,向每种情况添加新的细胞因子。
3. 细胞外通量测定
- 传感器墨盒的水合作用(第 0 天)
- 打开传感器盒的包装,然后小心地从实用程序板上取下传感器盒。
- 将传感器盒倒置放置,注意不要接触传感器探头。
- 用200 μL校准剂填充实用程序板(有关详细信息,请参见 材料表 ),并小心地将传感器盒装回实用程序板中。
- 或者,为了消除任何气泡的形成,将传感器盒在无菌的超纯水中孵育过夜,并在测定的早晨用预热的校准剂代替。
- 将传感器盒板在37°C下在非CO2调节的加热柜中孵育过夜。
注意:使用非 CO2 调节机柜非常重要,因为过量的 CO2 会影响传感器滤芯。确保通量分析仪(详见 材料表 )在使用前至少一天打开,以使其升温至37°C。
- 细胞包衣和线粒体抑制剂的制备(第1天)
- 制备含有NaHCO3(pH 8.3,0.1 M,1128μL),Cell-Tak(1mg / mL,48μL)和NaOH(1.0 M,24μL)的包衣溶液(见材料表)。
注意:涂层溶液应始终新鲜制作和使用。 - 打开新鲜的XF细胞培养板,向每个孔中加入12μL新鲜制备的包衣溶液。确保涂层溶液均匀分布在所有孔的底部。
- 在室温下用盖子孵育板30分钟,然后从所有孔中丢弃剩余的液体溶液。
- 用200μL无菌水洗涤板并丢弃液体。
- 用200μL细胞培养级无菌PBS洗涤板并丢弃液体。
- 将盘子放在室温下,让它干燥至少30分钟。
- 制备含有NaHCO3(pH 8.3,0.1 M,1128μL),Cell-Tak(1mg / mL,48μL)和NaOH(1.0 M,24μL)的包衣溶液(见材料表)。
- XF细胞培养板中的板T细胞(第1天)
- 根据实验设置(推荐水平:4 mM葡萄糖,1mM丙酮酸盐和3mM谷氨酰胺)将合适的XF RPMI培养基与葡萄糖,丙酮酸和谷氨酰胺混合,制备50mL测定培养基。
- 在非CO2 调节的培养箱中加热至37°C,并将pH值设置为7.4。确保有足够的培养基用于接种细胞和制备寡霉素和FCCP溶液(第3.4节)。
- 设计一个板布局,每个孔的细胞数量不断增加,用于优化运行或分析运行。使用四个4孔,填充培养基并注入培养基,进行背景测量。
- 计数在2.3部分制备的T细胞(通过优选方法)并根据板布局将正确数量的细胞移液到涂覆溶液的XF细胞培养板的每个孔中。
注意:每口井的最终体积可能会有所不同,但必须足以覆盖井的底部。 - 将XF细胞培养板在室温下以1000× g 离心10分钟,以将T细胞粘附在涂层表面上。
- 用200μL测定培养基洗涤细胞,弃置培养基并加入180μL测定培养基。
注意:使用倒置光学显微镜目视检查孔,以确保细胞附着并均匀分布在孔表面。 - 将XF细胞培养板在非CO2 调节的加热柜中孵育30分钟,以确保板的温度为37°C。
- 装载含有寡霉素和FCCP的传感器盒以进行优化运行(第1天)
注意:如果寡霉素和FCCP浓度已经优化,请继续阅读第3.5节。- 如步骤3.4.2和3.4.3所述,在测定培养基(在步骤3.3.1中制备)中制备寡霉素和FCCP的工作溶液。
- 寡霉素工作溶液:制备5μM溶液(2mL测定培养基+ 10μL1mM寡霉素储备)和3μM溶液(8mL测定培养基+ 24μL1mM寡霉素储备液)。
- FCCP工作溶液:准备2μM溶液(2mL测定培养基+ 13.2μL300μMFCCP原液)和1.3μM溶液(8ml测定培养基+ 34.6μL300μMFCCP原液)
- 将寡霉素或FCCP的工作溶液加载到传感器墨盒的注射口中(表2)。
注意。重要的是,任何注射口都不能只包含空气。如果由于任何原因,未使用所有进样端口,则需要用测定培养基填充空端口。 - 轻轻敲击工作台上的板的边缘,以去除注射口中的潜在气泡。
- 装载含有寡霉素、FCCP 和抗霉素 A 的传感器墨盒以进行检测(第 1 天)
- 根据先前优化运行中确定的最佳浓度,在测定培养基(在步骤3.3.1中制备)中制备寡霉素,FCCP溶液。此外,制备20μM抗霉素A溶液。
- 根据板布局将20μL寡霉素或FCCP加载到传感器墨盒的注射口A中。向所有孔的注射口B中加入22μL的20μM抗霉素A。一旦注射到孔中,所得的抗霉素A的浓度将为2μM。
- 在通量分析仪软件中设置实验方案。
- 为每个板布局的每个条件分配组和板图。
- 根据注入策略设计方案(表3 和 图1)。
注意:运行检测运行时,可以省略进样C和D。 - 保存检测设置,填写检测所需的信息,然后按 开始。
- 通量分析仪将要求提供第3.5节中准备的传感器盒。取下盖子,然后按照分析仪的指示插入传感器盒。
注:该测定将校准和检查由复选标记指示的传感器。校准成功后,分析仪将要求提供第3.3节中制备的XF细胞培养板。从分析仪中弹出实用程序板,并用XF细胞培养板代替以开始测定。
结果
正确测定OxPhos特性是研究T细胞时不可或缺的工具。但是,如果检测条件尚未优化,则存在误导性或错误结果的很大风险。在该协议中,非常注重每孔细胞数的优化以及要使用的寡霉素和FCCP的浓度。在所述设置中,将寡霉素和FCCP增量添加到同一孔中,增加线粒体调节剂的浓度。寡霉素和FCCP的最佳浓度可以从得到的孔的OCR曲线中确定为达到平台的浓度。
在代表性运行中,寡霉素以增加的浓度加入并抑制ATP合酶(电子传递链的复合物V),导致线粒体呼吸减少。在孔的累积浓度达到1μM后,OCR达到平台。从该浓度和增加浓度中OCR没有进一步降低(图1A)。对于用增增浓度的不耦合剂FCCP处理的孔,OCR水平如预期增加,直到在加入0.2μMFCCP后达到平台,表明在此浓度下获得了完全解耦(图1B)。优化每孔接种的细胞对于正确且可重复的测定非常重要。如果使用的细胞数太低,则细胞从测定培养基中去除的氧气水平太低,无法由分析仪正确测量。另一方面,如果每孔的细胞数量过高,则细胞的耗氧量会变得如此之高,以至于系统在每次测量后都无法补充测定培养基的氧水平,从而导致越来越缺氧的环境和错误的OxPhos表征。
在代表性运行中,细胞以每孔200,000和400,000个细胞的密度接种(图2A-C)。对于包含 200,000 个细胞的运行,初始 OCR 大约是每孔 400,000 个细胞运行的一半。对于FCCP治疗,最大OCR为61.6 pmol/min(200,000个细胞)与190,4 pmol/min(400,000个细胞)。在寡霉素治疗后,200,000个细胞的OCR崩溃为个位数OCR(6.4 pmol / min)。这低于运行的OCR,每孔有400,000个细胞用寡霉素(分别为25.8 pmol / min)处理。
因此,从优化运行中可以清楚地看出,使用1μM寡霉素和0.2μM FCCP进行未来测定需要每孔400,000个细胞数。在制造商推荐的经典设置中,依次添加寡霉素和FCCP,最后加入抗霉素A。对于T细胞,这不是最佳方法,因为可以看到寡霉素治疗限制了FCCP治疗后的解偶联(图3A,B)。在所提出的方法中,建议在两个孔中运行每个条件,并用寡霉素处理一个孔,另一个用FCCP处理,最后为两个孔添加抗霉素A。通过使用这种方法,寡霉素治疗不会影响FCCP治疗后的OCR。这种方法允许确定与经典设置相同的线粒体特性,其中按顺序添加药物(图3C)
最后,研究了细胞因子IL-2和IL-15对离体培养的人原代T细胞代谢的影响是否可以分化。事实上,IL-15培养的细胞具有更高的最大呼吸和备用呼吸能力,如前所述1(图4A-E)。基础呼吸和ATP产生不受影响。综上所述,该数据表明,使用细胞外通量分析仪可以成功地分析离体培养的人原代T细胞的线粒体呼吸。

图1:在离体培养的人原代T细胞中抑制剂寡霉素和FCCP滴定期间测量的耗氧率(OCR)。(B) 在FCCP从0-0.5μM终浓度逐步滴定过程中的OCR。请点击此处查看此图的放大版本。

图2:细胞浓度对离体培养的人原代T细胞OCR测量的影响。在注射(A)FCCP或(B)寡霉素后,每孔培养有200,000或400,000个细胞的离体培养的人原代T细胞的OCR测量。(C)使用每孔200,000或400,000个细胞对人原代T细胞进行基础呼吸,最大呼吸,ATP产生和备用呼吸能力。代表三个独立实验。请点击此处查看此图的放大版本。
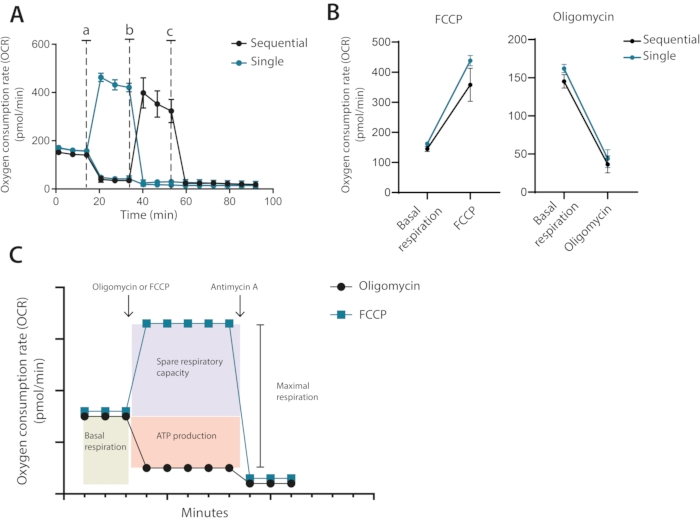
图3:单次或连续注射线粒体调节剂。 (A)在基线期间和注射寡霉素和FCCP(a,b)或抗霉素A(c)作为单次单次注射或顺序注射后的代表性OCR测量。(B)注射前(基础呼吸)或注射后寡霉素或FCCP作为单次注射或连续注射的OCR值。(C) 注入和测量策略的示意图。一个独立实验的代表 请点击此处查看此图的放大版本。
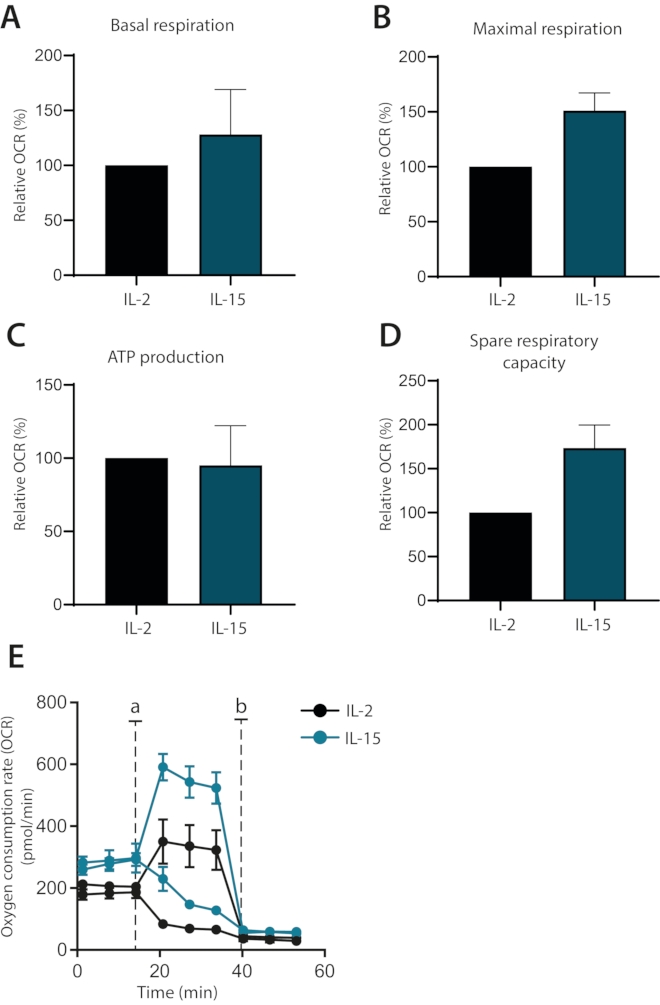
图4:细胞因子分化的人原代T细胞中线粒体呼吸的差异。 (A-D)用IL-2或IL-15培养7天(n = 3)的人原代T细胞的基础呼吸,最大呼吸,ATP产生和备用呼吸能力。(E)代表性的(A-D),注射寡霉素或FCCP(a)或抗霉素A(b)。请点击此处查看此图的放大版本。
| 细胞因子 | [库存] | 稀释因子 | [决赛] | |
| 条件 1 | 伊尔-2 | 3 x 106 U/mL | 30,000 | 100 微毫升 |
| 条件 2 | 伊尔-15 | 2 x 105 微毫升 | 2,000 | 100 微毫升 |
表1:用于指导T细胞代谢变化的细胞因子培养物的制备。
| 寡霉素 | 断续器 | |||||
| 工作溶胶 | 最后的结局。 | 卷。 | 工作溶胶 | 最后的结局。 | 卷。 | |
| 端口 A | 5.0 微米 | 0.50 微米 | 20 μL | 2.0 微米 | 0.2 微米 | 20 μL |
| 端口 B | 3.0 微米 | 0.75 微米 | 22 μL | 1.30 微米 | 0.3 微米 | 22 μL |
| 端口 C | 3.0 微米 | 1.0 微米 | 24 μL | 1.30 微米 | 0.4 微米 | 24 μL |
| 端口 D | 3.0 微米 | 1.25 微米 | 27 μL | 1.30 微米 | 0.5 微米 | 27 μL |
表2:线粒体抑制剂和调节剂的制备策略。 优化运行的制备浓度、工作浓度和注射策略。
| 行动 | 详 | 测量细节 |
| 基线 | 基线测量 | 3 次测量 |
| 注射 | 端口 A 注入 | 3 次测量 |
| 注射 | 端口 B 注入 | 3 次测量 |
| 注射 | 端口 C 注入 | 3 次测量 |
| 注射 | 端口 D 注入 | 3 次测量 |
| 量 | 其他测量 | 自选 |
表3:使用4次注射,每次注射3次测量,对线粒体抑制剂和调节剂进行滴定,进行优化运行的实验方案设计。
| 线粒体氧化磷酸化元素 | 解释 | ||
| 基础呼吸 | 基础呼吸是增加线粒体抑制剂之前受刺激的T细胞消耗氧气速率的基线测量。它是用于满足线粒体质子泄漏引起的细胞ATP需求的氧气消耗量的量度。因此,它概述了为提供ATP合成和质子泄漏而产生的质子电流。然而,它也是一种可以根据生长培养基中存在的底物,测定前细胞的刺激和其他外在因素而改变的措施。因此,基础呼吸是用于比较两种或更多种不同细胞类型和/或被认为影响细胞代谢状态的不同治疗方法的测量方法。 基础呼吸计算为添加任何线粒体调节剂(寡霉素或FCCP)之前和添加抗霉素A后OCR的差异 | ||
| 最大呼吸 | 该度量是氧化磷酸化可以消耗的最大氧气速率。氧化磷酸化消耗的氧气速率既取决于电子传递链将质子泵过线粒体内膜的能力,也取决于ATP合酶使用质子梯度从ADP磷酸化ATP的能力。ATP合酶的速度受到游离ADP底物的限制,从而受到细胞的一般能量状态的限制。当用线粒体解耦FCCP处理细胞时,质子可以自由地穿过线粒体内膜。这模拟了细胞经历不可饱和的能量需求的情况,因此最大呼吸量是电子传递链可以消耗的最大氧气速率的量度。 最大呼吸计算为用FCCP处理的细胞和用抗霉素A处理的细胞的OCR差异 | ||
| ATP 营业额 | ATP连锁呼吸被测量为使用寡霉素抑制ATP合酶后OCR的差异。否则通过氧化磷酸化用于ADP磷酸化的氧气将不再使用,因为该过程被阻止。因此,ATP连接呼吸相对于氧化磷酸化产生的ATP。AT连锁呼吸的变化是线粒体对细胞ATP需求改变的反应 ATP连锁呼吸计算为添加任何线粒体调节剂(寡霉素或FCCP)之前和添加寡霉素后OCR的差异 | ||
| 备用呼吸能力 | 备用呼吸能力是产生ATP的理论额外能力的量度,作为对增加的能量需求的反应。它被定义为基础呼吸和最大呼吸之间的差异。备用呼吸能力的变化可能是线粒体和细胞健康和灵活性的指标。 | ||
表4:使用通量分析仪研究的线粒体呼吸的各种成分的解释
讨论
在描述T细胞的能量状态时,氧化磷酸化的详细和正确的定量是不可或缺的工具。线粒体适应状态可能与 T 细胞活化电位、存活和分化直接相关1,5。使用该协议,可以确定氧化磷酸化的各种性质(详见 表4 )。精确定量氧化磷酸化的这些特性可以详细了解T细胞的能量状态。但是,为了获得可靠的结果,在设置实验时必须非常小心。
在此协议中,建议以下三个优化步骤 - 首先优化细胞数。通量分析仪正确测量氧浓度的能力遵循乙状结肠曲线;太小或太大的氧气变化将超出机器的运行间隔,因此无法正确测量。这需要在整个实验过程中使用细胞数量的优化。如果测定的细胞太少,则耗氧量的变化太低,无法正确测量。如果细胞过多,则存在测定培养基中氧气耗尽的风险。因此,建议进行初始运行,每个孔的细胞数范围为100,000-400,000个细胞。当绘制细胞数与基础呼吸时,最佳细胞计数将在曲线的线性范围内。在优化设置时,请注意,静息细胞和活化细胞之间的线粒体活性可能存在指数差异,因此需要相应地进行优化。
第二,抑制剂浓度的滴定。当用寡霉素和FCCP处理细胞时,重要的是要确定要使用的抑制剂的最佳浓度。浓度过低将导致次优抑制和线粒体呼吸测量不正确。人们通常使用最高推荐浓度的抑制剂,以确保获得完全的抑制。这也是有问题的,因为抑制剂浓度过高会产生多效性作用。像FCCP这样的解偶联剂也对线粒体以外的膜施加作用,导致一系列不良作用,包括质膜去极化,线粒体抑制和细胞毒性。在该协议中,寡霉素和FCCP的滴定与细胞数优化同时进行。在优化运行期间,使用四个可用的底物端口加入增加浓度的寡霉素或FCCP。在生成的OCR图中,最佳浓度可以直观地确定为OCR达到稳定平台的浓度。一旦寡霉素和FCCP的浓度被滴定,这些浓度将在整个实验过程中使用。
第三,依次与单次单独添加抑制剂。经典的海马测定通常先依次加入第一个寡霉素,然后加入FCCP。在T细胞和其他敏感细胞中,这种顺序添加可导致最大呼吸的错误定量。反过来,测量的备用呼吸能力水平将报告低于实际水平。这方面的严重例子包括备用呼吸能力值为阴性。当然,这在生物学上是不可能的,并且是由寡霉素治疗对线粒体的预敏化引起的。在该协议中,建议仅用寡霉素或FCCP处理细胞(参见 图3C 进行说明性比较)。
最后,这种优化的方案用于显示如何根据其线粒体呼吸清楚地将补充IL-15的人原代T细胞培养物与补充IL-2的细胞区分开来。IL-15培养的细胞具有更高的最大呼吸和备用呼吸能力,这是一种与记忆T细胞相关的代谢状态1,6。这些观察结果与先前将IL-15与记忆T细胞亚群联系起来的研究一致8。此外,与IL-2培养的细胞相比,观察到基础呼吸的差异,但ATP的产生没有差异。这表明这些细胞利用其糖酵解能力来顺应基础代谢需求,这是一种与更多分化细胞相关的途径。 综上所述,表明可以通过使用IL-15补充剂 在体外 建立人类记忆T细胞模型。使用富含IL-15的环境来促进记忆细胞的发展之前已经得到证明,并进一步支持了这一发现8。
在这种方法中,寡霉素,FCCP和抗霉素A已被用于量化OxPhos的性质。其他化合物具有类似的效果,可能更适合T细胞。一个例子是使用开耦剂BAM15代替FCCP来减少线粒体膜的去极化并避免细胞毒性9。在这种方法中,这些化合物尚未被考虑,因为寡霉素,FCCP和抗霉素A在过去十年中一直是海马实验推荐的线粒体调节剂。因此,这些化合物的使用得到了与OxPhos合作的审稿人和其他研究人员的认可。鼓励更有经验的海马通量分析仪用户使用这些替代化合物,但这些化合物的使用超出了本文的范围。
监测线粒体OxPhos是了解T细胞功能和改善癌症免疫疗法的重要工具。如前所述,IL-15扩增细胞 - 具有较少分化的记忆表型 - 被证明可以改善对CAR T细胞疗法的反应,因为它们不那么疲惫并且具有增加的抗肿瘤活性10。这种优化的方案可以成为研究临床前和临床环境中T细胞质量的有效工具。总之,该协议实施了优化细胞数量和抑制剂浓度的步骤,以便在代谢测定中使用 离体 培养的人原代T细胞。
披露声明
作者声明没有利益冲突。
致谢
Kasper Mølgaard和Anne Rahbech获得了Tømmermester Jørgen Holm og Hustru Elisa f. Hansens Mindelegat的资助。Kasper Mølgaardals还获得了Børnecancerfonden的资助。
材料
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
参考文献
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -. H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。