Method Article
Echtzeitüberwachung der mitochondrialen Atmung in zytokindifferenzierten humanen primären T-Zellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die metabolische Anpassung ist für T-Zellen von grundlegender Bedeutung, da sie Differenzierung, Persistenz und Zytotoxizität bestimmt. Hier wird ein optimiertes Protokoll zur Überwachung der mitochondrialen Atmung in ex vivo Zytokin-differenzierten humanen primären T-Zellen vorgestellt.
Zusammenfassung
Während der Aktivierung passt sich der Stoffwechsel von T-Zellen an Veränderungen an, die sich auf ihr Schicksal auswirken. Eine Erhöhung der mitochondrialen oxidativen Phosphorylierung ist für die T-Zell-Aktivierung unerlässlich, und das Überleben von Gedächtnis-T-Zellen hängt vom mitochondrialen Umbau ab. Folglich beeinflusst dies das langfristige klinische Ergebnis von Krebsimmuntherapien. Veränderungen der T-Zell-Qualität werden oft durch Durchflusszytometrie unter Verwendung bekannter Oberflächenmarker und nicht direkt durch ihren Stoffwechselzustand untersucht. Dies ist ein optimiertes Protokoll zur Messung der mitochondrialen Atmung primärer menschlicher T-Zellen in Echtzeit mit einem extrazellulären Flussanalysator und den Zytokinen IL-2 und IL-15, die den T-Zell-Stoffwechsel unterschiedlich beeinflussen. Es wird gezeigt, dass der Stoffwechselzustand von T-Zellen durch die Messung des Sauerstoffverbrauchs bei der Hemmung von Schlüsselkomplexen im Stoffwechselweg eindeutig unterschieden werden kann und dass die Genauigkeit dieser Messungen in hohem Maße von der optimalen Inhibitorkonzentration und der Inhibitorinjektionsstrategie abhängt. Dieses standardisierte Protokoll wird dazu beitragen, die mitochondriale Atmung als Standard für die T-Zell-Fitness bei der Überwachung und Untersuchung von Krebsimmuntherapien zu implementieren.
Einleitung
Die korrekte Entwicklung und Funktion von T-Zellen ist für die Fähigkeit des Immunsystems, Antigene zu erkennen und darauf zu reagieren, unerlässlich. Die mitochondriale oxidative Phosphorylierung (OxPhos) ändert sich je nach Zustand der T-Zelle. Naive T-Zellen verwenden OxPhos überwiegend zur Produktion von ATP, während aktivierte T-Zellen einen metabolischen Übergang durchlaufen, bei dem die Glykolyse dominant wird1. Nach der Effektorphase kehrt die kleine verbleibende Teilmenge der Gedächtnis-T-Zellen in einen von OxPhos2,3 dominierten Stoffwechselzustand zurück. Die Veränderungen von OxPhos folgen der Differenzierung von T-Zellen in einem solchen Maße, dass auch Teilmengen von T-Zellen durch ihre spezifischen OxPhos-Eigenschaften unterschieden werden können1. Umgekehrt ist OxPhos wichtig für die Funktion von T-Zellen, und die Hemmung von OxPhos blockiert nachweislich die Proliferation und Zytokinproduktion von T-Zellen4. Daher ist die Fähigkeit, die Eigenschaften von T-Zell-OxPhos präzise und reproduzierbar zu quantifizieren, ein leistungsfähiges Werkzeug für jeden, der mit T-Zellen arbeitet.
In diesem Protokoll werden die Eigenschaften von T-Zell-OxPhos mit einem extrazellulären Flussanalysator gemessen. Die Kernfunktion dieses Analysators besteht darin, kontinuierlich den Sauerstoffgehalt der Wachstumsmedien der zu analysierenden Zellen zu messen. Es wird angenommen, dass Sauerstoff, der aus den Wachstumsmedien entfernt wird, von den Zellen aufgenommen wird. Durch die Behandlung der Zellen mit einer Vielzahl von Oxphos-Inhibitoren oder Modifikatoren ist ein Abfall der Sauerstoffaufnahme mit der gehemmten oder modulierten Funktion verbunden. Zum Beispiel führt die Hemmung der ATP-Synthase zu einer reduzierten zellulären Aufnahme von Sauerstoff, der sonst zur Herstellung von ATP durch oxidative Phosphorylierung verwendet würde. Andere Geräte, einschließlich der Clark-Elektrode und des Oroboros-Instruments, bieten eine ähnliche Funktionalität, und jedes Instrument hat unterschiedliche Vorteile und Mängel. Eine breite Palette von Zelltypen kann für Studien in diesen Geräten verwendet werden, aber ein besonders herausfordernder Zelltyp sind menschliche primäre T-Lymphozyten5. Aufgrund ihrer geringen Größe, ihres schlechten Ex-vivo-Überlebens und ihrer nicht adhärenten Eigenschaften können menschliche primäre T-Zellen schwierig zu untersuchen sein.
Dies ist ein Protokoll zur Untersuchung der mitochondrialen Atmung menschlicher primärer T-Zellen durch einen extrazellulären Analysator. Das Protokoll ist in einen Optimierungslauf unterteilt, bei dem optimale Konzentrationen der Zellzahl pro Well, sowie die optimale Konzentration von Oligomycin und FCCP, bestimmt werden. Weiterhin ein Assay-Lauf, bei dem die optimierten Bedingungen genutzt werden.
Unter Verwendung von aus Blut gewonnenen humanen PBMCs und ex vivo primären T-Zellkulturen zeigt dieses Protokoll die Bedeutung einer optimalen Inhibitorkonzentration und die Relevanz der Verwendung separater anstelle einer sequentiellen Injektion von mitochondrialen Inhibitoren bei der Arbeit mit empfindlichen Zelltypen. Schließlich wird gezeigt, dass dieser Assay subtile Unterschiede in der mitochondrialen Atmung bei Polarisation mit den Zytokinen IL-2 und IL-15 robust nachweisen kann.
Protokoll
Die Experimente wurden nach den Richtlinien des Herlev-Krankenhauses und der Hauptstadtregion Dänemarks durchgeführt.
HINWEIS: Dieses Protokoll enthält Anweisungen für einen Optimierungslauf und einen Assays-Lauf. Es steht klar im Text, wenn Anweisungen für einen Optimierungslauf oder einen Assay-Lauf gelten. Führen Sie einen Optimierungslauf durch, bevor Sie mit den Assay-Läufen fortfahren
1. Menschliche periphere Blut mononukleär (PBMC) Isolierung von Buffy Coats
- PBMC-Isolierung
- Sammeln Sie Buffy-Mäntel von der entsprechenden Institution (gesammelt in Blutsammelbeuteln). Buffy-Mäntel stammen von gesunden Spendern. Schließen Sie Spender aus, die kürzlich Schmerzmittel verwendet haben.
- Besprühen Sie den Blutentnahmebeutel mit der Buffy-Schicht mit 70% Ethanol, bevor Sie ihn in einen Laminar-Flow-Schrank geben. Verwenden Sie immer sterile Techniken und sterile Hardware für alle Schritte
HINWEIS: Stellen Sie sicher, dass die richtigen Genehmigungen für den Umgang mit menschlichen Blutproben eingeholt werden. - Überführen Sie das Blut in ein steriles 50 ml Zentrifugenröhrchen.
- Verdünnen Sie das Blut mindestens 10% mit nicht ergänztem RPMI 1640.
- Gießen Sie 20 ml des bevorzugten Dichtegradientenmediums in ein 50 mL Zentrifugenröhrchen.
- Saugen Sie 25 ml des verdünnten Blutes in eine serologische Pipette ab. Stellen Sie die elektrische Pipettensteuerung auf die niedrigste Geschwindigkeit ein.
- Halten Sie das Rohr mit Dichtegradientenmedium in einem Winkel von 45° und legen Sie die serologische Pipettenspitze auf die Innenseite des 50 ml Zentrifugenröhrchens. Geben Sie langsam 25 ml des verdünnten Blutes aus der serologischen Pipette ab.
- Stellen Sie sicher, dass sich das verdünnte Blut und das Dichtegradientenmedium nicht vermischen. Stellen Sie sicher, dass das verdünnte Blut auf dem Dichtegradientenmedium ruht.
- Wiederholen Sie dies mit nachfolgenden Dichtegradienten-Mediumröhrchen, bis das gesamte verdünnte Blut verarbeitet ist.
- Bewegen Sie die Röhrchen vorsichtig zu einer Zentrifuge und Zentrifuge bei 1000 x g für 30 min in einem ausschwenkbaren Rotor bei Raumtemperatur (RT). Stellen Sie sicher, dass die Beschleunigung und der Bruch minimal sind.
HINWEIS: Nach der Zentrifugation sollten verschiedene Schichten sichtbar sein. Die obere, klare rosa-orange Schicht besteht aus dem Blutplasma und den Blutplättchen. Die mittlere weiße Schicht besteht aus den PBMCs, gefolgt von einer klaren Schicht, die aus dem Dichtegradientenmedium besteht, und schließlich einer dunkelroten Schicht am Boden mit roten Blutkörperchen. - Mit einer sterilen Pasteur-Pipette die PBMC-haltige weiße Schicht vorsichtig zu einem 50 ml Zentrifugenröhrchen abspritzen.
HINWEIS: Stellen Sie sicher, dass Sie das Dichtegradientenmedium nicht übertragen, da dies die nachgeschaltete Reinigung beeinträchtigt. Überschüssiges Plasma hat keinen Einfluss auf die Ergebnisse. - Fassen Sie alle gesammelten PBMCs im selben 50-ml-Zentrifugenröhrchen zusammen und füllen Sie mit RPMI 1640 bis zu 50 ml.
- Zentrifen Sie die Zellen bei 500 x g für 5 min bei RT (führen Sie die verbleibenden Zentrifugationsschritte bei dieser Einstellung durch, sofern nicht anders angegeben).
- Aspirieren Sie den Überstand und suspendieren Sie die Zellen in 30 ml RPMI 1640. Zählen Sie die Zellen mit einem Hämozytometer oder einem automatisierten Zellzähler.
- Für die Kryokonservierung resuspendieren Sie maximal 30 Millionen Zellen pro 1 ml Gefriermedium.
- Die Zellen in Kryoröhrchen überführen und mit einem ratengesteuerten Gefrierbehälter (-1 °C pro min) bis -80 °C einfrieren. Für die Langzeitlagerung verschieben Sie die PBMCs auf -140 °C.
HINWEIS: Begrenzen Sie die Zeit, in der sich die Zellen im gefrierenden Medium bei RT befinden. Bei RT ist DMSO für Zellen hochgiftig.
2. Kultivierung aktivierter humaner primärer T-Lymphozyten
- Auftauen der Zellen (Tag 1)
- Vorwärmen Sie 10 ml RPMI 1640 pro Probe auf etwa 37 °C.
- Nehmen Sie die gewünschte Anzahl von Zellampullen und lagern Sie sie vorübergehend auf Trockeneis.
- Suspendieren Sie die gefrorenen Zellen in 10 ml vorgewärmtem RPMI 1640.
- Zentrifugieren Sie die Zellen für 5 min bei 500 x g bei RT.
- Den Überstand entsorgen und die Zellen erneut waschen, indem man in 10 ml RPMI 1640 resuspendiert und wie in 2.1.4 beschrieben zentrifugiert.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen bei 2 x 106 Zellen pro ml X-VIVO 15 medium + 5% humanes Serum (im Folgenden: T-Zell-Medium).
- Platte 2 ml der Zellen pro Well in einer 24-Well Zellkulturplatte und Inkubation über Nacht bei 37 °C und 5% CO2.
- Aktivierung von Zellen (Tag 0)
- Waschen Sie CD3/CD28-Perlen, indem Sie 12,5 μL Perlen pro 1 Million Zellen in ein Mikrozentrifugenröhrchen übertragen. 12,5 μL PBS pro 12,5 μL Perlen hinzufügen.
HINWEIS: Es ist wichtig, die Durchstechflasche mit Perlen vor dem Gebrauch zu wirbeln. - Legen Sie das Mikrozentrifugenröhrchen für 1 min auf einen geeigneten Magneten.
- Verwerfen Sie den Puffer und suspendieren Sie die Perlen im ursprünglichen Volumen des T-Zell-Mediums (12,5 μL T-Zell-Medium pro 12,5 μL des ursprünglichen Volumens der Perlen).
- Fügen Sie 12,5 μL Kügelchen pro Million Zellen hinzu, was einem Verhältnis von 1:2 entspricht (Perlen: Zellen).
- Teilen Sie die Zellen in zwei Bedingungen mit jeweils etwa 5 Millionen Zellen.
- Fügen Sie das richtige Volumen an Zytokinen zu den in Tabelle 1 genannten Bedingungen hinzu.
- Inkubieren Sie die Zellen für 3 Tage bei 37 °C und 5% CO2.
- Waschen Sie CD3/CD28-Perlen, indem Sie 12,5 μL Perlen pro 1 Million Zellen in ein Mikrozentrifugenröhrchen übertragen. 12,5 μL PBS pro 12,5 μL Perlen hinzufügen.
- Kultivierung von Zellen (Tag 3 und 5)
- Suspendieren Sie die Zellen und teilen Sie sie auf, indem Sie die Hälfte des Volumens von jedem Brunnen in ein neues Bohrloch übertragen. Fügen Sie jedem Welle das gleiche Volumen an frischem T-Zell-Medium hinzu.
- Fügen Sie jeder Bedingung neue Zytokine hinzu, wie in Tabelle 1 erwähnt.
3. Extrazellulärer Flusstest
- Hydratation der Sensorkartusche (Tag 0)
- Packen Sie die Sensorkassette aus und entfernen Sie die Sensorkassette vorsichtig von der Utility-Platte.
- Legen Sie die Sensorpatrone kopfüber ab und achten Sie darauf, die Sensorsonden nicht zu berühren.
- Füllen Sie die Gebrauchsplatte mit 200 μL Kalibrant (siehe Materialtabelle für Details) und setzen Sie die Sensorpatrone vorsichtig wieder in die Utility-Platte ein.
- Alternativ können Sie, um jegliche Blasenbildung zu vermeiden, die Sensorpatrone über Nacht in sterilem Reinstwasser inkubieren und am Morgen des Assays durch ein vorgewärmtes Kalibrant ersetzen.
- Inkubieren Sie die Sensorkartuschenplatte bei 37 °C in einem nicht CO2-regulierten Wärmeschrank über Nacht.
HINWEIS: Es ist sehr wichtig, einen nicht CO2-regulierten Schrank zu verwenden, da überschüssiges CO2 die Sensorpatrone beeinflusst. Stellen Sie sicher, dass der Flux-Analysator (siehe Materialtabelle für Details) mindestens einen Tag vor Gebrauch eingeschaltet ist, damit er sich auf 37 °C erwärmen kann.
- Zellbeschichtung und Herstellung von mitochondrialen Inhibitoren (Tag 1)
- Bereiten Sie eine Beschichtungslösung (siehe Materialtabelle) vor, die NaHCO3 (pH 8,3, 0,1 M, 1128 μL), Cell-Tak (1 mg/ml, 48 μL) und NaOH (1,0 M, 24 μL) enthält.
HINWEIS: Die Beschichtungslösung sollte immer frisch hergestellt und verwendet werden. - Öffnen Sie eine frische XF-Zellkulturplatte und geben Sie 12 μL der frisch zubereiteten Beschichtungslösung zu jeder Vertiefung. Sorgen Sie für eine gleichmäßige Verteilung der Beschichtungslösung im Boden aller Vertiefungen.
- Inkubieren Sie die Platte bei RT mit aufgesetztem Deckel für 30 Minuten und entsorgen Sie die verbleibende flüssige Lösung aus allen Vertiefungen.
- Waschen Sie die Platte mit 200 μL sterilem Wasser und entsorgen Sie die Flüssigkeit.
- Waschen Sie die Platte mit 200 μL sterilem PBS in Zellkulturqualität und entsorgen Sie die Flüssigkeit.
- Lassen Sie die Platte bei RT und lassen Sie sie mindestens 30 min trocknen.
- Bereiten Sie eine Beschichtungslösung (siehe Materialtabelle) vor, die NaHCO3 (pH 8,3, 0,1 M, 1128 μL), Cell-Tak (1 mg/ml, 48 μL) und NaOH (1,0 M, 24 μL) enthält.
- Platten-T-Zellen in der XF-Zellkulturplatte (Tag 1)
- Bereiten Sie 50 ml Assay-Medien vor, indem Sie geeignete XF RPMI-Medien mit Glukose, Pyruvat und Glutamin gemäß Versuchsaufbau mischen (empfohlene Werte: 4 mM Glukose, 1 mM Pyruvat und 3 mM Glutamin).
- In einem nicht CO2-regulierten Inkubator auf 37 °C erhitzen und den pH-Wert auf 7,4 einstellen. Stellen Sie sicher, dass genügend Medien vorhanden sind, um Zellen zu beschichten und Oligomycin- und FCCP-Lösungen vorzubereiten (Abschnitt 3.4).
- Entwerfen Sie ein Plattenlayout mit einer zunehmenden Anzahl von Zellen pro Bohrung für den Optimierungslauf oder Assay-Lauf. Verwenden Sie vier 4 Vertiefungen, die mit Medien gefüllt und mit Medien injiziert werden, für Hintergrundmessungen.
- T-Zellen, die in Abschnitt 2.3 (nach dem bevorzugten Verfahren) hergestellt wurden, zählen und die richtige Anzahl von Zellen zu jeder Vertiefung der mit der Beschichtungslösung beschichteten XF-Zellkulturplatte gemäß dem Plattenlayout pipettieren.
HINWEIS: Das endgültige Volumen jedes Brunnens kann variieren, muss aber ausreichen, um den Boden des Brunnens abzudecken. - Zentrifen Sie die XF-Zellkulturplatte bei 1000 x g bei RT für 10 Minuten, um die T-Zelle an der beschichteten Oberfläche zu befestigen.
- Waschen Sie die Zellen mit 200 μL Assay-Medien, entsorgen Sie die Medien und fügen Sie 180 μL Assay-Medien hinzu.
HINWEIS: Untersuchen Sie die Vertiefungen visuell mit einem inversen Lichtmikroskop, um sicherzustellen, dass die Zellen befestigt und gleichmäßig über die Brunnenoberfläche verteilt sind. - Inkubieren Sie die XF-Zellkulturplatte 30 Minuten lang im nicht CO2-regulierten Wärmeschrank, um sicherzustellen, dass die Temperatur der Platte 37 ° C beträgt.
- Beschickung der Sensorkassette mit Oligomycin und FCCP für den Optimierungslauf (Tag 1)
HINWEIS: Wenn die Konzentrationen von Oligomycin und FCCP bereits optimiert wurden, fahren Sie mit Abschnitt 3.5 fort.- Es werden Arbeitslösungen von Oligomycin und FCCP in Assay-Medien (vorbereitet in Schritt 3.3.1) wie in den Schritten 3.4.2 und 3.4.3 beschrieben hergestellt.
- Oligomycin-Arbeitslösungen: 5 μM Lösung (2 ml Assay-Medien + 10 μL 1 mM Oligomycin-Stamm) und 3 μM Lösung (8 ml Assay-Medien + 24 μL 1 mM Oligomycin-Brühe).
- FCCP-Arbeitslösung: Herstellung von 2 μM Lösung (2 ml Assay-Medien + 13,2 μL 300 μM FCCP-Material) und einer 1,3 μM-Lösung (8 ml Assay-Medien + 34,6 μL 300 μM FCCP-Material)
- Laden Sie die Arbeitslösungen von Oligomycin oder FCCP in die Einspritzanschlüsse der Sensorpatrone (Tabelle 2).
ANMERKUNG. Es ist wichtig, dass keine Einspritzöffnungen nur Luft enthalten. Wenn aus irgendeinem Grund nicht alle Injektionsports verwendet werden, müssen leere Ports mit Assay-Medien gefüllt werden. - Klopfen Sie vorsichtig an die Kanten der Platte auf dem Tisch, um potenzielle Blasen in den Einspritzöffnungen zu entfernen.
- Laden der Sensorkassette mit Oligomycin, FCCP und Antimycin A für den Assay-Lauf (Tag 1)
- Bereiten Sie Lösungen von Oligomycin, FCCP in Assay-Medien (hergestellt in Schritt 3.3.1) entsprechend den optimalen Konzentrationen vor, die in einem früheren Optimierungslauf identifiziert wurden. Bereiten Sie auch eine 20 μM Antimycin A-Lösung vor.
- Laden Sie 20 μL entweder Oligomycin oder FCCP in den Einspritzanschluss A der Sensorkassette entsprechend dem Plattenlayout. Fügen Sie 22 μL 20 μM Antimycin A zu Injektionsport B aller Vertiefungen hinzu. Die resultierende Konzentration von Antimycin A, die einmal in die Vertiefung injiziert wurde, beträgt 2 μM.
- Einrichten des experimentellen Protokolls in der Flux Analyzer-Software.
- Weisen Sie die Gruppen und die Plattenzuordnung für jede Bedingung pro Plattenlayout zu.
- Entwerfen Sie das Protokoll gemäß der Injektionsstrategie (Tabelle 3 und Abbildung 1).
HINWEIS: Beim Ausführen von Assay-Läufen können die Injektionen C und D entfallen. - Speichern Sie die Assay-Einrichtung, füllen Sie die Informationen aus, die für den Assay erforderlich sind, und drücken Sie Start.
- Der Flussanalysator fragt nach der in Abschnitt 3.5 vorbereiteten Sensorpatrone. Entfernen Sie den Deckel und setzen Sie die Sensorpatrone gemäß den Anweisungen des Analysators ein.
HINWEIS: Der Assay kalibriert und überprüft Sensoren, die durch Häkchen gekennzeichnet sind. Nach erfolgreicher Kalibrierung fordert der Analysator die in Abschnitt 3.3 vorbereitete XF-Zellkulturplatte an. Die Gebrauchsplatte wird aus dem Analysator ausgeworfen und durch die XF-Zellkulturplatte ersetzt, um den Assay zu starten.
Ergebnisse
Eine korrekte Bestimmung der OxPhos-Eigenschaften ist ein unverzichtbares Werkzeug bei der Untersuchung von T-Zellen. Wenn die Assay-Bedingungen jedoch nicht optimiert wurden, besteht ein erhebliches Risiko irreführender oder fehlerhafter Ergebnisse. In diesem Protokoll liegt ein starker Fokus auf der Optimierung der Zellzahl pro Vertiefung und der zu verwendenden Konzentrationen von Oligomycin und FCCP. In der beschriebenen Einrichtung werden Oligomycin und FCCP inkrementell in dieselbe Vertiefung gegeben, wodurch die Konzentration der mitochondrialen Modulatoren erhöht wird. Die optimale Konzentration von Oligomycin und FCCP kann aus den resultierenden OCR-Kurven der Bohrlöcher als die Konzentration bestimmt werden, bei der ein Plateau erreicht wird.
Im repräsentativen Durchlauf wird Oligomycin in zunehmender Konzentration zugegeben und hemmt die ATP-Synthase (Komplex V der Elektronentransportkette), was zu einer verminderten mitochondrialen Atmung führt. Ein Plateau in der OCR wird erreicht, nachdem die akkumulative Konzentration der Bohrlöcher 1 μM erreicht hat. Aufgrund dieser Konzentration und steigender Konzentrationen wurde die OCR nicht weiter reduziert (Abbildung 1A). Bei Bohrlöchern, die mit einer inkrementellen Konzentration des Entkopplers FCCP behandelt wurden, stiegen die OCR-Spiegel wie erwartet an, bis sie nach Zugabe von 0,2 μM FCCP ein Plateau erreichten, was darauf hindeutet, dass bei dieser Konzentration eine vollständige Entkopplung erzielt wurde (Abbildung 1B). Eine Optimierung der pro Vertiefung plattierten Zellen ist wichtig für einen korrekten und reproduzierbaren Assay. Wenn die verwendete Zellzahl zu niedrig ist, ist der Sauerstoffgehalt, der von den Zellen aus den Assay-Medien entfernt wird, zu niedrig, um vom Analysator korrekt gemessen zu werden. Auf der anderen Seite, wenn die Anzahl der Zellen pro Vertiefung zu hoch ist, kann der Sauerstoffverbrauch der Zellen so hoch werden, dass das System den Sauerstoffgehalt der Assay-Medien nach jeder Messung nicht wieder auffüllen kann, was zu einer zunehmend hypoxischen Umgebung und einer fehlerhaften OxPhos-Charakterisierung führt.
Im repräsentativen Durchlauf wurden die Zellen mit einer Dichte von 200.000 und 400.000 Zellen pro Vertiefung ausgesät (Abbildung 2A-C). Für einen Lauf mit 200.000 Zellen ist die anfängliche OCR etwa die Hälfte eines Laufs mit 400.000 Zellen pro Well. Für die FCCP-Behandlung beträgt die maximale OCR 61,6 pmol/min (200.000 Zellen) gegenüber 190,4 pmol/min (400.000 Zellen). Nach der Behandlung mit Oligomycin kollabiert die OCR im Durchlauf mit 200.000 Zellen in eine einstellige OCR (6,4 pmol/min). Dies ist niedriger als die OCR des Laufs, mit 400.000 Zellen pro gut behandeltem Oligomycin (25,8 pmol / min).
Aus dem Optimierungslauf geht daher hervor, dass für zukünftige Assays eine Zellzahl von 400.000 Zellen pro Vertiefung erforderlich war, wobei 1 μM Oligomycin und 0,2 μM FCCP verwendet wurden. In der vom Hersteller empfohlenen klassischen Einrichtung werden Oligomycin und FCCP nacheinander mit der endgültigen Zugabe von Antimycin A zugegeben. Für T-Zellen ist dies nicht der optimale Ansatz, da die Oligomycin-Behandlung die Entkopplung nach der FCCP-Behandlung begrenzt (Abbildung 3A, B). In dieser vorgestellten Methode wird empfohlen, jede Bedingung in doppelten Vertiefungen auszuführen und eine Bohrung mit Oligomycin und die andere mit FCCP zu behandeln, mit einer abschließenden Zugabe von Antimycin A für beide Wells. Durch diesen Ansatz hat die Oligomycin-Behandlung keinen Einfluss auf die OCR nach der FCCP-Behandlung. Dieser Ansatz ermöglicht die Bestimmung der gleichen mitochondrialen Eigenschaften wie beim klassischen Aufbau, bei dem Medikamente nacheinander hinzugefügt werden (Abbildung 3C).
Abschließend wurde untersucht, ob die Wirkungen der Zytokine IL-2 und IL-15 auf den Stoffwechsel von ex vivo kultivierten menschlichen primären T-Zellen differenziert werden können. Tatsächlich besaßen IL-15-kultivierte Zellen eine höhere maximale Atmung und eine höhere Ersatzatmungskapazität, wie bereits gezeigt wurde1 (Abbildung 4A-E). Die Basalatmung und die ATP-Produktion waren nicht betroffen. Zusammengenommen zeigen diese Daten, dass die mitochondriale Atmung von ex vivo kultivierten menschlichen primären T-Zellen mit dem extrazellulären Flussanalysator erfolgreich analysiert werden kann.

Abbildung 1: Sauerstoffverbrauchsrate (OCR), gemessen während der Titration der Inhibitoren Oligomycin und FCCP in ex vivo kultivierten humanen primären T-Zellen. (A) OCR während der schrittweisen Titration von Oligomycin von 0-1,25 μM Endkonzentration. (B) OCR während der schrittweisen Titration von FCCP von 0-0,5 μM Endkonzentration. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Der Einfluss der Zellkonzentration auf OCR-Messungen in ex vivo kultivierten menschlichen primären T-Zellen. OCR-Messungen von ex vivo kultivierten humanen primären T-Zellen mit 200.000 oder 400.000 Zellen pro Well nach Injektion von entweder (A) FCCP oder (B) Oligomycin. (C) Basale Atmung, maximale Atmung, ATP-Produktion und freie Atemkapazität menschlicher primärer T-Zellen mit 200.000 oder 400.000 Zellen pro Bohrloch. Repräsentativ für drei unabhängige Experimente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
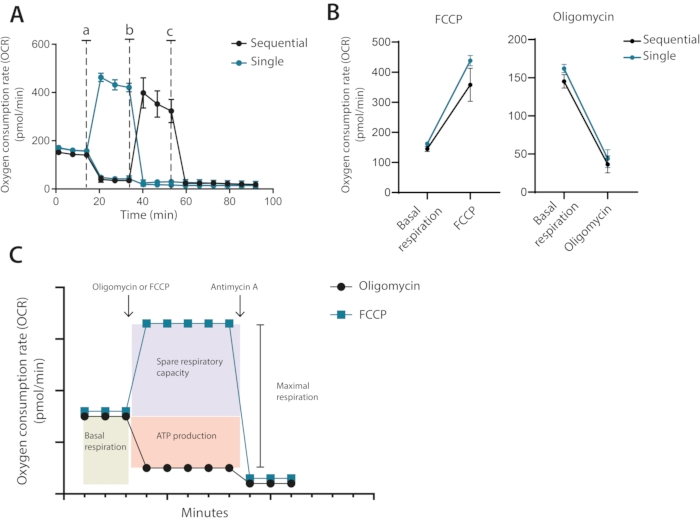
Abbildung 3: Einmalige oder sequentielle Injektion von mitochondrialen Modulatoren . (A) Repräsentative OCR-Messungen während des Ausgangswerts und nach der Injektion von Oligomycin und FCCP (a,b) oder Antimycin A (c) als einzelne Einzelinjektionen oder als sequentielle Injektionen. (B) OCR-Werte vor der Injektion (Basalatmung) oder nach der Injektion von Oligomycin oder FCCP als Einzelinjektionen oder sequentielle Injektionen. (C) Schematische Darstellung der Injektions- und Messstrategie. Vertreter eines unabhängigen Experiments Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
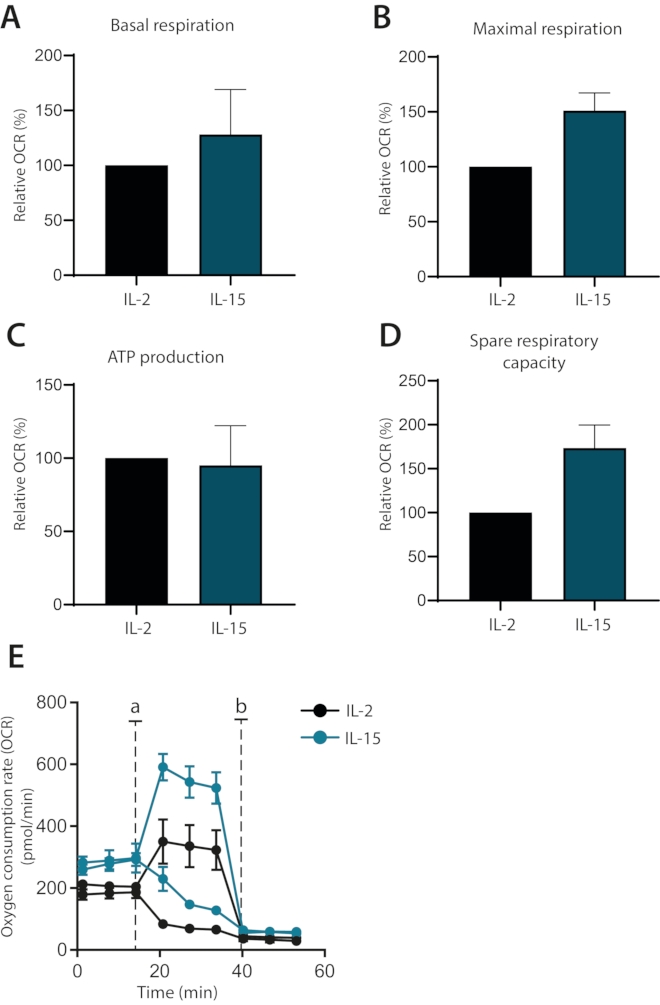
Abbildung 4: Unterschiede in der mitochondrialen Atmung in zytokindifferenzierten humanen primären T-Zellen. (A-D) Basale Atmung, maximale Atmung, ATP-Produktion und freie Atemkapazität menschlicher primärer T-Zellen, die sieben Tage lang mit IL-2 oder IL-15 kultiviert wurden (n = 3). (E) Repräsentative Parzellen von (A-D) mit Injektionen von Oligomycin oder FCCP (a) oder Antimycin A (b). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Zytokin | [Lagerbestand] | Verdünnungsfaktor | [Finale] | |
| Bedingung 1 | IL-2 | 3 x 106 HE/ml | 30,000 | 100 U/ml |
| Zustand 2 | IL-15 | 2 x 105 HE/ml | 2,000 | 100 U/ml |
Tabelle 1: Herstellung von Zytokinkulturen zur Steuerung metabolischer Veränderungen in T-Zellen.
| Oligomycin | FCCP | |||||
| Arbeitssol. | Abschließende Konk. | Bd. | Arbeitssol. | Abschließende Konk. | Bd. | |
| Anschluss A | 5,0 μM | 0,50 μM | 20 μL | 2,0 μM | 0,2 μM | 20 μL |
| Anschluss B | 3,0 μM | 0,75 μM | 22 μL | 1,30 μM | 0,3 μM | 22 μL |
| Anschluss C | 3,0 μM | 1,0 μM | 24 μL | 1,30 μM | 0,4 μM | 24 μL |
| Anschluss D | 3,0 μM | 1,25 μM | 27 μL | 1,30 μM | 0,5 μM | 27 μL |
Tabelle 2: Strategie zur Herstellung von mitochondrialen Inhibitoren und Modulatoren. Präparationskonzentrationen, Arbeitskonzentrationen und Injektionsstrategien für einen Optimierungslauf.
| Aktion | Details | Details zur Messung |
| Grundlinie | Baseline-Messungen | 3 Messungen |
| Injektion | Port A Injektion | 3 Messungen |
| Injektion | Port-B-Einspritzung | 3 Messungen |
| Injektion | Port-C-Einspritzung | 3 Messungen |
| Injektion | Port-D-Einspritzung | 3 Messungen |
| Messen | Zusätzliche Messungen | Wahlfrei |
Tabelle 3: Protokollentwurf eines Optimierungslaufs mit Titration von mitochondrialen Inhibitoren und Modulatoren unter Verwendung von 4 Injektionen mit jeweils 3 Messungen.
| Element der mitochondrialen oxidativen Phosphorylierung | Erklärung | ||
| Basale Atmung | Die Basalatmung ist ein Basismaß für die Sauerstoffrate, die von den stimulierten T-Zellen vor der Zugabe von mitochondrialen Inhibitoren verbraucht wird. Es ist ein Maß für den Sauerstoffverbrauch, der verwendet wird, um den zellulären ATP-Bedarf zu decken, der sich aus einem mitochondrialen Protonenleck ergibt. Als solches bietet es einen Überblick über den Protonenstrom, der erzeugt wird, um ATP-Synthese und Protonenleck zu liefern. Es ist jedoch auch eine Maßnahme, die in Abhängigkeit von den in den Wachstumsmedien vorhandenen Substraten, der Stimulation der Zellen vor dem Assay und anderen extrinsischen Faktoren verändert werden kann. Die Grundatmung ist daher ein Maß, das verwendet wird, um zwei oder mehr verschiedene Zelltypen und / oder verschiedene Behandlungen zu vergleichen, von denen angenommen wird, dass sie den zellulären Stoffwechselzustand der Zellen beeinflussen. Die Basalatmung wird als Differenz in der OCR vor der Zugabe von mitochondrialen Modulatoren (Oligomycin oder FCCP) und nach der Zugabe von Antimycin A berechnet. | ||
| Maximale Atmung | Dieses Maß ist die maximale Sauerstoffrate, die für die oxidative Phosphorylierung verbraucht werden kann. Die Sauerstoffrate, die durch oxidative Phosphorylierung verbraucht wird, wird sowohl durch die Fähigkeit der Elektronentransportkette, Protonen durch die innere mitochondriale Membran zu pumpen, als auch durch die Fähigkeit der ATP-Synthase, den Protonengradienten zu verwenden, um ATP aus ADP zu phosphorylieren, bestimmt. Die Geschwindigkeit der ATP-Synthase wird durch das freie ADP-Substrat und damit durch den allgemeinen energetischen Zustand der Zelle begrenzt. Bei der Behandlung der Zellen mit dem mitochondrialen Entkoppler FCCP können Protonen frei über die innere mitochondriale Membran zurückgehen. Dies ahmt eine Situation nach, in der die Zellen einen ungesättigten Energiebedarf haben, und die maximale Atmung ist daher ein Maß für die maximale Sauerstoffrate, die von der Elektronentransportkette verbraucht werden kann. Die maximale Atmung wird als Unterschied in der OCR von Zellen, die mit FCCP behandelt wurden, und Zellen, die mit Antimycin A behandelt wurden, berechnet | ||
| ATP-Umsatz | Die ATP-verknüpfte Atmung wird als Unterschied in der OCR nach Hemmung der ATP-Synthase unter Verwendung von Oligomycin gemessen. Der Sauerstoff, der sonst für die Phosphorylierung von ADP durch oxidative Phosphorylierung verbraucht würde, wird nicht mehr verwendet, da dieser Prozess gestoppt wird. Die ATP-gebundene Atmung ist daher relativ zu ATP, das durch oxidative Phosphorylierung erzeugt wird. Veränderungen in der AT-verknüpften Atmung sind eine Reaktion der Mitochondrien auf einen veränderten ATP-Bedarf der Zelle Die ATP-verknüpfte Atmung wird als Differenz in der OCR vor der Zugabe von mitochondrialen Modulatoren (Oligomycin oder FCCP) und nach der Zugabe von Oligomycin berechnet | ||
| Freie Atemkapazität | Die freie Atemkapazität ist ein Maß für eine theoretische zusätzliche Kapazität zur Produktion von ATP als Reaktion auf einen erhöhten Energiebedarf. Es ist definiert als der Unterschied zwischen Basalatmung und maximaler Atmung. Veränderungen der freien Atmungskapazität können ein Indikator für die Fitness und Flexibilität der Mitochondrien und Zellen sein. | ||
Tabelle 4: Erklärung der verschiedenen Komponenten der mitochondrialen Atmung, die mit dem Flussanalysator untersucht werden
Diskussion
Eine detaillierte und korrekte Quantifizierung der oxidativen Phosphorylierung ist ein unverzichtbares Werkzeug bei der Beschreibung der Energiezustände von T-Zellen. Der Zustand der mitochondrialen Fitness kann in direktem Zusammenhang mit dem T-Zell-Aktivierungspotenzial, dem Überleben und der Differenzierung stehen1,5. Mit diesem Protokoll ist es möglich, die verschiedenen Eigenschaften der oxidativen Phosphorylierung zu bestimmen (siehe Tabelle 4 für eine detaillierte Erklärung). Die genaue Quantifizierung dieser Eigenschaften der oxidativen Phosphorylierung bietet einen detaillierten Einblick in die Energiezustände von T-Zellen. Um jedoch zuverlässige Ergebnisse zu erhalten, muss bei der Einrichtung des Experiments große Sorgfalt walten gelassen werden.
In diesem Protokoll werden die drei folgenden Optimierungsschritte empfohlen - zuerst die Optimierung von Zellzahlen. Die Fähigkeit eines Flussmittelanalysators, Sauerstoffkonzentrationen korrekt zu messen, folgt einer Sigmoidkurve; Zu kleine oder zu große Sauerstoffveränderungen fallen außerhalb des Betriebsintervalls der Maschine und werden daher nicht korrekt gemessen. Dies erfordert eine Optimierung der Zellzahlen, die während des gesamten Experiments verwendet werden können. Werden zu wenige Zellen untersucht, sind die Veränderungen des Sauerstoffverbrauchs zu gering, um korrekt gemessen zu werden. Bei zu vielen Zellen besteht die Gefahr eines Sauerstoffmangels in den Assay-Medien. Ein erster Lauf wird daher empfohlen, mit Zellzahlen von 100.000-400.000 Zellen pro Well. Bei der Darstellung der Zellzahl im Vergleich zur Basalatmung liegt die optimale Zellzahl im linearen Bereich der Kurve. Bitte beachten Sie bei der Optimierung des Aufbaus, dass es einen exponentiellen Unterschied in der mitochondrialen Aktivität zwischen ruhenden und aktivierten Zellen geben kann und daher entsprechend optimiert werden muss.
Zweitens, Titration der Inhibitorkonzentrationen. Bei der Behandlung der Zellen mit Oligomycin und FCCP ist es wichtig, die optimalen Konzentrationen der zu verwendenden Inhibitoren zu identifizieren. Eine zu niedrige Konzentration führt zu einer suboptimalen Hemmung und einer falschen Messung der mitochondrialen Atmung. Es ist üblich, dass Menschen die höchsten empfohlenen Konzentrationen der Inhibitoren verwenden, um sicherzustellen, dass eine vollständige Hemmung erreicht wird. Dies ist auch problematisch, da zu hohe Konzentrationen der Inhibitoren pleiotrope Wirkungen haben können. Entkoppler wie FCCP üben ihre Wirkung auch auf andere Membranen als die mitochondrialen aus, was zu einer Reihe unerwünschter Effekte führt, einschließlich Plasmamembrandepolarisation, mitochondrialer Hemmung und Zytotoxizität. In diesem Protokoll erfolgt die Titration von Oligomycin und FCCP gleichzeitig mit der Zellzahloptimierung. Während eines Optimierungslaufs werden über die vier verfügbaren Substratports steigende Konzentrationen von Oligomycin oder FCCP hinzugefügt. Im resultierenden OCR-Diagramm kann die optimale Konzentration visuell als die Konzentration bestimmt werden, bei der die OCR ein stetiges Plateau erreicht. Sobald die Konzentration von Oligomycin und FCCP titriert wurde, sollen diese Konzentrationen während des gesamten Experiments verwendet werden.
Drittens, sequentielle versus einzelne individuelle Addition von Inhibitoren. Klassische Seepferdchen-Assays werden typischerweise mit der sequentiellen Addition des ersten Oligomycins durchgeführt, gefolgt von der Zugabe von FCCP. In T-Zellen und anderen empfindlichen Zellen kann eine solche sequentielle Addition zu einer fehlerhaften Quantifizierung der maximalen Atmung führen. Im Gegenzug werden die gemessenen Werte der freien Atemkapazität niedriger sein als sie sind. Schwerwiegende Beispiele dafür sind Werte der freien Atmungskapazität, die negativ sind. Dies ist natürlich biologisch nicht möglich und wird durch eine Präsensibilisierung der Mitochondrien durch eine Oligomycin-Behandlung verursacht. In diesem Protokoll wird stattdessen empfohlen, dass Zellen nur mit Oligomycin oder FCCP behandelt werden (siehe Abbildung 3C für einen illustrativen Vergleich).
Schließlich wird anhand dieses optimierten Protokolls gezeigt, wie IL-15-ergänzte humane primäre T-Zellkulturen anhand ihrer mitochondrialen Atmung deutlich von IL-2-ergänzten Zellen unterschieden werden können. IL-15-kultivierte Zellen besitzen eine höhere maximale Atmung und freie Atmungskapazität, ein Stoffwechselzustand, der mit Gedächtnis-T-Zellen verbunden ist1,6. Diese Beobachtungen stehen im Einklang mit früheren Studien, die IL-15 mit Gedächtnis-T-Zell-Untergruppen verbinden8. Darüber hinaus wurde ein Unterschied in der Basalatmung, aber nicht in der ATP-Produktion im Vergleich zu IL-2-kultivierten Zellen beobachtet. Dies deutet darauf hin, dass diese Zellen ihre glykolytische Kapazität nutzen, um die Anforderungen des Grundumsatzes zu erfüllen, ein Weg, der mit differenzierteren Zellen verbunden ist. Zusammengenommen zeigt sich, dass ein menschliches Gedächtnis-T-Zell-Modell in vitro durch Verwendung einer IL-15-Supplementierung etabliert werden kann. Die Verwendung einer IL-15-reichen Umgebung zur Förderung der Entwicklung von Gedächtniszellen wurde bereits demonstriert und unterstützt die Ergebnisse weiter8.
In dieser Methode wurden Oligomycin, FCCP und Antimycin A verwendet, um die Eigenschaften von OxPhos zu quantifizieren. Andere Verbindungen existieren mit ähnlichen Effekten, die möglicherweise besser für T-Zellen geeignet wären. Ein Beispiel wäre die Verwendung des Entkopplers BAM15 anstelle von FCCP, um die Depolarisation der mitochondrialen Membran zu verringern und Zytotoxizität zu vermeiden9. Bei dieser Methode wurden diese Verbindungen nicht berücksichtigt, da Oligomycin, FCCP und Antimycin A in den letzten zehn Jahren die empfohlenen mitochondrialen Modulatoren für Seahorse-Experimente waren. Die Verwendung dieser Verbindungen wird daher von Gutachtern und anderen Forschern, die mit OxPhos arbeiten, anerkannt. Erfahrenere Benutzer des Seahorse-Flussanalysators werden ermutigt, diese alternativen Verbindungen zu verwenden, aber die Verwendung dieser ist außerhalb des Rahmens dieses Papiers.
Die Überwachung des mitochondrialen OxPhos ist ein wesentliches Werkzeug zum Verständnis der T-Zell-Funktion und zur Verbesserung der Krebsimmuntherapien. Wie bereits erwähnt, wurde gezeigt, dass IL-15-expandierte Zellen - mit einem weniger differenzierten Gedächtnisphänotyp - das Ansprechen auf CAR-T-Zelltherapien verbesserten, da sie weniger erschöpft waren und eine erhöhte Antitumoraktivität aufwiesen10. Dieses optimierte Protokoll könnte ein wirksames Werkzeug sein, um die Qualität von T-Zellen sowohl im präklinischen als auch im klinischen Umfeld zu untersuchen. Zusammenfassend lässt sich sagen, dass dieses Protokoll Schritte zur Optimierung der Zellzahlen und Inhibitorkonzentrationen für die Verwendung von ex vivo kultivierten menschlichen primären T-Zellen in metabolischen Assays implementiert.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Kasper Mølgaard und Anne Rahbech erhielten Stipendien von Tømmermester Jørgen Holm og Hustru Elisa f. Hansens Mindelegat. Kasper Mølgaard erhielt auch ein Stipendium von Børnecancerfonden.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
Referenzen
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten