Method Article
الرصد في الوقت الحقيقي للتنفس الميتوكوندريا في الخلايا التائية الأولية البشرية المتباينة بالسيتوكين
* These authors contributed equally
In This Article
Summary
التكيف الأيضي أمر أساسي للخلايا التائية لأنه يملي التمايز والثبات والسمية الخلوية. هنا ، يتم تقديم بروتوكول محسن لمراقبة التنفس الميتوكوندريا في الخلايا التائية الأولية البشرية المتمايزة خارج الجسم الحي السيتوكين .
Abstract
أثناء التنشيط ، يتكيف التمثيل الغذائي للخلايا التائية مع التغييرات التي تؤثر على مصيرها. لا غنى عن زيادة الفسفرة التأكسدية للميتوكوندريا لتنشيط الخلايا التائية ، ويعتمد بقاء الخلايا التائية للذاكرة على إعادة تشكيل الميتوكوندريا. وبالتالي ، يؤثر هذا على النتائج السريرية طويلة الأجل للعلاجات المناعية للسرطان. غالبا ما تتم دراسة التغيرات في جودة الخلايا التائية عن طريق قياس التدفق الخلوي باستخدام علامات سطحية معروفة وليس مباشرة من خلال حالتها الأيضية. هذا بروتوكول محسن لقياس التنفس الميتوكوندريا في الوقت الحقيقي للخلايا التائية البشرية الأولية باستخدام محلل التدفق خارج الخلية والسيتوكينات IL-2 و IL-15 ، والتي تؤثر بشكل مختلف على استقلاب الخلايا التائية. يظهر أن الحالة الأيضية للخلايا التائية يمكن تمييزها بوضوح عن طريق قياس استهلاك الأكسجين عند تثبيط المجمعات الرئيسية في المسار الأيضي وأن دقة هذه القياسات تعتمد بشكل كبير على التركيز الأمثل للمثبط واستراتيجية حقن المثبطات. سيساعد هذا البروتوكول الموحد على تنفيذ التنفس الميتوكوندريا كمعيار للياقة البدنية للخلايا التائية في مراقبة ودراسة العلاجات المناعية للسرطان.
Introduction
يعد تطور الخلايا التائية الصحيحة ووظيفتها ضروريين لقدرة الجهاز المناعي على التعرف على المستضدات والاستجابة لها. تتغير الفسفرة التأكسدية للميتوكوندريا (OxPhos) وفقا لحالة الخلية التائية. تستخدم الخلايا التائية الساذجة في الغالب OxPhos لإنتاج ATP ، في حين تخضع الخلايا التائية المنشطة لانتقال استقلابي حيث يصبح تحلل السكر هو المهيمن1. بعد مرحلة المستجيب ، تعود المجموعة الفرعية الصغيرة المتبقية من خلايا الذاكرة T إلى حالة التمثيل الغذائي التي تهيمن عليها OxPhos2,3. تتبع تغيرات OxPhos تمايز الخلايا التائية لدرجة أنه حتى المجموعات الفرعية من الخلايا التائية يمكن تمييزها من خلال خصائصها المحددة في OxPhos 1. وعلى العكس من ذلك، فإن OxPhos مهم لوظيفة الخلايا التائية، وقد ثبت أن تثبيط OxPhos يمنع انتشار الخلايا التائية وإنتاج السيتوكين4. لذلك ، فإن القدرة على تحديد خصائص الخلايا التائية OxPhos بطريقة دقيقة وقابلة للتكرار هي أداة قوية لأي شخص يعمل مع الخلايا التائية.
في هذا البروتوكول ، يتم قياس خصائص OxPhos للخلايا التائية باستخدام محلل التدفق خارج الخلية. تتمثل الوظيفة الأساسية لهذا المحلل في قياس محتوى الأكسجين في وسائط نمو الخلايا المراد تحليلها باستمرار. يفترض أن الأكسجين الذي تتم إزالته من وسائط النمو يتم تناوله بواسطة الخلايا. من خلال علاج الخلايا بمجموعة متنوعة من مثبطات أو معدلات OxPhos ، يرتبط انخفاض امتصاص الأكسجين بالوظيفة المثبطة أو المعدلة. على سبيل المثال ، سيؤدي تثبيط سينثاز ATP إلى انخفاض امتصاص الخلايا للأكسجين الذي كان يمكن استخدامه لإنتاج ATP عن طريق الفسفرة التأكسدية. توفر المعدات الأخرى ، بما في ذلك قطب كلارك الكهربائي وأداة Oroboros ، وظائف مماثلة ، ولكل أداة مزايا وعيوب مختلفة. يمكن استخدام مجموعة واسعة من أنواع الخلايا للدراسات في هذه الأجهزة، ولكن أحد أنواع الخلايا الصعبة بشكل خاص هو الخلايا الليمفاوية التائية الأولية البشرية5. نظرا لصغر حجمها ، وضعف البقاء على قيد الحياة خارج الجسم الحي ، وخصائصها غير الملتصقة ، يمكن أن تكون الخلايا التائية الأولية البشرية صعبة الدراسة.
هذا بروتوكول لدراسة التنفس الميتوكوندريا للخلايا التائية الأولية البشرية بواسطة محلل خارج الخلية. ينقسم البروتوكول إلى تشغيل التحسين ، حيث يتم تحديد التركيزات المثلى لعدد الخلايا لكل بئر ، وكذلك التركيز الأمثل للأوليغومايسين و FCCP. علاوة على ذلك ، يتم تشغيل الفحص ، حيث يتم استخدام الظروف المحسنة.
باستخدام PBMCs البشرية المشتقة من الدم ومزارع الخلايا التائية الأولية خارج الجسم الحي ، يوضح هذا البروتوكول أهمية التركيز الأمثل للمثبطات وأهمية استخدام حقن منفصل بدلا من الحقن المتسلسل لمثبطات الميتوكوندريا عند العمل مع أنواع الخلايا الحساسة. أخيرا ، ثبت أن هذا الفحص يمكن أن يكتشف بقوة الاختلافات الدقيقة في تنفس الميتوكوندريا عند الاستقطاب مع السيتوكينات IL-2 و IL-15.
Protocol
أجريت التجارب بموجب المبادئ التوجيهية من مستشفى هيرليف ومنطقة العاصمة الدنماركية.
ملاحظة: يحتوي هذا البروتوكول على إرشادات لكل من تشغيل التحسين وتشغيل المقايسات. يتم كتابته بوضوح في النص عندما تكون التعليمات لتشغيل التحسين أو تشغيل المقايسة. تشغيل تشغيل التحسين قبل متابعة عمليات تشغيل الفحص
1. عزل الدم المحيطي البشري أحادي النواة (PBMC) عن المعاطف الناعمة
- عزل PBMC
- جمع المعاطف الناعمة من المؤسسة المناسبة (التي تم جمعها في أكياس جمع الدم). المعاطف الناعمة تنشأ من متبرعين أصحاء. استبعاد المتبرعين الذين استخدموا مسكنات الألم مؤخرا.
- رش كيس جمع الدم الذي يحتوي على معطف بافي مع 70٪ من الإيثانول قبل نقله إلى خزانة تدفق صفائحية. استخدم دائما تقنيات معقمة وأجهزة معقمة لجميع الخطوات
ملاحظة: تأكد من الحصول على التصاريح الصحيحة للتعامل مع عينات الدم البشرية. - نقل الدم إلى أنبوب طرد مركزي معقم 50 مل.
- تمييع الدم على الأقل 10 ٪ مع RPMI 1640 غير مكملة.
- صب 20 مل من وسط تدرج الكثافة المفضل في أنبوب طرد مركزي سعة 50 مل.
- استنشاق 25 مل من الدم المخفف إلى ماصة مصلية. اضبط وحدة تحكم الماصة الكهربائية على أقل سرعة.
- أمسك الأنبوب بوسط تدرج الكثافة بزاوية 45 درجة وضع طرف الماصة المصلية على الجانب الداخلي من أنبوب الطرد المركزي سعة 50 مل. إطلاق سراح ببطء 25 مل من الدم المخفف من ماصة مصلية.
- تأكد من عدم اختلاط الدم المخفف ووسط تدرج الكثافة. تأكد من أن الدم المخفف يستقر فوق وسط تدرج الكثافة.
- كرر ذلك مع أنابيب متوسطة متدرجة الكثافة اللاحقة حتى تتم معالجة جميع الدم المخفف.
- حرك الأنابيب بعناية إلى جهاز طرد مركزي وأجهزة طرد مركزي بسرعة 1000 × g لمدة 30 دقيقة في دوار متأرجح للخارج في درجة حرارة الغرفة (RT). تأكد من أن التسارع والكسر في الحد الأدنى.
ملاحظة: بعد الطرد المركزي، يجب أن تكون الطبقات المختلفة مرئية. تتكون الطبقة العلوية الواضحة من الوردي إلى البرتقالي من بلازما الدم والصفائح الدموية. تتكون الطبقة البيضاء الوسطى من PBMCs تليها طبقة واضحة تتكون من وسط تدرج الكثافة ، وأخيرا طبقة حمراء داكنة في القاع مع خلايا الدم الحمراء. - باستخدام ماصة باستور معقمة ، قم بشفط الطبقة البيضاء المحتوية على PBMC بعناية إلى أنبوب طرد مركزي سعة 50 مل.
ملاحظة: تأكد من عدم نقل وسط تدرج الكثافة لأن ذلك سيؤثر على تنقية المصب. البلازما الزائدة لن تؤثر على النتائج. - تجمع جميع PBMCs التي تم جمعها في نفس أنبوب الطرد المركزي سعة 50 مل وتتصل إلى 50 مل مع RPMI 1640.
- قم بطرد الخلايا مركزيا بسرعة 500 × g لمدة 5 دقائق في RT (قم بتنفيذ خطوات الطرد المركزي المتبقية في هذا الإعداد ما لم ينص على خلاف ذلك).
- شفط supernatant وإعادة تعليق الخلايا في 30 مل من RPMI 1640. عد الخلايا باستخدام مقياس الدم أو عداد الخلايا الآلي.
- للحفظ بالتبريد، أعد تعليق 30 مليون خلية كحد أقصى لكل 1 مل من وسط التجميد.
- انقل الخلايا إلى أنابيب التبريد وقم بتجميدها حتى -80 درجة مئوية باستخدام حاوية تجميد يتم التحكم فيها بمعدل (-1 درجة مئوية في الدقيقة). للتخزين على المدى الطويل، انقل PBMCs إلى -140 درجة مئوية.
ملاحظة: الحد من الخلايا الزمنية الموجودة في وسط التجميد عند RT. في RT ، DMSO شديد السمية للخلايا.
2. زراعة الخلايا الليمفاوية الأولية البشرية المنشطة
- ذوبان الخلايا (اليوم 1)
- قم بتسخين 10 مل من RPMI 1640 لكل عينة إلى حوالي 37 درجة مئوية.
- خذ العدد المطلوب من أمبولات الخلايا وخزنها مؤقتا على الثلج الجاف.
- أعد تعليق الخلايا المجمدة في 10 مل من RPMI 1640 المسخن مسبقا.
- الطرد المركزي للخلايا لمدة 5 دقائق في 500 × غرام في RT.
- تخلص من المادة الفائقة واغسل الخلايا مرة أخرى عن طريق التعليق في 10 مل من RPMI 1640 وأجهزة الطرد المركزي كما هو موضح في 2.1.4.
- تخلص من السوبرناتانت وأعد تعليق الخلايا عند 2 × 106 خلية لكل مل من X-VIVO 15 متوسطة + 5٪ مصل بشري (فيما يلي: وسط الخلايا التائية).
- لوحة 2 مل من الخلايا لكل بئر في صفيحة زراعة خلية 24 بئر وتحضن بين عشية وضحاها عند 37 درجة مئوية و 5٪ CO2.
- تنشيط الخلايا (اليوم 0)
- اغسل حبات CD3 / CD28 عن طريق نقل 12.5 ميكرولتر من الخرز لكل مليون خلية إلى أنبوب طرد مركزي دقيق. أضف 12.5 ميكرولتر من PBS لكل 12.5 ميكرولتر من الخرز.
ملاحظة: من المهم دوامة قارورة الخرز قبل الاستخدام. - ضع أنبوب الطرد المركزي الدقيق على مغناطيس مناسب لمدة 1 دقيقة.
- تخلص من المخزن المؤقت وأعد تعليق الخرز في الحجم الأصلي لوسط الخلايا التائية (12.5 ميكرولتر من وسط الخلايا التائية لكل 12.5 ميكرولتر من الحجم الأصلي للخرز).
- أضف 12.5 ميكرولتر من الخرز لكل مليون خلية تتوافق مع نسبة 1: 2 (الخرز: الخلايا).
- قسم الخلايا إلى حالتين مع حوالي 5 ملايين خلية في كل منهما.
- أضف الحجم الصحيح من السيتوكينات إلى الشروط كما هو مذكور في الجدول 1.
- احتضان الخلايا لمدة 3 أيام عند 37 درجة مئوية و 5 ٪ CO2.
- اغسل حبات CD3 / CD28 عن طريق نقل 12.5 ميكرولتر من الخرز لكل مليون خلية إلى أنبوب طرد مركزي دقيق. أضف 12.5 ميكرولتر من PBS لكل 12.5 ميكرولتر من الخرز.
- زراعة الخلايا (اليوم 3 و 5)
- أعد تعليق الخلايا وقسمها عن طريق نقل نصف الحجم من كل بئر إلى بئر جديد. أضف نفس الحجم من وسط الخلايا التائية الطازجة إلى كل بئر.
- إضافة سيتوكينات جديدة إلى كل شرط كما هو مذكور في الجدول 1.
3. فحص التدفق خارج الخلية
- ترطيب خرطوشة المستشعر (اليوم 0)
- قم بفك حزمة خرطوشة المستشعر وقم بإزالة خرطوشة المستشعر بعناية من لوحة الأداة المساعدة.
- ضع خرطوشة المستشعر رأسا على عقب ، مع الحرص على عدم لمس مجسات المستشعر.
- املأ لوحة الأداة المساعدة بعيار 200 ميكرولتر (انظر جدول المواد للحصول على التفاصيل) واستبدل خرطوشة المستشعر بعناية مرة أخرى في لوحة الأداة المساعدة.
- بدلا من ذلك ، للقضاء على أي تكوين فقاعة ، احتضن خرطوشة المستشعر في ماء فائق النقاء معقم بين عشية وضحاها واستبدلها بعيار تم تسخينه مسبقا في صباح يوم الفحص.
- احتضان لوحة خرطوشة المستشعر عند 37 درجة مئوية في خزانة تسخين غير منظمة CO2 بين عشية وضحاها.
ملاحظة: من المهم جدا استخدام خزانة غير منظمة CO2 لأن CO2 الزائد سيؤثر على خرطوشة المستشعر. تأكد من تشغيل محلل التدفق (انظر جدول المواد للحصول على التفاصيل) قبل يوم واحد على الأقل من الاستخدام للسماح له بالإحماء حتى 37 درجة مئوية.
- طلاء الخلايا وإعداد مثبطات الميتوكوندريا (اليوم 1)
- قم بإعداد محلول طلاء (انظر جدول المواد) يحتوي على NaHCO3 (الرقم الهيدروجيني 8.3 ، 0.1 م ، 1128 ميكرولتر) ، Cell-Tak (1 ملغ / مل ، 48 ميكرولتر) و NaOH (1.0 م ، 24 ميكرولتر).
ملاحظة: يجب دائما صنع محلول الطلاء واستخدامه طازجا. - افتح صفيحة زراعة خلايا XF طازجة وأضف 12 ميكرولتر من محلول الطلاء المعد حديثا إلى كل بئر. ضمان التوزيع المتساوي لمحلول الطلاء في قاع جميع الآبار.
- احتضن اللوحة في RT مع الغطاء لمدة 30 دقيقة وتخلص من المحلول السائل المتبقي من جميع الآبار.
- اغسل اللوحة ب 200 ميكرولتر من الماء المعقم وتخلص من السائل.
- اغسل اللوحة ب 200 ميكرولتر من PBS المعقمة من فئة زراعة الخلايا وتخلص من السائل.
- اترك الطبق في RT واتركه يجف لمدة 30 دقيقة على الأقل.
- قم بإعداد محلول طلاء (انظر جدول المواد) يحتوي على NaHCO3 (الرقم الهيدروجيني 8.3 ، 0.1 م ، 1128 ميكرولتر) ، Cell-Tak (1 ملغ / مل ، 48 ميكرولتر) و NaOH (1.0 م ، 24 ميكرولتر).
- خلايا اللوحة التائية في لوحة زراعة الخلايا XF (اليوم 1)
- قم بإعداد 50 مل من وسائط الفحص عن طريق خلط وسائط XF RPMI المناسبة مع الجلوكوز والبيروفات والجلوتامين وفقا للإعداد التجريبي (المستويات الموصى بها: 4 mM glucose و 1 mM pyruvate و 3 mM glutamine).
- سخني إلى 37 درجة مئوية في حاضنة غير منظمة CO2 واضبط الرقم الهيدروجيني على 7.4. تأكد من وجود وسائط كافية لطلاء الخلايا وإعداد حلول oligomycin و FCCP (القسم 3.4).
- صمم تخطيطا للوحة مع عدد متزايد من الخلايا لكل بئر لتشغيل التحسين أو تشغيل الفحص. استخدم أربعة 4 آبار ، مليئة بالوسائط وحقنها بالوسائط ، لقياس الخلفية.
- عد الخلايا التائية المعدة في القسم 2.3 (بالطريقة المفضلة) وقم بماصة العدد الصحيح من الخلايا إلى كل بئر من لوحة زراعة الخلايا XF المطلية بمحلول الطلاء ، وفقا لتخطيط اللوحة.
ملاحظة: قد يختلف الحجم النهائي لكل بئر ولكن يجب أن يكون كافيا لتغطية قاع البئر. - قم بالطرد المركزي للوحة زراعة الخلايا XF عند 1000 × g في RT لمدة 10 دقائق لالتصاق الخلية التائية بالسطح المطلي.
- اغسل الخلايا ب 200 ميكرولتر من وسائط الفحص ، وتخلص من الوسائط وأضف 180 ميكرولتر من وسائط الفحص.
ملاحظة: افحص الآبار بصريا باستخدام مجهر ضوئي مقلوب للتأكد من أن الخلايا متصلة وموزعة بالتساوي عبر سطح البئر. - احتضن لوحة زراعة الخلايا XF في خزانة التسخين غير الخاضعة لتنظيم CO2 لمدة 30 دقيقة لضمان أن تكون درجة حرارة اللوحة 37 درجة مئوية.
- خرطوشة مستشعر التحميل مع oligomycin و FCCP لتشغيل التحسين (اليوم 1)
ملاحظة: إذا كانت تركيزات الأوليغومايسين وFCCP قد تحسنت بالفعل، فتابع في القسم 3-5.- إعداد حلول عمل ل oligomycin و FCCP في وسائط الفحص (المعدة في الخطوة 3.3.1) كما هو موضح في الخطوتين 3.4.2 و 3.4.3.
- حلول عمل Oligomycin: قم بإعداد محلول 5 ميكرومتر (2 مل من وسائط الفحص + 10 ميكرولتر من مخزون أوليغومايسين 1 ملليمتر) ومحلول 3 ميكرومتر (8 مل من وسائط الفحص + 24 ميكرولتر من مخزون أوليغومايسين 1 ملليمتر).
- حل عمل FCCP: إعداد محلول 2 ميكرومتر (2 مل من وسائط الفحص + 13.2 ميكرولتر من مخزون FCCP 300 ميكرومتر) ومحلول 1.3 ميكرومتر (8 مل من وسائط الفحص + 34.6 ميكرولتر من مخزون FCCP 300 ميكرومتر)
- قم بتحميل حلول العمل الخاصة إما ب oligomycin أو FCCP في منافذ الحقن الخاصة بخرطوشة المستشعر (الجدول 2).
ملاحظه. من المهم ألا تحتوي منافذ الحقن على الهواء فقط. إذا لم يتم استخدام جميع منافذ الحقن لأي سبب من الأسباب، فيجب ملء المنافذ الفارغة بوسائط الفحص. - اضرب حواف اللوحة برفق على الطاولة لإزالة الفقاعات المحتملة في منافذ الحقن.
- تحميل خرطوشة المستشعر مع oligomycin، FCCP، وantimycin A لتشغيل الفحص (اليوم 1)
- قم بإعداد محاليل من oligomycin، FCCP في وسائط الفحص (أعدت في الخطوة 3.3.1) وفقا للتركيزات المثلى المحددة في تشغيل التحسين السابق. أيضا ، قم بإعداد محلول مضاد للمايسين A بحجم 20 ميكرومتر.
- قم بتحميل 20 ميكرولتر من oligomycin أو FCCP في منفذ الحقن A من خرطوشة المستشعر وفقا لتخطيط اللوحة. أضف 22 ميكرولتر من 20 ميكرومتر مضاد للمايسين A إلى منفذ الحقن B لجميع الآبار. سيكون التركيز الناتج من antimycin A بمجرد حقنه في البئر 2 ميكرومتر.
- إعداد بروتوكول تجريبي في برنامج محلل Flux.
- قم بتعيين المجموعات وخريطة اللوحة لكل شرط لكل تخطيط لوحة.
- تصميم البروتوكول وفقا لاستراتيجية الحقن (الجدول 3 والشكل 1).
ملاحظة: عند تشغيل الفحص، يمكن حذف الحقن C وD. - احفظ إعداد المقايسة، واملأ المعلومات المطلوب تضمينها للفحص، ثم اضغط على زر البدء.
- سيطلب محلل التدفق خرطوشة المستشعر المعدة في القسم 3.5. قم بإزالة الغطاء وأدخل خرطوشة المستشعر وفقا لتوجيهات المحلل.
ملاحظة: سيقوم الفحص بمعايرة أجهزة الاستشعار المشار إليها بعلامات الاختيار والتحقق منها. بعد المعايرة الناجحة، سيطلب المحلل لوحة زراعة الخلايا XF المعدة في القسم 3.3. يتم إخراج لوحة الأداة المساعدة من المحلل واستبدالها بلوحة زراعة الخلايا XF لبدء الفحص.
النتائج
يعد التحديد الصحيح لخصائص OxPhos أداة لا غنى عنها عند دراسة الخلايا التائية. ومع ذلك ، إذا لم يتم تحسين شروط الفحص ، فهناك خطر كبير من النتائج المضللة أو الخاطئة. في هذا البروتوكول ، هناك تركيز قوي على تحسين عدد الخلايا لكل بئر وتركيزات oligomycin و FCCP لاستخدامها. في الإعداد الموصوف ، تتم إضافة oligomycin و FCCP بشكل تدريجي إلى نفس البئر ، مما يزيد من تركيز معدلات الميتوكوندريا. يمكن تحديد التركيز الأمثل للأوليغومايسين و FCCP من منحنيات OCR الناتجة عن الآبار كتركيز حيث يتم الوصول إلى هضبة.
في التشغيل التمثيلي ، يضاف oligomycin بتركيز متزايد ويثبط synthase ATP (المركب V من سلسلة نقل الإلكترون) ، مما يؤدي إلى انخفاض تنفس الميتوكوندريا. يتم الوصول إلى هضبة في OCR بعد أن وصل التركيز التراكمي للآبار إلى 1 ميكرومتر. من هذا التركيز والتركيزات المتزايدة لم يتم تخفيض OCR أكثر من ذلك (الشكل 1A). وبالنسبة للآبار المعالجة بتركيز تدريجي من FCCP غير المقترن، زادت مستويات التعرف الضوئي على الحروف كما هو متوقع حتى وصلت إلى هضبة بعد إضافة 0.2 ميكرومتر من FCCP، مما يشير إلى أنه عند هذا التركيز تم الحصول على فك الارتباط الكامل (الشكل 1B). يعد تحسين الخلايا المطلية لكل بئر أمرا مهما لإجراء فحص صحيح وقابل للتكرار. إذا كان رقم الخلية المستخدمة منخفضا جدا ، فإن مستوى الأكسجين الذي تمت إزالته من وسائط الفحص بواسطة الخلايا منخفض جدا بحيث لا يمكن قياسه بشكل صحيح بواسطة المحلل. من ناحية أخرى ، إذا كان عدد الخلايا لكل بئر مرتفعا جدا ، يمكن أن يصبح استهلاك الأكسجين للخلايا مرتفعا جدا بحيث لا يستطيع النظام تجديد مستويات الأكسجين في وسائط الفحص بعد كل قياس ، مما يؤدي إلى بيئة نقص الأكسجة بشكل متزايد وتوصيف OxPhos خاطئ.
في الجولة التمثيلية ، تم زرع الخلايا بكثافة 200000 و 400000 خلية لكل بئر (الشكل 2A-C). بالنسبة للتشغيل مع 200000 خلية ، فإن OCR الأولي هو ما يقرب من نصف تشغيل مع 400000 خلية لكل بئر. بالنسبة لعلاج FCCP ، فإن الحد الأقصى للتعرف الضوئي على الحروف هو 61.6 pmol / min (200,000 خلية) مقابل 190,4 pmol / min (400,000 خلية). بعد علاج oligomycin ، ينهار OCR قيد التشغيل مع 200000 خلية إلى OCR مكون من رقم واحد (6.4 pmol / min). هذا أقل من OCR للتشغيل ، مع 400000 خلية لكل معالجة جيدة مع oligomycin (25.8 pmol / min ، على التوالي).
لذلك ، من خلال تشغيل التحسين ، من الواضح أن عدد الخلايا البالغ 400000 خلية لكل بئر كان مطلوبا للفحوصات المستقبلية ، باستخدام 1 ميكرومتر أوليغومايسين و 0.2 ميكرومتر FCCP. في الإعداد الكلاسيكي الموصى به من قبل الشركة المصنعة ، تتم إضافة oligomycin و FCCP بالتتابع مع الإضافة النهائية ل antimycin A. بالنسبة للخلايا التائية ، ليس هذا هو النهج الأمثل حيث يمكن رؤية علاج oligomycin للحد من فك الارتباط بعد علاج FCCP (الشكل 3A ، B). في هذه الطريقة المقدمة ، يوصى بتشغيل كل حالة في آبار مكررة ومعالجة أحدهما جيدا باستخدام oligomycin والآخر باستخدام FCCP ، مع إضافة نهائية من antimycin A لكلا البئرين. باستخدام هذا النهج ، لا يؤثر علاج oligomycin على OCR بعد علاج FCCP. يسمح هذا النهج بتحديد نفس خصائص الميتوكوندريا مثل الإعداد الكلاسيكي ، حيث تتم إضافة الأدوية بالتسلسل (الشكل 3C)
وأخيرا، تم التحقيق فيما إذا كان يمكن التمييز بين آثار السيتوكينات IL-2 و IL-15 على عملية التمثيل الغذائي للخلايا التائية الأولية البشرية المستزرعة خارج الجسم الحي. والواقع أن الخلايا المستزرعة في IL-15 تمتلك قدرة تنفس قصوى أعلى وقدرة تنفسية احتياطية، كما تبين من قبل(1) (الشكل 4A-E). لم يتأثر التنفس القاعدي وإنتاج ATP. تظهر هذه البيانات مجتمعة أن التنفس الميتوكوندريا للخلايا التائية الأولية البشرية المستزرعة خارج الجسم الحي يمكن تحليلها بنجاح باستخدام محلل التدفق خارج الخلية.

الشكل 1: معدل استهلاك الأكسجين (OCR) الذي تم قياسه أثناء معايرة مثبطات الأوليغوميسين و FCCP في الخلايا التائية الأولية البشرية المستزرعة خارج الجسم الحي. (A) OCR أثناء المعايرة بالتحليل الحجمي للأوليغوميسين تدريجيا من التركيز النهائي 0-1.25 ميكرومتر. (ب) التعرف الضوئي على الحروف أثناء المعايرة التدريجية ل FCCP من التركيز النهائي 0-0.5 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تأثير تركيز الخلايا على قياسات التعرف الضوئي على الحروف في الخلايا التائية الأولية البشرية المستزرعة خارج الجسم الحي . قياسات التعرف الضوئي على الحروف للخلايا التائية الأولية البشرية المستزرعة خارج الجسم الحي مع 200000 أو 400000 خلية لكل بئر بعد حقن إما (A) FCCP أو (B) Oligomycin. (ج) التنفس القاعدي، والتنفس الأقصى، وإنتاج ATP، والقدرة التنفسية الاحتياطية للخلايا التائية الأولية البشرية باستخدام 200,000 أو 400,000 خلية لكل بئر. ممثل لثلاث تجارب مستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
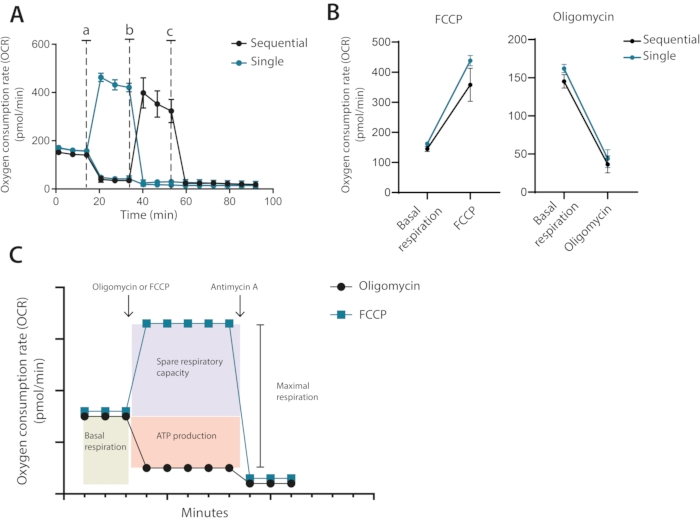
الشكل 3: الحقن الفردي أو المتسلسل لمعدلات الميتوكوندريا . (أ) قياسات OCR التمثيلية أثناء خط الأساس وبعد حقن الأوليغوميسين و FCCP (أ ، ب) ، أو أنتيميسين أ (ج) كحقن فردية واحدة أو كحقن متتابعة. (ب) قيم التعرف الضوئي على الحروف قبل الحقن (التنفس القاعدي) أو بعد حقن الأوليغوميسين أو FCCP كحقن مفردة أو حقن متتابعة. (ج) التمثيل التخطيطي لاستراتيجية الحقن والقياس. ممثل تجربة مستقلة واحدة يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
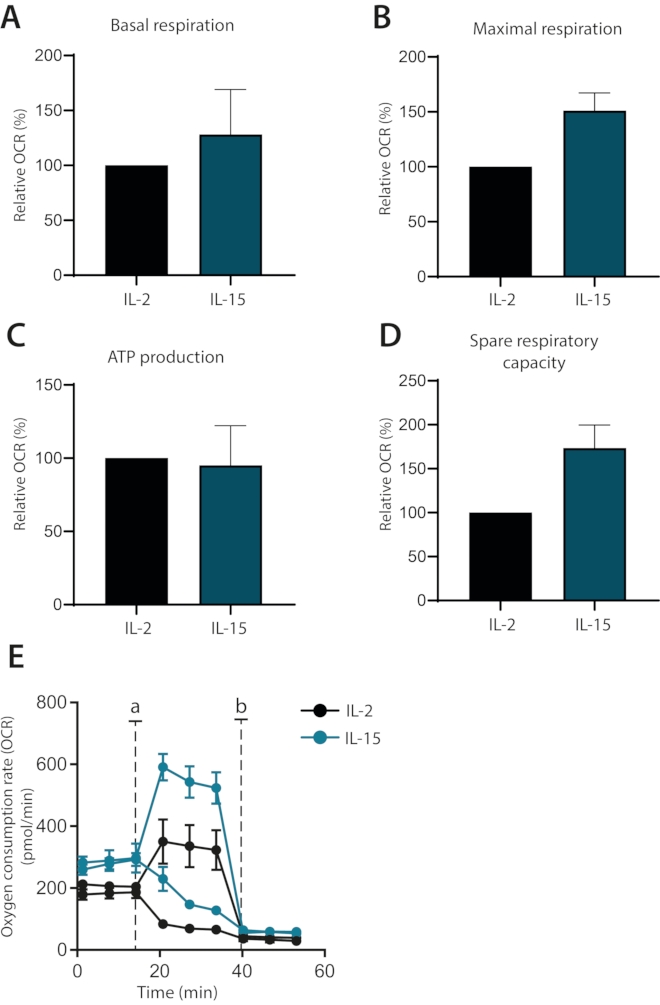
الشكل 4: الاختلافات في التنفس الميتوكوندريا في الخلايا التائية الأولية البشرية المتباينة بالسيتوكين. (أ-دال) التنفس القاعدي ، والتنفس الأقصى ، وإنتاج ATP ، والقدرة التنفسية الاحتياطية للخلايا التائية الأولية البشرية المستزرعة باستخدام IL-2 أو IL-15 لمدة سبعة أيام (n = 3). (ه) قطع تمثيلية من (A-D) ، مع حقن Oligomycin أو FCCP (أ) أو antimycin A (ب). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| السيتوكين | [الأسهم] | عامل التخفيف | [نهائي] | |
| الشرط 1 | IL-2 | 3 × 106 U/mL | 30,000 | 100 يو/مل |
| الشرط 2 | IL-15 | 2 × 105 U / مل | 2,000 | 100 يو/مل |
الجدول 1: تحضير مزارع السيتوكين المستخدمة لتوجيه التغيرات الأيضية في الخلايا التائية.
| أوليغوميسين | FCCP | |||||
| العمل سول. | المخروط النهائي. | المجلد. | العمل سول. | المخروط النهائي. | المجلد. | |
| المنفذ أ | 5.0 ميكرومتر | 0.50 ميكرومتر | 20 ميكرولتر | 2.0 ميكرومتر | 0.2 ميكرومتر | 20 ميكرولتر |
| المنفذ B | 3.0 ميكرومتر | 0.75 ميكرومتر | 22 ميكرولتر | 1.30 ميكرومتر | 0.3 ميكرومتر | 22 ميكرولتر |
| المنفذ C | 3.0 ميكرومتر | 1.0 ميكرومتر | 24 ميكرولتر | 1.30 ميكرومتر | 0.4 ميكرومتر | 24 ميكرولتر |
| المنفذ D | 3.0 ميكرومتر | 1.25 ميكرومتر | 27 ميكرولتر | 1.30 ميكرومتر | 0.5 ميكرومتر | 27 ميكرولتر |
الجدول 2: استراتيجية تحضير مثبطات الميتوكوندريا ومعدلاتها. تركيزات التحضير وتركيزات العمل واستراتيجيات الحقن لتشغيل التحسين.
| فعل | التفاصيل | تفاصيل القياس |
| الاساس | قياسات خط الأساس | 3 قياسات |
| حقن | حقن المنفذ A | 3 قياسات |
| حقن | حقن المنفذ B | 3 قياسات |
| حقن | حقن المنفذ C | 3 قياسات |
| حقن | حقن المنفذ D | 3 قياسات |
| قاس | قياسات إضافية | اختياري |
الجدول 3: تصميم بروتوكول تشغيل التحسين مع معايرة مثبطات الميتوكوندريا والمعدلات باستخدام 4 حقن مع 3 قياسات في كل منها.
| عنصر الفسفرة المؤكسدة الميتوكوندريا | تفسير | ||
| التنفس القاعدي | التنفس القاعدي هو مقياس أساسي لمعدل الأكسجين الذي تستهلكه الخلايا التائية المحفزة قبل إضافة مثبطات الميتوكوندريا. وهو مقياس لاستهلاك الأكسجين المستخدم لتلبية الطلب الخلوي ATP الناتج عن تسرب بروتون الميتوكوندريا. على هذا النحو ، فإنه يوفر نظرة عامة على تيار البروتون المتولد لتزويد تخليق ATP وتسرب البروتون. ومع ذلك ، فهو أيضا مقياس يمكن تغييره اعتمادا على الركائز الموجودة في وسائط النمو ، وتحفيز الخلايا قبل الفحص والعوامل الخارجية الأخرى. وبالتالي فإن التنفس القاعدي هو مقياس يستخدم لمقارنة نوعين أو أكثر من أنواع الخلايا المختلفة و / أو العلاجات المختلفة التي يعتقد أنها تؤثر على الحالة الأيضية الخلوية للخلايا. يتم حساب التنفس القاعدي على أنه الفرق في التعرف الضوئي على الحروف قبل إضافة أي معدلات الميتوكوندريا (oligomycin أو FCCP) وبعد إضافة antimycin A | ||
| أقصى قدر من التنفس | هذا المقياس هو الحد الأقصى لمعدل الأكسجين الذي يمكن استهلاكه للفسفرة التأكسدية. يتم تحديد معدل الأكسجين المستهلك بواسطة الفسفرة التأكسدية من خلال قدرة سلسلة نقل الإلكترون على ضخ البروتونات عبر غشاء الميتوكوندريا الداخلي ، وقدرة سينثاز ATP على استخدام تدرج البروتون إلى فوسفوريلات ATP من ADP. سرعة سينثاز ATP محدودة بالركيزة ADP الحرة وبالتالي بالحالة الحيوية العامة للخلية. عند معالجة الخلايا باستخدام FCCP غير المقترن بالميتوكوندريا ، يمكن للبروتونات أن تعبر بحرية عبر غشاء الميتوكوندريا الداخلي. هذا يحاكي الوضع الذي تواجه فيه الخلايا طلبا غير قابل للتشبع على الطاقة ، وبالتالي فإن التنفس الأقصى هو مقياس للمعدل الأقصى للأكسجين الذي يمكن أن تستهلكه سلسلة نقل الإلكترون. يتم حساب التنفس الأقصى على أنه الفرق في التعرف الضوئي على الحروف للخلايا المعالجة ب FCCP والخلايا المعالجة بمضاد المايسين A | ||
| معدل دوران ATP | يتم قياس التنفس المرتبط ب ATP على أنه الفرق في OCR بعد تثبيط سينثاز ATP باستخدام oligomycin. لن يتم استخدام الأكسجين الذي كان سيتم استهلاكه بطريقة أخرى لفسفرة ADP بواسطة الفسفرة التأكسدية بعد الآن عند إيقاف هذه العملية. وبالتالي فإن التنفس المرتبط ب ATP مرتبط ب ATP الناتج عن الفسفرة التأكسدية. التغيرات في التنفس المرتبط ب AT-هو استجابة الميتوكوندريا لطلب ATP المتغير للخلية يتم حساب التنفس المرتبط ب ATP على أنه الفرق في التعرف الضوئي على الحروف قبل إضافة أي معدلات ميتوكوندريا (oligomycin أو FCCP) وبعد إضافة oligomycin | ||
| القدرة التنفسية الاحتياطية | القدرة التنفسية الاحتياطية هي مقياس لقدرة إضافية نظرية لإنتاج ATP كاستجابة للطلب المتزايد النشط. يتم تعريفه على أنه الفرق بين التنفس القاعدي والتنفس الأقصى. يمكن أن تكون التغيرات في القدرة التنفسية الاحتياطية مؤشرا على لياقة الميتوكوندريا والخلايا ومرونتها. | ||
الجدول 4: شرح المكونات المختلفة للتنفس الميتوكوندريا التي تمت دراستها باستخدام محلل التدفق
Discussion
يعد التحديد الكمي المفصل والصحيح للفسفرة التأكسدية أداة لا غنى عنها عند وصف حالات الطاقة للخلايا التائية. يمكن أن ترتبط حالة لياقة الميتوكوندريا ارتباطا مباشرا بإمكانات تنشيط الخلايا التائية والبقاء على قيد الحياة والتمايز1,5. باستخدام هذا البروتوكول ، من الممكن تحديد الخصائص المختلفة للفسفرة التأكسدية (انظر الجدول 4 للحصول على شرح مفصل). يوفر التحديد الكمي الدقيق لهذه الخصائص للفسفرة التأكسدية نظرة مفصلة على حالات الطاقة للخلايا التائية. ومع ذلك ، للحصول على نتائج موثوقة ، يجب توخي الحذر الشديد عند إعداد التجربة.
في هذا البروتوكول ، ينصح بخطوات التحسين الثلاث التالية أولا ، تحسين أرقام الخلايا. تتبع قدرة محلل التدفق على قياس تركيزات الأكسجين بشكل صحيح منحنى السيني. التغيرات في الأكسجين التي تكون صغيرة جدا أو كبيرة جدا ستقع خارج فترة تشغيل الجهاز وبالتالي لن يتم قياسها بشكل صحيح. وهذا يتطلب تحسين أرقام الخلايا لاستخدامها طوال التجربة بأكملها. إذا تم فحص عدد قليل جدا من الخلايا ، فإن التغيرات في استهلاك الأكسجين منخفضة جدا بحيث لا يمكن قياسها بشكل صحيح. إذا كان هناك عدد كبير جدا من الخلايا ، فهناك خطر من استنفاد الأكسجين في وسائط الفحص. لذلك يوصى بإجراء تشغيل أولي ، حيث تتراوح أعداد الخلايا من 100000 إلى 400000 خلية لكل بئر. عند رسم رقم الخلية مقابل التنفس القاعدي ، سيكون عدد الخلايا الأمثل في النطاق الخطي للمنحنى. عند تحسين الإعداد ، يرجى الانتباه إلى أنه يمكن أن يكون هناك اختلاف أسي في نشاط الميتوكوندريا بين الخلايا المستقرة والمنشطة ، وبالتالي يجب تحسينها وفقا لذلك.
ثانيا ، معايرة تركيزات المثبطات. عند معالجة الخلايا باستخدام oligomycin و FCCP ، من المهم تحديد التركيزات المثلى للمثبطات التي سيتم استخدامها. سيؤدي التركيز المنخفض جدا إلى تثبيط دون المستوى الأمثل وقياس غير صحيح لتنفس الميتوكوندريا. من الشائع أن يستخدم الناس أعلى التركيزات الموصى بها من المثبطات لضمان الحصول على تثبيط كامل. هذا هو أيضا إشكالية لأن تركيزات عالية جدا من مثبطات يمكن أن يكون لها آثار تعدد الأضداد. تمارس غير المقرنات مثل FCCP أيضا آثارها على الأغشية الأخرى غير الميتوكوندريا ، مما يؤدي إلى مجموعة من التأثيرات غير المرغوب فيها ، بما في ذلك إزالة الاستقطاب من غشاء البلازما ، وتثبيط الميتوكوندريا ، والسمية الخلوية. في هذا البروتوكول ، تتم معايرة oligomycin و FCCP في وقت واحد مع تحسين رقم الخلية. أثناء تشغيل التحسين ، تتم إضافة تركيزات متزايدة من oligomycin أو FCCP باستخدام منافذ الركيزة الأربعة المتاحة. في مخطط التعرف الضوئي على الحروف الناتج ، يمكن تحديد التركيز الأمثل بصريا على أنه التركيز الذي يصل فيه OCR إلى هضبة ثابتة. بمجرد معايرة تركيز الأوليغومايسين و FCCP ، سيتم استخدام هذه التركيزات طوال التجربة.
ثالثا ، إضافة متسلسلة مقابل إضافة فردية واحدة للمثبطات. عادة ما يتم إجراء اختبارات فرس البحر الكلاسيكية مع إضافة متسلسلة لأول oligomycin تليها إضافة FCCP. في الخلايا التائية والخلايا الحساسة الأخرى ، يمكن أن تؤدي هذه الإضافة المتسلسلة إلى تقدير كمي خاطئ للتنفس الأقصى. وفي المقابل، فإن المستويات المقاسة من القدرة التنفسية الاحتياطية ستكون أقل مما هي عليه. ومن الأمثلة الخطيرة على ذلك قيم القدرة التنفسية الاحتياطية السلبية. هذا ، بالطبع ، غير ممكن بيولوجيا وينتج عن التحسس المسبق للميتوكوندريا عن طريق علاج oligomycin. في هذا البروتوكول ، يوصى بدلا من ذلك بمعالجة الخلايا فقط إما بالأوليغوميسين أو FCCP (انظر الشكل 3C للحصول على مقارنة توضيحية).
أخيرا ، يتم استخدام هذا البروتوكول الأمثل لإظهار كيف يمكن تمييز مزارع الخلايا التائية الأولية البشرية المكملة ب IL-15 بوضوح عن الخلايا المكملة ب IL-2 بناء على تنفسها الميتوكوندري. تمتلك الخلايا المستزرعة IL-15 أقصى قدر من التنفس وقدرة تنفسية احتياطية ، وهي حالة استقلابية مرتبطة بخلايا الذاكرة التائية1,6. تتماشى هذه الملاحظات مع الدراسات السابقة التي تربط IL-15 بالمجموعات الفرعية للخلايا التائية للذاكرة8. بالإضافة إلى ذلك ، لوحظ اختلاف في التنفس القاعدي ولكن ليس في إنتاج ATP بالمقارنة مع الخلايا المستزرعة IL-2. هذا يشير إلى أن هذه الخلايا تستخدم قدرتها على تحلل السكر للامتثال لمتطلبات التمثيل الغذائي القاعدي ، وهو مسار مرتبط بخلايا أكثر تمايزا. إذا أخذنا معا ، فقد تبين أنه يمكن إنشاء نموذج للخلايا التائية للذاكرة البشرية في المختبر باستخدام مكملات IL-15. وقد سبق إثبات استخدام بيئة غنية ب IL-15 لتعزيز تطوير خلايا الذاكرة ويدعم النتائج بشكل أكبر8.
في هذه الطريقة ، تم استخدام oligomycin، FCCP، و antimycin A لتحديد خصائص OxPhos. توجد مركبات أخرى ذات تأثيرات مماثلة ، والتي من المحتمل أن تكون أكثر ملاءمة للخلايا التائية. ومن الأمثلة على ذلك استخدام BAM15 غير المقترن بدلا من FCCP لتقليل إزالة الاستقطاب من غشاء الميتوكوندريا وتجنب السمية الخلوية9. في هذه الطريقة ، لم يتم النظر في هذه المركبات ، حيث أن oligomycinو FCCP و antimycin A كانت معدلات الميتوكوندريا الموصى بها لتجارب فرس البحر على مدار العقد الماضي. لذلك يتم التعرف على استخدام هذه المركبات من قبل المراجعين وغيرهم من الباحثين الذين يعملون مع OxPhos. يتم تشجيع المستخدمين الأكثر خبرة لمحلل تدفق فرس البحر على استخدام هذه المركبات البديلة ، ولكن استخدامها خارج نطاق هذه الورقة.
مراقبة الميتوكوندريا OxPhos هي أداة أساسية لفهم وظيفة الخلايا التائية وتحسين العلاجات المناعية للسرطان. وكما ذكرنا سابقا، تبين أن الخلايا الموسعة IL-15 - ذات النمط الظاهري للذاكرة الأقل تمايزا - تعمل على تحسين الاستجابات لعلاجات الخلايا التائية CAR، لأنها كانت أقل استنفادا وكان لها نشاط مضاد للورم متزايد10. يمكن أن يكون هذا البروتوكول الأمثل أداة فعالة لدراسة جودة الخلايا التائية في كل من الإعدادات قبل السريرية والسريرية. في الختام ، ينفذ هذا البروتوكول خطوات لتحسين أعداد الخلايا وتركيزات المثبطات لاستخدام الخلايا التائية الأولية البشرية المستزرعة خارج الجسم الحي في المقايسات الأيضية.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تلقى كاسبر مولغارد وآن راهبيش منحا من Tømmermester Jørgen Holm og Hustru Elisa f. Hansens Mindelegat. كما حصل كاسبر مولغارد على منحة من Børnecancerfonden.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
References
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -. H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved