Method Article
Monitoraggio in tempo reale della respirazione mitocondriale in cellule T primarie umane graduate differenziate con citochine
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'adattamento metabolico è fondamentale per le cellule T in quanto detta differenziazione, persistenza e citotossicità. Qui viene presentato un protocollo ottimizzato per il monitoraggio della respirazione mitocondriale in cellule T primarie umane differenziate ex vivo con citochine.
Abstract
Durante l'attivazione, il metabolismo delle cellule T si adatta ai cambiamenti che influenzano il loro destino. Un aumento della fosforilazione ossidativa mitocondriale è indispensabile per l'attivazione delle cellule T e la sopravvivenza delle cellule T della memoria dipende dal rimodellamento mitocondriale. Di conseguenza, ciò influisce sull'esito clinico a lungo termine delle immunoterapie contro il cancro. I cambiamenti nella qualità delle cellule T sono spesso studiati dalla citometria a flusso utilizzando marcatori di superficie ben noti e non direttamente dal loro stato metabolico. Questo è un protocollo ottimizzato per misurare la respirazione mitocondriale in tempo reale delle cellule T umane primarie utilizzando un analizzatore di flusso extracellulare e le citochine IL-2 e IL-15, che influenzano in modo diverso il metabolismo delle cellule T. È dimostrato che lo stato metabolico delle cellule T può essere chiaramente distinto misurando il consumo di ossigeno quando si inibiscono complessi chiave nella via metabolica e che l'accuratezza di queste misurazioni dipende fortemente dalla concentrazione ottimale di inibitori e dalla strategia di iniezione degli inibitori. Questo protocollo standardizzato aiuterà a implementare la respirazione mitocondriale come standard per l'idoneità delle cellule T nel monitoraggio e nello studio delle immunoterapie contro il cancro.
Introduzione
Il corretto sviluppo e la funzione delle cellule T sono essenziali per la capacità del sistema immunitario di riconoscere e rispondere agli antigeni. La fosforilazione ossidativa mitocondriale (OxPhos) cambia in base allo stato della cellula T. Le cellule T naïve utilizzano prevalentemente OxPhos per produrre ATP, mentre le cellule T attivate subiscono una transizione metabolica in cui la glicolisi diventa dominante1. Dopo la fase effettrice, il piccolo sottoinsieme rimanente di cellule T di memoria ritorna ad uno stato metabolico dominato da OxPhos2,3. I cambiamenti di OxPhos seguono la differenziazione delle cellule T a tal punto che anche sottoinsiemi di cellule T possono essere differenziati dalle loro proprietà specifiche di OxPhos1. Al contrario, OxPhos è importante per la funzione delle cellule T e l'inibizione di OxPhos ha dimostrato di bloccare la proliferazione e la produzione di citochine delle cellule T4. Pertanto, la capacità di quantificare le proprietà delle cellule T OxPhos in modo preciso e riproducibile è uno strumento potente per chiunque lavori con le cellule T.
In questo protocollo, le proprietà delle cellule T OxPhos sono misurate utilizzando un analizzatore di flusso extracellulare. La funzione principale di questo analizzatore è quella di misurare continuamente il contenuto di ossigeno dei mezzi di crescita delle cellule da analizzare. Si presume che l'ossigeno rimosso dai mezzi di crescita sia assorbito dalle cellule. Trattando le cellule con una varietà di inibitori o modificatori di OxPhos, un calo dell'assorbimento di ossigeno è associato alla funzione inibita o modulata. Ad esempio, l'inibizione dell'ATP sintasi porterà ad un ridotto assorbimento cellulare di ossigeno che altrimenti verrebbe utilizzato per produrre ATP mediante fosforilazione ossidativa. Altre apparecchiature, tra cui l'elettrodo Clark e lo strumento Oroboros, offrono funzionalità simili e ogni strumento presenta vantaggi e carenze diversi. Una vasta gamma di tipi di cellule può essere utilizzata per studi in questi dispositivi, ma un tipo di cellula particolarmente impegnativo sono i linfociti T primari umani5. A causa delle loro piccole dimensioni, della scarsa sopravvivenza ex vivo e delle proprietà non aderenti, le cellule T primarie umane possono essere difficili da studiare.
Questo è un protocollo per studiare la respirazione mitocondriale delle cellule T primarie umane mediante un analizzatore extracellulare. Il protocollo è diviso in una corsa di ottimizzazione, in cui vengono determinate le concentrazioni ottimali di numero di cellule per pozzo, nonché la concentrazione ottimale di oligomicina e FCCP. Inoltre, viene eseguito un test, in cui vengono utilizzate le condizioni ottimizzate.
Utilizzando PBMC umane derivate dal sangue e colture di cellule T primarie ex vivo , questo protocollo dimostra l'importanza della concentrazione ottimale di inibitori e la rilevanza dell'uso separato anziché di un'iniezione sequenziale di inibitori mitocondriali quando si lavora con tipi di cellule sensibili. Infine, è dimostrato che questo test può rilevare in modo robusto sottili differenze nella respirazione mitocondriale dopo polarizzazione con citochine IL-2 e IL-15.
Protocollo
Gli esperimenti sono stati condotti secondo le linee guida dell'ospedale Herlev e della regione della capitale della Danimarca.
NOTA: questo protocollo contiene istruzioni sia per un'esecuzione di ottimizzazione che per un'esecuzione di test. È chiaramente scritto nel testo quando le istruzioni sono per un'esecuzione di ottimizzazione o un'esecuzione di analisi. Eseguire un'esecuzione di ottimizzazione prima di continuare con le esecuzioni di analisi
1. Isolamento mononucleato del sangue periferico umano (PBMC) da buffy coats
- Isolamento PBMC
- Raccogli i cappotti buffy dall'istituzione appropriata (raccolti in sacche di raccolta del sangue). I cappotti Buffy provengono da donatori sani. Escludere i donatori che hanno recentemente utilizzato antidolorifici.
- Spruzzare la sacca per la raccolta del sangue contenente il buffy coat con il 70% di etanolo prima di trasferirla in un armadio a flusso laminare. Utilizzare sempre tecniche sterili e hardware sterile per tutti i passaggi
NOTA: Assicurarsi che siano ottenute le autorizzazioni corrette per la manipolazione dei campioni di sangue umano. - Trasferire il sangue in un tubo centrifugo sterile da 50 ml.
- Diluire il sangue di almeno il 10% con RPMI 1640 non integrato.
- Versare 20 mL del mezzo gradiente di densità preferito in un tubo centrifuga da 50 mL.
- Aspirare 25 ml di sangue diluito in una pipetta sierologica. Impostare il controller della pipetta elettrica alla velocità più bassa.
- Tenere il tubo con gradiente di densità medio ad un angolo di 45° e appoggiare la punta della pipetta sierologica sul lato interno del tubo centrifuga da 50 mL. Rilasciare lentamente 25 ml di sangue diluito dalla pipetta sierologica.
- Assicurarsi che il sangue diluito e il mezzo del gradiente di densità non si mescolino. Assicurarsi che il sangue diluito riposi sopra il mezzo del gradiente di densità.
- Ripetere questa operazione con i successivi tubi medi a gradiente di densità fino a quando tutto il sangue diluito non viene elaborato.
- Spostare con attenzione i tubi in una centrifuga e centrifuga a 1000 x g per 30 minuti in un rotore swing-out a temperatura ambiente (RT). Assicurarsi che l'accelerazione e la rottura siano al minimo.
NOTA: Dopo la centrifugazione, dovrebbero essere visibili vari strati. Lo strato superiore, chiaro da rosa ad arancione, è costituito dal plasma sanguigno e dalle piastrine. Lo strato bianco medio è costituito dai PBMC seguiti da uno strato chiaro costituito dal mezzo gradiente di densità e infine da uno strato rosso scuro nella parte inferiore con globuli rossi. - Utilizzando una pipetta Pasteur sterile, aspirare accuratamente lo strato bianco contenente PBMC in un tubo centrifugo da 50 ml.
NOTA: assicurarsi di non trasferire il mezzo del gradiente di densità in quanto ciò influirà sulla purificazione a valle. L'eccesso di plasma non influenzerà i risultati. - Raggruppare tutti i PBMC raccolti nello stesso tubo centrifugo da 50 mL e rabboccare fino a 50 mL con RPMI 1640.
- Centrifugare le celle a 500 x g per 5 minuti a RT (eseguire le restanti fasi di centrifugazione a questa impostazione se non diversamente specificato).
- Aspirare il surnatante e risospendere le celle in 30 ml di RPMI 1640. Contare le cellule utilizzando un emocitometro o un contatore cellulare automatizzato.
- Per la crioconservazione, sospendere un massimo di 30 milioni di cellule per 1 mL di terreno di congelamento.
- Trasferire le cellule su criotubi e congelare fino a -80 °C utilizzando un contenitore di congelamento a velocità controllata (-1 °C al minuto). Per la conservazione a lungo termine, spostare i PBMC a -140 °C.
NOTA: limitare il tempo in cui le celle si trovano nel mezzo di congelamento in CORRISPONDENZA DI RT. A RT, DMSO è altamente tossico per le cellule.
2. Coltivazione di linfociti T primari umani attivati
- Scongelamento delle cellule (Giorno 1)
- Preriscaldare 10 mL di RPMI 1640 per campione a circa 37 °C.
- Prendere il numero desiderato di fiale cellulari e conservarle temporaneamente su ghiaccio secco.
- Risospendare le celle congelate in 10 ml di RPMI 1640 preriscaldato.
- Centrifugare le celle per 5 min a 500 x g a RT.
- Scartare il surnatante e lavare nuovamente le celle riesempendo in 10 ml di RPMI 1640 e centrifugando come descritto al punto 2.1.4.
- Scartare il surnatante e risospese le cellule a 2 x 106 cellule per mL di X-VIVO 15 medio + 5% siero umano (di seguito: mezzo di cellule T).
- Piastra 2 mL delle cellule per pozzetto in una piastra di coltura cellulare a 24 pozzetti e incubare durante la notte a 37 °C e 5% di CO2.
- Attivazione delle cellule (Giorno 0)
- Lavare le perle CD3/CD28 trasferendo 12,5 μL di perline per 1 milione di cellule a un tubo microcentrifuga. Aggiungere 12,5 μL di PBS per 12,5 μL di perline.
NOTA: È importante ruotare il flaconcino di perline prima dell'uso. - Posizionare il tubo della microcentrifuga su un magnete adatto per 1 minuto.
- Scartare il tampone e risospendere le perline nel volume originale del mezzo delle cellule T (12,5 μL di mezzo cellulare T per 12,5 μL del volume originale di perline).
- Aggiungere 12,5 μL di perline per milione di cellule corrispondenti ad un rapporto di 1:2 (perline: cellule).
- Dividere le cellule in due condizioni con circa 5 milioni di cellule in ciascuna.
- Aggiungere il volume corretto di citochine alle condizioni menzionate nella Tabella 1.
- Incubare le cellule per 3 giorni a 37 °C e 5% di CO2.
- Lavare le perle CD3/CD28 trasferendo 12,5 μL di perline per 1 milione di cellule a un tubo microcentrifuga. Aggiungere 12,5 μL di PBS per 12,5 μL di perline.
- Coltivazione di cellule (Giorno 3 e 5)
- Risospesce le celle e dividetele trasferendo metà del volume da ciascun pozzo in un nuovo pozzo. Aggiungere lo stesso volume di mezzo cellulare T fresco a ciascun pozzetto.
- Aggiungere nuove citochine a ciascuna condizione come menzionato nella Tabella 1.
3. Saggio del flusso extracellulare
- Idratazione della cartuccia del sensore (Giorno 0)
- Disimballare la cartuccia del sensore e rimuovere con cura la cartuccia del sensore dalla piastra dell'utilità.
- Posizionare la cartuccia del sensore capovolta, facendo attenzione a non toccare le sonde del sensore.
- Riempire la piastra di utilità con 200 μL di calibrante (vedere Tabella dei materiali per i dettagli) e sostituire con attenzione la cartuccia del sensore nella piastra di utilità.
- In alternativa, per eliminare qualsiasi formazione di bolle, incubare la cartuccia del sensore in acqua ultrapura sterile durante la notte e sostituirla con un calibrante preriscaldato la mattina del test.
- Incubare la piastra della cartuccia del sensore a 37 °C in un armadio di riscaldamento non regolato da CO2 durante la notte.
NOTA: è molto importante utilizzare un armadio non regolato da CO2 poiché l'eccesso di CO2 influenzerà la cartuccia del sensore. Assicurarsi che l'analizzatore di flusso (vedere Tabella dei materiali per i dettagli) sia acceso almeno un giorno prima dell'uso per consentirgli di riscaldarsi fino a 37 °C.
- Rivestimento cellulare e preparazione di inibitori mitocondriali (Giorno 1)
- Preparare una soluzione di rivestimento (vedere Tabella dei materiali) contenente NaHCO3 (pH 8,3, 0,1 M, 1128 μL), Cell-Tak (1 mg/mL, 48 μL) e NaOH (1,0 M, 24 μL).
NOTA: La soluzione di rivestimento deve essere sempre fatta e utilizzata fresca. - Aprire una piastra di coltura cellulare XF fresca e aggiungere 12 μL della soluzione di rivestimento appena preparata a ciascun pozzetto. Garantire una distribuzione uniforme della soluzione di rivestimento sul fondo di tutti i pozzetti.
- Incubare la piastra a RT con il coperchio acceso per 30 minuti ed eliminare la soluzione liquida rimanente da tutti i pozzetti.
- Lavare la piastra con 200 μL di acqua sterile ed eliminare il liquido.
- Lavare la piastra con 200 μL di PBS sterile di grado di coltura cellulare ed eliminare il liquido.
- Lasciare il piatto a RT e lasciarlo asciugare per almeno 30 minuti.
- Preparare una soluzione di rivestimento (vedere Tabella dei materiali) contenente NaHCO3 (pH 8,3, 0,1 M, 1128 μL), Cell-Tak (1 mg/mL, 48 μL) e NaOH (1,0 M, 24 μL).
- Cellule T della piastra nella piastra di coltura cellulare XF (Giorno 1)
- Preparare 50 mL di mezzi di saggio mescolando i mezzi XF RPMI adatti con glucosio, piruvato e glutammina secondo la configurazione sperimentale (livelli raccomandati: 4 mM di glucosio, 1 mM di piruvato e 3 mM di glutammina).
- Riscaldare a 37 °C in un incubatore non regolato a CO2 e impostare il pH a 7,4. Assicurarsi che vi siano mezzi sufficienti per la placcatura delle cellule e la preparazione di oligomicina e soluzioni FCCP (paragrafo 3.4).
- Progettare un layout di piastra con un numero crescente di celle per pozzetto per l'esecuzione dell'ottimizzazione o l'esecuzione del test. Utilizzare quattro pozzi 4, riempiti con supporti e iniettati con supporti, per le misurazioni di fondo.
- Contare le cellule T preparate nel paragrafo 2.3 (con il metodo preferito) e pipettare il numero corretto di celle per ciascun pozzetto della piastra di coltura cellulare XF rivestita con la soluzione di rivestimento, secondo il layout della piastra.
NOTA: Il volume finale di ciascun pozzetto può variare ma deve essere sufficiente a coprire il fondo del pozzo. - Centrifugare la piastra di coltura cellulare XF a 1000 x g a RT per 10 minuti per far aderire la cellula T alla superficie rivestita.
- Lavare le cellule con 200 μL di mezzi di analisi, scartare il fluido e aggiungere 180 μL di mezzi di analisi.
NOTA: ispezionare visivamente i pozzetti utilizzando un microscopio a luce invertita per assicurarsi che le cellule siano attaccate e distribuite uniformemente sulla superficie del pozzo. - Incubare la piastra di coltura cellulare XF nell'armadio di riscaldamento non regolato da CO2 per 30 minuti per garantire che la temperatura della piastra sia di 37 °C.
- Cartuccia sensore di carico con oligomicina e FCCP per l'ottimizzazione (Giorno 1)
NOTA: Se le concentrazioni di oligomicina e FCCP sono già state ottimizzate, continuare al paragrafo 3.5.- Preparare soluzioni di lavoro di oligomicina e FCCP in mezzi di saggio (preparati nella fase 3.3.1) come descritto nei passaggi 3.4.2 e 3.4.3.
- Soluzioni di lavoro di oligomicina: preparare una soluzione da 5 μM (2 mL di mezzi di saggio + 10 μL di 1 mM di oligomicina) e una soluzione da 3 μM (8 mL di mezzi di saggio + 24 μL di 1 mM di stock di oligomicina).
- Soluzione di lavoro FCCP: Preparare una soluzione da 2 μM (2 mL di mezzo di saggio + 13,2 μL di 300 μM FCCP di stock) e una soluzione da 1,3 μM (8 ml di mezzi di saggio + 34,6 μL di 300 μM FCCP stock)
- Caricare le soluzioni di lavoro di oligomicina o FCCP nelle porte di iniezione della cartuccia del sensore (Tabella 2).
NOTA. È importante che nessuna porta di iniezione contenga solo aria. Se, per qualsiasi motivo, non vengono utilizzate tutte le porte di iniezione, le porte vuote devono essere riempite con supporti di analisi. - Battere delicatamente i bordi della piastra sul tavolo per rimuovere potenziali bolle nelle porte di iniezione.
- Cartuccia del sensore di carico con oligomicina, FCCP e antimicina A per il test (Giorno 1)
- Preparare soluzioni di oligomicina, FCCP in mezzi di analisi (preparati nella fase 3.3.1) in base alle concentrazioni ottimali identificate in una precedente esecuzione di ottimizzazione. Inoltre, preparare una soluzione di antimicina A da 20 μM.
- Caricare 20 μL di oligomicina o FCCP nella porta di iniezione A della cartuccia del sensore in base al layout della piastra. Aggiungere 22 μL di 20 μM di antimicina A alla porta di iniezione B di tutti i pozzetti. La concentrazione risultante di antimicina A una volta iniettata nel pozzo sarà di 2 μM.
- Impostazione del protocollo sperimentale nel software di analisi Flux.
- Assegnare i gruppi e la mappa della piastra per ogni condizione per layout della piastra.
- Progettare il protocollo in base alla strategia di iniezione (Tabella 3 e Figura 1).
NOTA: durante l'esecuzione di Assay, l'iniezione C e D può essere omessa. - Salvare la configurazione del test, compilare le informazioni necessarie per l'inclusione per il test e premere Start.
- L'analizzatore di flusso richiederà la cartuccia del sensore preparata nel paragrafo 3.5. Rimuovere il coperchio e inserire la cartuccia del sensore come indicato dall'analizzatore.
NOTA: il test calibra e controlla i sensori indicati da segni di spunta. Dopo una calibrazione riuscita, l'analizzatore richiederà la piastra di coltura cellulare XF preparata nel paragrafo 3.3. La piastra di utilità viene espulsa dall'analizzatore e sostituita con la piastra di coltura cellulare XF per avviare il test.
Risultati
Una corretta determinazione delle proprietà di OxPhos è uno strumento indispensabile quando si studiano le cellule T. Tuttavia, se le condizioni del test non sono state ottimizzate, vi è un rischio sostanziale di risultati fuorvianti o errati. In questo protocollo, c'è una forte attenzione all'ottimizzazione del numero di cellule per pozzo e alle concentrazioni di oligomicina e FCCP da utilizzare. Nella configurazione descritta, oligomicina e FCCP vengono aggiunti in modo incrementale allo stesso pozzo, aumentando la concentrazione dei modulatori mitocondriali. La concentrazione ottimale di oligomicina e FCCP può essere determinata dalle curve OCR risultanti dei pozzi come la concentrazione in cui viene raggiunto un plateau.
Nella corsa rappresentativa, l'oligomicina viene aggiunta in una concentrazione crescente e inibisce l'ATP sintasi (Complesso V della catena di trasporto degli elettroni), con conseguente diminuzione della respirazione mitocondriale. Un plateau in OCR viene raggiunto dopo che la concentrazione accumulativa dei pozzi ha raggiunto 1 μM. Da questa concentrazione e dall'aumento delle concentrazioni l'OCR non è stato ulteriormente ridotto (Figura 1A). Per i pozzetti trattati con una concentrazione incrementale del disaccoppiatore FCCP, i livelli di OCR sono aumentati come previsto fino a raggiungere un plateau dopo l'aggiunta di 0,2 μM di FCCP, indicando che a questa concentrazione è stato ottenuto il disaccoppiamento completo (Figura 1B). Un'ottimizzazione delle cellule placcate per pozzetto è importante per un saggio corretto e riproducibile. Se il numero di cellule utilizzato è troppo basso, il livello di ossigeno rimosso dal mezzo di analisi dalle cellule è troppo basso per essere misurato correttamente dall'analizzatore. D'altra parte, se il numero di cellule per pozzo è troppo alto, il consumo di ossigeno delle cellule può diventare così alto che il sistema non può reintegrare i livelli di ossigeno del mezzo di saggio dopo ogni misurazione, portando a un ambiente sempre più ipossico e a una caratterizzazione errata di OxPhos.
Nella corsa rappresentativa, le cellule sono state seminate ad una densità di 200.000 e 400.000 cellule per pozzetto (Figura 2A-C). Per una corsa con 200.000 celle, l'OCR iniziale è circa la metà di una corsa con 400.000 celle per pozzetto. Per il trattamento FCCP, l'OCR massimo è 61,6 pmol/min (200.000 cellule) contro 190,4 pmol/min (400.000 cellule). Dopo il trattamento con oligomicina, l'OCR in esecuzione con 200.000 cellule collassa in OCR a una cifra (6,4 pmol / min). Questo è inferiore all'OCR della corsa, con 400.000 cellule per pozzo trattate con oligomicina (25,8 pmol / min, rispettivamente).
Pertanto, dall'esecuzione dell'ottimizzazione, è chiaro che è stato richiesto un numero di celle di 400.000 cellule per pozzo per test futuri, utilizzando 1 μM di oligomicina e 0,2 μM FCCP. Nella configurazione classica raccomandata dal produttore, l'oligomicina e la FCCP vengono aggiunte in sequenza con l'aggiunta finale di antimicina A. Per le cellule T, questo non è l'approccio ottimale in quanto il trattamento con oligomicina può essere visto per limitare il disaccoppiamento dopo il trattamento FCCP (Figura 3A, B). In questo metodo presentato, si raccomanda di eseguire ogni condizione in pozzetti duplicati e trattare un pozzo con oligomicina e l'altro con FCCP, con un'aggiunta finale di antimicina A per entrambi i pozzetti. Utilizzando questo approccio, il trattamento con oligomicina non influisce sull'OCR dopo il trattamento con FCCP. Questo approccio consente di determinare le stesse proprietà mitocondriali del setup classico, in cui i farmaci vengono aggiunti in sequenza (Figura 3C)
Infine, è stato studiato se gli effetti delle citochine IL-2 e IL-15 potessero essere differenziati sul metabolismo delle cellule T primarie umane coltivate ex vivo. In effetti, le cellule coltivate con IL-15 possedevano una respirazione massima più elevata e una capacità respiratoria di riserva, come è stato dimostrato in precedenza1 (Figura 4A-E). La respirazione basale e la produzione di ATP non sono state influenzate. Nel loro insieme, questi dati mostrano che la respirazione mitocondriale di cellule T primarie umane coltivate ex vivo può essere analizzata con successo utilizzando l'analizzatore di flusso extracellulare.

Figura 1: Tasso di consumo di ossigeno (OCR) misurato durante la titolazione degli inibitori oligomicina e FCCP in cellule T primarie umane coltivate ex vivo . (A) OCR durante la titolazione graduale di oligomicina da 0-1,25 μM concentrazione finale. (B) OCR durante la titolazione graduale di FCCP da 0-0,5 μM di concentrazione finale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: L'influenza della concentrazione cellulare sulle misurazioni OCR in cellule T primarie umane coltivate ex vivo . Misurazioni OCR di cellule T primarie umane in coltura ex vivo con 200.000 o 400.000 cellule per pozzetto dopo iniezione di (A) FCCP o (B) Oligomicina. (C) Respirazione basale, respirazione massima, produzione di ATP e capacità respiratoria di riserva delle cellule T primarie umane utilizzando 200.000 o 400.000 cellule per pozzetto. Rappresentativo di tre esperimenti indipendenti. Fare clic qui per visualizzare una versione più grande di questa figura.
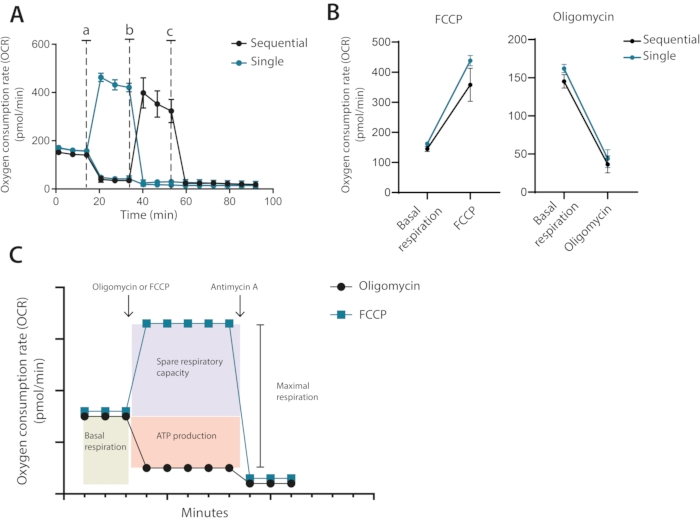
Figura 3: Iniezione singola o sequenziale di modulatori mitocondriali. (A) Misurazioni OCR rappresentative durante il basale e dopo l'iniezione di oligomicina e FCCP (a,b), o antimicina A (c) come singole iniezioni o come iniezioni sequenziali. (B) Valori di OCR prima dell'iniezione (respirazione basale) o dopo iniezione di oligomicina o FCCP come iniezioni singole o iniezioni sequenziali. (C) Rappresentazione schematica della strategia di iniezione e misurazione. Rappresentante di un esperimento indipendente Fare clic qui per visualizzare una versione più grande di questa figura.
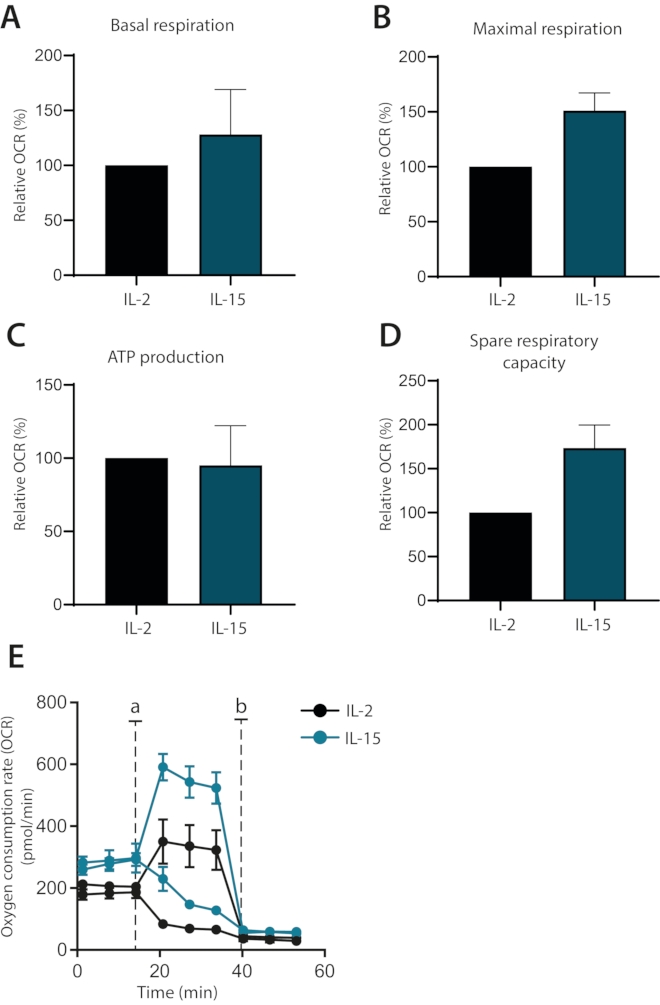
Figura 4: Differenze nella respirazione mitocondriale nelle cellule T primarie umane differenziate con citochine. (A-D) Respirazione basale, respirazione massima, produzione di ATP e capacità respiratoria di riserva delle cellule T primarie umane coltivate con IL-2 o IL-15 per sette giorni (n = 3). (E) Trame rappresentative di (A-D), con iniezioni di oligomicina o FCCP (a) o antimicina A (b). Fare clic qui per visualizzare una versione più grande di questa figura.
| Citochine | [Stock] | Fattore di diluizione | [Finale] | |
| Condizione 1 | IL-2 · | 3 x 106 U/mL | 30,000 | 100 U/mL |
| Condizione 2 | IL-15 · | 2 x 105 U/mL | 2,000 | 100 U/mL |
Tabella 1: Preparazione di colture di citochine utilizzate per guidare i cambiamenti metabolici nelle cellule T.
| Oligomicina | FCCP · | |||||
| Sol di lavoro. | Finale conc. | Vol. | Sol di lavoro. | Finale conc. | Vol. | |
| Porta A | 5,0 μM | 0,50 μM | 20 μL | 2,0 μM | 0,2 μM | 20 μL |
| Porta B | 3,0 μM | 0,75 μM | 22 μL | 1,30 μM | 0,3 μM | 22 μL |
| Porta C | 3,0 μM | 1,0 μM | 24 μL | 1,30 μM | 0,4 μM | 24 μL |
| Porta D | 3,0 μM | 1,25 μM | 27 μL | 1,30 μM | 0,5 μM | 27 μL |
Tabella 2: Strategia per la preparazione di inibitori e modulatori mitocondriali. Concentrazioni di preparazione, concentrazioni di lavoro e strategie di iniezione per una corsa di ottimizzazione.
| Azione | Dettagli | Dettagli di misurazione |
| Riferimento | Misurazioni di base | 3 misurazioni |
| Iniezione | Iniezione della porta A | 3 misurazioni |
| Iniezione | Iniezione della porta B | 3 misurazioni |
| Iniezione | Iniezione della porta C | 3 misurazioni |
| Iniezione | Iniezione della porta D | 3 misurazioni |
| Misura | Misure aggiuntive | Opzionale |
Tabella 3: Progettazione del protocollo di una corsa di ottimizzazione con titolazione di inibitori mitocondriali e modulatori utilizzando 4 iniezioni con 3 misurazioni in ciascuna.
| Elemento di fosforilazione ossidativa mitocondriale | Spiegazione | ||
| Respirazione basale | La respirazione basale è una misura di base del tasso di ossigeno consumato dalle cellule T stimolate prima dell'aggiunta di inibitori mitocondriali. È una misura del consumo di ossigeno utilizzato per soddisfare la domanda di ATP cellulare derivante dalla perdita di protoni mitocondriali. Come tale, fornisce una panoramica della corrente protonica generata per fornire la sintesi di ATP e la perdita di protoni. Tuttavia, è anche una misura che può essere modificata a seconda dei substrati presenti nei mezzi di crescita, della stimolazione delle cellule prima del test e di altri fattori estrinseci. La respirazione basale è quindi una misura utilizzata per confrontare due o più diversi tipi di cellule e/o diversi trattamenti che si ritiene influenzino lo stato metabolico cellulare delle cellule. La respirazione basale viene calcolata come differenza nell'OCR prima di aggiungere qualsiasi modulatore mitocondriale (oligomicina o FCCP) e dopo l'aggiunta di antimicina A | ||
| Respirazione massima | Questa misura è il tasso massimo di ossigeno che può essere consumato per la fosforilazione ossidativa. Il tasso di ossigeno consumato dalla fosforilazione ossidativa è determinato sia dalla capacità della catena di trasporto degli elettroni di pompare protoni attraverso la membrana mitocondriale interna, sia dalla capacità dell'ATP sintasi di utilizzare il gradiente protonico per fosforilare ATP da ADP. La velocità dell'ATP sintasi è limitata dal substrato ADP libero e quindi dallo stato energetico generale della cellula. Quando si trattano le cellule con il disaccoppiatore mitocondriale FCCP, i protoni possono liberamente attraversare la membrana mitocondriale interna. Questo imita una situazione in cui le cellule sperimentano una domanda di energia insaturabile, e la respirazione massima è quindi una misura del tasso massimo di ossigeno che può essere consumato dalla catena di trasporto degli elettroni. La respirazione massima è calcolata come la differenza nell'OCR delle cellule trattate con FCCP e delle cellule trattate con antimicina A | ||
| Fatturato ATP | La respirazione legata all'ATP viene misurata come la differenza nell'OCR dopo l'inibizione dell'ATP sintasi usando l'oligomicina. L'ossigeno che altrimenti verrebbe consumato per la fosforilazione dell'ADP mediante fosforilazione ossidativa non verrà più utilizzato poiché questo processo viene arrestato. La respirazione legata all'ATP è quindi relativa all'ATP prodotto dalla fosforilazione ossidativa. I cambiamenti nella respirazione legata all'AT sono una risposta dei mitocondri a una domanda alterata di ATP della cellula La respirazione legata all'ATP viene calcolata come differenza nell'OCR prima di aggiungere qualsiasi modulatore mitocondriale (oligomicina o FCCP) e dopo l'aggiunta di oligomicina | ||
| Capacità respiratoria di riserva | La capacità respiratoria di riserva è una misura di una capacità teorica extra di produrre ATP come risposta a una maggiore domanda energetica. È definito come la differenza tra la respirazione basale e la respirazione massima. I cambiamenti nella capacità respiratoria di riserva possono essere un indicatore della forma fisica e della flessibilità mitocondriale e cellulare. | ||
Tabella 4: Spiegazione dei vari componenti della respirazione mitocondriale studiati utilizzando l'analizzatore di flusso
Discussione
La quantificazione dettagliata e corretta della fosforilazione ossidativa è uno strumento indispensabile quando si descrivono gli stati energetici delle cellule T. Lo stato di idoneità mitocondriale può essere direttamente correlato al potenziale di attivazione delle cellule T, alla sopravvivenza e alla differenziazione1,5. Con questo protocollo è possibile determinare le varie proprietà della fosforilazione ossidativa (vedi Tabella 4 per una spiegazione dettagliata). La quantificazione precisa di queste proprietà della fosforilazione ossidativa offre una visione dettagliata degli stati energetici delle cellule T. Tuttavia, per ottenere risultati affidabili, è necessario prestare molta attenzione durante l'impostazione dell'esperimento.
In questo protocollo, i tre seguenti passaggi di ottimizzazione sono consigliati: in primo luogo, l'ottimizzazione dei numeri di cella. La capacità di un analizzatore di flusso di misurare correttamente le concentrazioni di ossigeno segue una curva sigmoidea; le variazioni di ossigeno troppo piccole o troppo grandi non rientreranno nell'intervallo di funzionamento della macchina e quindi non saranno misurate correttamente. Ciò richiede un'ottimizzazione dei numeri di cella da utilizzare durante l'intero esperimento. Se vengono analizzate troppo poche cellule, i cambiamenti nel consumo di ossigeno sono troppo bassi per essere misurati correttamente. Se troppe cellule, c'è il rischio di esaurimento di ossigeno nel mezzo di analisi. Si consiglia quindi una corsa iniziale, con numeri di cella che vanno da 100.000 a 400.000 celle per pozzetto. Quando si traccia il numero di cellule rispetto alla respirazione basale, il conteggio ottimale delle cellule sarà nell'intervallo lineare della curva. Quando si ottimizza la configurazione, si prega di essere consapevoli del fatto che può esserci una differenza esponenziale nell'attività mitocondriale tra cellule a riposo e attivate, e quindi deve essere ottimizzata di conseguenza.
In secondo luogo, la titolazione delle concentrazioni di inibitori. Quando si trattano le cellule con oligomicina e FCCP, è importante identificare le concentrazioni ottimali degli inibitori da utilizzare. Una concentrazione troppo bassa si tradurrà in un'inibizione non ottimale e in una misurazione errata della respirazione mitocondriale. È comune che le persone utilizzino le più alte concentrazioni raccomandate degli inibitori per garantire che si ottenga una piena inibizione. Questo è anche problematico in quanto concentrazioni troppo elevate degli inibitori possono avere effetti pleiotropici. I disaccoppiatori come FCCP esercitano anche i loro effetti su membrane diverse dal mitocondriale, con conseguente serie di effetti indesiderati, tra cui la depolarizzazione della membrana plasmatica, l'inibizione mitocondriale e la citotossicità. In questo protocollo, la titolazione di oligomicina e FCCP viene eseguita contemporaneamente all'ottimizzazione del numero di cellule. Durante un'esecuzione di ottimizzazione, vengono aggiunte concentrazioni crescenti di oligomicina o FCCP utilizzando le quattro porte del substrato disponibili. Nel diagramma OCR risultante, la concentrazione ottimale può essere determinata visivamente come la concentrazione alla quale l'OCR raggiunge un plateau costante. Una volta che la concentrazione di oligomicina e FCCP è stata titolata, queste concentrazioni devono essere utilizzate durante l'esperimento.
In terzo luogo, l'aggiunta sequenziale rispetto a quella individuale singola di inibitori. I saggi classici del cavalluccio marino sono tipicamente condotti con l'aggiunta sequenziale della prima oligomicina seguita dall'aggiunta di FCCP. Nelle cellule T e in altre cellule sensibili, tale aggiunta sequenziale può comportare una quantificazione errata della respirazione massimale. A loro volta, i livelli misurati di capacità respiratoria di riserva riporteranno inferiori a quelli che sono. Esempi gravi di questo includono valori di capacità respiratoria di riserva che sono negativi. Questo, naturalmente, non è biologicamente possibile ed è causato da una pre-sensibilizzazione dei mitocondri mediante trattamento con oligomicina. In questo protocollo, si raccomanda invece che le cellule siano trattate solo con oligomicina o FCCP (vedere la Figura 3C per il confronto illustrativo).
Infine, questo protocollo ottimizzato viene utilizzato per mostrare come le colture di cellule T primarie umane integrate con IL-15 possono essere chiaramente distinte dalle cellule integrate con IL-2 in base alla loro respirazione mitocondriale. Le cellule coltivate con IL-15 possiedono una respirazione massima più elevata e una capacità respiratoria di riserva, uno stato metabolico legato alle cellule T della memoria1,6. Queste osservazioni sono in linea con studi precedenti che collegano IL-15 ai sottoinsiemi di cellule T di memoria8. Inoltre, è stata osservata una differenza nella respirazione basale ma non nella produzione di ATP rispetto alle cellule coltivate con IL-2. Ciò indica che queste cellule usano la loro capacità glicolitica per soddisfare le richieste metaboliche basali, una via associata a cellule più differenziate. Nel complesso, è dimostrato che un modello di cellule T di memoria umana può essere stabilito in vitro utilizzando la supplementazione di IL-15. L'utilizzo di un ambiente ricco di IL-15 per promuovere lo sviluppo delle cellule di memoria è stato precedentemente dimostrato e supporta ulteriormente i risultati8.
In questo metodo, oligomicina, FCCP e antimicina A sono stati utilizzati per quantificare le proprietà di OxPhos. Esistono altri composti con effetti simili, che potenzialmente sarebbero più adatti per le cellule T. Un esempio potrebbe essere quello di utilizzare il disaccoppiatore BAM15 invece di FCCP per ridurre la depolarizzazione della membrana mitocondriale ed evitare la citotossicità9. In questo metodo, questi composti non sono stati considerati, poiché oligomicina, FCCP e antimicina A sono stati i modulatori mitocondriali raccomandati per gli esperimenti seahorse nell'ultimo decennio. L'uso di questi composti è quindi riconosciuto dai revisori e da altri ricercatori che lavorano con OxPhos. Gli utenti più esperti dell'analizzatore di flusso di cavallucci marini sono incoraggiati a utilizzare questi composti alternativi, ma l'uso di questi è al di fuori dello scopo di questo documento.
Il monitoraggio dell'OxPhos mitocondriale è uno strumento essenziale per comprendere la funzione delle cellule T e migliorare le immunoterapie del cancro. Come accennato in precedenza, le cellule espanse IL-15 - con un fenotipo di memoria meno differenziato - hanno dimostrato di migliorare le risposte alle terapie con cellule T CAR, in quanto erano meno esauste e avevano una maggiore attività antitumorale10. Questo protocollo ottimizzato potrebbe essere uno strumento efficace per studiare la qualità delle cellule T sia in ambito preclinico che clinico. In conclusione, questo protocollo implementa passaggi per l'ottimizzazione del numero di cellule e delle concentrazioni di inibitori per l'uso di cellule T primarie umane coltivate ex vivo in saggi metabolici.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Kasper Mølgaard e Anne Rahbech hanno ricevuto sovvenzioni da Tømmermester Jørgen Holm og Hustru Elisa f. Hansens Mindelegat. Kasper Mølgaard ha anche ricevuto una sovvenzione da Børnecancerfonden.
Materiali
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
Riferimenti
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -. H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon