Method Article
Surveillance en temps réel de la respiration mitochondriale dans les cellules T primaires humaines différenciées par cytokines
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’adaptation métabolique est fondamentale pour les lymphocytes T car elle dicte la différenciation, la persistance et la cytotoxicité. Ici, un protocole optimisé pour surveiller la respiration mitochondriale dans les cellules T primaires humaines différenciées par cytokines ex vivo est présenté.
Résumé
Lors de l’activation, le métabolisme des lymphocytes T s’adapte aux changements qui ont un impact sur leur devenir. Une augmentation de la phosphorylation oxydative mitochondriale est indispensable pour l’activation des lymphocytes T, et la survie des lymphocytes T mémoire dépend du remodelage mitochondrial. Par conséquent, cela affecte le résultat clinique à long terme des immunothérapies anticancéreuses. Les changements dans la qualité des lymphocytes T sont souvent étudiés par cytométrie en flux à l’aide de marqueurs de surface bien connus et non directement par leur état métabolique. Il s’agit d’un protocole optimisé pour mesurer la respiration mitochondriale en temps réel des cellules T humaines primaires à l’aide d’un analyseur de flux extracellulaire et des cytokines IL-2 et IL-15, qui affectent différemment le métabolisme des cellules T. Il est démontré que l’état métabolique des lymphocytes T peut être clairement distingué en mesurant la consommation d’oxygène lors de l’inhibition de complexes clés dans la voie métabolique et que la précision de ces mesures dépend fortement de la concentration optimale d’inhibiteurs et de la stratégie d’injection d’inhibiteurs. Ce protocole normalisé aidera à mettre en œuvre la respiration mitochondriale en tant que norme pour l’aptitude des lymphocytes T dans la surveillance et l’étude des immunothérapies contre le cancer.
Introduction
Le développement et la fonction corrects des lymphocytes T sont essentiels à la capacité du système immunitaire à reconnaître les antigènes et à y répondre. La phosphorylation oxydative mitochondriale (OxPhos) change en fonction de l’état de la cellule T. Les lymphocytes T naïfs utilisent principalement OxPhos pour produire de l’ATP, tandis que les lymphocytes T activés subissent une transition métabolique où la glycolyse devient dominante1. Après la phase effectrice, le petit sous-ensemble restant de lymphocytes T mémoire revient à un état métabolique dominé par OxPhos2,3. Les changements d’OxPhos suivent la différenciation des lymphocytes T à un tel degré que même des sous-ensembles de lymphocytes T peuvent être différenciés par leurs propriétés spécifiques d’OxPhos1. Inversement, OxPhos est important pour le fonctionnement des lymphocytes T, et il a été démontré que l’inhibition d’OxPhos bloque la prolifération et la production de cytokines des lymphocytes T4. Par conséquent, la capacité de quantifier les propriétés des lymphocytes T OxPhos de manière précise et reproductible est un outil puissant pour quiconque travaille avec des lymphocytes T.
Dans ce protocole, les propriétés des lymphocytes T OxPhos sont mesurées à l’aide d’un analyseur de flux extracellulaire. La fonction principale de cet analyseur est de mesurer en continu la teneur en oxygène des milieux de croissance des cellules à analyser. L’oxygène retiré du milieu de croissance est supposé être absorbé par les cellules. En traitant les cellules avec une variété d’inhibiteurs ou de modificateurs d’OxPhos, une baisse de l’absorption d’oxygène est associée à la fonction inhibée ou modulée. Par exemple, l’inhibition de l’ATP synthase entraînera une réduction de l’absorption cellulaire de l’oxygène qui serait autrement utilisé pour produire de l’ATP par phosphorylation oxydative. D’autres équipements, y compris l’électrode Clark et l’instrument Oroboros, offrent des fonctionnalités similaires, et chaque instrument présente des avantages et des inconvénients différents. Un large éventail de types de cellules peut être utilisé pour des études dans ces dispositifs, mais un type de cellule particulièrement difficile est les lymphocytes T primaires humains5. En raison de leur petite taille, de leur faible survie ex vivo et de leurs propriétés non adhérentes, les cellules T primaires humaines peuvent être difficiles à étudier.
Il s’agit d’un protocole pour étudier la respiration mitochondriale des cellules T primaires humaines par un analyseur extracellulaire. Le protocole est divisé en une série d’optimisation, où les concentrations optimales du nombre de cellules par puits, ainsi que la concentration optimale d’olligomycine et de FCCP, sont déterminées. En outre, une exécution d’essai, où les conditions optimisées sont utilisées.
En utilisant des PBMC humains d’origine sanguine et des cultures de lymphocytes T primaires ex vivo , ce protocole démontre l’importance d’une concentration optimale d’inhibiteurs et la pertinence d’utiliser une injection séparée au lieu d’une injection séquentielle d’inhibiteurs mitochondriaux lorsque vous travaillez avec des types de cellules sensibles. Enfin, il est démontré que ce test peut détecter de manière robuste des différences subtiles dans la respiration mitochondriale lors de la polarisation avec les cytokines IL-2 et IL-15.
Protocole
Les expériences ont été menées selon les directives de l’hôpital Herlev et de la région de la capitale du Danemark.
Remarque : Ce protocole contient des instructions pour une exécution d’optimisation et une exécution de tests. Il est clairement écrit dans le texte lorsque les instructions concernent une exécution d’optimisation ou une exécution de test. Exécuter une exécution d’optimisation avant de poursuivre les exécutions d’assay
1. Isolement mononucléaire du sang périphérique humain (PBMC) des pelages bouffants
- Isolation PBMC
- Prélever les manteaux bouffants de l’établissement approprié (recueillis dans des poches de collecte de sang). Les manteaux Buffy proviennent de donneurs sains. Exclure les donneurs qui ont récemment utilisé des analgésiques.
- Vaporisez la poche de prélèvement sanguin contenant le manteau bouffant avec de l’éthanol à 70% avant de la transférer dans une armoire à flux laminaire. Utilisez toujours des techniques stériles et du matériel stérile pour toutes les étapes
REMARQUE : S’assurer que les autorisations correctes pour la manipulation des échantillons de sang humain sont obtenues. - Transférer le sang dans un tube de centrifugeuse stérile de 50 mL.
- Diluer le sang au moins 10% avec RPMI 1640 non supplémenté.
- Versez 20 mL du milieu de gradient de densité préféré dans un tube de centrifugeuse de 50 mL.
- Aspirer 25 mL du sang dilué dans une pipette sérologique. Réglez le contrôleur de pipette électrique à la vitesse la plus basse.
- Maintenez le tube avec un milieu de gradient de densité à un angle de 45° et posez la pointe de la pipette sérologique sur la face interne du tube de centrifugeuse de 50 mL. Libérer lentement 25 mL de sang dilué de la pipette sérologique.
- Assurez-vous que le sang dilué et le milieu de gradient de densité ne se mélangent pas. Assurez-vous que le sang dilué repose sur le milieu de gradient de densité.
- Répétez cette opération avec les tubes de milieu à gradient de densité suivants jusqu’à ce que tout le sang dilué soit traité.
- Déplacez soigneusement les tubes vers une centrifugeuse et centrifugez à 1000 x g pendant 30 min dans un rotor oscillant à température ambiante (RT). Assurez-vous que l’accélération et la pause sont au minimum.
REMARQUE: Après la centrifugation, différentes couches doivent être visibles. La couche supérieure, rose à orange claire, se compose du plasma sanguin et des plaquettes. La couche blanche moyenne se compose des PBMC suivis d’une couche claire qui se compose du milieu de gradient de densité, et enfin d’une couche rouge foncé au fond avec des globules rouges. - À l’aide d’une pipette Pasteur stérile, aspirer soigneusement la couche blanche contenant du PBMC dans un tube de centrifugeuse de 50 mL.
REMARQUE: Assurez-vous de ne pas transférer le milieu de gradient de densité car cela affectera la purification en aval. L’excès de plasma n’affectera pas les résultats. - Regroupez tous les PBMC collectés dans le même tube de centrifugeuse de 50 mL et rechargez jusqu’à 50 mL avec RPMI 1640.
- Centrifugez les cellules à 500 x g pendant 5 min à TA (effectuez les étapes de centrifugation restantes à ce réglage, sauf indication contraire).
- Aspirer le surnageant et remettre les cellules en suspension dans 30 mL de RPMI 1640. Comptez les cellules à l’aide d’un hémocytomètre ou d’un compteur cellulaire automatisé.
- Pour la cryoconservation, remettre en suspension un maximum de 30 millions de cellules par 1 mL de milieu de congélation.
- Transférer les cellules dans des cryotubes et congeler jusqu’à -80 °C à l’aide d’un récipient de congélation à vitesse contrôlée (-1 °C par minute). Pour un stockage à long terme, déplacez les PBMC à -140 °C.
REMARQUE: Limitez la durée pendant laquelle les cellules sont dans le milieu de congélation à RT. À RT, le DMSO est très toxique pour les cellules.
2. Culture de lymphocytes T primaires humains activés
- Décongélation des cellules (Jour 1)
- Préchauffer 10 mL de RPMI 1640 par échantillon à environ 37 °C.
- Prenez le nombre souhaité d’ampoules cellulaires et stockez-les temporairement sur de la glace carbonique.
- Remettre en suspension les cellules congelées dans 10 mL de RPMI 1640 préchauffé.
- Centrifuger les cellules pendant 5 min à 500 x g à TA.
- Jeter le surnageant et laver à nouveau les cellules en les remettant en suspension dans 10 mL de RPMI 1640 et en centrifugeuse comme décrit au point 2.1.4.
- Jeter le surnageant et remettre en suspension les cellules à 2 x 106 cellules par mL de milieu X-VIVO 15 + 5% de sérum humain (ci-après : milieu cellulaire T).
- Plaque 2 mL des cellules par puits dans une plaque de culture cellulaire de 24 puits et incuber pendant la nuit à 37 °C et 5 % de CO2.
- Activation des cellules (Jour 0)
- Laver les billes CD3/CD28 en transférant 12,5 μL de billes par 1 million de cellules dans un tube de microcentrifugation. Ajouter 12,5 μL de PBS par 12,5 μL de billes.
REMARQUE: Il est important de vortexer le flacon de perles avant utilisation. - Placez le tube de microcentrifugation sur un aimant approprié pendant 1 min.
- Jeter le tampon et remettre les billes en suspension dans le volume d’origine du milieu cellulaire T (12,5 μL de milieu cellulaire T pour 12,5 μL du volume original de perles).
- Ajouter 12,5 μL de billes par million de cellules correspondant à un rapport de 1:2 (perles : cellules).
- Divisez les cellules en deux conditions avec environ 5 millions de cellules dans chacune.
- Ajouter le volume correct de cytokines aux conditions mentionnées dans le tableau 1.
- Incuber les cellules pendant 3 jours à 37 °C et 5 % de CO2.
- Laver les billes CD3/CD28 en transférant 12,5 μL de billes par 1 million de cellules dans un tube de microcentrifugation. Ajouter 12,5 μL de PBS par 12,5 μL de billes.
- Culture de cellules (Jours 3 et 5)
- Resuspendez les cellules et divisez-les en transférant la moitié du volume de chaque puits dans un nouveau puits. Ajouter le même volume de milieu cellulaire T frais à chaque puits.
- Ajouter de nouvelles cytokines à chaque condition comme mentionné dans le tableau 1.
3. Test de flux extracellulaire
- Hydratation de la cartouche du capteur (Jour 0)
- Déballez la cartouche du capteur et retirez-la soigneusement de la plaque de l’utilitaire.
- Placez la cartouche du capteur à l’envers, en prenant soin de ne pas toucher les sondes du capteur.
- Remplissez la plaque utilitaire avec 200 μL d’étrier (voir la table des matériaux pour plus de détails) et replacez soigneusement la cartouche du capteur dans la plaque utilitaire.
- Alternativement, pour éliminer toute formation de bulles, incuber la cartouche du capteur dans de l’eau ultrapure stérile pendant la nuit et remplacez-la par un calibrant préchauffé le matin du test.
- Incuber la plaque de la cartouche du capteur à 37 °C dans une armoire chauffante non régulée au CO2 pendant la nuit.
REMARQUE: Il est très important d’utiliser une armoire non régulée en CO2 car un excès de CO2 influencera la cartouche du capteur. Assurez-vous que l’analyseur de flux (voir tableau des matériaux pour plus de détails) est allumé au moins un jour avant utilisation pour lui permettre de se réchauffer à 37 °C.
- Revêtement cellulaire et préparation d’inhibiteurs mitochondriaux (Jour 1)
- Préparer une solution de revêtement (voir tableau des matériaux) contenant du NaHCO3 (pH 8,3, 0,1 M, 1128 μL), du Cell-Tak (1 mg/mL, 48 μL) et du NaOH (1,0 M, 24 μL).
REMARQUE: La solution de revêtement doit toujours être faite et utilisée fraîche. - Ouvrez une plaque de culture cellulaire XF fraîche et ajoutez 12 μL de la solution de revêtement fraîchement préparée à chaque puits. Assurer une distribution uniforme de la solution de revêtement dans le fond de tous les puits.
- Incuber la plaque à RT avec le couvercle pendant 30 min et jeter la solution liquide restante de tous les puits.
- Lavez la plaque avec 200 μL d’eau stérile et jetez le liquide.
- Lavez la plaque avec 200 μL de PBS stérile de qualité de culture cellulaire et jetez le liquide.
- Laissez la plaque à TA et laissez-la sécher pendant au moins 30 min.
- Préparer une solution de revêtement (voir tableau des matériaux) contenant du NaHCO3 (pH 8,3, 0,1 M, 1128 μL), du Cell-Tak (1 mg/mL, 48 μL) et du NaOH (1,0 M, 24 μL).
- Cellules T de la plaque dans la plaque de culture cellulaire XF (Jour 1)
- Préparer 50 mL de milieux d’essai en mélangeant des milieux XF RPMI appropriés avec du glucose, du pyruvate et de la glutamine selon la configuration expérimentale (niveaux recommandés : 4 mM de glucose, 1 mM de pyruvate et 3 mM de glutamine).
- Chauffer à 37 °C dans un incubateur non corégulé et fixer le pH à 7,4. S’assurer qu’il y a suffisamment de milieu pour le placage des cellules et la préparation des solutions d’oligomycine et de FCCP (rubrique 3.4).
- Concevez une disposition de plaque avec un nombre croissant de cellules par puits pour l’exécution de l’optimisation ou de l’essai. Utilisez quatre puits 4, remplis de milieux et injectés de milieux, pour les mesures de fond.
- Compter les lymphocytes T préparés à la section 2.3 (selon la méthode préférée) et pipeter le nombre correct de cellules dans chaque puits de la plaque de culture cellulaire XF recouverte de la solution de revêtement, selon la disposition de la plaque.
REMARQUE: Le volume final de chaque puits peut varier, mais doit être suffisant pour couvrir le fond du puits. - Centrifugez la plaque de culture cellulaire XF à 1000 x g à RT pendant 10 min pour faire adhérer la cellule T à la surface revêtue.
- Lavez les cellules avec 200 μL de milieu d’essai, jetez-les et ajoutez 180 μL de milieu d’essai.
REMARQUE: Inspectez visuellement les puits à l’aide d’un microscope à lumière inversée pour vous assurer que les cellules sont attachées et réparties uniformément sur la surface du puits. - Incuber la plaque de culture cellulaire XF dans l’armoire chauffante non régulée au CO2 pendant 30 minutes pour s’assurer que la température de la plaque est de 37 °C.
- Chargement de la cartouche de capteur avec oligomycine et FCCP pour l’optimisation (Jour 1)
REMARQUE : Si les concentrations d’oligomycine et de FCCP étaient déjà optimisées, continuer à la rubrique 3.5.- Préparer des solutions de travail d’oligomycine et de FCCP dans des milieux d’essai (préparés à l’étape 3.3.1) comme décrit aux étapes 3.4.2 et 3.4.3.
- Solutions de travail à l’oligomycine : préparer une solution de 5 μM (2 mL de milieu d’essai + 10 μL de 1 mM de stock d’oligomycine) et une solution de 3 μM (8 mL de milieu d’essai + 24 μL de 1 mM de stock d’oligomycine).
- Solution de travail FCCP : Préparer une solution de 2 μM (2 mL de milieu d’essai + 13,2 μL de 300 μM de papier FCCP) et une solution de 1,3 μM (8 ml de milieu d’essai + 34,6 μL de 300 μM de papier FCCP)
- Chargez les solutions de travail d’oligomycine ou de FCCP dans les orifices d’injection de la cartouche du capteur (tableau 2).
NOTE. Il est important qu’aucun orifice d’injection ne contienne uniquement de l’air. Si, pour une raison quelconque, tous les ports d’injection ne sont pas utilisés, les ports vides doivent être remplis de supports de dosage. - Frappez doucement les bords de la plaque sur la table pour éliminer les bulles potentielles dans les orifices d’injection.
- Cartouche de capteur de chargement avec oligomycine, FCCP et antimycine A pour l’exécution du test (Jour 1)
- Préparer des solutions d’oligomycine, FCCP dans des milieux d’essai (préparés à l’étape 3.3.1) en fonction des concentrations optimales identifiées lors d’une précédente exécution d’optimisation. Préparez également une solution d’antimycine A de 20 μM.
- Chargez 20 μL d’oligomycine ou de FCCP dans l’orifice d’injection A de la cartouche du capteur selon la disposition de la plaque. Ajouter 22 μL de 20 μM d’antimycine A au port d’injection B de tous les puits. La concentration résultante d’antimycine A une fois injectée dans le puits sera de 2 μM.
- Configuration d’un protocole expérimental dans le logiciel d’analyse de flux.
- Affectez les groupes et la carte de plaque pour chaque condition par disposition de plaque.
- Concevoir le protocole en fonction de la stratégie d’injection (tableau 3 et figure 1).
REMARQUE: Lors de l’exécution d’Assay, les injections C et D peuvent être omises. - Enregistrez la configuration du test, remplissez les informations requises pour être inclus pour le test et appuyez sur Démarrer.
- L’analyseur de flux demandera la cartouche de capteur préparée à la section 3.5. Retirez le couvercle et insérez la cartouche du capteur selon les instructions de l’analyseur.
REMARQUE: Le test étalonnera et vérifiera les capteurs indiqués par des coches. Après un étalonnage réussi, l’analyseur demandera la plaque de culture cellulaire XF préparée à la section 3.3. La plaque utilitaire est éjectée de l’analyseur et remplacée par la plaque de culture cellulaire XF pour démarrer le test.
Résultats
Une détermination correcte des propriétés d’OxPhos est un outil indispensable lors de l’étude des lymphocytes T. Toutefois, si les conditions d’essai n’ont pas été optimisées, il existe un risque important de résultats trompeurs ou erronés. Dans ce protocole, l’accent est mis sur l’optimisation du nombre de cellules par puits et des concentrations d’oligomycine et de FCCP à utiliser. Dans la configuration décrite, l’oligomycine et le FCCP sont ajoutés progressivement au même puits, ce qui augmente la concentration des modulateurs mitochondriaux. La concentration optimale d’olligomycine et de FCCP peut être déterminée à partir des courbes OCR résultantes des puits ainsi que de la concentration où un plateau est atteint.
Dans la course représentative, l’oligomycine est ajoutée dans une concentration croissante et inhibe l’ATP synthase (complexe V de la chaîne de transport d’électrons), entraînant une diminution de la respiration mitochondriale. Un plateau en OCR est atteint après que la concentration accumulative des puits a atteint 1 μM. À partir de cette concentration et de l’augmentation des concentrations, l’OCR n’a pas été réduite davantage (figure 1A). Pour les puits traités avec une concentration incrémentielle du fccP découpleur, les niveaux d’OCR ont augmenté comme prévu jusqu’à atteindre un plateau après l’ajout de 0,2 μM de FCCP, ce qui indique qu’à cette concentration, un découplage complet a été obtenu (figure 1B). Une optimisation des cellules plaquées par puits est importante pour un dosage correct et reproductible. Si le nombre de cellules utilisées est trop faible, le niveau d’oxygène retiré du milieu d’essai par les cellules est trop faible pour être correctement mesuré par l’analyseur. D’autre part, si le nombre de cellules par puits est trop élevé, la consommation d’oxygène des cellules peut devenir si élevée que le système ne peut pas reconstituer les niveaux d’oxygène du milieu d’essai après chaque mesure, ce qui conduit à un environnement de plus en plus hypoxique et à une caractérisation erronée d’OxPhos.
Dans la série représentative, les cellules ont été ensemencées à une densité de 200 000 et 400 000 cellules par puits (figure 2A-C). Pour une course avec 200 000 cellules, l’OCR initial est d’environ la moitié d’une course avec 400 000 cellules par puits. Pour le traitement FCCP, l’OCR maximale est de 61,6 pmol/min (200 000 cellules) contre 190,4 pmol/min (400 000 cellules). Après un traitement à l’oligomycine, l’OCR en cours d’exécution avec 200 000 cellules s’effondre en OCR à un chiffre (6,4 pmol / min). C’est inférieur à l’OCR de la course, avec 400 000 cellules par puits traité à l’oligomycine (25,8 pmol/min, respectivement).
Par conséquent, d’après l’exécution de l’optimisation, il est clair qu’un nombre de cellules de 400 000 cellules par puits était nécessaire pour les essais futurs, en utilisant 1 μM d’oligomycine et 0,2 μM de FCCP. Dans la configuration classique recommandée par le fabricant, l’oligomycine et le FCCP sont ajoutés séquentiellement avec l’ajout final d’antimycine A. Pour les lymphocytes T, ce n’est pas l’approche optimale car le traitement à l’oligomycine peut être vu pour limiter le découplage après le traitement FCCP (Figure 3A,B). Dans cette méthode présentée, il est recommandé d’exécuter chaque condition dans des puits en double et de traiter l’un avec de l’oligomycine et l’autre avec du FCCP, avec un ajout final d’antimycine A pour les deux puits. En utilisant cette approche, le traitement à l’oligomycine n’affecte pas l’OCR après le traitement FCCP. Cette approche permet de déterminer les mêmes propriétés mitochondriales que la configuration classique, où les médicaments sont ajoutés en séquence (Figure 3C)
Enfin, il a été étudié si les effets des cytokines IL-2 et IL-15 pouvaient être différenciés sur le métabolisme des cellules T primaires humaines cultivées ex vivo. En effet, les cellules cultivées à l’IL-15 possédaient une respiration maximale plus élevée et une capacité respiratoire inutilisée, comme cela a été montré précédemment1 (figure 4A-E). La respiration basale et la production d’ATP n’ont pas été affectées. Prises ensemble, ces données montrent que la respiration mitochondriale des cellules T primaires humaines cultivées ex vivo peut être analysée avec succès à l’aide de l’analyseur de flux extracellulaire.

Figure 1 : Taux de consommation d’oxygène (OCR) mesuré pendant le titrage des inhibiteurs oligomycine et FCCP dans des lymphocytes T primaires humains cultivés ex vivo. (A) OCR pendant le titrage progressif de l’oligomycine à partir de 0-1,25 μM concentration finale. (B) OCR pendant le titrage progressif du FCCP à partir de 0-0,5 μM de concentration finale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Influence de la concentration cellulaire sur les mesures OCR dans les lymphocytes T primaires humains cultivés ex vivo. Mesures OCR de lymphocytes T primaires humains cultivés ex vivo avec 200 000 ou 400 000 cellules par puits après injection de (A) FCCP ou (B) d’oligomycine. (C) Respiration basale, respiration maximale, production d’ATP et capacité respiratoire inutilisée des lymphocytes T primaires humains utilisant 200 000 ou 400 000 cellules par puits. Représentatif de trois expériences indépendantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
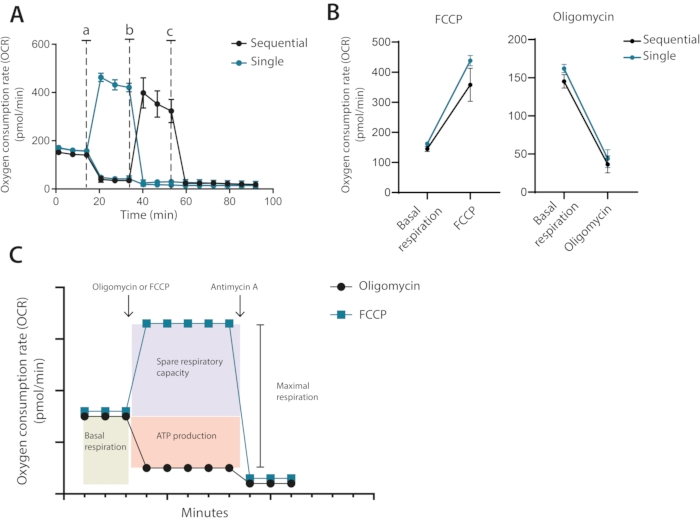
Figure 3 : Injection simple ou séquentielle de modulateurs mitochondriaux. (A) Mesures OCR représentatives pendant la ligne de base et après l’injection d’oligomycine et de FCCP (a, b) ou d’antimycine A (c) sous forme d’injections individuelles uniques ou d’injections séquentielles. (B) Valeurs OCR avant l’injection (respiration basale) ou après l’injection d’oligomycine ou de FCCP sous forme d’injections uniques ou séquentielles. (C) Représentation schématique de la stratégie d’injection et de mesure. Représentant d’une expérience indépendante Veuillez cliquer ici pour voir une version plus grande de cette figure.
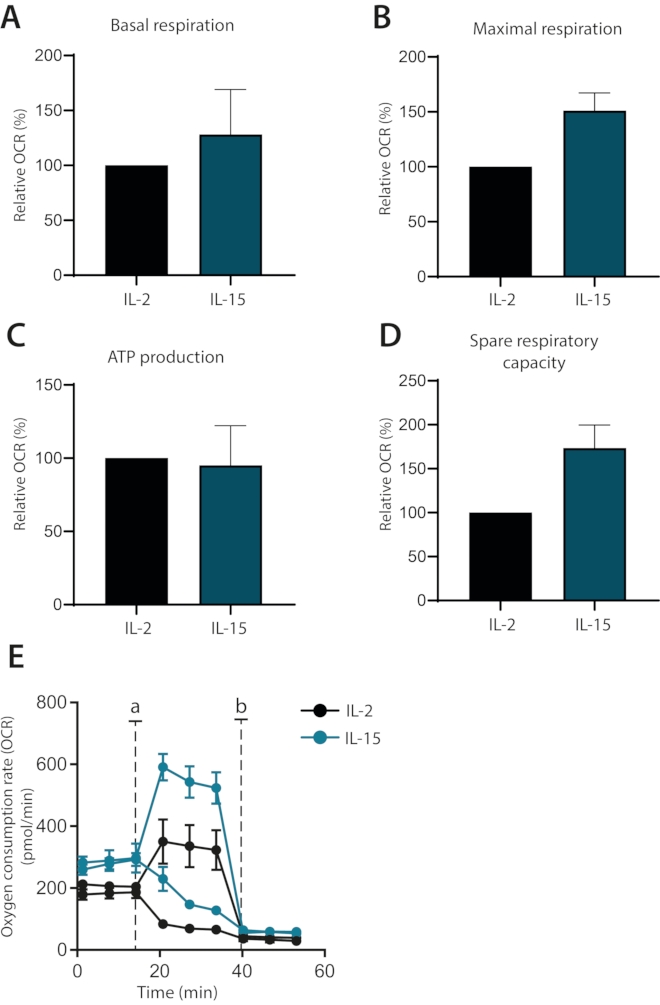
Figure 4 : Différences dans la respiration mitochondriale dans les lymphocytes T primaires humains différenciés par cytokines. (A-D) Respiration basale, respiration maximale, production d’ATP et capacité respiratoire inutilisée des lymphocytes T primaires humains cultivés avec de l’IL-2 ou de l’IL-15 pendant sept jours (n = 3). (E) Parcelles représentatives de (A-D), avec des injections d’oligomycine ou de FCCP (a) ou d’antimycine A (b). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Cytokine | [Stock] | Facteur de dilution | [Finale] | |
| Condition 1 | IL-2 | 3 x 106 U/mL | 30,000 | 100 U/mL |
| Condition 2 | IL-15 | 2 x 105 U/mL | 2,000 | 100 U/mL |
Tableau 1 : Préparation de cultures de cytokines utilisées pour guider les changements métaboliques dans les lymphocytes T.
| Oligomycine | Le | |||||
| Sol de travail. | Conc. final. | Vol. | Sol de travail. | Conc. final. | Vol. | |
| Port A | 5,0 μM | 0,50 μM | 20 μL | 2,0 μM | 0,2 μM | 20 μL |
| Port B | 3,0 μM | 0,75 μM | 22 μL | 1,30 μM | 0,3 μM | 22 μL |
| Port C | 3,0 μM | 1,0 μM | 24 μL | 1,30 μM | 0,4 μM | 24 μL |
| Port D | 3,0 μM | 1,25 μM | 27 μL | 1,30 μM | 0,5 μM | 27 μL |
Tableau 2 : Stratégie de préparation des inhibiteurs et modulateurs mitochondriaux. Concentrations de préparation, concentrations de travail et stratégies d’injection pour une exécution d’optimisation.
| Action | Détails | Détails de la mesure |
| Ligne de base | Mesures de référence | 3 mesures |
| Injection | Injection du port A | 3 mesures |
| Injection | Injection du port B | 3 mesures |
| Injection | Injection du port C | 3 mesures |
| Injection | Injection du port D | 3 mesures |
| Mesurer | Mesures supplémentaires | Optionnel |
Tableau 3 : Conception du protocole d’une opération d’optimisation avec titrage des inhibiteurs et modulateurs mitochondriaux à l’aide de 4 injections avec 3 mesures dans chacune.
| Élément de phosphorylation oxydative mitochondriale | Explication | ||
| Respiration basale | La respiration basale est une mesure de base du taux d’oxygène consommé par les lymphocytes T stimulés avant l’ajout d’inhibiteurs mitochondriaux. C’est une mesure de la consommation d’oxygène utilisée pour répondre à la demande cellulaire d’ATP résultant d’une fuite de protons mitochondriaux. En tant que tel, il fournit une vue d’ensemble du courant protonique généré pour alimenter la synthèse de l’ATP et la fuite de protons. Cependant, c’est aussi une mesure qui peut être modifiée en fonction des substrats présents dans le milieu de croissance, de la stimulation des cellules avant le dosage et d’autres facteurs extrinsèques. La respiration basale est donc une mesure utilisée pour comparer deux ou plusieurs types de cellules différents et/ou différents traitements censés affecter l’état métabolique cellulaire des cellules. La respiration basale est calculée comme la différence d’OCR avant d’ajouter des modulateurs mitochondriaux (oligomycine ou FCCP) et après l’ajout d’antimycine A | ||
| Respiration maximale | Cette mesure est le taux maximal d’oxygène qui peut être consommé pour la phosphorylation oxydative. Le taux d’oxygène consommé par phosphorylation oxydative est déterminé à la fois par la capacité de la chaîne de transport d’électrons à pomper des protons à travers la membrane mitochondriale interne et par la capacité de l’ATP synthase à utiliser le gradient de protons pour phosphoryler l’ATP de l’ADP. La vitesse de l’ATP synthase est limitée par le substrat ADP libre et donc par l’état énergétique général de la cellule. Lors du traitement des cellules avec le découpleur mitochondrial FCCP, les protons peuvent librement traverser la membrane mitochondriale interne. Cela imite une situation où les cellules subissent une demande d’énergie insaturable, et la respiration maximale est donc une mesure du taux maximal d’oxygène qui peut être consommé par la chaîne de transport d’électrons. La respiration maximale est calculée comme la différence d’OCR des cellules traitées par FCCP et des cellules traitées par antimycine A | ||
| Chiffre d’affaires ATP | La respiration liée à l’ATP est mesurée comme la différence dans l’OCR après inhibition de l’ATP synthase à l’aide de l’oligomycine. L’oxygène qui serait autrement consommé pour la phosphorylation de l’ADP par phosphorylation oxydative ne sera plus utilisé car ce processus est arrêté. La respiration liée à l’ATP est donc relative à l’ATP produit par phosphorylation oxydative. Les changements dans la respiration liée à l’AT sont une réponse des mitochondries à une demande altérée d’ATP de la cellule La respiration liée à l’ATP est calculée comme la différence d’OCR avant d’ajouter des modulateurs mitochondriaux (oligomycine ou FCCP) et après l’ajout d’oligomycine | ||
| Capacité respiratoire de rechange | La capacité respiratoire disponible est une mesure d’une capacité théorique supplémentaire à produire de l’ATP en réponse à une demande énergétique accrue. Il est défini comme la différence entre la respiration basale et la respiration maximale. Les changements dans la capacité respiratoire inutilisée peuvent être un indicateur de la forme et de la flexibilité des mitochondries et des cellules. | ||
Tableau 4 : Explication des différents composants de la respiration mitochondriale étudiés à l’aide de l’analyseur de flux
Discussion
La quantification détaillée et correcte de la phosphorylation oxydative est un outil indispensable pour décrire les états énergétiques des lymphocytes T. L’état de la condition mitochondriale peut être directement lié au potentiel d’activation, à la survie et à la différenciation des lymphocytes T1,5. Avec ce protocole, il est possible de déterminer les différentes propriétés de la phosphorylation oxydative (voir tableau 4 pour une explication détaillée). La quantification précise de ces propriétés de phosphorylation oxydative offre un aperçu détaillé des états énergétiques des lymphocytes T. Cependant, pour obtenir des résultats fiables, il faut faire très attention lors de la mise en place de l’expérience.
Dans ce protocole, les trois étapes d’optimisation suivantes sont conseillées: d’abord, l’optimisation des nombres de cellules. La capacité d’un analyseur de flux à mesurer correctement les concentrations d’oxygène suit une courbe sigmoïde; les changements d’oxygène trop petits ou trop importants tomberont en dehors de l’intervalle de fonctionnement de la machine et ne seront donc pas mesurés correctement. Cela nécessite une optimisation du nombre de cellules à utiliser tout au long de l’expérience. Si trop peu de cellules sont analysées, les changements dans la consommation d’oxygène sont trop faibles pour être correctement mesurés. S’il y a trop de cellules, il y a un risque d’épuisement de l’oxygène dans le milieu d’essai. Une première exécution est donc recommandée, avec un nombre de cellules allant de 100 000 à 400 000 cellules par puits. Lors du traçage du nombre de cellules par rapport à la respiration basale, le nombre optimal de cellules se situera dans la plage linéaire de la courbe. Lors de l’optimisation de la configuration, sachez qu’il peut y avoir une différence exponentielle dans l’activité mitochondriale entre les cellules au repos et activées, et doit donc être optimisé en conséquence.
Deuxièmement, le titrage des concentrations d’inhibiteurs. Lors du traitement des cellules avec de l’olligomycine et du FCCP, il est important d’identifier les concentrations optimales des inhibiteurs à utiliser. Une concentration trop faible entraînera une inhibition sous-optimale et une mesure incorrecte de la respiration mitochondriale. Il est courant que les gens utilisent les concentrations recommandées les plus élevées des inhibiteurs pour s’assurer qu’une inhibition complète est obtenue. Ceci est également problématique car des concentrations trop élevées d’inhibiteurs peuvent avoir des effets pléiotropes. Les découpleurs comme le FCCP exercent également leurs effets sur les membranes autres que les mitochondries, ce qui entraîne une gamme d’effets indésirables, notamment la dépolarisation de la membrane plasmique, l’inhibition mitochondriale et la cytotoxicité. Dans ce protocole, le titrage de l’oligomycine et du FCCP est effectué simultanément avec l’optimisation du nombre de cellules. Au cours d’une exécution d’optimisation, des concentrations croissantes d’oligomycine ou de FCCP sont ajoutées à l’aide des quatre ports de substrat disponibles. Dans le diagramme OCR résultant, la concentration optimale peut être déterminée visuellement comme la concentration à laquelle l’OCR atteint un plateau stable. Une fois que la concentration d’oligomycine et de FCCP a été titrée, ces concentrations doivent être utilisées tout au long de l’expérience.
Troisièmement, l’ajout séquentiel versus individuel d’inhibiteurs. Les essais classiques d’hippocampes sont généralement effectués avec l’ajout séquentiel de la première oligomycine suivie de l’ajout de FCCP. Dans les lymphocytes T et d’autres cellules sensibles, une telle addition séquentielle peut entraîner une quantification erronée de la respiration maximale. À leur tour, les niveaux mesurés de capacité respiratoire inutilisée seront inférieurs à ce qu’ils sont. Des exemples graves de ceci incluent des valeurs de capacité respiratoire inutilisée qui sont négatives. Ceci n’est, bien sûr, pas biologiquement possible et est causé par une pré-sensibilisation des mitochondries par un traitement à l’oligomycine. Dans ce protocole, il est plutôt recommandé que les cellules ne soient traitées qu’avec de l’oligomycine ou du FCCP (voir la figure 3C pour une comparaison illustrative).
Enfin, ce protocole optimisé est utilisé pour montrer comment les cultures de lymphocytes T primaires humains supplémentées en IL-15 peuvent être clairement distinguées des cellules supplémentées en IL-2 en fonction de leur respiration mitochondriale. Les cellules cultivées en IL-15 possèdent une respiration maximale plus élevée et une capacité respiratoire de réserve, un état métabolique lié aux lymphocytes T mémoire1,6. Ces observations sont conformes aux études précédentes qui lient l’IL-15 à des sous-ensembles de lymphocytes T mémoire8. En outre, une différence dans la respiration basale mais pas dans la production d’ATP par rapport aux cellules cultivées en IL-2 a été observée. Cela indique que ces cellules utilisent leur capacité glycolytique pour se conformer aux demandes métaboliques de base, une voie associée à des cellules plus différenciées. Pris ensemble, il est démontré qu’un modèle de lymphocytes T de mémoire humaine peut être établi in vitro en utilisant une supplémentation en IL-15. L’utilisation d’un environnement riche en IL-15 pour favoriser le développement de cellules mémoire a déjà été démontrée et soutient davantage les résultats8.
Dans cette méthode, l’oligomycine, le FCCP et l’antimycine A ont été utilisés pour quantifier les propriétés d’OxPhos. D’autres composés existent avec des effets similaires, qui seraient potentiellement mieux adaptés aux lymphocytes T. Un exemple serait d’utiliser le découpleur BAM15 au lieu de FCCP pour diminuer la dépolarisation de la membrane mitochondriale et éviter la cytotoxicité9. Dans cette méthode, ces composés n’ont pas été pris en compte, car l’olligomycine, le FCCP et l’antimycine A ont été les modulateurs mitochondriaux recommandés pour les expériences sur les hippocampes au cours de la dernière décennie. L’utilisation de ces composés est donc reconnue par les examinateurs et autres chercheurs travaillant avec OxPhos. Les utilisateurs plus expérimentés de l’analyseur de flux Seahorse sont encouragés à utiliser ces composés alternatifs, mais leur utilisation n’entre pas dans le cadre du présent document.
La surveillance de l’OxPhos mitochondrial est un outil essentiel pour comprendre la fonction des lymphocytes T et améliorer les immunothérapies anticancéreuses. Comme mentionné précédemment, il a été démontré que les cellules EXPANSÉES IL-15 - avec un phénotype de mémoire moins différencié - amélioraient les réponses aux thérapies à base de cellules CAR-T, car elles étaient moins épuisées et avaient une activité antitumorale accrue10. Ce protocole optimisé pourrait être un outil efficace pour étudier la qualité des lymphocytes T dans les contextes précliniques et cliniques. En conclusion, ce protocole met en œuvre des étapes pour optimiser le nombre de cellules et les concentrations d’inhibiteurs pour l’utilisation de cellules T primaires humaines cultivées ex vivo dans des tests métaboliques.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Kasper Mølgaard et Anne Rahbech ont reçu des subventions de Tømmermester Jørgen Holm og Hustru Elisa f. Hansens Mindelegat. Kasper Mølgaard a également reçu une subvention du Børnecancerfonden.
matériels
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
Références
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -. H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon