Method Article
ניטור בזמן אמת של נשימה מיטוכונדריאלית בתאי T ראשוניים אנושיים מובחנים בציטוקינים
* These authors contributed equally
In This Article
Summary
הסתגלות מטבולית היא בסיסית עבור תאי T כפי שהיא מכתיבה בידול, התמדה, וציטוטוקסיות. כאן, פרוטוקול ממוטב לניטור נשימה מיטוכונדריאלית בתאי T ראשוניים אנושיים מובחנים ex vivo .
Abstract
במהלך ההפעלה, חילוף החומרים של תאי T מסתגל לשינויים המשפיעים על גורלם. עלייה בזרחן חמצוני מיטוכונדריאלי היא הכרחית להפעלת תאי T, והישרדותם של תאי T זיכרון T תלויה בשיפוץ מיטוכונדריאלי. כתוצאה מכך, זה משפיע על התוצאה הקלינית ארוכת הטווח של אימונותרפיות סרטן. שינויים באיכות תאי T נחקרים לעתים קרובות על ידי ציטומטריית זרימה באמצעות סמני שטח ידועים ולא ישירות על ידי מצבם המטבולי. זהו פרוטוקול ממוטב למדידת נשימה מיטוכונדריאלית בזמן אמת של תאי T אנושיים ראשוניים באמצעות מנתח שטף חוץ-תאי והציטוקינים IL-2 ו- IL-15, המשפיעים באופן שונה על חילוף החומרים של תאי T. הוכח כי המצב המטבולי של תאי T ניתן להבחין בבירור על ידי מדידת צריכת החמצן בעת עיכוב מתחמי מפתח במסלול המטבולי וכי הדיוק של מדידות אלה תלוי מאוד בריכוז מעכב אופטימלי ואסטרטגיית הזרקת מעכבים. פרוטוקול מתוקנן זה יסייע ליישם נשימה מיטוכונדריאלית כסטנדרט לכושר תאי T בניטור ולמידה של חיסונים לסרטן.
Introduction
התפתחות ותפקוד תקינים של תאי T חיוניים ליכולתה של מערכת החיסון לזהות ולהגיב לאנטיגנים. זרחן חמצוני מיטוכונדריאלי (OxPhos) משתנה בהתאם למצב תא ה- T. תאי T נאיביים משתמשים בעיקר באוקספוס כדי לייצר ATP, בעוד שתאי T מופעלים עוברים מעבר מטבולי שבו הגליקוליזה הופכת דומיננטית1. לאחר שלב המשפיע, תת-קבוצה קטנה שנותרה של תאי T זיכרון חוזרת למצב מטבולי הנשלט על ידי OxPhos2,3. השינויים של OxPhos בצע את ההבחנה של תאי T עד כדי כך שאפילו תת קבוצות של תאי T ניתן להבדיל על ידי הספציפי שלהם הוא תכונות OxPhos1. לעומת זאת, OxPhos חשוב לתפקוד תאי T, ועיכוב של OxPhos הוכח לחסום התפשטות וייצור ציטוקינים של תאי T4. לכן, היכולת לכמת את המאפיינים של תא T OxPhos באופן מדויק וניתן לשחזור היא כלי רב עוצמה עבור כל מי שעובד עם תאי T.
בפרוטוקול זה, מאפיינים של תא T OxPhos נמדדים באמצעות מנתח שטף חוץ תאי. תפקיד הליבה של מנתח זה הוא למדוד ברציפות את תכולת החמצן של מדיית הצמיחה של התאים שיש לנתח. חמצן שהוסר ממדיית הצמיחה הוא הניח להיות נלקח על ידי התאים. על ידי טיפול בתאים עם מגוון של מעכבי OxPhos או מכפילים, ירידה בספיגת חמצן קשורה לתפקוד המעכב או המווסת. לדוגמה, עיכוב של סינתאז ATP יוביל לספיגה תאית מופחתת של חמצן שאחרת היה משמש לייצור ATP על ידי זרחן חמצוני. ציוד אחר, כולל האלקטרודה קלארק ומכשיר Oroboros, מציע פונקציונליות דומה, ולכל מכשיר יש יתרונות וחסרונות שונים. מגוון רחב של סוגי תאים יכול לשמש למחקרים במכשירים אלה, אך סוג תא אחד מאתגר במיוחד הוא לימפוציטים T ראשוני אנושיים5. בשל גודלם הקטן, ex vivo הישרדות ירודה, ומאפיינים שאינם חסידים, תאי T ראשוניים אנושיים יכולים להיות מאתגרים ללמוד.
זהו פרוטוקול לחקר הנשימה המיטוכונדריאלית של תאי T ראשוניים אנושיים על ידי מנתח חוץ-תאי. הפרוטוקול מחולק לרוץ אופטימיזציה, שבו ריכוזים אופטימליים של מספר תא לכל באר, כמו גם את הריכוז האופטימלי של oligomycin ו FCCP, נקבעים. יתר על כן, ריצה Assay, שבו התנאים הממוטבים משמשים.
באמצעות PBMCs אנושיים שמקורם בדם ותרביות תאי T ראשיות ex vivo , פרוטוקול זה מדגים את החשיבות של ריכוז מעכב אופטימלי ואת הרלוונטיות של שימוש נפרד במקום הזרקה רציפה של מעכבי מיטוכונדריה בעת עבודה עם סוגי תאים רגישים. לבסוף, הוא הוכיח כי בדיקה זו יכולה לזהות היטב הבדלים עדינים בנשימה מיטוכונדריאלית על קיטוב עם ציטוקינים IL-2 ו IL-15.
Protocol
הניסויים בוצעו תחת ההנחיות של בית החולים הרלב ואזור הבירה של דנמרק.
הערה: פרוטוקול זה מכיל הוראות הן עבור הפעלת מיטוב והן עבור הפעלת Assays. הוא כתוב בבירור בטקסט כאשר ההוראות הן עבור הפעלת מיטוב או הפעלת Assay. הפעל הפעלת מיטוב לפני שתמשיך בהפעלות Assay
1. בידוד חד-גרעיני של דם היקפי אנושי (PBMC) ממעילי באפי
- בידוד PBMC
- לאסוף מעילי באפי מהמוסד המתאים (שנאסף בשקיות איסוף דם). מעילי באפי מקורם בתורמים בריאים. אל תכלול תורמים שהשתמשו לאחרונה במשככי כאבים.
- יש לרסס את שקית איסוף הדם המכילה את מעיל הבאפי ב-70% אתנול לפני המעבר לארון זרימה למינארי. השתמש תמיד בטכניקות סטריליות ובחומרה סטרילית לכל השלבים
הערה: ודא כי האישורים הנכונים לטיפול בדגימות דם אנושיות מתקבלים. - מעבירים את הדם לצינור צנטריפוגה סטרילי של 50 מ"ל.
- לדלל את הדם לפחות 10% עם RPMI 1640 ללא תוספת.
- יוצקים 20 מ"ל של מדיום שיפוע הצפיפות המועדף בצינור צנטריפוגה של 50 מ"ל.
- שאפו 25 מ"ל של הדם המדולל לתוך פיפטה סרולוגית. הגדר את בקר הפיפטה החשמלית למהירות הנמוכה ביותר.
- החזק את הצינור עם מדיום שיפוע צפיפות בזווית של 45° והנח את קצה פיפטה סרולוגי בצד הפנימי של צינור צנטריפוגה 50 מ"ל. שחרר לאט 25 מ"ל של הדם המדולל מהפיפטה הסרולוגית.
- ודא שהדם המדולל ומדיום שיפוע הצפיפות אינם מתערבבים. ודא שהדם המדולל מונח על גבי מדיום שיפוע הצפיפות.
- חזור על זה עם צינורות בינוניים שיפוע צפיפות הבאים עד כל הדם המדולל מעובד.
- בזהירות להעביר את הצינורות לצנטריפוגה וצנטריפוגה ב 1000 x g במשך 30 דקות ברוטור מתנדנד החוצה בטמפרטורת החדר (RT). ודא כי ההאצה וההפסקה הם לכל הפחות.
הערה: לאחר צנטריפוגה, שכבות שונות צריכות להיות גלויות. השכבה העליונה, הוורוד-כתומה הצלולה, מורכבת מפלזמת הדם וטסיות הדם. השכבה הלבנה האמצעית מורכבת מ- PBMCs ואחריה שכבה ברורה המורכבת ממדיום שיפוע הצפיפות, ולבסוף שכבה אדומה כהה בתחתית עם תאי דם אדומים. - באמצעות פיפטת פסטר סטרילית, שאפו בזהירות את השכבה הלבנה המכילה PBMC לצינור צנטריפוגה של 50 מ"ל.
הערה: הקפד לא להעביר את מדיום שיפוע הצפיפות מכיוון שהדבר ישפיע על טיהור במורד הזרם. עודף פלזמה לא ישפיע על התוצאות. - מאגר כל PBMCs שנאסף באותו צינור צנטריפוגה 50 מ"ל ומעל עד 50 מ"ל עם RPMI 1640.
- צנטריפוגה התאים ב 500 x g במשך 5 דקות ב RT (לבצע את שלבי צנטריפוגה הנותרים בהגדרה זו, אלא אם צוין אחרת).
- שאפו את העל-טבעי והגדילו מחדש את התאים ב-30 מ"ל של RPMI 1640. ספור את התאים באמצעות hemocytometer או מונה תאים אוטומטי.
- עבור cryopreservation, resuspend מקסימום של 30 מיליון תאים לכל 1 מ"ל של בינוני מקפיא.
- מעבירים את התאים להקפאות ומקפיאים עד למינוס 80 מעלות צלזיוס באמצעות מיכל הקפאה מבוקר קצב (-1 מעלות צלזיוס לדקה). לאחסון לטווח ארוך, העבר את מחשבי ה- PBMCs למינוס 140 °C (65 °F).
הערה: הגבל את הזמן שבו תאים נמצאים במדיום ההקפאה ב- RT. ב RT, DMSO הוא רעיל מאוד לתאים.
2. פולחן של לימפוציטים T ראשוניים אנושיים מופעלים
- הפשרת תאים (יום 1)
- טרום חם 10 מ"ל של RPMI 1640 לכל מדגם סביב 37 °C (50 °F).
- קח את המספר הרצוי של אמפולות תאים ולאחסן אותם באופן זמני על קרח יבש.
- resuspend התאים הקפואים ב 10 מ"ל של RPMI 1640 שחומם מראש.
- צנטריפוגה התאים במשך 5 דקות ב 500 x g ב RT.
- להשליך את supernatant ולשטוף את התאים שוב על ידי resuspending ב 10 מ"ל של RPMI 1640 וצנטריפוגה כמתואר 2.1.4.
- להשליך את supernatant ו resuspend התאים ב 2 x 106 תאים למ"ל של X-VIVO 15 בינוני + 5% סרום אנושי (להלן: תא T בינוני).
- צלחת 2 מ"ל של התאים לבאר בצלחת תרבית תאים 24-well ודגר לילה ב 37 °C (5 ° C ) ו 5% CO2.
- הפעלת תאים (יום 0)
- לשטוף חרוזים CD3 / CD28 על ידי העברת 12.5 μL של חרוזים לכל 1 מיליון תאים לצינור microcentrifuge. הוסף 12.5 μL של PBS לכל 12.5 μL של חרוזים.
הערה: חשוב לערבב את הבקבוקון של חרוזים לפני השימוש. - מניחים את צינור microcentrifuge על מגנט מתאים במשך 1 דקה.
- להשליך את המאגר מחדש את החרוזים בנפח המקורי של מדיום תא T (12.5 μL של מדיום תא T לכל 12.5 μL של הנפח המקורי של חרוזים).
- הוסף 12.5 μL של חרוזים למיליון תאים המתאימים ליחס של 1:2 (חרוזים: תאים).
- חלק את התאים לשני תנאים עם כ-5 מיליון תאים בכל אחד מהם.
- הוסף את הנפח הנכון של ציטוקינים לתנאים כאמור בטבלה 1.
- לדגור על התאים במשך 3 ימים ב 37 °C (5° פרנהייט) ו 5% CO2.
- לשטוף חרוזים CD3 / CD28 על ידי העברת 12.5 μL של חרוזים לכל 1 מיליון תאים לצינור microcentrifuge. הוסף 12.5 μL של PBS לכל 12.5 μL של חרוזים.
- פולחן של תאים (יום 3 ו -5)
- לנפח מחדש את התאים ולפצל אותם על ידי העברת מחצית הנפח מכל באר לבאר חדשה. הוסף את אותו נפח של מדיום תא T טרי לכל באר.
- הוסף ציטוקינים חדשים לכל תנאי כאמור בטבלה 1.
3. בדיקת שטף חוץ-תאית
- הידרציה של מחסנית החיישן (יום 0)
- פרק את מחסנית החיישן והסר בזהירות את מחסנית החיישן מלוחית השירות.
- הנח את מחסנית החיישן הפוכה, והקפיד לא לגעת בבדיקות החיישן.
- מלא את צלחת השירות עם 200 μL של calibrant (ראה טבלת חומרים לפרטים) ולהחליף בזהירות את מחסנית החיישן בחזרה לתוך צלחת השירות.
- לחלופין, כדי לחסל כל היווצרות בועה, לדגור מחסנית החיישן במים אולטרה-פוריים סטריליים בן לילה ולהחליף אותו עם calibrant שחומם מראש בבוקר של הבדיקה.
- דגור על צלחת מחסנית החיישן ב 37 °C (37 °F) בארון חימום שאינו מוסדר CO2 בן לילה.
הערה: חשוב מאוד להשתמש בארון מוסדר שאינו CO2 מאז עודף CO2 2 ישפיע על מחסנית החיישן. ודא כי מנתח השטף (ראה טבלת חומרים לקבלת פרטים) מופעל לפחות יום לפני השימוש כדי לאפשר לו להתחמם עד 37 °C (60 °F).
- ציפוי תאים והכנת מעכבי מיטוכונדריה (יום 1)
- הכן פתרון ציפוי (ראה טבלת חומרים) המכיל NaHCO3 (pH 8.3, 0.1 M, 1128 μL), Cell-Tak (1 מ"ג / מ"ל, 48 μL) ו NaOH (1.0 M, 24 μL).
הערה: פתרון ציפוי תמיד צריך להיעשות ולהשתמש טרי. - פתחו צלחת תרבית תאים XF טרייה והוסיפו 12 μL של פתרון הציפוי הטרי לכל באר. להבטיח אפילו הפצה של פתרון ציפוי בתחתית כל הבארות.
- לדגור על הצלחת ב RT עם המכסה על במשך 30 דקות ולהשליך את הפתרון הנוזלי הנותר מכל הבארות.
- לשטוף את הצלחת עם 200 μL של מים סטריליים ולהשליך את הנוזל.
- לשטוף את הצלחת עם 200 μL של PBS סטרילי כיתה תרבית התא ולהשליך את הנוזל.
- השאירו את הצלחת ב RT ולתת לו להתייבש לפחות 30 דקות.
- הכן פתרון ציפוי (ראה טבלת חומרים) המכיל NaHCO3 (pH 8.3, 0.1 M, 1128 μL), Cell-Tak (1 מ"ג / מ"ל, 48 μL) ו NaOH (1.0 M, 24 μL).
- תאי T צלחת בלוח תרבית התא XF (יום 1)
- הכינו 50 מ"ל של מדיה לבדיקה על ידי ערבוב מדיה מתאימה של XF RPMI עם גלוקוז, פירובט וגלוטמין על פי התקנה ניסיונית (רמות מומלצות: 4 מ"מ גלוקוז, 1 מ"מ פירובט ו 3 מ"מ גלוטמין).
- מחממים ל-37 מעלות צלזיוס בחממה מוסדרת שאינה CO2 ומגדירים את רמת החומציות ב-7.4. ודא שיש מספיק מדיה לציפוי תאים ולהכנת פתרונות אוליגומיטיצין ו- FCCP (סעיף 3.4).
- עצב פריסת לוח עם מספר גדל והולך של תאים לבאר עבור הפעלת מיטוב או הפעלת Assay. השתמש בארבע בארות 4, מלא מדיה מוזרק עם מדיה, למדידות רקע.
- ספירת תאי T שהוכנו בסעיף 2.3 (בשיטה המועדפת) ופיפטה את המספר הנכון של תאים לכל באר של צלחת תרבית התא XF מצופה בתמיסת הציפוי, על פי פריסת הלוח.
הערה: הכרך הסופי של כל באר עשוי להשתנות אך חייב להספיק כדי לכסות את תחתית הבאר. - צנטריפוגה צלחת תרבית התא XF ב 1000 x g ב RT במשך 10 דקות כדי לדבוק את תא T למשטח מצופה.
- לשטוף את התאים עם 200 μL של מדיה לבדיקה, להשליך את המדיה ולהוסיף 180 μL של מדיה בדיקה.
הערה: בדוק באופן חזותי את הבארות באמצעות מיקרוסקופ אור הפוך כדי לוודא שהתאים מחוברים ומופצים באופן שווה על פני השטח של הבאר. - דגירה על צלחת תרבית התא XF בארון החימום המוסדר שאינו CO2 במשך 30 דקות כדי להבטיח שטמפרטורת הצלחת היא 37 מעלות צלזיוס.
- טעינת מחסנית חיישן עם אוליגומיצין ו FCCP עבור אופטימיזציה לרוץ (יום 1)
הערה: אם אוליגומיצין וריכוזים FCCP כבר היו ממוטבים, להמשיך בסעיף 3.5.- הכן פתרונות עבודה של אוליגומיצין ו- FCCP במדיה assay (מוכן בשלב 3.3.1) כמתואר בשלבים 3.4.2 ו 3.4.3.
- פתרונות עבודה Oligomycin: להכין פתרון 5 μM (2 מ"ל של מדיה assay + 10 μL של 1 mM מלאי oligomycin) ו 3 μM פתרון (8 מ"ל של מדיה assay + 24 μL של 1 mM מלאי אוליגומיצין).
- פתרון עבודה FCCP: הכן פתרון 2 מיקרומטר (2 מ"ל של מדיה assay + 13.2 μL של 300 μM FCCP מניות) ופתרון 1.3 μM (8 מ"ל של מדיה assay + 34.6 μL של 300 μM FCCP מניות)
- טען את פתרונות העבודה של אוליגומיצין או FCCP ליציאות ההזרקה של מחסנית החיישן (טבלה 2).
הערה. חשוב כי אין יציאות הזרקה להכיל אוויר בלבד. אם, מכל סיבה שהיא, לא כל יציאות ההזרקה משמשות, יש למלא יציאות ריקות במדיה של Assay. - לדפוק בעדינות את הקצוות של הצלחת על השולחן כדי להסיר בועות פוטנציאליות ביציאות ההזרקה.
- מחסנית חיישן טעינה עם אוליגומיצין, FCCP, ו antimycin A עבור הפעלת Assay (יום 1)
- הכן פתרונות של אוליגומיצין, FCCP במדיה assay (מוכן בשלב 3.3.1) על פי הריכוזים האופטימליים שזוהו בהפעלת אופטימיזציה קודמת. כמו כן, להכין 20 μM אנטימיצין A פתרון.
- טען 20 μL של או oligomycin או FCCP לתוך יציאת הזרקה A של מחסנית החיישן על פי פריסת צלחת. הוסף 22 μL של 20 μM אנטימיצין A ליציאת הזרקה B של כל הבארות. הריכוז המתקבל של אנטימיצין A פעם מוזרק לתוך הבאר יהיה 2 מיקרומטר.
- הגדרת פרוטוקול ניסיוני בתוכנת מנתח Flux.
- הקצה את הקבוצות ומפת הלוחות עבור כל תנאי לכל פריסת צלחת.
- עצבו את הפרוטוקול בהתאם לאסטרטגיית ההזרקה (טבלה 3 ואיור 1).
הערה: בעת הפעלת אסאי פועל פועל, הזרקה C ו- D ניתן להשמיט. - שמור את הגדרת הבדיקה, מלא את המידע הדרוש להיכלל עבור הבדיקה ולחץ על התחל.
- מנתח השטף יבקש את מחסנית החיישן שהוכנה בסעיף 3.5. הסר את המכסה והכנס את מחסנית החיישן לפי הוראות המנתח.
הערה: הבדיקה תכייל ותבדוק חיישנים המצוינים על-ידי סימני ביקורת. לאחר כיול מוצלח, המנתח יבקש את לוח תרבית התא XF שהוכן בסעיף 3.3. לוח השירות נפלט מהמנתח ומוחלף בלוח תרבית התא XF כדי להתחיל את הבדיקה.
תוצאות
קביעה נכונה של תכונות OxPhos היא כלי הכרחי בעת לימוד תאי T. עם זאת, אם תנאי הבדיקה לא עברו אופטימיזציה, קיים סיכון משמעותי לתוצאות מטעות או שגויות. בפרוטוקול זה, יש דגש חזק על אופטימיזציה של מספר תא לכל באר וריכוזים של oligomycin ו FCCP לשמש. בהתקנה המתוארת, אוליגומיצין ו- FCCP מתווספים בהדרגה לאותה באר, מה שמגדיל את הריכוז של אפננים מיטוכונדריאליים. הריכוז האופטימלי של אוליגומיצין ו- FCCP ניתן לקבוע מתוך עקומות זיהוי התווים האופטי (OCR) הנובעות מהבארות כמו הריכוז שבו הרמה מגיעה.
בריצה הייצוגית, אוליגומיצין מתווסף בריכוז הולך וגובר ומעכב ATP סינתאז (קומפלקס V של שרשרת הובלת האלקטרונים), וכתוצאה מכך ירידה בנשימה המיטוכונדריאלית. רמה ב OCR הוא הגיע לאחר הריכוז המצטבר של הבארות הגיע 1 מיקרומטר. מריכוז זה ומהריכוזים הגוברים OCR לא צומצם עוד יותר (איור 1A). עבור בארות שטופלו בריכוז מצטבר של FCCP uncoupler, רמות זיהוי התווים האופטי (OCR) עלו כצפוי עד שהגיעו לרמה לאחר הוספת 0.2 מיקרומטר של FCCP, מה שמצביע על כך שבריכוז זה הושג ניתוק מלא (איור 1B). אופטימיזציה של תאים מצופים לכל באר חשוב לבדיקה נכונה לשחזור. אם מספר התא המשומש נמוך מדי, רמת החמצן שהוסרה ממדיית הבדיקה על ידי התאים נמוכה מכדי להימדד כראוי על ידי המנתח. מצד שני, אם מספר התאים לבאר גבוה מדי, צריכת החמצן של התאים יכולה להיות כל כך גבוהה עד שהמערכת לא יכולה לחדש את רמות החמצן של מדיית הבדיקה לאחר כל מדידה, מה שמוביל לסביבה היפוקסית יותר ויותר ואפיון OxPhos שגוי.
בריצה הייצוגית, תאים נזרעו בצפיפות של 200,000 ו-400,000 תאים לבאר (איור 2A-C). עבור ריצה עם 200,000 תאים, זיהוי התווים האופטי (OCR) הראשוני הוא כמחצית מריצה עם 400,000 תאים לבאר. לטיפול ב-FCCP, זיהוי תווים אופטי מרבי הוא 61.6 pmol/min (200,000 תאים) לעומת 190,4 pmol/min (400,000 תאים). לאחר טיפול אוליגומיצין, OCR בריצה עם 200,000 תאים מתמוטט לתוך OCR חד ספרתי (6.4 pmol / min). זה נמוך יותר מאשר OCR של הריצה, עם 400,000 תאים לכל מטופל היטב עם אוליגומיצין (25.8 pmol/min, בהתאמה).
לכן, מן האופטימיזציה לרוץ, ברור כי מספר תא של 400,000 תאים לבאר נדרש עבור בדיקות עתידיות, באמצעות 1 μM oligomycin ו 0.2 μM FCCP. במערך הקלאסי המומלץ על ידי היצרן, אוליגומיצין ו FCCP מתווספים ברצף עם התוספת הסופית של אנטימיצין A. עבור תאי T, זו אינה הגישה האופטימלית שכן ניתן לראות את הטיפול באוליגומיצין מגביל את הניתוק לאחר טיפול FCCP (איור 3A, B). בשיטה מוצגת זו, מומלץ להפעיל כל תנאי בארות כפולות ולטפל אחד היטב עם אוליגומיצין והשני עם FCCP, עם תוספת סופית של אנטימיצין A עבור שתי הבארות. באמצעות גישה זו, הטיפול oligomycin אינו משפיע על OCR לאחר טיפול FCCP. גישה זו מאפשרת לקבוע את אותם מאפיינים מיטוכונדריאליים כמו ההתקנה הקלאסית, שבה תרופות מתווספות ברצף (איור 3C)
לבסוף, הוא נחקר אם ההשפעות של ציטוקינים IL-2 ו IL-15 ניתן להבדיל על חילוף החומרים של ex vivo תרבית תאי T ראשוני אנושי. ואכן, לתאים בתרבית IL-15 היו נשימה מקסימלית גבוהה יותר ויכולת נשימה רזרבית, כפי שהוכח בעבר (איור 4A-E). נשימה בסיסית וייצור ATP לא הושפעו. יחד, נתונים אלה מראים כי הנשימה המיטוכונדריאלית של תאי T ראשוניים אנושיים מתורבתים ex vivo ניתן לנתח בהצלחה באמצעות מנתח שטף חוץ תאי.

איור 1: שיעור צריכת חמצן (OCR) נמדד במהלך טיטרציה של מעכבי אוליגומיצין ו- FCCP בתאי T ראשיים אנושיים מתורבתים לשעבר . (A) זיהוי תווים אופטי (OCR) במהלך תיקון צעדים של אוליגומיצין מריכוז סופי של 0-1.25 מיקרומטר. (B) זיהוי תווים אופטי (OCR) במהלך שלב titration של FCCP מריכוז סופי של 0-0.5 μM. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ההשפעה של ריכוז התאים על מדידות זיהוי תווים אופטי (OCR) בתאי T ראשוניים אנושיים מתורבתים. מדידות OCR של ex vivo תרבית תאי T ראשוניים אנושיים עם 200,000 או 400,000 תאים לבאר לאחר הזרקה של או (A) FCCP או (B) אוליגומיצין. (ג) נשימה בסיסית, נשימה מקסימלית, ייצור ATP ויכולת נשימה רזרבית של תאי T ראשוניים אנושיים באמצעות 200,000 או 400,000 תאים לבאר. נציג של שלושה ניסויים עצמאיים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
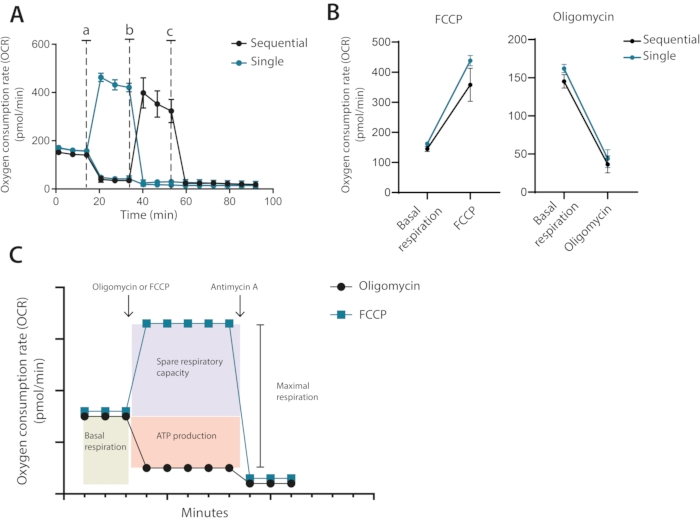
איור 3: הזרקה יחידה או רציפה של אפננים מיטוכונדריאליים. (A) מדידות זיהוי תווים אופטי (OCR מייצגות) במהלך הבסיס ולאחר הזרקת אוליגומיצין ו- FCCP (א,ב), או אנטימיצין A (ג) כזריקות בודדות בודדות או כהזרקות רציפות. (B) ערכי זיהוי תווים אופטי (OCR לפני הזרקה (נשימה בסיסית) או לאחר הזרקת אוליגומיצין או FCCP כזריקות בודדות או זריקות רציפות. (ג) ייצוג סכמטי של אסטרטגיית הזרקה ומדידה. נציג של ניסוי עצמאי אחד אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
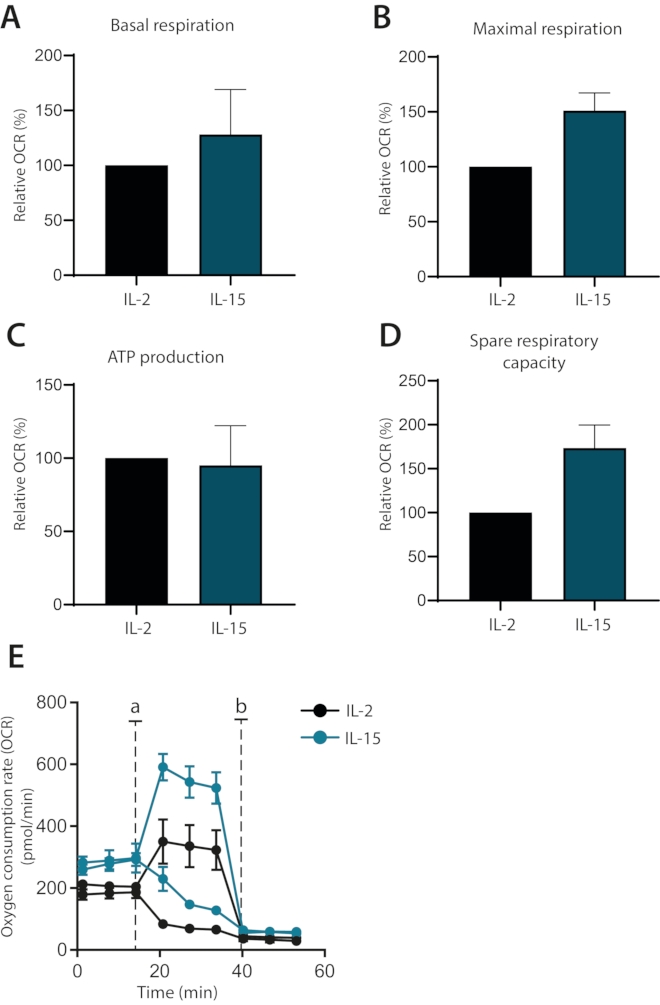
איור 4: הבדלים בנשימה מיטוכונדריאלית בתאי T ראשוניים אנושיים מובחנים בציטוקינים. (א-ד) נשימה בסיסית, נשימה מקסימלית, ייצור ATP ויכולת נשימה רזרבית של תאי T ראשוניים אנושיים בתרבית IL-2 או IL-15 במשך שבעה ימים (n = 3). (E) חלקות מייצגות של (A-D), עם זריקות של אוליגומיצין או FCCP (א) או אנטימיצין A (ב). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| ציטוקינים | [מלאי] | גורם דילול | [סופי] | |
| תנאי 1 | IL-2 | 3 x 106 U/mL | 30,000 | 100 U/mL |
| תנאי 2 | IL-15 | 2 x 105 U/mL | 2,000 | 100 U/mL |
טבלה 1: הכנת תרביות ציטוקינים המשמשות להנחיית שינויים מטבוליים בתאי T.
| אוליגומיצין | FCCP | |||||
| עובד סול. | הסכמה סופית. | וול. | עובד סול. | הסכמה סופית. | וול. | |
| יציאה A | 5.0 μM | 0.50 מיקרומטר | 20 μL | 2.0 μM | 0.2 מיקרומטר | 20 μL |
| יציאה B | 3.0 μM | 0.75 מיקרומטר | 22 μL | 1.30 מיקרומטר | 0.3 מיקרומטר | 22 μL |
| יציאה C | 3.0 μM | 1.0 מיקרומטר | 24 μL | 1.30 מיקרומטר | 0.4 מיקרומטר | 24 μL |
| יציאה D | 3.0 μM | 1.25 מיקרומטר | 27 μL | 1.30 מיקרומטר | 0.5 מיקרומטר | 27 μL |
טבלה 2: אסטרטגיה להכנת מעכבי מיטוכונדריה ומאפננים. ריכוזי הכנה, ריכוזי עבודה ואסטרטגיות הזרקה עבור ריצת אופטימיזציה.
| פעולה | פרטים | פרטי מדידה |
| בסיסית | מדידות בסיסיות | 3 מדידות |
| זריקה | הזרקת יציאה A | 3 מדידות |
| זריקה | הזרקת יציאה B | 3 מדידות |
| זריקה | הזרקת יציאה C | 3 מדידות |
| זריקה | הזרקת יציאה D | 3 מדידות |
| מידה | מדידות נוספות | אופציונלי |
טבלה 3: עיצוב פרוטוקול של אופטימיזציה לרוץ עם טיטרציה של מעכבי מיטוכונדריאלי ומאפננים באמצעות 4 זריקות עם 3 מדידות בכל אחד.
| אלמנט של זרחן חמצוני מיטוכונדריאלי | הסבר | ||
| נשימה בסיסית | נשימה בסיסית היא מדד בסיסי של קצב החמצן הנצרך על ידי תאי T מגורה לפני תוספת של מעכבי מיטוכונדריה. זהו מדד של צריכת החמצן המשמשת כדי לענות על הביקוש ATP הסלולר הנובע מדליפת פרוטון מיטוכונדריאלי. ככזה, הוא מספק סקירה כללית של זרם הפרוטון שנוצר כדי לספק סינתזת ATP ודליפת פרוטון. עם זאת, זהו גם מדד שניתן לשנות בהתאם למצעים הקיימים בתקשורת הצמיחה, גירוי של תאים לפני הבדיקה וגורמים חיצוניים אחרים. הנשימה הבסיסית היא אפוא אמצעי המשמש להשוואת שני סוגי תאים שונים או יותר ו/או טיפולים שונים האמין להשפיע על המצב המטבולי התאי של התאים. נשימה בסיסית מחושבת כהבדל ב- OCR לפני הוספת אפננים מיטוכונדריאליים (אוליגומיצין או FCCP) ולאחר הוספת אנטימיצין A | ||
| נשימה מקסימלית | מדד זה הוא הקצב המקסימלי של חמצן שניתן לצרוך עבור זרחן חמצוני. קצב החמצן הנצרך על ידי זרחן חמצוני נקבע הן על ידי היכולת של שרשרת הובלת האלקטרונים לשאוב פרוטונים על פני הממברנה המיטוכונדריאלית הפנימית, והן על ידי היכולת של סינתאז ATP להשתמש בשיפוע הפרוטונים לזרחן ATP מ- ADP. המהירות של סינתאז ATP מוגבלת על ידי מצע ADP חינם ובכך על ידי המצב האנרגטי הכללי של התא. בעת טיפול בתאים עם FCCP uncoupler המיטוכונדריאלי, פרוטונים יכולים לחצות בחופשיות בחזרה על פני הממברנה המיטוכונדריאלית הפנימית. זה מחקה מצב שבו התאים חווים דרישת אנרגיה בלתי רוויה, והנשימה המקסימלית היא אפוא מדד לקצב המקסימלי של חמצן שניתן לצרוך על ידי שרשרת הובלת האלקטרונים. נשימה מקסימלית מחושבת כהבדל ב- OCR של תאים שטופלו ב- FCCP ותאים שטופלו באנטימיצין A | ||
| מחזור ATP | נשימה הקשורה ATP נמדדת כהבדל OCR לאחר עיכוב של סינתאז ATP באמצעות אוליגומיצין. החמצן שאחרת היה נצרך עבור זרחן של ADP על ידי זרחן חמצוני כבר לא ישמש כמו תהליך זה נעצר. נשימה הקשורה ATP היא אפוא יחסית ATP המיוצר על ידי זרחן חמצוני. שינויים בנשימה המקושרת ל- AT הם תגובה של המיטוכונדריה לדרישת ATP שונה של התא נשימה מקושרת ATP מחושבת כהפרש ב- OCR לפני הוספת אפננים מיטוכונדריאליים (אוליגומיצין או FCCP) ולאחר הוספת אוליגומיסצין | ||
| קיבולת נשימה רזרבית | יכולת הנשימה הרזרבית היא מדד ליכולת תיאורטית נוספת לייצר ATP כתגובה לביקוש אנרגטי מוגבר. הוא מוגדר כהבדל בין נשימה בסיסית לנשימה מקסימלית. שינויים ביכולת הנשימה הרזרבית יכולים להיות אינדיקטור לכושר וגמישות מיטוכונדריאלי ותאי. | ||
טבלה 4: הסבר על המרכיבים השונים של נשימה מיטוכונדריאלית הנחקרים באמצעות מנתח השטף
Discussion
כימות מפורט ונכון של זרחן חמצוני הוא כלי הכרחי כאשר מתארים את מצבי האנרגיה של תאי T. מצב הכושר המיטוכונדריאלי יכול להיות קשור ישירות לפוטנציאל הפעלת תאי T, הישרדות ובידול1,5. עם פרוטוקול זה, ניתן לקבוע את המאפיינים השונים של זרחן חמצוני (ראה טבלה 4 להסבר מפורט). כימות מדויק של תכונות אלה של זרחן חמצוני מציע תובנה מפורטת על מצבי האנרגיה של תאי T. עם זאת, כדי להשיג תוצאות אמינות, יש להקפיד מאוד בעת הגדרת הניסוי.
בפרוטוקול זה, שלושת שלבי המיטוב הבאים מומלץ-הראשון, אופטימיזציה של מספרי תאים. היכולת של מנתח שטף למדוד כראוי ריכוזי חמצן עוקבת אחר עקומת סיגמואיד; שינויים בחמצן קטנים מדי או גדולים מדי ייפלו מחוץ למרווח ההפעלה של המכונה ולכן לא יימדדו כראוי. זה מחייב אופטימיזציה של מספרי תאים לשימוש לאורך כל הניסוי. אם נבדקים מעט מדי תאים, השינויים בצריכת החמצן נמוכים מכדי להימדד כראוי. אם יותר מדי תאים, קיים סיכון של דלדול חמצן בתקשורת הבדיקה. לכן מומלץ לבצע הפעלה ראשונית, עם מספרי תאים הנעים בין 100,000-400,000 תאים לבאר. בעת התוויית מספר תא לעומת נשימה בסיסית, ספירת התאים האופטימלית תהיה בטווח הליניארי של העקומה. בעת אופטימיזציה של ההתקנה, שים לב כי יכול להיות הבדל מעריכי בפעילות המיטוכונדריאלית בין תאים נחים ומופעלים, ולכן יש למטב בהתאם.
שנית, טיטרציה של ריכוזי מעכבים. כאשר מטפלים בתאים עם אוליגומיצין ו- FCCP, חשוב לזהות את הריכוזים האופטימליים של המעכבים לשימוש. ריכוז נמוך מדי יגרום לעיכוב תת-אופטימלי ומדידה שגויה של נשימה מיטוכונדריאלית. זה נפוץ כי אנשים להשתמש בריכוזים המומלצים הגבוהים ביותר של המעכבים כדי להבטיח כי עיכוב מלא מתקבל. זה גם בעייתי כמו ריכוזים גבוהים מדי של מעכבים יכול להיות השפעות pleiotropic. Unouplers כמו FCCP גם להפעיל את השפעתם על ממברנות שאינן המיטוכונדריה, וכתוצאה מכך מגוון של השפעות לא רצויות, כולל depolarization קרום פלזמה, עיכוב מיטוכונדריאלי, ו ציטוטוקסיות. בפרוטוקול זה, טיטרציה של oligomycin ו FCCP נעשה בו זמנית עם אופטימיזציה מספר תא. במהלך הפעלת אופטימיזציה, הגדלת ריכוזים של oligomycin או FCCP מתווספים באמצעות ארבע יציאות המצע הזמינות. בדיאגרמת זיהוי התווים האופטימלית המתקבלת, הריכוז האופטימלי יכול להיקבע חזותית כריכוז שבו זיהוי התווים האופטי (OCR) מגיע לרמה יציבה. לאחר הריכוז של oligomycin ו FCCP כבר titrated, ריכוזים אלה יש להשתמש לאורך כל הניסוי.
שלישית, רצף לעומת תוספת בודדת של מעכבים. בדיקות סוסון ים קלאסיות נערכות בדרך כלל עם התוספת הרציפה של האוליגומיצין הראשון ואחריו התוספת של FCCP. בתאי T ובתאים רגישים אחרים, תוספת רציפה כזו יכולה לגרום לכימות שגוי של נשימה מקסימלית. בתורו, הרמות הנמדדות של קיבולת הנשימה הרזרבית ידווחו נמוך יותר ממה שהם. דוגמאות חמורות לכך כוללות ערכים של יכולת נשימה רזרבית שהם שליליים. זה, כמובן, לא אפשרי מבחינה ביולוגית והוא נגרם על ידי רגישות מוקדמת של המיטוכונדריה על ידי טיפול אוליגומיצין. בפרוטוקול זה, במקום זאת מומלץ שהתאים יטופלו רק עם אוליגומיצין או FCCP (ראו איור 3C להשוואה המחשה).
לבסוף, פרוטוקול ממוטב זה משמש כדי להראות כיצד ניתן להבחין בבירור בין תרביות תאי T ראשיים של IL-15 לתאים בתוספת IL-2 בהתבסס על הנשימה המיטוכונדריאלית שלהם. לתאים בעלי תרבית IL-15 יש נשימה מקסימלית גבוהה יותר ויכולת נשימה רזרבית, מצב מטבולי המקושר לתאי זיכרון T1,6. תצפיות אלה עולות בקנה אחד עם מחקרים קודמים המקשרים IL-15 לתתי-קבוצות תא T זיכרון8. בנוסף, נצפה הבדל בנשימה הבסיסית אך לא בייצור ATP בהשוואה לתאים בעלי תרבית IL-2. זה מצביע על כך שתאים אלה משתמשים ביכולת הגליקוליטית שלהם כדי לעמוד בדרישות המטבוליות הבסיסיות, מסלול הקשור לתאים מובחנים יותר. יחד, הוא הראה כי מודל תא T זיכרון אנושי ניתן להקים במבחנה באמצעות תוספי IL-15. שימוש בסביבה עשירה ב-IL-15 לקידום התפתחות תאי זיכרון הוכח בעבר ותומך עוד יותר בממצאים8.
בשיטה זו, אוליגומיצין, FCCP, ו antimycin A שימשו כדי לכמת את המאפיינים של OxPhos. תרכובות אחרות קיימות עם השפעות דומות, אשר פוטנציאל יהיה מתאים יותר עבור תאי T. דוגמה לכך היא להשתמש BAM15 uncoupler במקום FCCP כדי להפחית את depolarization של הממברנה המיטוכונדריאלית וכדי למנוע ציטוטוקסיות9. בשיטה זו, תרכובות אלה לא נחשבו, כמו אוליגומיצין, FCCP, ואנטימיצין A היו אפננים המיטוכונדריאליים המומלצים לניסויי סוסון ים בעשור האחרון. השימוש בתרכובות אלה מוכר אפוא על ידי סוקרים וחוקרים אחרים העובדים עם OxPhos. משתמשים מנוסים יותר של מנתח שטף סוסון הים מעודדים להשתמש אלה תרכובות חלופיות, אבל השימוש אלה הוא מחוץ לטווח של נייר זה.
ניטור OxPhos מיטוכונדריאלי הוא כלי חיוני להבנת תפקוד תאי T ושיפור immunotherapies סרטן. כאמור, תאים מורחבים IL-15 - עם פנוטיפ זיכרון פחות מובחן - הוכחו כמשפרים את התגובות לטיפולים בתאי CAR T, מכיוון שהם היו פחות מותשים והייתה להם פעילות אנטיטומור מוגברת10. פרוטוקול ממוטב זה יכול להיות כלי יעיל לחקר האיכות של תאי T הן בהגדרות פרה-קליניות והן בהגדרות קליניות. לסיכום, פרוטוקול זה מיישם צעדים לאופטימיזציה של מספרי תאים וריכוזי מעכבים לשימוש בתאי T ראשוניים אנושיים מתורבתים ex vivo בבדיקות מטבוליות.
Disclosures
המחברים מצהירים שאין ניגוד אינטרסים.
Acknowledgements
קספר מולגארד ואן רהבך קיבלו מענקים מטומרמסטר יורגן הולם og Hustru Elisa f. Hansens Mindelegat. קספר מולגארדלסו קיבל מענק מבורנקנסורפונדן.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well tissue culture plate | Nunc | 142485 | |
| Anti-CD3xCD28 beads | Gibco | 11161D | |
| Antimycin A | Merck | A8674 | |
| Carbonyl cyanide 4-(trifluoromethoxy)-phenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Cell-Tak | Corning | 354240 | For coating |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D9170 | |
| Human Serum | Sigma Aldrich | H4522 | Heat inactivated at 56 °C for 30 min |
| IL-15 | Peprotech | 200-02 | |
| IL-2 | Peprotech | 200-15 | |
| Lymphoprep | Stemcell Technologies | 07801 | |
| Oligomycin | Merck | O4876 | |
| PBS | Thermo Fisher | 10010023 | |
| RPMI 1640 | Gibco-Thermo Fisher | 61870036 | |
| Seahorse Calibrant | Agilent Technologies | 102416-100 | |
| Seahorse XF 1.0 M glucose solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100 mM pytuvate solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200 mM glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF RPMI medium, pH7.4 | Agilent Technologies | 103576-100 | XF RPMI media |
| Seahorse XFe96 Analyser | Agilent Technologies | Flux analyzer | |
| Seahorse XFe96 cell culture microplates | Agilent Technologies | 102416-100 | XF cell culture plate |
| Seahorse XFe96 sensor cartridge | Agilent Technologies | 102416-100 | |
| Sodium Bicarbonate concentrate 0.1 M (NaHCO3) | Sigma Aldrich | 36486 | |
| Sodium Hydroxide solution 1 N (NaOH) | Sigma Aldrich | S2770-100ML | |
| X-VIVO 15 | Lonza | BE02-060F | |
| T cell beads magnet DynaMag-2 Magnet | Thermo Fisher | 12321D | |
| Seahorse wave | Flux analyzer software |
References
- vander Windt, G. J. W., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Krauss, S., Brand, M. D., Buttgereit, F. Signaling takes a breath--new quantitative perspectives on bioenergetics and signal transduction. Immunity. 15 (4), 497-502 (2001).
- vander Windt, G. J. W., et al. CD8 memory T cells have a bioenergetic advantage that underlies their rapid recall ability. Proceedings of the National Academy of Sciences of the United States of America. 110 (35), 14336-14341 (2013).
- Chang, C. -. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- vander Windt, G. J. W., Chang, C. -. H., Pearce, E. L. Measuring bioenergetics in T cells using a Seahorse extracellular flux analyzer. Current Protocols in Immunology. 113, 1-14 (2016).
- Buck, M. D., O'Sullivan, D., Pearce, E. L. T cell metabolism drives immunity. Journal of Experimental Medicine. 212 (9), 1345-1360 (2015).
- Rivadeneira, D. B., Delgoffe, G. M. Antitumor T-cell reconditioning: Improving metabolic fitness for optimal cancer immunotherapy. Clinical Cancer Research. 24 (11), 2473-2481 (2018).
- Cieri, N., et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors. Blood. 121 (4), 573-584 (2013).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Alizadeh, D., et al. IL15 enhances CAR-T cell antitumor activity by reducing mTORC1 activity and preserving their stem cell memory phenotype. Cancer Immunology Research. 7 (5), 759-772 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved