Method Article
CRISPR/Cas9 を使用して遺伝子変異カルレティキュリン サイトカイン依存性造血細胞での発癌性の活動を調査する編集
要約
CRISPR/Cas9 を使用して、編集対象となる遺伝子は、遺伝子の生物機能の理解を促進しています。ここでは、その発癌性の活動を研究するためにサイトカイン依存性造血細胞のモデル カルレティキュリン変異に CRISPR/Cas9 方法論を活用します。
要約
クラスター化された空間定期的に短い回文繰り返し (CRISPR) は CRISPR 関連 (Cas) 9 サイト固有の真核生物ゲノムのなどの RNA 誘導の核酸を生成する科学者によって用途が変更されている原核生物の適応免疫システム編集します。Cas9 によるゲノム工学を使用して、効率的に、簡単に、確実が多く biomedically に関連する哺乳類細胞および生物における内在性の遺伝子を変更します。ここで特定の遺伝の突然変異の生物学的機能を理解する CRISPR/Cas9 方法論を利用する方法の例を紹介します。シングル ガイド Rna (sgRNAs) 特定の地域における内因性Calr座をターゲットの配信によってカルレティキュリン (CALR) 変異によるインターロイキン 3 (mIL-3) 依存プロ B (Ba/F3) 細胞内モデル、挿入・削除 (塩基) 骨髄増殖性腫瘍 (MPN)、血液の癌の種類と患者のCALRの突然変異が発生します。SgRNAs は、非相同末端結合 (NHEJ) 様々 なサイズの indels の扱いを与えることで修復されている対象地域の二重鎖切断 (Dsb) を作成します。我々 は、造血細胞変換のCalr突然変異の生理的レベル式の効果を理解する、標準 ba/f3 細胞形質転換試験を採用しています。このアプローチは、様々 な哺乳類細胞の生物学的機能を研究する他の遺伝子に適用できます。
概要
CRISPR/Cas9 技術最近生きている細胞および生物における標的ゲノム編集をもたらしました。それは生物医学研究のための非常に強力なツールとなっている、現在遺伝病1の治療のための潜在的な道として利用されています。すべてのゲノムの編集ツールのための基礎は変更する genomic 位置で、ヌクレアーゼによる DNA 二重鎖切断 (DSB) の作成に依存します。非相同末端結合 (NHEJ) または相同監督修理 (HDR)2,3によって、Dsb を修復できます。他のゲノムの核酸、亜鉛指核酸 (ZFNs) などを工学上 Cas9 ヌクレアーゼと転写活性化因子のようなエフェクター核酸分解酵素 (TALENs) の利点は、比較目的の DNA シーケンスにヌクレアーゼのターゲット RNA 依存性ZFNs と TALENs2,3の蛋白質 DNA 相互作用。
原核細胞4,5適応免疫系として CRISPR/Cas9 ヌクレアーゼ経路の発見は後、多くの努力は哺乳類セルライン、モデル生物2,用経路の適応になっています。3。 遺伝子編集用ツールとして CRISPR/Cas9 経路は 2 つの主要なコンポーネントを利用して: Cas9 ヌクレアーゼと sgRNAs 金利2,3の遺伝子をターゲットに化膿連鎖球菌(Sp) が派生しました。SgRNA は、20 ヌクレオチド RNA DNA 塩基の相補性2,3ゲノムの特定のサイトに、直接 Cas9 で構成されます。SgRNA のターゲット サイトは 5' SpCas9 ヌクレアーゼによって認識され、NGG の形で protospacer の隣接するモチーフ (PAM) のサイトに隣接してある必要があります。これらのツールは、sgRNAs を対象とする関心領域を設計することによって任意の DNA シーケンスに Cas9 を送信できます。さらに Sp Cas9 を得、特定のアプリケーションによって異なる機能を持つ Cas9 の追加バリエーションがあります。たとえば、対象の編集に高い特異性と6、7の刻み目をつける人 DNA の単鎖切断能力 Cas9 バリエーションがあります。さらに、触媒非アクティブ Cas9 は最近転写調節8に開発され。科学者は、遺伝子のノックやノックアウト遺伝子9、機能喪失、利得関数のライブラリ画面10と遺伝子の生物学的機能を研究するなど、アプリケーションのさまざまな CRISPR/Cas9 システムを使用している今モデル生物11工学。
このプロトコルではCALRの突然変異の生物学的機能を理解する、ba/f3 細胞形質転換試験 CRISPR/Cas9 の方法論と組み合わせています。Ba/f3 細胞は IL 3 に表示できるマウス IL 3 依存造血細胞ライン BCR-ABL12など特定の遺伝子の発現に依存します。変異カルレティキュリン ba/f3 細胞サイトカイン依存性の成長を変換できるかどうかを理解するためには、CRISPR/Cas9 を使用して塩基変異を導入する内因性のCalr座のエクソン 9 を対象とし、適用するセルから IL 3 を撤回した、正の選択圧、MPN 患者は、利得関数のCALR突然変異をさたことを目標にします。デザイン、クローニング、sgRNAs、Cas9 の安定発現細胞の開発の配信プロトコルが含まれ、CRISPR 検診対象の遺伝子編集します。このプロトコルは異なる遺伝子または様々 なサイトカイン依存性細胞線に適用できるし、モデリングと癌関連遺伝子の生物学的機能を勉強で特に有用。
プロトコル
1. sgRNA オンライン ツールを使用してデザイン13
-
自由に利用できるオンライン ツールを使用して興味の遺伝子をターゲット sgRNAs をデザインします。
- ブロード研究所 sgRNA デザイナー web ツールに興味の遺伝子の NCBI 参照シーケンスのコピーとペースト: (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design)。
注: このツールを識別エクソン内の胸の谷間のサイトと sgRNA シーケンスし、エクソン内クリーブそれでもエキソン/イントロン境界にまたがるもの。 - ダウンロードし、excel のテキスト出力ファイルに開きます。
- SgRNA シーケンスと sgRNA コンテキスト シーケンスに表示される列に焦点を当てます。Protospacer 隣接するモチーフ (PAM) sgRNA シーケンスが含まれていないが、コンテキストのシーケンスに注意してください。
- ターゲットの有効性スコアが 1 のスコアが高い開裂の効率を表す 0 から 1 の規模で予測された胸の谷間効率スコアを示しているに注意してください。
- '種' 関数 excel 有効性スコアまたは 'ターゲット カット %' の列をターゲットの遺伝子内の場所もターゲットを並べ替えるを使用します。
注: は、特定のドメインまたは関心のエクソンを対象とする sgRNAs を識別するのに役立ちます遺伝子内の位置によって並べ替えです。 - 高い関心のある分野を対象とする 3-6 sgRNAs を選択 (> 0.6) ターゲットの有効性スコア。どのような種類の突然変異は目的 (ください参照図 1カルレティキュリンに使用されるターゲット戦略を説明する) 表現型行うことができます知っていることができます。
注: 他の良い候補者が不足がある場合は、推奨の 0.6 の有効性スコアしきい値以下 sgRNAs を考慮必要があります。 - 潜在的なオフターゲット効果 (http://crispr.mit.edu/) の画面に MIT gRNA 分析 web ツールを使用します。各 sgRNA を選択、ターゲット シーケンス (PAM を含む) を実行します。
メモ: ブロード研究所 sgRNA デザイナー web ツールを使っても的外れの効果 (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design) の画面に。- 100 のスコアが高い特異性を示すことを MIT sgRNA 解析ツールが 1 〜 100 のスケールでに各 sgRNA にスコアに注意してください。70 より大きいスコアと最小のオフターゲット効果の sgRNA を表します。このウェブサイトはまたリストを生成する候補ガイドがそれぞれのゲノムとどのように多くの不一致の別の場所にターゲットをヒット。
注: ターゲットをヒット以上 4 つの不一致は、安全14と見なされます。以下の 4 つの不一致でターゲットをヒットはエクソン14内にある場合に問題となる可能性があります。
- 100 のスコアが高い特異性を示すことを MIT sgRNA 解析ツールが 1 〜 100 のスケールでに各 sgRNA にスコアに注意してください。70 より大きいスコアと最小のオフターゲット効果の sgRNA を表します。このウェブサイトはまたリストを生成する候補ガイドがそれぞれのゲノムとどのように多くの不一致の別の場所にターゲットをヒット。
- 2-3 sgRNAs ターゲット ターゲット遺伝子のための関心領域内の異なる場所である最高のペアになっている胸の谷間効率とオフのターゲット スコアを選択 (sgRNA シーケンスCalrのエクソン 9 をターゲットのテーブル 1を参照)。
注: 実験の目的に応じてより大きい重点は上記のツールから得られる別の値に置かれるかもしれない。
- ブロード研究所 sgRNA デザイナー web ツールに興味の遺伝子の NCBI 参照シーケンスのコピーとペースト: (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design)。
2. クローニング sgRNA Oligos13
-
前方のオリゴを生成します。
- PAM サイトなし sgRNA シーケンスの一覧を作成します。
- SgRNA シーケンスの 5' 端が G ではない場合、シーケンスの 5' 端に G を追加します。
注: この G は、U6 駆動 sgRNA 転写レベルを最大化するため必要です。G の添加は、m1 sgRNA (表 1) に必要です。 - G 最適化ガイド シーケンス (ない PAM) の 5' 端にシーケンス"CACC"を追加 (テーブル 2) BsmBI に焼なまし oligos のライゲーションに必要なオーバー ハングを生成するためにlentiGuide ベクトルを消化 (手順 3 を参照してください).
-
逆のオリゴを生成します。
- 逆の補数 G 最適化ガイド シーケンス (PAM なし)。
- 逆補完 G 最適化ガイド シーケンス (表 2) の 5' 末端に"AAAC"シーケンスを追加します。
- プライマー合成会社から設計されていた oligos を注文します。
-
アニールし、oligos をリン酸化
- 前方オリゴ (100 μ M)、逆オリゴ (100 μ M) の 1 μ L の 1 μ L を追加、1 μ L T4 結紮 x 10 のバッファー、T4 ポリヌクレオチド キナーゼ (pnk 式) の 0.5 μ L と H2O PCR チューブに 6.5 μ L (合計 = 10 μ L)。
- たちで次のプログラムを実行: 30 分、95 ° C 5 分、0.1 で 25 95 からランプ 37 ° C ° C/s。
- H2o. に反応生成物を希釈します。
3. lentiGuide Puro ベクトル13の消化
-
ダイジェスト lentiGuide Puro ベクトル
- 次のコンポーネントと 50 μ L 消化反応を組み立てる: 円形プラスミド、2 μ L (30 台) BsmBI 制限の酵素、制限酵素バッファーと H2o. の 50 μ L まで 5 μ L の 5 μ g
- 55 ° C で 2 時間反応を実行します。最初の 1 時間後、1 μ L 以上の制限の酵素の BsmBI を追加します。
-
Dephosphorylate カットのバックボーン
- 脱燐酸化酵素反応バッファーの 7 μ L とホスファターゼ酵素の 2 μ L を消化のベクトルに追加します。
- 37 ° C で 30 分間インキュベートします。
- PCR は、カットと商業キットを使用して脱燐酸化されたバックボーンを浄化します。
注: 代替 miniprep キットで提供されているピンク色のついた列青の色のついた列これらより大型プラスミドのサイズに対応することができますので。(2 番目の時間を通って最初の溶出から溶離された DNA を実行) に二倍列から DNA を溶出して溶出バッファーで溶出する前に 90 ° C の熱ブロックを加熱することによって、収量を増やすことができます。
4. 結紮 ofAnnealed Oligos 消化バックボーン13に
- 追加 50 消化バックボーン、1 μ L の ng 焼鈍オリゴ希釈、1 μ L T4 結紮 x 10 のバッファー、T4 リガーゼと H2O PCR チューブに 10 μ L まで 1 μ L。室温で 1 時間インキュベートします。
- Ligation の反作用の 2 μ L で Stbl3 セルを変換します。100 μ g/mL アンピシリンとホストゲノム スープ (LB) 寒天プレート上にプレートし、37 ° C で一晩インキュベート
- 3 コロニーをピックアップし、小型準備文化に接種します。
-
正しいオリゴ挿入を検証します。
- それぞれの文化や商業キットを使用して U6 プロモーターのプライマーから始まってオリゴ挿入部位により、一連の miniprep を実行します。
- Midi 準備またはシーケンス確認文化のマキシ prep を実行します。
5 世代携帯 lLines 安定を表現する SpCas9 の
注: このプロトコルには、レンチ ウイルス感染によって pLX_TRC311 Cas9 プラスミドの配信が含まれます。このプロトコルはマウス インターロイキン 3 (mIL-3) 依存 pro-B (Ba/F3) 細胞、懸濁液のセルラインの詳細に記載されて、セル タイプごとに最寄りの培養条件を使用して他のセル型に合わせることができます。Ba/f3 細胞の培養液から成っている 10% 牛胎児血清 1% ペニシリン/ストレプトマイシン添加 RPMI/L-グルタミンとマウス インターロイキン 3 10 ng/mL。
-
HEK 293 t 細胞を transfect します。
- 10 cm 培養皿あたり 3 × 106 HEK 293 t 細胞を播きます。トランスフェクション前に一晩シード細胞を保ちます。
注: HEK 293 t 細胞付着性のセル行、ウイルス産生に日常的に使用されます。セルは、10% 牛胎児血清 1% ペニシリン/ストレプトマイシン/L-グルタミンを DMEM に保持されます。セルは、トランスフェクションの時点で 80% の合流をする必要があります。 - 前の暖かい減少血清メディア (Opti MEM) と成長媒体。
- チューブに低下した血清中メディアの 500 μ L、pLX_TRC311 Cas9 構築、pCMV VSV G レンチ ウイルス包装プラスミドの 4 μ g と psPAX2 レンチ ウイルス包装プラスミドの 4 μ g の 7 μ g を追加します。
注: 293 t 細胞の 10 cm 皿あたりの全 DNA は 15 μ g です。 - DNA をよく混ぜ、トランスフェクション試薬の 45 μ L を追加します。軽く混ぜて、20 分間放置します。
注: 血清は、トランスフェクション試薬とプラスミド DNA との複合体形成を阻害するため低下した血清中のメディアを使用することが重要です。 - 293 t 板の古い培地を吸引し、新しい成長培地 5 mL を追加します。
- 293 t プレートにドロップ賢明な方法で DNA、トランスフェクション試薬のミックスを追加します。ゆっくり旋回し、24 h の CO2を 37 ° C、5% で孵化させなさい。
- 24、48 h ポスト トランスフェクションでウイルス上清を収穫します。クリオバイアル管 (1.6 mL/チューブと 1.5 mL は感染症に使用する) に 0.22 μ m のフィルターそして因数を通過します。
- -80 ° C のウイルス上清を保存します。
注: レンチ ウイルス上清は、6 ヶ月以内に使用できます。可能であれば、spinfection 伝達対象となる新鮮なウイルス)。
- 10 cm 培養皿あたり 3 × 106 HEK 293 t 細胞を播きます。トランスフェクション前に一晩シード細胞を保ちます。
-
Ba/f3 細胞のレンチ ウイルス感染
- 凍結されている場合は、氷の上のウイルス上清を解凍します。
- 4 分の 300 x g で細胞を遠心します。
- 上清を吸引し、3 x 106セル/mL の濃度で細胞を再懸濁します。
- 再懸濁細胞、ウイルス上清の 1.5 mL、polybrene の 4 μ L を 500 μ l 添加 (在庫: 2 mg/mL) と 6 も組織培養プレートに m IL3 10 ng/mL。含めるコントロールとしてウイルス上清ではなくメディアの 1.5 mL でも、感染していないことを確認します。
注: ウイルス上清を追加量は感染 (MOI) の多様性に対応する必要があります < 1。 - 37 ° C で 120 分の 440 x g でプレートを遠心分離します。
- 遠心分離機からプレートを取ると 37 ° C および 5% の CO2インキュベーターに配置し、一晩成長することができます。
- 24 h 後スピンダウンするとセルと 6 ウェル プレートで新鮮な暖かいメディアの 5 mL で再懸濁します。
-
Cas9 感染細胞の選択
- セルを回し、ブラストサイジン、48 h のポスト spinfection の 5 μ G/ml を添加した新鮮な暖かいメディアで再懸濁します。
- ブラストサイジンまたは感染していない (否定的な) 制御の細胞が死んでいるまで 9 日のセルを選択します。
- 選択が完了したら、一度耐性細胞をブラストサイジンの濃度の低い媒体に転送します。
6. Cas9 のレポーターアッセイ活動15
- 親細胞とレンチ ウイルス感染によって pXPR-011 と Cas9 を安定に発現する細胞を変換 (手順 5.1 5.2 を参照)。
注: このベクトルには GFP と GFP をターゲット ガイドの両方が含まれます。アクティブな Cas9 を含むセルは、GFP (図 2) の削減になります。 - セルを選択後、48 h の投稿 spinfection 2 μ G/ml が 3 日間。
- フローサイトメトリーによる GFP 発現のためのサンプルを分析します。
注: 50% 以上の GFP の削減は、最適な Cas9 活動を表します。50% 低下よりも小さい場合に Cas9 の活性を高めることブラストサイジン選択の高い濃度をされる可能性があります。すべての細胞は、ブラストサイジン選択を耐えることができます。この場合、他の選択のカセット Cas9 ベクトルの使用必要があります。さらに、いないすべての細胞は Cas9 の安定した表現を許容できます。この場合、Cas9 のトランスフェクションを使用可能性があります。
7. Cas9 発現細胞に sgRNAs の Spinfection
- 5.1 5.2 の手順 sgRNAs のレンチ ウイルス感染興味のセルにします。
メモ: ステップ 5.1.3、セクション 4 から検証 lentiGuide Puro 構造 pLX_TRC311 Cas9 構築を取り付けます。 - 48 h は spinfection の記事、ピューロマイシン 2 μ g/mL で 3 日間のセルを選択します。
- 抗生物質の濃度の低い媒体に耐性細胞を転送し、十分な編集を許可する 4 日間別の選択を続行します。
8. ba/f3 細胞変換と m IL3 撤退を使用して肯定的な選択
注: この試金ミル 3 依存 ba/f3 細胞について、サイトカイン依存セル行に適用することができます。
- 指数関数的に成長している ba/f3 細胞異所萌出へ Cas9 と関心の sgRNA を表現するスピンダウンします。
- 上清を吸引し、5 mL のリン酸緩衝生理食塩水 (PBS) で細胞を洗ってください。
- スピン ・ ダウン セルと 8.2 の洗浄手順を繰り返します 4 回 (この手順により、メディアが IL 3 の自由)。
- PBS を吸引し、IL 3 せず新鮮なメディアの 5 mL の細胞を再懸濁します。
- 診断または細胞生存率アナライザーを使用してセルをカウントします。
- シード IL 3 せず新鮮なメディアの 2 mL の容量で 1 x 10 の5セル/ml の濃度で 6 も組織培養プレートで 3 通のセル。
- 監視し、8 日間の合計は 2 日おきのセルをカウントします。
注: 通常 IL 3 に欠けている ba/f3 細胞が死ぬ IL 3 飢餓の 2 日後。アッセイのネガティブ コントロールを含めることが重要です (通常非ターゲットのガイドはコントロールとして使用されます)。
9. CRISPR ターゲットの編集のスクリーニング
- SgRNA 胸の谷間サイトの下流・上流のプライマーのスクリーニング CRISPR をデザインします。
注: は、巨大挿入・ sgRNA ・ ターゲット ・ サイトの削除 (塩基) によって検出を受けないだろうように予測された胸の谷間サイトからプライマー、少なくとも 100 bp を使用します。 - (成長曲線の終わり) 変換された細胞および細胞前サイトカイン撤退からゲノム DNA (gDNA) を分離します。
注: は常に遺伝子の編集用のコントロールとして非ターゲット ガイドを過剰発現細胞を含みます。前に、と後、変換に対して積極的に選択されたクローンが識別され、増殖性の利点を持っている細胞から gDNA を分離します。 - 次のコンポーネントで 50 μ L の PCR を組み立てる: 2 x PCR ミックス、前方プライマー (10 μ M)、逆プライマー (10 μ M) の 1 μ L、gDNA と H2O 50 μ L までの 50-100 ng の 1 μ L を 25 μ l 添加します。
注: 多数の高品質なポリメラーゼは 9.3 の手順で使えます。 - たちの次のパラメーターを使用して、サンプルを実行: 1 分の 95 ° C、30 のサイクル (94 ° C 1 分、52 ° C、30 s、30 のための 72 ° C s) と 10 分のための 72 ° C。この PCR は、表 3に掲げるCalrプライマーに最適です。9.1 gDNA をテストに基づいた手順で設計されたプライマーのため PCR 条件を最適化します。
- 1 x トリス-酢酸-EDTA (TAE) バッファーを使用して 10 V/cm 2% アガロースゲルで 5 μ L のサンプルを実行します。存在のためのサンプルを調べる/増幅バンドがない場合は興味の遺伝子のサイズに対応します。
- PCR の反作用 (45 μ L) の残りの部分を使用して、PCR の浄化を実行します。
- キット プラスミッドのベクトルへのクローニングは PCR で、amplicons のクローンを作成します。たとえば、T 簡単 pGEM ベクトルは通常使用されます。
- Stbl3 細胞または他の互換性のあるセルおよび関連抗生物質と LB 寒天培地プレート上にプレートにプラスミッドを変換します。10-20 のコロニー、小型の準備、各 1 つを選択、サンガーの各クローンを対象とオクターリピート CRISPR/Cas9 編集から作成を特徴付けるためのシーケンス。
注: 必要な場合、並べ替え (FACS) を一括で実行でした単一蛍光活性化セル編集特定塩基を持つクローンを分離する人口です。さらより確実にターゲットに sgRNA ターゲット地域にまたがる PCR 産物のディープ シーケンスを使用して、編集を定量化する次世代シークエンシング (NGS) のメソッドを使用できます。たとえば、分解または潮によってオクターリピートの追跡を subcloning 代わりに使用して、スペクトルと細胞 (https://tide.nki.nl/#about)16のプールで生成標的突然変異の頻度を正確に決定できます。
結果
ここで説明した方法を使用して、この実験の目的は、内因性造血細胞形質転換Calr遺伝子座に塩基変異導入機能の効果です。CRISPR/Cas9 システムは、ba/f3 細胞の内因性のCalr突然変異を作成するツールとして使用されます。2 sgRNAs は、 CALRで通常発生の挿入または削除 (塩基) 変異領域でエクソン 9 のCalr (図 1) をターゲットに選ばれた-変異 MPN 患者17,18。(M1) の最初の sgRNA は、その高い開裂の効率と良好なオフのターゲット スコアに基づいて選ばれました (表 1)。2 番目の sgRNA (m2) エクソン 9 内での位置のために主に選ばれた、高開裂の効率と良好なターゲットを編集領域に追加の sgRNAs の欠乏のためのスコア (表 1)。2 つの異なる sgRNAs (m1 または m2) は観察された効果のターゲット遺伝子の編集によるものであることを確認する別の感染症で使用されました。オフターゲット効果が複数の独立した sgRNAs によって共有される可能性があります。非ターゲット コントロール (スクランブル) は、ネガティブ コントロールとしても使用されました。この軌跡に Dsb を作成するCalrエクソン 9 Cas9 エンドヌクレアーゼの募集が予想されます。NHEJ は, オクターリピート変数のサイズ (図 1) を生成することができますが、Dsb を修復、でしょう。
開発するには、体外ba/f3 細胞に CRISPR/Cas9 システム、Cas9 タンパク質を安定に発現する細胞は、上記プロトコルに従ってレンチウイルスベクターを介した伝達によって作られました。安定した Cas9 式の堅牢な Cas9 活動を結果します。PXPR-011、GFP とターゲットに GFP15ガイドの両方を含む記者コンストラクトによって Ba/F3-Cas9 細胞における Cas9 活性を測定しました。アクティブな Cas9 を含むセルは、GFP15の削減になります。GFP は、フローサイトメトリーを用いた細胞で測定しました。Ba/F3-Cas9 のセルは、堅牢な Cas9 活動 (図 2) に対応する GFP で約 76% の削減を表示しました。
入力 1 サイトカイン受容体、トロンボポエチン受容体 (MPL)、エリスロポエチン受容体 (EPOR)、顆粒球コロニー刺激因子受容体 (G CSFR) のそれぞれを個別など安定して決定する Ba/F3-Cas9 細胞で発現のba/f3 細胞のトランスフォーメーションを誘導に変異カルレティキュリンと協同性。SgRNA 構造 (m1、m2 またはスクランブル (非ターゲット ガイド)) の伝達は、それぞれ Cas9 と関心の受容体を安定に発現する ba/f3 細胞を実施しました。セルは、CRISPR/Cas9 遺伝子を編集するための十分な時間を許可するピューロマイシン 7 日に選ばれました。正の選択圧はサイトカイン (mIL-3) の細胞を飢えによって適用されます。この飢餓圧力の目標 ba/f3 細胞のサイトカイン依存しない成長と転換の結果、MPN の患者で観察されたCalrエクソン 9、に似てオクターリピートが選択されて場合を識別することです。8 日間の合計の成長曲線が行い、セルはその変換 (図 3)19を測定するごとに 2 日間を数えられました。ゲノム DNA 抽出細胞ペレットは、ターゲットを編集用にチェックし、拡大記事サイトカイン飢餓 (図 3)19オクターリピートを監視する成長カーブの端に成長曲線の開始前に集められました。
Calrサイトカイン依存性の成長を認めた-ないCalrが、Ba/F3-MPL-Cas9 細胞 (図 4 b) を対象とした-親の Ba/F3-Cas9 細胞 (図 4 a)、または Ba/F3-Cas9 細胞の異所萌出へ EPOR (図 4 を表現します。) または19G CSFR (図 4)。Calr ターゲット Ba/F3-MPL-Cas9 細胞でミル 3 独立した増殖した対象の遺伝子編集の結果を確認する細胞収穫 8 日ポスト ミル 3 撤退とゲノム DNA 抽出された19歳でした。ターゲット サイトにまたがる 422 bp 地域は、表3 のプライマーを用いて増幅されました。補助的 PCR 産物のクローニングを行ったし、30 の個々 のクローンは、サンガーの送信されたシーケンス。M1 または m2 のCalr-ターゲットを絞った Ba/F3-MPL-Cas9 細胞、意図したカット サイト (図 5)19でさまざまなサイズのすべての含まれているサブのクローン オクターリピート。13 のうち 11 m1 サブ クローン オクターリピート +1 bp フレーム シフト突然変異 (図 5)、それらに類似したを含む患者の発見が見つかりました。M2 Calrの-+1 bp frameshifts (図 5)19に導いたオクターリピートを含む 10 のうち 17 サブ クローンが発見された細胞をターゲットします。これらのデータを確認する CRISPR/Cas9-の導入 + 1 bp フレーム シフト突然変異を介した内因性Calrエクソン 9 軌跡 Calr19に発癌性活動をみださない十分です。図5 シーケンス データがないことをも示してヘテロ接合の導入 + Calrの内因性遺伝子座に 1 bp フレーム シフト突然変異は Ba/F3-MPL 細胞、観測によりそのCALRを変換するのに十分な突然変異が MPN 患者17,18通常ヘテロ接合です。NHEJ は修復、オクターリピート間高い異質性の結果です、ので興味のクローンを分離する並べ替え 1 つのセルを実行でした。これは、ように CRISPR/Cas9 によって作成された特定の突然変異の効果を研究する研究者。
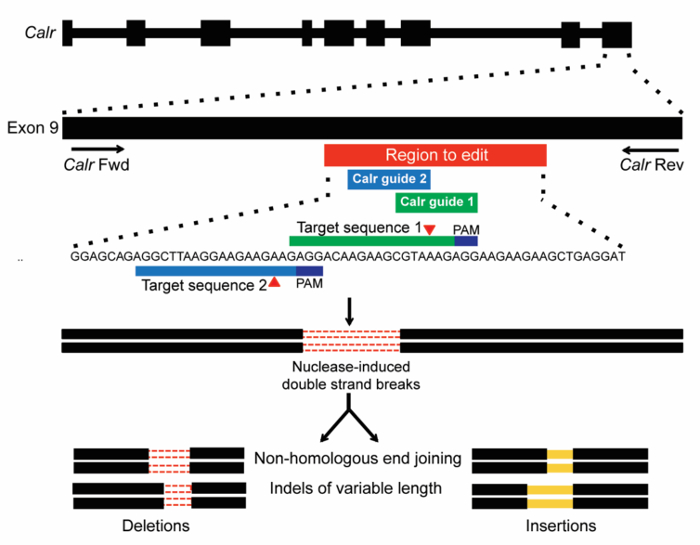
図 1: CRISPR/Cas9 遺伝子編集Calrのエクソン 9 のターゲットのスキーマです。ターゲットに対応するマウスCalrエクソン 9 領域内のサイトをターゲットに設計された 2 つの sgRNAs によって、+ 1 bp フレーム シフト突然変異人間 MPN (赤いバー)。PAMs (紺) とターゲット シーケンスが表示されていると Cas9 で胸の谷間の予想サイト、赤い三角形によって示されます。Dsb CRISPR/Cas9 によって生成された、NHEJ 可変長19オクターリピートを生成すると予想されるによって修復されます。この図の拡大版を表示するのにはここをクリックしてください。
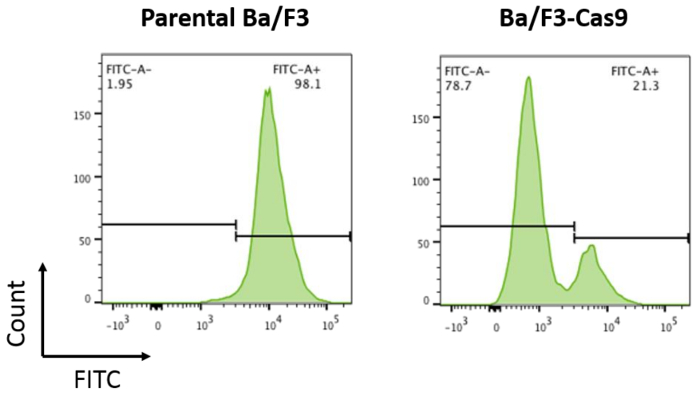
図 2: Cas9 活性します。親 ba/f3 細胞と Cas9 を過剰発現 ba/f3 細胞が導入した pXPR-011 Cas9 活性を測定します。GFP の削減 Cas9 活動の増加と相関します。親 ba/f3 細胞は、FITC + ~ 76%、FITC の減少、Ba/F3-Cas9 細胞と比較して 〜 100% です。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 感染症と ba/f3 細胞における sgRNAs の選択のためのタイムライン。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 内因性のCalr遺伝子座に +1 bp フレーム シフト変異の導入で Calr に発癌性活動をみださない十分です。親 Ba/F3-Cas9 (A ~ D) 成長曲線細胞 (A) Ba/F3-MPL-Cas9 細胞 (B)、Ba/F3-EPOR-Cas9 (C) と Ba/F3-G-CSFR-Cas9 細胞 (D) に示します Calr ターゲットの ba IL 3 独立した成長/F3 MPL Cas9 細胞だけ19。この図の拡大版を表示するのにはここをクリックしてください。

図 5:サンガー シーケンスの検証。対象の内在性Calr (エクソン 9) Ba/F3-MPL 細胞での編集の確認。+1 bp フレーム シフト突然変異、黒19で示されます。この図の拡大版を表示するのにはここをクリックしてください。
| ターゲット遺伝子 | sgRNA ID | ターゲット シーケンス (5' 3') | ストランド | 開裂の効率 | オフのターゲット スコア | ||
| Calr | m1 | AGAGGACAAGAAGCGTAAAGAGG | + | 0.7 | 70 | ||
| Calr | m2 | GAGGCTTAAGGAAGAAGAAGAGG | + | 0.3 | 28 | ||
表 1:20-mer の protospacer シーケンス PAM を含むサイト (太字) でターゲットにエクソン 9 Calr の 2 sgRNAs19。
| プライマー ID | シーケンス (5' 3') |
| m1-F | CACCGAGAGGACAAGAAGCGTAAAG |
| m1-R | AAACCTTTACGCTTCTTGTCCTCTC |
| m2-F | CACCGAGGCTTAAGGAAGAAGAAG |
| m2-R | AAACCTTCTTCTTCCTTAACCTC |
表 2: Protospacer シーケンスとその逆補"CACC"と"AAAC"BsmBI 制限酵素を用いた pLenti ガイド ベクターにクローニングに追加19。
| プライマー ID | シーケンス (5' 3') |
| Calr_Fwd | ACCACCTGTCTTTCCGTTCT |
| Calr_Rev | GGCCTCTACAGCTCATCCTT |
表 3: CRISPR sgRNA 胸の谷間サイトの下流・上流、PCR のプライマーのスクリーニングします。
ディスカッション
ここで我々 は造血細胞のCALR突然変異の生物学的機能を研究する CRISPR/Cas9 遺伝子編集の使用を示します。このプロトコルの成功は複数の要因に依存します。まず、どのような種類の突然変異は、望まれる表現型の責任を知ることが重要です。このプロトコルでは読み出しはミル 3 独立 ba/f3 細胞のトランスフォーメーションと突然変異の種類です。 CALRのエクソン 9 オクターリピート。しかし、望ましい突然変異が単一塩基置換の場合、HDR を介した修復は好ましい方法正確な点突然変異や一本鎖か二本鎖 DNA ドナー テンプレート2,から挿入が生じますので3。 ノックアウト遺伝子は、その後、大規模なゲノム削除早いコーディング エクソンをターゲットの作成ですが20を優先する必要がある場合。
第二に、セルの行は正の選択圧のポスト サイトカイン撤退を可能にするためにサイトカイン依存をする必要があります。すべての細胞が Cas9 の安定した表現を容認することに注意することが重要だ (6.3 の手順を参照してください)。ブラストサイジンの選択は、すべての細胞によって容認されていない可能性があります。この場合、別の選択のカセットと他の Cas9 構造の選択必要があります。Ba/f3 細胞などサイトカイン依存性細胞ラインを使用しての注意点は、サイトカイン、次の興味の異所萌出へ表現された遺伝子の変異の買収の結果として時々 自発的なサイトカイン依存性の成長する影響を受けやすい撤退21。したがって、適切なコントロールの使用が観察された細胞変換がターゲットに CRISPR 遺伝子編集が自信を持ってするために必要です。このプロトコルでは導入を対象とした sgRNA 制御や Ba/F3-EPOR Ba/F3-MPL 細胞とCalrで導入した Ba/F3-GCSFR 細胞の細胞変形は見られなかった-sgRNAs を対象としました。これは、さらに自信を持って Ba/F3-MPL セルの携帯電話変換対象の内在性Calr軌跡の編集の結果であることを提供します。
このプロトコルでは NHEJ による DNA 修復は、図 5に示すようオクターリピート変数のサイズを紹介します。+1 bp フレーム シフト変異ポスト サイトカイン撤退につながるオクターリピートの拡大を捜すために編集されたセルの一括人口のサブ サンプルのシーケンスを行ったサンガーによる解析。次世代シーケンス ステップ 9.9 に記載は、定量化するより堅牢な方法ターゲット一括細胞集団の編集します。特定クローンの解析が必要な場合、単一のセルの一括人口の並べ替えは必要。単一のセルの並べ替えは特定タイプの突然変異から生じる生物学的作用を理解する上で有利であり目標の突然変異の 2 つの異なるタイプ間の違いを理解するときに便利です。
CRISPR/Cas9 システムと 1 つの懸念は、胸の谷間イベント対象地域外であるオフのターゲット効果です。地域の外で起こったゲノムの編集かどうかを調べないといけないだろう CRISPR/Cas9 系の特異性を評価し、変換された人口に観察された変形につながる的外れの効果が含まれていないことを確認してください。関心します。これは、ゲノムは意図されていたターゲットに重要な配列類似性と潜在的なターゲットをゲノム遺伝子編集 Cas9/NHEJ 駆動の証拠を捜すことによって行うことができます。このため、次世代シーケンス処理される可能性がありますもゲノムに沿って指定された場所でオフターゲット効果の周波数を定量的に評価します。オフターゲット効果の可能性を減らすためには、さまざまな要因は、プロトコルに組み込むことができます。結果で述べたように、表現型が対象のイベントの結果であることと、関心領域をターゲットと複数の sgRNAs を勉強できます。また、最近の研究では、一七ヌクレオチドと切り捨てられた sgRNAs がターゲットを胸の谷間のイベント22の頻度を減らすことができますを示唆しています。さらに、安定した式から Cas9 への長期暴露は、オフターゲット効果の高い周波数で起因できます。Cas9 と、sgRNA の両方を含む二重ベクトル システム可能性があります Cas9; の安定式ではなくプロトコルで使用することに注意することが重要です。ただし、これらのベクトルは非常に大きく、低レンチ ウイルスの力価と低い感染効率は、傾向があります。その結果、nucleofection による細胞 Cas9 コンストラクト トランスフェクションを使用できます。また、eSpCas9 構築6など、最近のレポートは対象の編集、高い特異性と Cas9 構造を開発しました。
要約すると、CRISPR/Cas9 は、エンジニア リング ツール、生理機能の発現レベルの遺伝子の突然変異の研究を可能にする効率的で安価な信頼性の高いゲノムを表します。ここで我々 は CRISPR/Cas9 遺伝子編集造血細胞のCALR変異の機能の効果の理解を進めるための堅牢で効率的な方法として採用しています。
開示事項
我々 は本レポートに関する利害の対立があります。
謝辞
この作品は、NIH (R01HL131835)、デイモン ・ ラニアン臨床賞、スターがんコンソーシアムによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| BsmBI | New England Biolabs | R0580L | |
| Blasticidin | Sigma Aldrich | 15025 | |
| Puromycin | Life Technologies | A1113803 | |
| Stbl3 cells | Life Technologies | C737303 | |
| TransIT-LT1 | Thermo Fisher Scientific | MIR2300 | |
| Opti-MEM | Life Technologies | 51985034 | |
| RPMI | Thermo Fisher Scientific | MT10040CV | |
| DMEM | Thermo Fisher Scientific | 10-017-CV | |
| Fetal bovine serum (FBS) | Omega Scientific | FB-11 | |
| Penicillin/streptomycin/L-glutamine | Life Technologies | 10378016 | |
| mIL-3 | Peprotech | 213-13 | |
| psPAX2 | Addgene | N/A | |
| pCMV-VSV-G | Addgene | N/A | |
| pLX_TRC311-Cas9 | Addgene | N/A | |
| polybrene | Sigma Aldrich | H9268 | |
| pXPR-011 | Addgene | N/A | |
| Phosphate Buffered Saline (PBS) | Genessee Scientific | 25-507 | |
| TAE buffer | Thermo Fisher Scientific | FERB49 | |
| LentiGuide-Puro | Addgene | Plasmid #52963 | |
| PNK | New England Biolabs | M0201S | |
| T4 ligase | New England Biolabs | M0202S | |
| PCR purification kit | Qiagen | 28104 | |
| Miniprep kit | Qiagen | 27104 |
参考文献
- DeWitt, M. A., et al. Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Sci Trans Med. 8, 360(2016).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 4, 347-355 (2014).
- Gaj, T., Gerbach, C. A., Barbas, C. F. ZFN, TALEN, CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 31 (7), 397-405 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wiedenheft, B., Samuel, S. H., Doudna, J. A. RNA-guided genetic silencing systems in bacteria and archea. Nature. 482 (7385), 331-338 (2012).
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., Zhang, F. Rationally engineered Cas9 nucleases with improved specificity. Science. 351 (6268), 84-88 (2016).
- Ran, F. A., et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell. 154 (6), 1380-1389 (2013).
- Larson, M. H., et al. CRISPR interference (CRISPRi) for sequence-specific control of gene expression. Nat Protoc. 8 (11), 2180-2196 (2013).
- Wang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kim, H. S., et al. CRISPR/Cas9-mediated Gene-knockout screens and target identification via Whole genome sequencing uncover host genes required for picornavirus infection. J Biol Chem. 10, 1074(2017).
- Heckl, D., et al. Generation of mouse models of myeloid malignancies with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nat Biotechnol. 32 (9), 941-946 (2014).
- Daley, G. Q., Baltimore, D. Transformation of an interleukin 3-dependent hematopoietic cell line by the chronic myelogenous leukemia-specific bcr/abl protein. Proc Natl Acad Sci USA. 85, 9312-9316 (1988).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biol. 17, 148(2016).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nat Biotechnol. 32, 1262-1267 (2014).
- Brinkman, E. K., et al. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucl Acid Res. 42, e168(2014).
- Klampfl, T., et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med. 369, 2379-2390 (2013).
- Nangalia, J., et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2. N Engl J Med. 369, 2391-2405 (2013).
- Elf, S., et al. Mutant Calreticulin requires both its mutant C-terminus and the thrombopoietin receptor for oncogenic transformation. Cancer Discovery. 6 (4), 368-381 (2016).
- Bauer, D. E., Canver, M. C., Orkin, S. H. Generation of Genomic Deletions in Mammalian Cell lines via CRISPR/Cas9. J. Vis. Exp. (95), e52118(2015).
- Watanabe-Smith, K., et al. Analysis of acquired mutations in transgenes arising in Ba/F3 transformation assays: findings and recommendations. Oncotarget. 8, 12596-12606 (2017).
- Fu, Y., et al. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. NatBiotechnol. 32, 279-284 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved