Method Article
利用 CRISPR/Cas9 基因编辑研究细胞因子依赖性造血细胞中突变钙的致癌活性
摘要
有针对性的基因编辑使用 CRISPR/Cas9 极大地促进了对基因的生物功能的理解。在这里, 我们利用 CRISPR/Cas9 的方法, 模型钙突变的细胞因子依赖性造血细胞, 以研究其致癌活动。
摘要
聚类定期 interspaced 短复发重复 (CRISPR) 是一种自适应免疫系统的原, 已被科学家用来产生 RNA 引导核酸, 如 CRISPR 相关 (Cas) 9 site-specific 真核基因组编辑.Cas9 的基因组工程被用来有效、容易和有力地改变许多生物相关的哺乳动物细胞系和生物体内源基因。在这里, 我们展示了一个如何利用 CRISPR/Cas9 方法来理解特定基因突变的生物学功能的例子。我们模型钙 (CALR) 突变的小鼠 interleukin-3 (mIL-3) 依赖亲 B (Ba/F3) 细胞通过交付单一指南 rna (sgRNAs) 的目标内源性CALR所在地在特定地区的插入和/或删除 (indel) CALR突变发生在骨髓肿瘤 (MPN), 一种类型的血液癌症患者。sgRNAs 在目标区域创建双链断裂 (DSBs), 由同源端连接 (NHEJ) 修复, 以提供各种尺寸的 indels。然后, 我们采用标准 Ba/F3 细胞转化法, 以了解生理水平表达的Calr突变对造血细胞转化的影响。这种方法可应用于其他基因, 以研究其生物学功能的各种哺乳动物细胞系。
引言
CRISPR/Cas9 技术最近在活细胞和生物体中彻底改变了目标基因组的编辑。它已成为生物医学研究的一个非常强大的工具, 目前正被用作治疗遗传性疾病的潜在途径1。所有基因组编辑工具的基础是建立一个核酸诱导的 DNA 双链断裂 (争端) 在基因组所在地要修改。DSBs 可以通过同源结束连接 (NHEJ) 或同源定向修复 (HDR)2,3进行修复。Cas9 核酸优于其他基因组工程核酸, 如锌指核酸 (ZFNs) 和转录激活剂样效应核酸 (TALENs) 的优势是它依赖于 RNA 的目标核酸到一个理想的 DNA 序列, 比较到 ZFNs 和 TALENs 中发现的蛋白质-DNA 相互作用2,3。
在原核细胞 CRISPR/Cas9 核酸通路作为自适应免疫系统的发现后4,5, 许多努力已经适应了哺乳动物细胞系和模型生物体的使用途径2,3. 作为基因编辑的工具, CRISPR/Cas9 通路利用两个主要组成部分:链球菌化脓(Sp) 衍生 Cas9 核酸和 sgRNAs 的目标基因的兴趣2,3。sgRNA 由20核苷酸组成, 通过 RNA-DNA 基对互补2,3, 直接 Cas9 到基因组上的特定站点。sgRNA 的目标位置必须位于相邻的 protospacer 相邻主题 (PAM) 的位置, 其形式为 5 "NGG, 这是 SpCas9 核酸所认可的。有了这些工具, Cas9 可以通过设计 sgRNAs 的目标区域来引导到任何 DNA 序列。除了 Sp 派生的 Cas9, 还有其他的变体, Cas9 具有不同的功能, 这取决于特定的应用程序。例如, 有 Cas9 的变种具有更高的特异性为在目标编辑或单分裂容量为脱氧核糖核酸偷6,7。此外, 催化的非活动 Cas9 最近已经发展为转录调节8。科学家们现在已经使用 CRISPR/Cas9 系统的各种应用, 如基因敲除和击倒研究的生物学功能的基因9, 功能和功能库屏幕10和遗传模型有机体的工程学11。
在本协议中, 我们将 CRISPR/Cas9 方法与 Ba/F3 细胞转化法结合起来, 以了解CALR突变的生物学功能。Ba/F3 细胞是一种小鼠 IL-3 依赖的造血细胞系, 可以 IL-3 独立于某些致癌基因的表达, 如 BCR 的12。为了了解突变体钙是否能将 Ba/F3 细胞转化为细胞因子的独立生长, 我们针对内生的Calr轨迹的外显子9使用 CRISPR/Cas9 引入 indel 突变, 然后从细胞中撤回 IL-3, 以应用积极的选择压力, 与目标综述功能CALR突变发现 MPN 患者。该协议包括 sgRNAs 的设计、克隆和交付、稳定 Cas9 表达细胞的开发和 CRISPR 靶基因编辑的筛选。该协议可以应用于不同的基因和各种细胞因子相关的兴趣, 在模型和研究癌症相关基因的生物学功能方面特别有价值。
研究方案
1. sgRNA 设计使用在线工具13
-
设计 sgRNAs 的目标基因的兴趣使用免费的在线工具。
- 复制并粘贴感兴趣基因的 NCBI 参考序列到宽广的学院 sgRNA 设计师网页工具: (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design)。
注意: 此工具可识别显内的 sgRNA 序列和跨越内含子/外显子边界但仍在外显子内进行劈裂的那些。 - 下载并打开 excel 中的文本输出文件。
- 关注于用 sgRNA 序列和 sgRNA 上下文序列填充的列。请注意, sgRNA 序列不包含 protospacer 相邻的主题 (PAM), 但上下文序列是这样的。
- 请注意, 在目标的功效评分列出了预测的劈裂效率评分的0至 1, 其中评分1表示更高的劈裂效率。
- 使用 excel 的 "排序" 功能, 可以通过 "目标切口%" 列的效果评分或目标基因内的位置来排列目标。
注意: 根据基因中的位置进行分类对识别特定域或感兴趣的外显子的 sgRNAs 是有用的。 - 选择 3-6 sgRNAs, 目标的领域与高 (> 0.6) 的目标效果评分。它可能是有用的, 知道什么样的突变可能负责的表型, 是需要的 (请参见图 1解释的目标策略用于钙)。
注: sgRNAs 低于建议的0.6 效果评分阈值时, 应考虑到缺乏其他良好的候选人。 - 使用 MIT gRNA 分析 web 工具来筛选潜在的不相干效果 (http://crispr.mit.edu/)。对于选定的每个 sgRNA, 运行目标序列 (包括 PAM)。
注: 广泛的研究所 sgRNA 设计师网页工具也可用于筛选不相干效果 (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design)。- 请注意, 麻省理工学院 sgRNA 分析工具的评分每 sgRNA 1-100, 其中得分100表示更高的特异度。分数大于70是理想的, 代表一个 sgRNA 的最低不相干效果。这个网站还会生成一个不相干点击列表, 其中有他们在基因组中的位置, 以及他们与候选指南有多少不匹配。
注意: 四不匹配或更大的非目标命中被视为安全14。如果低于四的不匹配, 则可能会有问题, 如果它们属于显14。
- 请注意, 麻省理工学院 sgRNA 分析工具的评分每 sgRNA 1-100, 其中得分100表示更高的特异度。分数大于70是理想的, 代表一个 sgRNA 的最低不相干效果。这个网站还会生成一个不相干点击列表, 其中有他们在基因组中的位置, 以及他们与候选指南有多少不匹配。
- 选择 2-3 sgRNAs, 目标基因感兴趣的区域内的不同位置, 并具有最高配对的劈裂效率和不相干分数 (参见表 1 , 用于针对Calr的外显子9的 sgRNA 序列。
注: 根据实验目标的不同, 可以更加强调从所述工具中获得的各种值。
- 复制并粘贴感兴趣基因的 NCBI 参考序列到宽广的学院 sgRNA 设计师网页工具: (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design)。
2. 克隆 sgRNA 寡13
-
生成正向寡
- 创建没有 PAM 站点的 sgRNA 序列的列表。
- 如果 sgRNA 序列的5结尾不是 g, 则将 g 添加到序列的5的末尾。
注意: 这 G 是必要的最大化 U6-driven sgRNA 转录水平。添加 G 对于 m1 sgRNA (表 1) 是必需的。 - 将序列 "CACC" 添加到 G 优化引导序列的5端 (没有 PAM) (表 2), 以便生成将退火的寡结扎到 BsmBI消化 lentiGuide 向量 (参见步骤 3)所需的悬垂。
-
生成反向寡聚
- 反向补全 G 优化引导序列 (无 PAM)。
- 将序列 "AAAC" 添加到反向补充的 G 优化指南序列的5端 (表 2)。
- 从底漆合成公司订购设计的寡。
-
退火和化寡
- 添加1µL 的正向寡核苷酸 (100 µM), 1 µL 的反向寡糖 (100 µM), 1 µL 的 10x T4 结扎缓冲, 0.5 µL 的 T4 核苷酸激酶 (PNK) 和6.5 µL 的 H2O 到 PCR 管 (总 = 10 µL)。
- 运行以下程序在 thermocycler:37 ˚C 为30分钟, 95 ˚C 为 5 min, 舷梯从95到25在0.1 ° c/s。
- 在 H2O 中, 将反应产物稀释在1:250。
3. lentiGuide-普洛矢量的消解13
-
文摘 lentiGuide-普洛向量
- 用以下成分组装50µL 消化反应: 5 µg 的循环质粒, 2 µL (30 单位) BsmBI 限制性酶, 5 µL 限制酶缓冲和高达50µL 的 H2O。
- 在55° c 下运行2小时的反应。在第一个小时之后, 添加1µL 更多的 BsmBI 限制性酶。
-
Dephosphorylate 切割骨干
- 添加7µL 磷酸酯酶反应缓冲剂和2µL 磷酸腺酵素对消化载体。
- 孵育30分钟, 在37° c。
- PCR 纯化切割和化骨干使用商业套件。
注: 用 miniprep 套件蓝色的列替换提供的粉红色的列, 因为它们可以更好地容纳大质粒大小。在洗脱之前, 通过在90˚C 热块中加热洗脱缓冲剂, 通过在末端两次从柱上洗脱 dna (从第一次洗脱中运行洗 dna) 可以提高产量。
4. 结扎 ofAnnealed 寡成消化骨干13
- 添加 50 ng 消化骨干, 1 µL 退火寡稀释, 1 µL 的 10x T4 结扎缓冲, 1 µL T4 连接和高达10µL 的 H2O 到 PCR 管。室温孵育1小时
- 用2µL 的结扎反应对 Stbl3 细胞进行转化。用100µg/毫升氨苄西林在性汤 (LB) 琼脂板上, 在37° c 的夜间孵育。
- 选择3殖民地和接种到一个 mini-prep 的文化。
-
验证正确的寡聚插入
- 使用商业套件从 U6 启动子的底漆开始, 对每种文化和序列进行 miniprep。
- 执行一个 midi 准备或最大的顺序验证的文化准备。
5. 细胞 lLines 稳定表达 SpCas9 的生成
注: 本协议涉及慢感染 pLX_TRC311-Cas9 质粒的交付。本协议详细描述了小鼠 interleukin-3 (mIL-3) 依赖亲 B (Ba/F3) 细胞, 悬浮细胞线, 并可以适应其他细胞类型使用的首选培养条件为每个细胞类型。Ba/F3 细胞培养基由 RPMI 补充10% 胎牛血清、1% 青霉素/链霉素/l-谷氨酰胺和10小鼠白细胞介素3。
-
染 HEK-293T 细胞
- 种子 3 x 106 HEK-293T 细胞每10厘米组织培养皿。在转染前一夜保留种子细胞。
注: HEK-293T 细胞是附着的细胞系, 通常用于病毒生产。细胞维持在 DMEM 补充10% 胎牛血清, 1% 青霉素/链霉素/l-谷氨酰胺。细胞在转染时应80% 汇合。 - 前温热还原的血清培养基 (优化) 和生长培养基。
- 添加500µL 的减少血清培养基, 7 µg pLX_TRC311-Cas9 结构, 4 µg pCMV-VSV-慢包装质粒和4µg psPAX2 慢包装质粒成管
注: 每 10 cm 293T 细胞的总 DNA 是15µg。 - 混合 DNA, 加入45µL 的转染试剂。轻轻地混合, 让它站立20分钟。
注意: 由于血清会抑制转染试剂和质粒 DNA 之间的复杂形成, 所以使用降低血清培养基是很重要的。 - 在293T 板中吸取旧培养基, 加入5毫升的新培养基。
- 添加 DNA 和转染试剂混合在一个下降明智的方式, 以293T 板。轻轻地旋转, 在37° c 和 5% CO2下孵育24小时。
- 收获病毒清在24和 48 h 后转染。通过一个0.22 µm 过滤器和分到一个 cryovial 管 (1.6 毫升/管和1.5 毫升将用于感染)。
- 在-80 ° c 贮存病毒上清液。
注: 慢上清液可在6月内使用。如果可能, spinfection transductions 应该用新鲜的病毒来执行。
- 种子 3 x 106 HEK-293T 细胞每10厘米组织培养皿。在转染前一夜保留种子细胞。
-
Ba/F3 细胞的慢感染
- 冰冻时, 将病毒上清液解冻。
- 离心机细胞在 300 x g 为4分钟。
- 吸气上清和重细胞的浓度为 3 x 106细胞/毫升。
- 添加500µL 的悬浮细胞, 1.5 毫升的病毒上清, 4 µL 的凝聚 (股票: 2 毫克/毫升) 和 10 ng/毫升 m-IL3 在6良好的组织培养板。确保包括一个未感染的良好与1.5 毫升的媒体, 而不是病毒上清作为一个控制。
注: 增加的病毒上清液的数量应对应于多种感染 (莫伊) < 1。 - 离心板在 440 x g 为 120 min 在37° c。
- 从离心机中取出盘子, 在37° c 和 5% CO2孵化器中放置, 并允许在一夜之间生长。
- 在24小时后旋转下来的细胞, 重与5毫升的新鲜温暖的媒体在一个6井板。
-
Cas9 感染细胞的选择
- 旋转下来的细胞和重与新鲜温暖的媒体补充5µg/毫升的 blasticidin, 48 小时后 spinfection。
- 选择9天与 blasticidin 或直到未感染 (阴性) 控制细胞死亡的细胞。
- 一旦选择完成, 将耐药细胞转移到低浓度 blasticidin 的培养基中。
6. 记者检测 Cas9 活动15
- 传感器父母细胞和细胞稳定表达 Cas9 与 pXPR-011 的慢感染 (见步骤 5.1-5.2)。
注: 此矢量包含 gfp 和以 gfp 为靶的指南。含有活性 Cas9 的细胞会导致 GFP 的减少 (图 2)。 - 选择3天的细胞与2µg/毫升的嘌呤, 48 小时后 spinfection。
- 用流式细胞仪分析 GFP 表达的样品。
注意: GFP 减少50% 或以上代表最佳 Cas9 活动。如果观察到少于50% 的减少, 可以使用更高浓度的 blasticidin 选择来增加 Cas9 活性。并非所有的单元格线都能容忍 blasticidin 选择。在这种情况下, 使用 Cas9 向量与其他选择磁带可能是必要的。此外, 并非所有细胞系都能耐受 Cas9 的稳定表达。在这种情况下, 可以使用瞬态转染 Cas9。
7. sgRNAs Spinfection Cas9 表达细胞的研究
- 按照步骤 5.1-5.2 的慢感染的 sgRNAs 成细胞的利益。
注意: 在步骤5.1.3 中, 将 pLX_TRC311-Cas9 构造替换为从4节中验证的 lentiGuide-普洛构造。 - 48 h 后 spinfection, 选择3天的细胞与2µg/毫升的嘌呤。
- 将耐药细胞转移到较低浓度抗生素的培养基中, 再继续选择4天, 以便进行足够的编辑。
8. 利用 m-IL3 提取 Ba/F3 细胞转化和阳性选择
注: 本法用于 mIL-3 依赖的 Ba/F3 细胞, 但可应用于任何细胞因子依赖的干细胞系。
- Ba/F3 细胞 ectopically 表达 Cas9 和 sgRNA 的兴趣。
- 吸入上清液, 用5毫升磷酸缓冲盐水 (PBS) 冲洗细胞。
- 旋转下来的细胞和重复洗涤步骤在8.2 四次 (这一步确保媒体是免费的 IL-3)。
- 吸入 PBS 和重5毫升的新鲜媒体没有 IL-3 的细胞。
- 使用例或单元生存能力分析器对单元格进行计数。
- 在6个组织培养板中, 以 1 x 105细胞/毫升的浓度, 在2毫升的新鲜培养基的总体积内, 在没有 IL-3 的情况下, 将细胞种在一式三份。
- 每2天监测和计数细胞, 总共8天。
注: Ba/F3 细胞缺乏 IL-3 通常死亡2天后 IL-3 饥饿。重要的是要在分析中包括一个负控制 (通常是一个互不指南被用作一个控制)。
9. CRISPR 的目标编辑筛选
- sgRNA 劈裂部位上游和下游 CRISPR 筛选底漆的设计
注: 从预测的劈裂部位使用至少 100 bp, 以确保检测不会受到 sgRNA 目标站点上的大插入和/或删除 (indel) 的影响。 - 分离基因组 DNA (gDNA) 从被转换的细胞 (在成长曲线的末端) 和从细胞 pre-cytokine 撤退。
注意: 始终包括表达互不指南中的单元格作为基因编辑的控制。将 gDNA 从细胞中分离出来之前和之后的转变将会发现那些积极选择并具有增殖优势的克隆。 - 组装50µL pcr 与以下组成部分:25 µL 的 2x pcr 混合, 1 µL 前引物 (10 µM), 1 µL 的反向底漆 (10 µM), 50-100 ng gDNA, 和 H2O 高达50µL。
注: 许多高保真聚合可在步骤9.3 中使用。 - 使用以下参数在 thermocycler 中运行示例:95 1 分钟, 30 周期 (94 ° c 为 1 min, 52 ° c 为三十年代, 72 ° c 为三十年代), 和72° c 为 10 min。此 PCR 针对表 3中列出的Calr引物进行了优化。在 gDNA 试验的基础上对9.1 步设计的引物对 PCR 条件进行优化。
- 使用1x 醋酸三乙酸-EDTA (泰) 缓冲液在10伏/cm 上运行2% 琼脂糖凝胶样品的5µL。检查样本的存在/缺席的放大带相应大小的基因感兴趣。
- 使用 pcr 反应的其余部分 (45 µL) 进行 pcr 纯化。
- 克隆增与 PCR 克隆试剂盒成质粒载体。例如, 通常使用 pGEM T 容易向量。
- 将质粒转化为 Stbl3 细胞或其它相容的细胞, 并用相关的抗生素将其放入 LB 琼脂板上。选择10-20 殖民地, mini-prep 每一个, 并服从每一个克隆到桑格排序的特点 indels 创建的 CRISPR/Cas9 编辑。
注意: 如果需要, 可以在批量编辑的种群上执行单细胞荧光活化细胞分类 (资产管制), 以将克隆与特定的 indel 分离。此外, 下一代测序 (NGS) 方法可用于更有力地量化的目标编辑使用 PCR 增跨越 sgRNA 目标区域的深度排序。例如, 可以使用分解或潮汐跟踪 Indels, 而不是亚精确地确定在一个单元格池 (https://tide.nki.nl/#about)16中生成的目标突变的频谱和频率。
结果
采用本文所概述的方法, 本实验的目的是研究在造血细胞转化过程中引入 indel 突变对内源性Calr轨迹的功能效应。CRISPR/Cas9 系统被用作在 Ba/F3 细胞中创建内源性的Calr突变的工具。选择了两个 sgRNAs 来针对Calr (图 1) 的外显子 9, 在该区域中, 插入和/或删除 (indel) 突变通常发生在Calr变种 MPN 患者17、18中。第一 sgRNA (m1) 是根据其高的劈裂效率和有利的不相干分数 (表 1) 选择的。第二个 sgRNA (m2) 的选择主要是其在外显子9和缺乏额外的 sgRNAs 在该地区编辑与高解理效率和有利的不相干分数 (表 1) 的位置。两个不同的 sgRNAs (m1 或 m2) 被用于单独的感染, 以确保观察到的效果是由于靶基因的编辑。非目标效果不太可能由多个独立的 sgRNAs 共享。互不控制 (争夺) 也被用作负控制。Cas9 切到Calr外显子9的招聘预计将在这个轨迹上创建 DSBs。然后, DSBs 将由 NHEJ 修复, 它可以生成可变大小的 indels (图 1)。
为发展 Ba/F3 细胞中的体外CRISPR/Cas9 系统, 以慢介导的转导为根据上述协议, 对 Cas9 蛋白进行稳定表达的细胞。稳定的 Cas9 表达导致健壮的 Cas9 活动。在 Ba/F3-Cas9 细胞中的 Cas9 活性是由 pXPR-011, 一个包含 gfp 和指南靶向 gfp15的记者结构来测量的。包含活动 Cas9 的单元格将导致减少 GFP15。用流式细胞仪测量细胞中的 GFP。Ba/F3-Cas9 细胞在 GFP 中显示约76% 的减少, 对应于健壮的 Cas9 活动 (图 2)。
1型细胞因子受体, 如生成受体 (MPL), 促红细胞生成素受体 (EPOR) 和粒细胞集落刺激因子受体 (G-捷克斯洛伐克) 分别在 Ba/F3-Cas9 细胞中稳定表达, 以确定其协同与突变钙诱导 Ba/F3 细胞转化。sgRNA 结构的转导 (m1, m2 或扰 (互不指南)) 然后在每个 Ba/F3 细胞系中进行了稳定表达 Cas9 和感兴趣的受体。细胞, 然后选择了7天与嘌呤, 让足够的时间, CRISPR/Cas9 基因编辑。然后通过饥饿细胞因子 (mIL-3) 来应用积极的选择压力。这饥饿压力的目标是确定, 如果 indels 在Calr外显子 9, 相似于那些观察在 MPN 患者, 被选择为, 导致细胞因子独立成长和转换 Ba/F3 细胞。生长曲线进行了总共8天和细胞计数每2天测量他们的转换 (图 3)19。在生长曲线开始前和生长曲线结束时收集细胞颗粒进行基因组 DNA 提取, 以检查是否有目标编辑, 并监测扩大后细胞因子饥饿的 indels (图 3)19。
细胞因子独立生长观察在Calr-目标 Ba/F3-MPL-Cas9 细胞 (图 4B), 但不是Calr目标父母 Ba/F3-Cas9 细胞 (图 4A), 或 Ba/F3-Cas9 细胞 ectopically 表达 EPOR (图4C) 或 G-捷克斯洛伐克 (图 4D)19。为了证实 Calr 靶 Ba/F3-MPL-Cas9 细胞的 mIL-3 独立生长是在靶基因编辑的结果, 细胞被收获了8天后 mIL-3 撤退和基因组 DNA 被提取了19。使用表 3中列出的引物放大了跨越目标站点的 422 bp 区域。对 PCR 增进行了亚克隆, 并对30个体克隆进行了桑格测序。对于 m1 或 m2 Calr-目标 Ba/F3-MPL-Cas9 单元, 所有 sub-clones 都在预期的剪切站点 (图 5)19中包含不同大小的 indels。11 13 m1 sub-clones 被发现含有 indels, 导致 +1 bp frameshift 突变 (图 5), 与患者中发现的相似。对于 m2 Calr-目标单元格, 在 17 sub-clones 中发现10个包含 indels, 导致 +1 bp frameshifts (图 5)19。这些数据证实, CRISPR/Cas9 介导的 + 1 bp frameshift 突变的内生Calr外显子9的轨迹足以赋予致癌活动 Calr19。图 5中的排序数据还表明, 对内源Calr轨迹的杂 + 1 bp frameshift 突变的引入足以转换 Ba/F3-MPL 细胞, 符合Calr的观察突变通常杂在 MPN 患者中17,18。由于 NHEJ 修复的结果在 indels 之间的高异质性, 单细胞排序, 以孤立的兴趣克隆可以执行。这将使研究员研究 CRISPR/Cas9 产生的特定突变的影响。
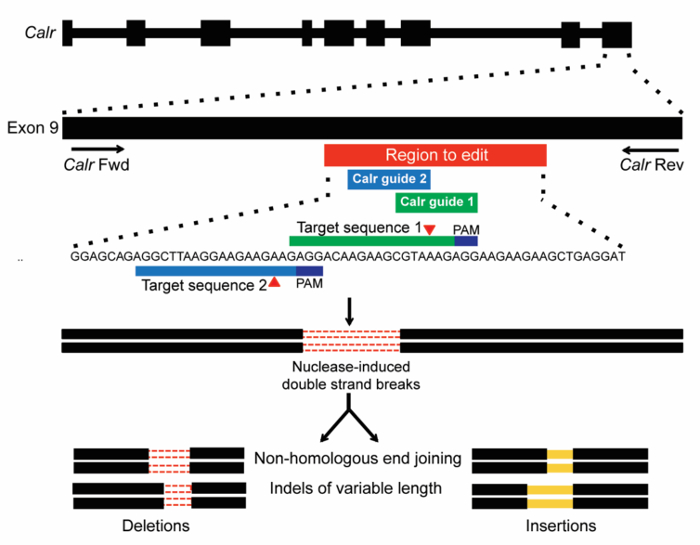
图 1: CRISPR/Cas9 基因编辑的模式针对Calr的外显子9。两个 sgRNAs 被设计为针对鼠标内的站点Calr外显子9区域对应的目标由 + 1 bp frameshift 突变在人类 MPN (红酒吧)。PAMs (深蓝色) 的目标序列显示, Cas9 的预期位置由红色三角形表示。由 CRISPR/Cas9 生成的 DSBs 然后由 NHEJ 进行修复, 预计将生成可变长度为19的 indels。请单击此处查看此图的较大版本.
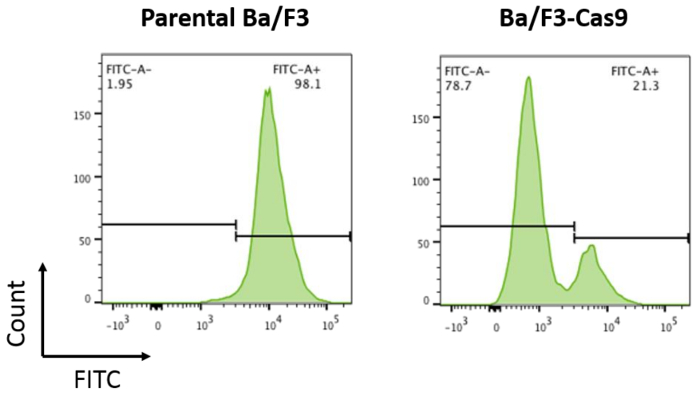
图 2: Cas9 活性测定.父母 Ba/F3 细胞和 Ba/F3 细胞表达 Cas9 转与 pXPR-011, 以测量 Cas9 活动。GFP 的减少与 Cas9 活性的增加有关。父母 Ba/F3 细胞是〜 100% FITC + 相比, Ba/F3-Cas9 细胞的 FITC 减少了约76%。请单击此处查看此图的较大版本.

图 3: 感染的时间轴和 Ba/F3 细胞中 sgRNAs 的选择.请单击此处查看此图的较大版本.

图 4: 引入 +1 bp frameshift 突变到内生的Calr轨迹足以将致癌活动授予 Calr。(a-d) 父 Ba/F3-Cas9 单元格 (a) Ba/F3-MPL-Cas9 单元格 (B)、Ba/F3-EPOR-Cas9 单元格 (C) 和 Ba/F3-G-CSFR-Cas9 单元格 (D) 中的增长曲线显示 IL-3 Calr 的独立增长-目标 Ba/F3-MPL-Cas9 单元格仅19。请单击此处查看此图的较大版本.

图 5:桑格测序验证。确认在 Ba/F3-MPL 单元格中内源Calr (外显子 9) 的目标编辑。+1 bp frameshift 突变以黑色表示19。请单击此处查看此图的较大版本.
| 靶基因 | sgRNA ID | 目标序列 (5 "到 3") | 线 | 劈裂效率 | 目标得分 | ||
| Calr | m1 | AGAGGACAAGAAGCGTAAAGAGG | + | 0。7 | 70 | ||
| Calr | m2 | GAGGCTTAAGGAAGAAGAAGAGG | + | 0。3 | 28 | ||
表 1:20 protospacer 序列, 包括 PAM 站点 (粗体), 用于两个 sgRNAs 目标外显子9的 Calr19。
| 底漆编号 | 序列 (5 "到 3") |
| m1-F | CACCGAGAGGACAAGAAGCGTAAAG |
| m1-R | AAACCTTTACGCTTCTTGTCCTCTC |
| m2-F | CACCGAGGCTTAAGGAAGAAGAAG |
| m2-R | AAACCTTCTTCTTCCTTAACCTC |
表 2: Protospacer 序列及其与 "CACC" 和 "AAAC" 的反向补充, 以 BsmBI 限制性酶为载体, 添加到 pLenti 引导向量中的克隆19。
| 底漆编号 | 序列 (5 "到 3") |
| Calr_Fwd | ACCACCTGTCTTTCCGTTCT |
| Calr_Rev | GGCCTCTACAGCTCATCCTT |
表 3: CRISPR 筛选 PCR 底漆上游和下游的 sgRNA 裂解部位。
讨论
在这里, 我们展示了使用 CRISPR/Cas9 基因编辑研究的生物学功能的CALR突变的造血细胞。该协议的成功与否高度依赖于多个因素。首先, 重要的是要知道什么类型的突变可能是负责的表型, 是需要的。在本协议中, 读数是 Ba/F3 细胞向 mIL-3 独立的转化, 而突变的类型在CALR的外显子9中 indels。但是, 如果所需的突变是单个基对替代, 那么 HDR 介导的修复是首选方法, 因为它可以引入精确点突变或从单或双的 DNA 捐赠者模板2,3. 如果想要敲除基因, 那么创建 large-scale 基因组删除的目标是早期编码显是首选20。
其次, 细胞系必须是细胞因子依赖性的, 以允许阳性选择压力后细胞因子的提取。重要的是要注意, 并非所有的细胞线都能容忍 Cas9 的稳定表达 (参见步骤 6.3)。这可能是由于 blasticidin 选择, 这是不能容忍的所有细胞线。在这种情况下, 选择其他 Cas9 结构与不同的选择磁带可能是必要的。使用细胞因子依赖的细胞系, 如 Ba/F3 细胞的警告是, 它们易受自发细胞因子的独立生长, 有时由于在细胞因子的 ectopically 表达基因的突变的获取退出21。因此, 需要使用适当的控制, 以确信观察到的细胞转化是由于目标 CRISPR 基因的编辑。在本协议中, 我们没有观察到 Ba/F3-MPL 细胞转互不 sgRNA 控制或 Ba/F3-EPOR 和 Ba/F3-GCSFR 细胞转与Calr-目标 sgRNAs 的细胞转换。这提供了进一步的信心, 即 Ba/F3-MPL 单元格中的细胞转换是对内生Calr轨迹的目标编辑的结果。
在本协议中, 由 NHEJ 进行的 DNA 修复引入了可变大小的 indels, 如图 5所示。通过桑格测序的分析, 进行了样本的大量人口的编辑细胞, 以寻找扩大的 indels, 导致 +1 bp frameshift 突变后细胞因子退出。步骤9.9 中提到的下一代排序是一种更健壮的方法, 用于量化对散装细胞群体的目标编辑。如果需要对特定克隆进行分析, 则需要对批量填充进行单个单元格排序。单细胞分选有利于理解特定类型突变所产生的生物学效应, 当目标是了解两种不同类型的突变之间的差异时是有用的。
CRISPR/Cas9 系统的一个关注是不相干效应, 这是在目标区域之外的分裂事件。为了评估 CRISPR/Cas9 系统的特异性, 并确保转化的种群不含有导致观察到的转变的任何不相干效应, 我们将不得不研究基因组的编辑是否发生在兴趣.这可以通过寻找证据 Cas9/NHEJ-driven 基因组编辑在潜在的不相干基因组基因座, 与预期目标的显著序列相似性。为此, 下一代测序也可用于定量评估在特定地点沿基因组的不相干效应的频率。为了减少不相干效应的可能性, 可以将不同的因素纳入议定书。如结果所述, 研究多 sgRNAs 靶区的兴趣, 确保表型是一个目标事件的结果。此外, 最近的研究表明, 截断 sgRNAs 与17核苷酸可以减少不相干分裂事件的频率22。此外, 长期暴露在 Cas9 从稳定的表达可能导致更高的频率不相干效应。必须注意的是, 包含 Cas9 和 sgRNA 的双矢量系统可以在协议中使用, 而不是 Cas9 的稳定表达式;然而, 这些载体往往是非常大, 导致低慢效价和较低的感染效率。因此, 可以使用 nucleofection 在细胞中 Cas9 结构的瞬态转染。最近的报告还开发了具有更高特异性的 Cas9 结构, 用于目标编辑, 如 eSpCas9 构造6。
总之, CRISPR/Cas9 代表了一种高效、廉价和可靠的基因组工程工具, 允许对生理表达水平的基因突变进行研究。在这里, 我们使用 CRISPR/Cas9 基因编辑作为一种有力和有效的方法, 以促进理解的功能效应的CALR突变的造血细胞。
披露声明
我们没有与本报告有关的利益冲突。
致谢
这项工作得到了 NIH (R01HL131835), 一个达蒙罗扬临床研究员奖和斯塔尔癌症财团的支持。
材料
| Name | Company | Catalog Number | Comments |
| BsmBI | New England Biolabs | R0580L | |
| Blasticidin | Sigma Aldrich | 15025 | |
| Puromycin | Life Technologies | A1113803 | |
| Stbl3 cells | Life Technologies | C737303 | |
| TransIT-LT1 | Thermo Fisher Scientific | MIR2300 | |
| Opti-MEM | Life Technologies | 51985034 | |
| RPMI | Thermo Fisher Scientific | MT10040CV | |
| DMEM | Thermo Fisher Scientific | 10-017-CV | |
| Fetal bovine serum (FBS) | Omega Scientific | FB-11 | |
| Penicillin/streptomycin/L-glutamine | Life Technologies | 10378016 | |
| mIL-3 | Peprotech | 213-13 | |
| psPAX2 | Addgene | N/A | |
| pCMV-VSV-G | Addgene | N/A | |
| pLX_TRC311-Cas9 | Addgene | N/A | |
| polybrene | Sigma Aldrich | H9268 | |
| pXPR-011 | Addgene | N/A | |
| Phosphate Buffered Saline (PBS) | Genessee Scientific | 25-507 | |
| TAE buffer | Thermo Fisher Scientific | FERB49 | |
| LentiGuide-Puro | Addgene | Plasmid #52963 | |
| PNK | New England Biolabs | M0201S | |
| T4 ligase | New England Biolabs | M0202S | |
| PCR purification kit | Qiagen | 28104 | |
| Miniprep kit | Qiagen | 27104 |
参考文献
- DeWitt, M. A., et al. Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Sci Trans Med. 8, 360(2016).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 4, 347-355 (2014).
- Gaj, T., Gerbach, C. A., Barbas, C. F. ZFN, TALEN, CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 31 (7), 397-405 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wiedenheft, B., Samuel, S. H., Doudna, J. A. RNA-guided genetic silencing systems in bacteria and archea. Nature. 482 (7385), 331-338 (2012).
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., Zhang, F. Rationally engineered Cas9 nucleases with improved specificity. Science. 351 (6268), 84-88 (2016).
- Ran, F. A., et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell. 154 (6), 1380-1389 (2013).
- Larson, M. H., et al. CRISPR interference (CRISPRi) for sequence-specific control of gene expression. Nat Protoc. 8 (11), 2180-2196 (2013).
- Wang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kim, H. S., et al. CRISPR/Cas9-mediated Gene-knockout screens and target identification via Whole genome sequencing uncover host genes required for picornavirus infection. J Biol Chem. 10, 1074(2017).
- Heckl, D., et al. Generation of mouse models of myeloid malignancies with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nat Biotechnol. 32 (9), 941-946 (2014).
- Daley, G. Q., Baltimore, D. Transformation of an interleukin 3-dependent hematopoietic cell line by the chronic myelogenous leukemia-specific bcr/abl protein. Proc Natl Acad Sci USA. 85, 9312-9316 (1988).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biol. 17, 148(2016).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nat Biotechnol. 32, 1262-1267 (2014).
- Brinkman, E. K., et al. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucl Acid Res. 42, e168(2014).
- Klampfl, T., et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med. 369, 2379-2390 (2013).
- Nangalia, J., et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2. N Engl J Med. 369, 2391-2405 (2013).
- Elf, S., et al. Mutant Calreticulin requires both its mutant C-terminus and the thrombopoietin receptor for oncogenic transformation. Cancer Discovery. 6 (4), 368-381 (2016).
- Bauer, D. E., Canver, M. C., Orkin, S. H. Generation of Genomic Deletions in Mammalian Cell lines via CRISPR/Cas9. J. Vis. Exp. (95), e52118(2015).
- Watanabe-Smith, K., et al. Analysis of acquired mutations in transgenes arising in Ba/F3 transformation assays: findings and recommendations. Oncotarget. 8, 12596-12606 (2017).
- Fu, Y., et al. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. NatBiotechnol. 32, 279-284 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。