Method Article
שימוש CRISPR/Cas9 ג'ין עריכה כדי לחקור את פעילות Oncogenic Calreticulin מוטציה בתאים Hematopoietic תלויי ציטוקין
In This Article
Summary
ג'ין יישוב עריכה באמצעות CRISPR/Cas9 הנחתה במידה רבה את ההבנה של פונקציות ביולוגיות של גנים. כאן, אנו מנצלים את המתודולוגיה CRISPR/Cas9 כדי דגם calreticulin מוטציות בתאים hematopoietic תלויי-ציטוקין לשם פעילותם oncogenic למידה.
Abstract
באשכולות interspaced בקביעות קצר palindromic חזרה (CRISPR) היא מערכת חסינות מסתגלת ב אאוקריוטים, כי יש כבר לשנות את ייעודו על ידי מדענים לייצר nucleases מונחה RNA, כגון CRISPR-הקשורים (Ca) 9 עבור גנום האיקריוטים בייעודי לאתר עריכה. הנדסה הגנום על ידי Cas9 משמש לשינוי ביעילות, בקלות, robustly גנים אנדוגני שורות תאים בתרבית של רלוונטיות biomedically ואורגניזמים רבים. הנה אנחנו מראים כיצד לנצל את המתודולוגיה CRISPR/Cas9 להבין את התפקוד הביולוגי של מוטציות גנטיות מסוימות. אנחנו מודל calreticulin (CALR) מוטציות בתאים מאתר אינטרלוקין-3 (mIL-3) התלויים pro-B (Ba/F3) על ידי משלוח של מדריך בודד RNAs (sgRNAs) מיקוד של לוקוס Calr אנדוגני באזור ספציפי שבו הכניסה ו/או מחיקה (ויאסין ) CALR מוטציות מתרחשות אצל חולים עם myeloproliferative neoplasms (MPN), סוג של סרטן הדם. SgRNAs ליצור מעברי חוט כפול (DSBs) באזור יישוב שבו תוקנו עד סוף שאינם הומולוגיים להצטרף (NHEJ) לתת indels בגדלים שונים. ואז נשתמש וזמינותו טרנספורמציה הסלולר Ba/F3 סטנדרטי כדי להבין את השפעת פיזיולוגיים רמת ביטוי של מוטציות Calr על טרנספורמציה הסלולר hematopoietic. גישה זו ניתן ליישם את הגנים האחרים ללמוד תפקידם הביולוגי בקווים בתרבית של תאים שונים.
Introduction
CRISPR/Cas9 טכנולוגיה יש מהפכה לאחרונה הגנום יישוב עריכה בתוך תאים חיים ואורגניזמים. זה הפך להיות כלי רב עוצמה עבור המחקר הביו-רפואי, כעת להיות מנוצל כמו שדרה פוטנציאל לטיפול של מחלות גנטיות1. הבסיס של כל הגנום כלי עריכה מסתמך על בריאת הנוצרות על-ידי נוקלאז DNA כפול נטושים הפסקה (DSB)-מיקומה גנומית כדי להיות שונה. DSBs אפשר לתקן על ידי שאינם הומולוגיים סוף-הצטרפות (NHEJ) או תיקון מכוון הומולוגיה (HDR)2,3. היתרון של נוקלאז Cas9 על פני אחרים הגנום הנדסה nucleases, כגון אבץ אצבע nucleases (ZFNs), nucleases אפקטור כמו מפעיל שעתוק (TALENs) הוא תלותה RNA הכוונת של נוקלאז לרצף DNA הרצוי, בהשוואה כדי אינטראקציות חלבון-DNA שנמצאו ZFNs ו TALENs2,3.
לאחר הגילוי של הנתיב נוקלאז CRISPR/Cas9 כמו מערכת חיסונית אדפטיבית תאים prokaryotic4,5, מאמץ הושקעה התאמת מסלול לשימוש שורות תאים בתרבית של מודל אורגניזמים2, 3. ככלי לעריכה ג'ין, מסלול CRISPR/Cas9 מנצל שני רכיבים מרכזיים: הפישחה ינפל תומימת סטרפטוקוקוס (Sp) נגזר נוקלאז Cas9 ו- sgRNAs מיקוד הגן של הריבית2,3. SgRNA מורכב נוקלאוטידים 20 את Cas9 ישירות למקום ספציפי על הגנום באמצעות ה-RNA-DNA זוג בסיסים משלימים את החסר2,3. אתר היעד של sgRNA חייב לשקר סמוכים לאתר מוטיב סמוכים (פאם) protospacer בצורה של 5' הגולה, אשר הוכר על ידי נוקלאז SpCas9. עם כלים אלה, Cas9 ויכולה להיות מכוונת לסייע כל רצף ה-DNA על-ידי עיצוב sgRNAs את המטרה האזור של ריבית. בנוסף ל Sp נגזר Cas9, יש גירסאות נוספות עבור Cas9 עם תכונות שונות בהתאם ליישום מסוים. לדוגמה, ישנן גרסאות Cas9 עם הם ברמת פירוט גבוהה לעריכה--יעד או יכולת המחשוף יחיד-גדיל DNA חותך6,7. יתר על כן, Cas9 catalytically לא פעיל לאחרונה פותחה עבור גנים ברמת השעתוק תקנה8. מדענים עכשיו להשתמש במערכת CRISPR/Cas9 עבור מגוון של יישומים, כגון גן knockin נוקאאוט ללמוד על תפקודים ביולוגיים של גנים9, אובדן-של-פונקציה ורווח-של-פונקציה ספריית מסכי10 ותעשיה הנדסה של אורגניזמים דגם11.
ב פרוטוקול זה, אנו משלבים את המתודולוגיה CRISPR/Cas9 עם וזמינותו טרנספורמציה הסלולר Ba/F3 כדי להבין את התפקוד הביולוגי של מוטציות CALR . Ba/F3 תאים הם קו מהתא hematopoietic IL-3 מאתר יכולה לבצע רינדור של IL-3 עצמאית על ביטוי של oncogenes מסוימים כגון BCR-ABL12. על מנת להבין אם המוטציה calreticulin יכול להפוך תאים Ba/F3 לצמיחה עצמאית ציטוקין, אנו ממוקד אקסון 9 של מיקומה Calr אנדוגני באמצעות CRISPR/Cas9 להציג ויאסין מוטציות, ואז נסוגו IL-3 מן התאים כדי להחיל לחץ חיובי הבחירה, עם המטרה של recapitulating רווח-של-פונקציה CALR מוטציות נמצאו בחולים MPN. הפרוטוקול כולל של עיצוב, שיבוט, משלוח של sgRNAs, התפתחותם של תאים לביטוי יציב של Cas9, הקרנה של CRISPR--יעד ג'ין עריכה. פרוטוקול זה ניתן להחיל על גנים שונים וקווים תא תלויי-ציטוקינים שונים של עניין, והוא יקר במיוחד ב דוגמנות ולימוד הפונקציה הביולוגי של גנים המעורבים ב סרטן.
Protocol
1. sgRNA עיצוב באמצעות כלים מקוונים13
-
עיצוב sgRNAs מיקוד הגן עניין באמצעות כלי מקוון זמינה בחופשיות.
- העתק והדבק את רצף ההתייחסות NCBI הגן עניין בכלי אינטרנט מעצבים במכון sgRNA: (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design).
הערה: כלי זה מזהה רצפי sgRNA עם מחשוף אתרי בתוך exons, אלה המתפרסים על הגבול אינטרון/אקסון אבל עדיין קליב בתוך אקסון. - להורדה, פתח קובץ הפלט של טקסט ב- excel.
- דגש על העמודות מאוכלס עם הרצפים sgRNA ואת ההקשר sgRNA רצפים. שימו לב כי הרצפים sgRNA אינם מכילים את מוטיב סמוך protospacer (פאם) אך הרצפים בהקשר.
- הערה הציון ביעד היעילות מפרטת את הציון יעילות המחשוף החזוי בסולם של 0 עד 1 איפה ציון של 1 מציין יעילות גבוהה יותר של המחשוף.
- שימוש בפונקציה 'מיון' של excel להורות גם המטרות לפי התוצאה יעילות או לפי מיקום בתוך הגן של היעד באמצעות העמודה 'גזור היעד %'.
הערה: מיון לפי מיקום בתוך הגן שימושית לזיהוי sgRNAs המכוונות בתחום מסוים או אקסון של עניין. - בחר sgRNAs 3-6 שמכוונות את תחום העניין עם גבוה (> 0.6) יעילות ציונים על המטרה. זה יכול להיות שימושי לדעת אילו סוגים של מוטציות עשויים להיות אחראים פנוטיפ זה הרצוי (אנא ראה איור 1 המסביר את אסטרטגיית מיקוד משמש calreticulin).
הערה: sgRNAs מתחת לסף ציון יעילות 0.6 הציע להתייחס כאשר יש חוסר של מועמדים טובים אחרים. - השתמש בכלי האינטרנט ניתוח של gRNA MIT למסך לאפקטים חופש-יעד פוטנציאליים (http://crispr.mit.edu/). עבור כל sgRNA נבחר, הפעל את רצף המטרה (כולל את פאם).
הערה: הכלי מעצבים באינטרנט sgRNA במכון יכול לשמש גם עבור ביטול-יעד אפקטים (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design) מסך.- שימו לב כי כלי הניתוח sgRNA MIT ציונים לכל sgRNA בקנה מידה של 1 ל- 100 איפה ציון של 100 מציין הם ברמת פירוט גבוהה. ציון גדול מ- 70 הוא אידיאלי ומייצג של sgRNA עם מינימום תופעות את המטרה. אתר זה יוצרת גם רשימה של חופש-יעד להיטים עם המיקום שלהם בתוך הגנום של כמה התאמות בכל אחד מהם יש עם המדריך המועמד.
הערה: להיטים את המטרה עם אי-התאמות ארבע ומעלה נחשבים בטוחים14. את המטרה להיטים עם פחות מארבעה אי-התאמות עשוי להיות בעייתי אם הם נופלים בתוך exons14.
- שימו לב כי כלי הניתוח sgRNA MIT ציונים לכל sgRNA בקנה מידה של 1 ל- 100 איפה ציון של 100 מציין הם ברמת פירוט גבוהה. ציון גדול מ- 70 הוא אידיאלי ומייצג של sgRNA עם מינימום תופעות את המטרה. אתר זה יוצרת גם רשימה של חופש-יעד להיטים עם המיקום שלהם בתוך הגנום של כמה התאמות בכל אחד מהם יש עם המדריך המועמד.
- לבחור 2-3 sgRNAs אשר יעד מקומות נפרדים בתוך האזור מעניין עבור הגן היעד, ויש אשר הציונים הגבוה ביותר המחשוף לזווג את המטרה ויעילות (לקבלת רצפי sgRNA מיקוד אקסון 9 של Calr, ראה טבלה 1 ).
הערה: בהתאם היעדים ניסיוני, דגש רב יותר אפשר למקם על הערכים השונים המתקבלים בכלים שהוזכרו.
- העתק והדבק את רצף ההתייחסות NCBI הגן עניין בכלי אינטרנט מעצבים במכון sgRNA: (http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design).
2. שיבוט sgRNA Oligos13
-
צור את oligo קדימה
- צור רשימת הרצפים sgRNA בלי האתר פאם.
- להוסיף G לסוף 5' של הרצף אם 5' סוף הרצף sgRNA אינה לסול
הערה: G זה הוא הכרחי עבור הגדלת רמת שעתוק sgRNA מונחה-U6. תוספת של G הוא הכרחי עבור sgRNA m1 (טבלה 1). - הוסף את הרצף "CACC" 5' בסוף הרצף הממוטבים G מדריך (לא פאם) (טבלה 2) על מנת ליצור את המסוכך על הדרושות מצדו של annealed oligos לתוך BsmBI מתעכל וקטור lentiGuide (ראה שלב 3).
-
צור את oligo הפוכה
- הפוך משלים הרצף הממוטבים G מדריך (לא פאם).
- הוסף את הרצף "AAAC" 5' בסוף הרצף הפוכה המלווים מדריך הממוטבים G (טבלה 2).
- סדר oligos מעוצב מחברה סינתזה פריימר.
-
Anneal, phosphorylate oligos
- להוסיף 1 µL של קדימה oligo (100 מיקרומטר), µL 1 של oligo הפוכה (100 מיקרומטר), מאגר µL 1 של 10 x T4 מצדו, 0.5 µL של T4 polynucleotide קינאז (PNK), µL 6.5 של H2O לרכבת התחתית PCR (סה כ = 10 µL).
- להפעיל את התוכנית הבאה thermocycler: 37 הלעפה תרוטרפמט במשך 30 דקות, 95 הלעפה תרוטרפמט במשך 5 דקות, שיפוע בין 95 ל- 25 ב- 0.1 º C/s.
- לדלל את המוצר התגובה לפי 1:250 H2O.
3. מערכת העיכול של lentiGuide-פורו וקטור13
-
תקציר lentiGuide-פורו וקטור
- כנס לתגובה עיכול 50 µL עם הרכיבים הבאים: 5 µg של פלסמיד מעגלית, µL 2 (30 יחידות) של אנזים הגבלה BsmBI, 5 µL מאגר אנזים הגבלה של עד 50 µL של H2O.
- הפעל את התגובה כבר שעתיים-55 מעלות צלזיוס. לאחר השעה הראשונה, להוסיף 1 µL יותר של אנזים הגבלה BsmBI.
-
Dephosphorylate עמוד השדרה לחתוך
- להוסיף 7 µL פוספטאז התגובה מאגר ו- 2 µL של האנזים פוספטאז הווקטור מעוכל.
- תקופת דגירה של 30 דקות ב- 37 מעלות צלזיוס.
- PCR לטהר את החתך ואת עמוד השדרה dephosphorylated באמצעות ערכת מסחרי.
הערה: תחליף העמודות בצבע ורוד שסופק עם ערכת miniprep כחול עמודות צבעוניות מאז אלה כדאי להכיל פלסמיד גדול מידות. ניתן להגדיל את התשואה על ידי חימום המאגר • תנאי בתוך גוש חום הלעפה תרוטרפמט 90 לפני • תנאי ועל ידי eluting ה-DNA מן העמודה פעמיים בסוף (הפעלת הדנ א eluted מ • הראשון תנאי חזרה דרך בפעם השנייה).
4. מצדו ofAnnealed Oligos לתוך עמוד השדרה מתעכל13
- להוסיף 50 ng מתעכל חוט שדרה, µL 1 של annealed oligo דילול, מאגר µL 1 של 10 x T4 מצדו, 1 µL של T4 ליגאז ועד 10 µL של H2O לרכבת התחתית PCR. תקופת דגירה של h 1 בטמפרטורת החדר
- להפוך תאים Stbl3 עם 2 µL של התגובה מצדו. צלחת על צלחת אגר מרק (ליברות) lysogeny עם 100 אמפיצילין µg/mL, דגירה בין לילה ב 37 º C.
- לבחור 3 מושבות, לחסן בתרבות הלמידה המצומצמת.
-
לאמת את ההכנסה oligo הנכון
- ביצוע של miniprep עבור כל תרבות וכל רצף דרך האתר ההכנסה oligo החל מפריימר של האמרגן U6 באמצעות ערכת מסחרי.
- ביצוע של midi-הכנה או מקסי-הכנה של התרבות תבדוק-רצף.
5. דור של תא lLines Stably SpCas9 לבטא
הערה: פרוטוקול זה כרוך המסירה של פלסמיד pLX_TRC311-Cas9 על-ידי זיהום lentiviral. פרוטוקול זה מתואר בפירוט עבור מאתר אינטרלוקין-3 (mIL-3) pro-B (Ba/F3) תאים ניזונים, קו תא ההשעיה, יכול להיות מותאם סוגי תאים אחרים באמצעות התנאים תרבות מועדפת עבור כל סוג התא. המדיום תרבות עבור תאים Ba/F3 מורכב בתוספת סרום שור עוברית 10%, 1% פניצילין/סטרפטומיצין RPMI/L-גלוטמין ו 10 ננוגרם למ"ל אינטרלויקין מאתר 3.
-
Transfect תאים HEK-293T
- זרע 3 x 10 תאים6 HEK-293T לכל מאכל תרביות רקמה 10 ס מ. לשמור תאים הזריעה בן לילה לפני תרביות תאים.
הערה: HEK-293T התאים הם קו תא חסיד, נעשה שימוש באופן שגרתי לייצור וירוס. התאים נשמרים ב- DMEM בתוספת סרום שור עוברית 10%, 1% פניצילין/סטרפטומיצין/L-גלוטמין. תאים צריך להיות 80% confluent בזמן של תרביות תאים. - חם מראש מופחת סרום מדיה (Opti-מ), מדיום הגידול.
- להוסיף 500 µL של התקשורת מופחת סרום, 7 µg של pLX_TRC311-Cas9 לבנות, 4 µg של פלסמיד אריזה lentiviral pCMV-VSV-G ו- 4 µg של psPAX2 lentiviral אריזה פלסמיד לתוך צינור
הערה: DNA הכולל לכל צלחת 10 ס מ של תאים 293T היא 15 µg. - מערבבים היטב את ה-DNA ולהוסיף 45 µL של ריאגנט תרביות תאים. לערבב בעדינות, ומשהים 20 דקות.
הערה: חשוב להשתמש בסרום מופחתת מדיה כי סרום ימנע היווצרות מורכבות בין תרביות תאים ריאגנט פלסמיד ה-DNA. - האחות המדיום הישן בצלחת 293T ולהוסיף 5 מ של מדיום הגידול החדש.
- להוסיף את התמהיל ריאגנט DNA ו תרביות תאים באופן חכם טיפה הצלחת 293T. מערבולת בעדינות, דגירה-37 מעלות צלזיוס ו-5% CO2 במשך 24 שעות ביממה.
- הקציר supernatants ויראלי-תקנים פוסט h 24 ו-48. עוברים דרך מסנן מיקרומטר 0.22 aliquot לתוך צינור cryovial (1.6 mL/צינור ו 1.5 mL רצון לשמש עבור זיהום).
- תגובת שיקוע ויראלי חנות ב-80 מעלות צלזיוס.
הערה: תגובת שיקוע lentiviral יכול לשמש בתוך 6 חודשים. אם אפשרי, spinfection transductions צריכה להתבצע עם וירוס טריים).
- זרע 3 x 10 תאים6 HEK-293T לכל מאכל תרביות רקמה 10 ס מ. לשמור תאים הזריעה בן לילה לפני תרביות תאים.
-
זיהום lentiviral של תאים Ba/F3
- להפשיר את תגובת שיקוע ויראלי בקרח, אם קפוא.
- צנטריפוגה תאים ב g x 300 במשך 4 דקות.
- האחות תגובת שיקוע, resuspend את התאים-ריכוז של 3 x 106 תאים/מ ל....
- להוסיף 500 µL של תאים resuspended, 1.5 מ של תגובת שיקוע ויראלי, 4 µL של polybrene (מניות: 2 מ"ג/מ"ל) ו- 10 ננוגרם למ"ל של m-IL3 בצלחת תרביות רקמה 6-. טוב. הקפד לכלול נגוע היטב עם 1.5 מ של המדיה במקום תגובת שיקוע ויראלי כפקד.
הערה: כמות תגובת שיקוע ויראלי הוסיף צריכה להתאים את ריבוי של זיהום (MOI) < 1. - Centrifuge את הצלחת-440 גרם x עבור 120 דקות ב 37 º C.
- לוקח את הצלחת לצאת לצנטריפוגה מקום 37 ° C ו- 5% CO2 מגשים ומאפשרים לגדול בין לילה.
- ספין למטה התאים לאחר 24 שעות, resuspend עם 5 מ של התקשורת חמים טריים צלחת 6-. טוב.
-
בחירת התאים Cas9 נגוע
- ספין למטה התאים, resuspend עם מדיה חם טרי בתוספת 5 µg/mL של blasticidin, spinfection פוסט 48 שעות.
- בחר את התאים במשך 9 ימים עם blasticidin או עד נגוע השליטה (שלילי) תאים מתים.
- לאחר הבחירה יושלם, העבר את התאים עמיד בינוני עם ריכוז נמוך יותר של blasticidin.
6. כתב Assay עבור Cas9 פעילות15
- מגלי הורים תאים ותאים stably לבטא Cas9 עם pXPR-011 על-ידי זיהום lentiviral (ראה שלבים 5.1-5.2).
הערה: וקטור זה מכיל GFP וגם מדריך מיקוד GFP. תאים המכילים Cas9 פעיל תגרום לירידה של GFP (איור 2). - בחר את התאים במשך 3 ימים עם 2 µg/mL של puromycin, spinfection פוסט 48 שעות.
- לנתח את הדגימות לביטוי GFP ידי cytometry זרימה.
הערה: ירידה GFP של 50% או יותר מייצג פעילות Cas9 אופטימלית. ריכוז גבוה יותר של הבחירה blasticidin יכול לשמש כדי להגדיל פעילות Cas9 אם פחות נצפית ירידה של 50%. שורות תאים לא כל יכול לסבול blasticidin הבחירה. במקרה זה, השימוש וקטורים Cas9 עם קלטות בחירה אחרים ייתכן שיהיה צורך. בנוסף, לא כל שורות תאים יכול לסבול ביטוי יציב של Cas9. במקרה זה, עשוי לשמש ארעי תרביות תאים של Cas9.
7. Spinfection של sgRNAs לתוך התאים לבטא Cas9
- בצעו את צעדים 5.1-5.2 זיהום lentiviral של sgRNAs לתוך תאים של עניין.
הערה: בשלב 5.1.3, החלף לבנות pLX_TRC311-Cas9 lentiGuide-פורו הבונה מאומת של סעיף 4. - 48 שעות לכתוב spinfection, בחר את התאים במשך 3 ימים עם 2 µg/mL של puromycin.
- להעביר את התאים עמיד בינוני עם ריכוז נמוך יותר של אנטיביוטיקה והמשך הבחירה עבור עוד 4 ימים לאפשר עריכה מספיקות.
8. Ba/F3 טרנספורמציה הסלולר ומבחר חיובי באמצעות m-IL3 גמילה
הערה: assay הזה מתואר עבור מיל-3 תאים ניזונים Ba/F3 אך יכול לחול על כל קו מהתא ציטוקין.
- ספין למטה שמתקדמות Ba/F3 תאים ectopically לבטא את Cas9, את sgRNA של עניין.
- האחות תגובת שיקוע ולשטוף את התאים 5 מ של פוספט Buffered מלוחים (PBS).
- ספין למטה התאים, חזור על השלב שטיפת ב 8.2 ארבע פעמים (שלב זה מבטיח כי התקשורת היא ללא תשלום של IL-3).
- האחות של PBS, resuspend את התאים ב 5 מ של מדיה טריים ללא IL-3.
- לספור את התאים באמצעות hemocytometer או מנתח הכדאיות התא.
- הזרע התאים שהפקידים בצלחת תרביות רקמה 6-ובכן-ריכוז של עונה 1 פרק 105 תאים למ"ל בשנת הנפח הכולל של 2 מ של מדיה טריים ללא IL-3.
- לפקח ולספור את התאים כל יומיים עבור סכום כולל של 8 ימים.
הערה: Ba/F3 תאים חסר IL-3 בדרך כלל למות פוסט 2 ימים רעב IL-3. חשוב לכלול פקד שלילי וזמינותו (בדרך כלל משמש מדריך ללא פילוח כפקד).
9. הקרנת לעריכה ביעד CRISPR
- עיצוב CRISPR הקרנת תחל ויוצאת של אתר פצילות sgRNA
הערה: השתמש תחל לפחות 100 bp מאתר המחשוף חזויים כדי להבטיח זיהוי לא להיות מושפע ההכנסה גדולים ו/או מחיקה (ויאסין) ב אתר המטרה sgRNA. - לבודד דנ א גנומי (gDNA) מתאי טרנספורמציה (בסוף עקומת גדילה), תאים טרום-ציטוקין נסיגה.
הערה: תמיד כוללים תאים overexpressing המדריך ללא פילוח כפקד לעריכה ג'ין. בידוד gDNA מתאי לפני ואחרי השינוי לזהות שיבוטים זה נבחרו באופן חיובי עבור ויש יתרון המקדימות. - להרכיב µL 50 PCR עם הרכיבים הבאים: 25 µL של תערובת x PCR 2, µL 1 של פריימר לפנים (10 מיקרומטר), µL 1 של פריימר הפוכה (10 מיקרומטר), 50-100 ננוגרם של gDNA, ו- H2O עד 50 µL.
הערה: רבים באיכות גבוהה polymerases עשוי לשמש בשלב 9.3. - לרוץ דגימות thermocycler באמצעות הפרמטרים הבאים: 95° C עבור 1 דקות, 30 מחזורים של (94 ° C במשך 1 דקה, 52 ° C ל 30 s, 72 ° C ל 30 s), ו- 72 מעלות צלזיוס למשך 10 דקות. זה ה-PCR ממוטב תחל Calr המופיעה בטבלה 3. למטב את תנאי ה-PCR הזוג פריימר מתוכנן בשלב 9.1 בהתבסס על הבדיקות gDNA.
- הפעל µL 5 של הדגימות על ג'ל agarose 2%-10 V/ס מ באמצעות מאגר טריס-אצטט-EDTA (טה) x 1. נבחן דוגמאות לנוכחות / היעדרות של להקת מוגבר המתאימים בגודלם על הגן של עניין.
- להשתמש את שאר התגובה PCR (45 µL) כדי לבצע טיהור של ה-PCR.
- לשכפל את amplicons עם ה-PCR שיבוט ערכת לתוך פלסמיד וקטור. לדוגמה, pGEM T-קל וקטורים משמשים בדרך כלל.
- להפוך את פלסמיד תאים Stbl3 או אחרים תאים תואם וצלחת אל LB פלטות אגר עם אנטיביוטיקה הרלוונטיים. בחרו 10-20 מושבות, הכנה מיני כל אחת מהן, נושא כל המשובטים סנגר רצף לאפיין את indels שנוצר מעריכת CRISPR/Cas9.
הערה: אם רצונך בכך, תא בודד תא פלורסצנטיות מופעל שמיון (FACS) יכול להתבצע על הנפח לערוך האוכלוסייה כדי לבודד שיבוט עם ויאסין ספציפיים. יתר על כן, הדור הבא רצף שיטות (הגדרות) יכול לשמש יותר robustly לכמת על המטרה עריכה באמצעות רצף עמוק של ה-PCR amplicons המתפרסות על-פני אזור היעד sgRNA. לדוגמה, ניתן להשתמש מעקב של Indels על ידי פירוק או הגאות במקום subcloning כדי לקבוע במדויק את הספקטרום ואת התדירות של יישוב מוטציות שנוצרו בתוך בריכה של תאים (https://tide.nki.nl/#about)16.
תוצאות
שימוש בשיטת המתוארים כאן, מטרת ניסוי זה היא לבחון את השפעות פונקציונלי היכרות עם מוטציות ויאסין על מיקומה Calr אנדוגני-תא hematopoietic טרנספורמציה. מערכת CRISPR/Cas9 משמש ככלי ליצירת מוטציות Calr אנדוגני בתאים Ba/F3. SgRNAs שני נבחרו כדי להתמקד אקסון 9 של Calr (איור 1), באזור שבו הוספות ו/או מחיקה (ויאסין) מוטציות מתרחשות לרוב ב- CALR-מוטציה MPN חולים17,18. SgRNA הראשון (m1) נבחרה בהתבסס על מחשוף גבוה היעילות שלה ואת הציונים את המטרה חיובית (טבלה 1). SgRNA השני (m2) נבחר בעיקר עבור מיקומו בתוך אקסון 9, בשל העדר sgRNAs נוספים באזור כדי לערוך עם מחשוף גבוהה ויעילות אוהדת את המטרה ציונים (טבלה 1). שני sgRNAs נפרדים (m1 או m2) שימשו זיהומים נפרד כדי להבטיח כי ההשפעות שנצפו היו עקב עריכת הגן על המטרה. תופעות מחוץ-יעד סביר להניח להיות משותף על ידי מספר sgRNAs עצמאית. הפקד ללא פילוח (לערבל) שימש גם פקד שלילי. גיוס endonuclease Cas9 כדי Calr אקסון 9 הוא חזה כדי ליצור DSBs לוקוס זה. DSBs ואז יהיה לתקנו על-ידי NHEJ, אשר ניתן להפיק indels בגדלים משתנים (איור 1).
כדי לפתח במבחנה CRISPR/Cas9 מערכת Ba/F3 תאים, התאים stably לבטא את החלבון Cas9 נעשו על ידי lentiviral בתיווך התמרה חושית לפי הפרוטוקול המתואר לעיל. הביטוי Cas9 יציב תוצאות בפעילות Cas9 חזקים. Cas9 פעילות בתאים Ba/F3-Cas9 נמדדה על ידי pXPR-011, מבנה הכתב המכיל GFP וגם מדריך מיקוד GFP15. תאים המכילים Cas9 פעיל תגרום לירידה של GFP15. GFP נמדדה בתאים באמצעות cytometry זרימה. Ba/F3-Cas9 תאים להציג ירידה של-76% ה-GFP, המתאימים לפעילות Cas9 חזקים (איור 2).
הקלד 1 קולטנים ציטוקינים, כגון הקולטן thrombopoietin (הזט ב), הקולטן אריתרופויאטין (EPOR) ועירור של גרנולוציט המושבה-גורם קולטן (G-CSFR) היו כל אחד בנפרד, הביע stably בתאים Ba/F3-Cas9 כדי לקבוע שלהם cooperativity עם calreticulin מוטציה ב גרימת שינוי של תאים Ba/F3. התמרה חושית של המבנה sgRNA (m1, m2 או לטרוף (ללא פילוח מדריך)) אז בוצע בכל הקווים תא Ba/F3 לבטא stably Cas9, הקולטן של עניין. תאים נבחרו לאחר מכן במשך 7 ימים עם puromycin כדי לאפשר מספיק זמן לעריכה ג'ין CRISPR/Cas9. בלחץ חיובי הבחירה אז הוחל מאת ברעב התאים של ציטוקינים (mIL-3). המטרה של הלחץ הזה רעב הוא לזהות אם indels ב Calr אקסון 9, דומים לאלו שנצפו בחולים MPN, נבחרו, וכתוצאה מכך ציטוקין תלויית צמיחה ושינוי של תאים Ba/F3. עקומת גדילה בוצע עבור סכום כולל של 8 ימים, התאים נספרו כל יומיים כדי למדוד את השינוי (איור 3)19. תא כדורי להפקת DNA גנומי נאספו לפני ההתחלה של עקומת הגדילה, בסוף עקומת הגדילה לבדוק לעריכה--יעד וכדי לפקח על indels שהתרחב פוסט ציטוקין רעב (איור 3)19.
גידול עצמאי ציטוקין נצפתה ב Calr-ממוקד Ba/F3-הזט ב- Cas9 תאים (איור 4B), אבל לא Calr-ממוקד Ba/F3-Cas9 הורים תאים (איור 4A), או תואר ראשון/F3-Cas9 תאים ectopically לבטא EPOR (איור 4C ) או G-CSFR (איור 4D)19. כדי לוודא כי הצמיחה עצמאית mIL-3 תאים ממוקדות Calr Ba/F3-הזט ב- Cas9 היה תוצאה של ג'ין על המטרה עריכה, היו תאים שנקטפו 8 ימים פוסט mIL-3 נסיגה והיה דנ א גנומי שחולצו19. אזור bp 422 המתפרסות על-פני אתר היעד היה מוגבר באמצעות תחל את המפורטים בטבלה3. תת שכפול של PCR amplicons בוצעה ו 30 שיבוטים בודדים נשלחו עבור סנגר רצף. M1 או m2 Calr-יישוב Ba/F3-הזט ב- Cas9 תאים, כל indels שיבוטים המשנה הכלולים בגדלים שונים-אתר המיועד לחתוך (איור 5)19. 11 מתוך 13 m1 שיבוטים תת נמצאו להכיל indels שהובילו +1 bp frameshift מוטציות (איור 5), דומים לאלה שנמצאו חולים. עבור m2 Calr-ממוקד תאים, שיבוטים משנה 10 מתוך 17 נמצאו להכיל indels שהובילו +1 bp frameshifts (איור 5)19. נתונים אלו מאשרים CRISPR/Cas9-מתווכת הקדמה של + 1bp frameshift מוטציות כדי אנדוגני Calr אקסון 9 לוקוס מספיקה להתייעץ oncogenic פעילות Calr19. הנתונים רצף באיור 5 גם מרמז המבוא של משפחתית ולא משפחתית הטרוזיגוטיים + 1bp מוטציות frameshift על מיקומה Calr אנדוגני הוא מספיק כדי להפוך תאים Ba/F3-הזט ב, בקנה אחד עם התצפית הזו CALR מוטציות הן בדרך כלל משפחתית ולא. משפחתית הטרוזיגוטיים MPN חולים17,18. מאז NHEJ תיקון תוצאות הטרוגניות גבוהה בין indels, תא בודד מיון כדי לבודד שיבוט עניין יכול להתבצע. יכולת זו תאפשר החוקר לחקור את ההשפעות של מוטציות ספציפיות שנוצרו על-ידי CRISPR/Cas9.
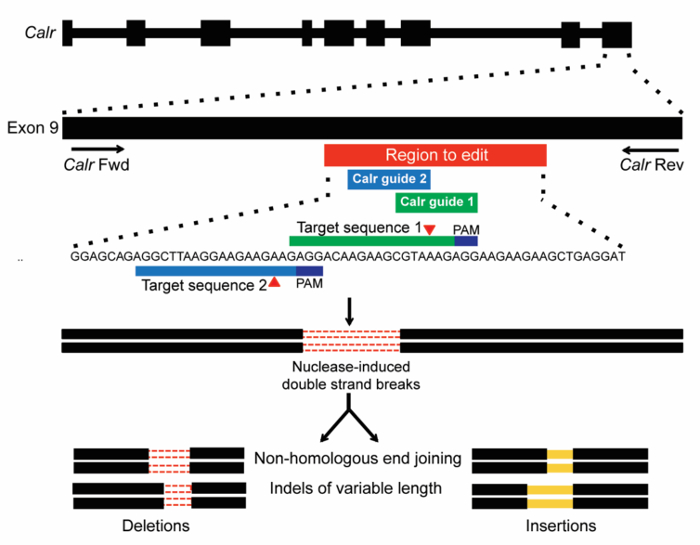
איור 1: סכימה של CRISPR/Cas9 ג'ין עריכת פילוח של אקסון 9 של Calr. SgRNAs שני תוכננו למטרה אתר בתוך אזור אקסון 9 Calr העכבר המתאים לו ייעוד מאת + 1bp frameshift מוטציות MPN אנושי (בר אדום). רצפי היעד עם PAMs (כחול כהה) מוצגים, אתרים הצפוי של פצילות מאת Cas9 מסומנים באמצעות משולשים אדומים. DSBs שנוצר על ידי CRISPR/Cas9 מכן תוקנו על ידי NHEJ, אשר צפוי להפיק indels של אורך משתנה19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
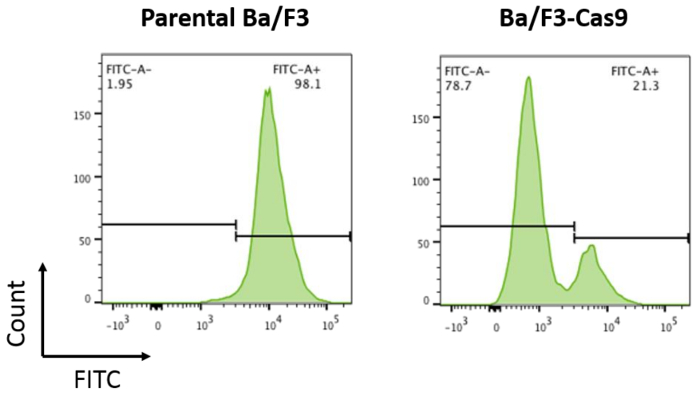
איור 2: assay פעילות Cas9. הורים Ba/F3 תאים ותאים Ba/F3 overexpressing Cas9 היו transduced עם pXPR-011 כדי למדוד פעילות Cas9. צמצום GFP בקורלציה עם פעילות מוגברת של Cas9. הורים Ba/F3 תאים הם ~ 100% FITC + בהשוואה לתאים Ba/F3-Cas9 איפה FITC הוא מופחת על ידי ~ 76%. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: ציר זמן עבור זיהום ומבחר sgRNAs בתאים Ba/F3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: ההיכרות של +1 bp frameshift מוטציות לוקוס Calr אנדוגני מספיקה להתייעץ oncogenic פעילות Calr. עקומות גדילה (י-ם) בהורים Ba/F3-Cas9 תאים תאים (A) Ba/F3-הזט ב- Cas9 (B), Ba/F3-EPOR-Cas9 תאים (C), ומדגים תאים Ba/F3-G-CSFR-Cas9 (D) IL-3 גידול עצמאי ממוקדות Calr Ba / F3-הזט ב- Cas9 תאי היחידה19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: סנגר רצף אימות. אישור--יעד עריכה של אנדוגני Calr (אקסון 9) בתאים Ba/F3-הזט. +1 bp frameshift מוטציות מסומנים שחור19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| היעד ג'ין | מזהה sgRNA | רצף המטרה (5' ל 3') | סטרנד | יעילות המחשוף | ציון את המטרה | ||
| Calr | m1 | AGAGGACAAGAAGCGTAAAGAGG | + | 0.7 | 70 | ||
| Calr | m2 | GAGGCTTAAGGAAGAAGAAGAGG | + | 0.3 | 28 | ||
טבלה 1:20-mer רצפים protospacer כולל את פאם באתר (באותיות מודגשות) עבור שני sgRNAs מיקוד אקסון 9 של Calr 19.
| פריימר מזהה | רצף (5' ל 3') |
| m1-F | CACCGAGAGGACAAGAAGCGTAAAG |
| m1-R | AAACCTTTACGCTTCTTGTCCTCTC |
| m2-F | CACCGAGGCTTAAGGAAGAAGAAG |
| m2-R | AAACCTTCTTCTTCCTTAACCTC |
בטבלה 2: רצפים Protospacer שלהם משלים הפוכה עם "CACC" ו "AAAC" הוסיף לקראת שיבוט לתוך וקטור pLenti-מדריך באמצעות אנזים הגבלה BsmBI 19.
| פריימר מזהה | רצף (5' ל 3') |
| Calr_Fwd | ACCACCTGTCTTTCCGTTCT |
| Calr_Rev | GGCCTCTACAGCTCATCCTT |
טבלה 3: CRISPR הקרנת תחל PCR ויוצאת של אתר פצילות sgRNA.
Discussion
כאן אנחנו מדגימים את השימוש CRISPR/Cas9 ג'ין עריכה כדי לחקור את תפקוד ביולוגי CALR מוטציות בתאים hematopoietic. ההצלחה של פרוטוקול זה תלויה מאוד גורמים רבים. ראשית, חשוב לדעת אילו סוגים של מוטציות עשויים להיות אחראים פנוטיפ רצויה. פרוטוקול זה, המדידה הוא הטרנספורמציה של תאים Ba/F3 לעצמאות mIL-3, סוגי מוטציות הם indels ב אקסון 9 של CALR. עם זאת, אם המוטציה הרצוי החלפה בסיס יחיד זוג, אז תיקון בתיווך HDR היא השיטה המועדפת כי זה יכול להציג מוטציות נקודה מדויקת או הוספות של סטרנד יחיד או כפול גדילי DNA התורם תבנית2, 3. בעת הצורך כדי הסתרה, הגן, אז הקמת רחבת היקף מחיקות גנומית מיקוד מוקדם exons קידוד מועדף20.
שנית, שורת התאים להיות תלויי-ציטוקין תאפשר בחירה חיובי לחץ פוסט ציטוקין הנסיגה. חשוב לציין כי לא כל שורות תאים יכול לסבול את הביטוי יציב של Cas9 (ראה שלב 6.3). זה יכול להיות בגלל הבחירה blasticidin, אשר איננה מקובלת על ידי כל שורות תאים. במקרה זה, הבחירה של מבנים אחרים Cas9 עם קלטות בחירה שונה ייתכן שיהיה צורך. אזהרה משימוש שורות תאים תלויי-ציטוקינים, כגון תאים Ba/F3 היא שהם רגישים צמיחה עצמאית ציטוקין ספונטנית, לעיתים עקב הרכישה של מוטציות בגן ectopically ביטוי של עניין בעקבות ציטוקין גמילה21. לפיכך, השימוש של הפקדים המתאימים נדרש על מנת להיות בטוחים כי השינוי הסלולר שנצפה נובע--יעד CRISPR ג'ין עריכה. ב פרוטוקול זה, לא נתבונן טרנספורמציה הסלולר ב Ba/F3-הזט ב תאים transduced עם פקד sgRNA ללא פילוח או Ba/F3-EPOR ותאים Ba/F3-GCSFR transduced עם Calr-ממוקד sgRNAs. זה מספק ביטחון נוספים והשינוי התאית בתאים Ba/F3-הזט ב הזה הוא תוצאה של--יעד עריכה של מיקומה Calr אנדוגני.
ב פרוטוקול זה, תיקון ה-DNA על ידי NHEJ מציג indels בגדלים משתנים, כפי שניתן לראות באיור5. ניתוח לפי סנגר רצף בוצעה מדגם המשנה של האוכלוסייה בכמות גדולה של תאים הערוך על מנת לחפש ההרחבה של indels שיובילו לנסיגה +1 bp frameshift מוטציות פוסט ציטוקין. הדור הבא רצף שצוין בשלב 9.9 היא דרך עמידים יותר לכמת על המטרה עריכה עבור אוכלוסיות תאים בכמות גדולה. אם ניתוח על שיבוט ספציפי רצוי, ואז תא בודד מיון של האוכלוסייה בצובר הכרחי. מיון תא יחיד יש יתרון להבין את ההשפעה הביולוגית הנובע סוג מסוים של מוטציה והיא שימושית כאשר המטרה היא להבין את ההבדלים בין שני סוגים שונים של מוטציות.
הדאגה אחד עם מערכת CRISPR/Cas9 הוא רחוק ממסלול הנחיתה-תופעות, אשר המחשוף אירועים מחוץ לאזור יישוב. כדי להעריך את ייחודה של מערכת CRISPR/Cas9 וכדי לוודא כי האוכלוסיות טרנספורמציה אינם מכילים כל תופעות מחוץ-יעד מובילים שינוי שנצפו, יהיה עלינו לבחון הגנום עריכה אירעה מחוץ לאזור של ריבית. זה יכול להיעשות על ידי חיפשה עדויות Cas9/NHEJ-מונע הגנום העריכה את-יעד פוטנציאליים לוקוסים גנומית עם רצף משמעותי הדמיון בין המטרה המיועדת. בשביל זה, הדור הבא רצפי יכול לשמש גם כדי להעריך באופן כמותי את התדירות של חופש-יעד אפקטים במיקומים שצוינו לאורך הגנום. כדי להפחית את האפשרות לאפקטים חופש-יעד, גורמים שונים יכול להיות שולבו הפרוטוקול. כאמור בתוצאות, לומד sgRNAs מרובים פילוח האזור עניין מבטיח פנוטיפ תוצאה של אירוע ביעד. יתר על כן, מחקרים שנעשו לאחרונה הראו כי sgRNAs קטום עם 17 נוקלאוטידים יכולים להפחית את התדירות של חופש-יעד המחשוף אירועים22. בנוסף, חשיפה ממושכת כדי Cas9 הביטוי יציב יכול לגרום תדר גבוה יותר של תופעות מחוץ-יעד. חשוב לציין כי מערכת וקטור כפול המכיל גם Cas9 וגם את sgRNA ניתן להשתמש בפרוטוקול במקום הביטוי יציב של Cas9; עם זאת, וקטורים אלה נוטים להיות גדולים מאוד ולגרום כייל נמוך lentiviral ויעילות זיהום נמוכה יותר. כתוצאה מכך, תרביות תאים ארעית של הבונה Cas9 בתאים על-ידי nucleofection יכול לשמש. דיווחים אחרונים פיתחו גם בונה Cas9 עם הם ברמת פירוט גבוהה לעריכה--יעד, כמו למשל eSpCas9 לבנות6.
לסיכום, CRISPR/Cas9 מייצג של הגנום יעיל, זול ואמין כלי הנדסה, ומאפשר לחקר מוטציות גנטיות ברמות ביטוי פיזיולוגי. כאן אנו מעסיקים CRISPR/Cas9 ג'ין עריכה כמו שיטה חזקה ויעילה כדי לקדם את ההבנה בהשפעות של CALR מוטציות בתאים hematopoietic.
Disclosures
יש לנו שאין ניגודי אינטרסים הקשורים בדו ח זה.
Acknowledgements
עבודה זו נתמכה על ידי NIH (R01HL131835), פרס החוקר הקליני דיימון ראניון. האיחוד סרטן סטאר.
Materials
| Name | Company | Catalog Number | Comments |
| BsmBI | New England Biolabs | R0580L | |
| Blasticidin | Sigma Aldrich | 15025 | |
| Puromycin | Life Technologies | A1113803 | |
| Stbl3 cells | Life Technologies | C737303 | |
| TransIT-LT1 | Thermo Fisher Scientific | MIR2300 | |
| Opti-MEM | Life Technologies | 51985034 | |
| RPMI | Thermo Fisher Scientific | MT10040CV | |
| DMEM | Thermo Fisher Scientific | 10-017-CV | |
| Fetal bovine serum (FBS) | Omega Scientific | FB-11 | |
| Penicillin/streptomycin/L-glutamine | Life Technologies | 10378016 | |
| mIL-3 | Peprotech | 213-13 | |
| psPAX2 | Addgene | N/A | |
| pCMV-VSV-G | Addgene | N/A | |
| pLX_TRC311-Cas9 | Addgene | N/A | |
| polybrene | Sigma Aldrich | H9268 | |
| pXPR-011 | Addgene | N/A | |
| Phosphate Buffered Saline (PBS) | Genessee Scientific | 25-507 | |
| TAE buffer | Thermo Fisher Scientific | FERB49 | |
| LentiGuide-Puro | Addgene | Plasmid #52963 | |
| PNK | New England Biolabs | M0201S | |
| T4 ligase | New England Biolabs | M0202S | |
| PCR purification kit | Qiagen | 28104 | |
| Miniprep kit | Qiagen | 27104 |
References
- DeWitt, M. A., et al. Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Sci Trans Med. 8, 360(2016).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 4, 347-355 (2014).
- Gaj, T., Gerbach, C. A., Barbas, C. F. ZFN, TALEN, CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 31 (7), 397-405 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wiedenheft, B., Samuel, S. H., Doudna, J. A. RNA-guided genetic silencing systems in bacteria and archea. Nature. 482 (7385), 331-338 (2012).
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., Zhang, F. Rationally engineered Cas9 nucleases with improved specificity. Science. 351 (6268), 84-88 (2016).
- Ran, F. A., et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell. 154 (6), 1380-1389 (2013).
- Larson, M. H., et al. CRISPR interference (CRISPRi) for sequence-specific control of gene expression. Nat Protoc. 8 (11), 2180-2196 (2013).
- Wang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Kim, H. S., et al. CRISPR/Cas9-mediated Gene-knockout screens and target identification via Whole genome sequencing uncover host genes required for picornavirus infection. J Biol Chem. 10, 1074(2017).
- Heckl, D., et al. Generation of mouse models of myeloid malignancies with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nat Biotechnol. 32 (9), 941-946 (2014).
- Daley, G. Q., Baltimore, D. Transformation of an interleukin 3-dependent hematopoietic cell line by the chronic myelogenous leukemia-specific bcr/abl protein. Proc Natl Acad Sci USA. 85, 9312-9316 (1988).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biol. 17, 148(2016).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nat Biotechnol. 32, 1262-1267 (2014).
- Brinkman, E. K., et al. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucl Acid Res. 42, e168(2014).
- Klampfl, T., et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med. 369, 2379-2390 (2013).
- Nangalia, J., et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2. N Engl J Med. 369, 2391-2405 (2013).
- Elf, S., et al. Mutant Calreticulin requires both its mutant C-terminus and the thrombopoietin receptor for oncogenic transformation. Cancer Discovery. 6 (4), 368-381 (2016).
- Bauer, D. E., Canver, M. C., Orkin, S. H. Generation of Genomic Deletions in Mammalian Cell lines via CRISPR/Cas9. J. Vis. Exp. (95), e52118(2015).
- Watanabe-Smith, K., et al. Analysis of acquired mutations in transgenes arising in Ba/F3 transformation assays: findings and recommendations. Oncotarget. 8, 12596-12606 (2017).
- Fu, Y., et al. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. NatBiotechnol. 32, 279-284 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved