Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Panoramica
Fonte: Peiman Shahbeigi-Roodposhti e Sina Shahbazmohamadi, Dipartimento di Ingegneria Biomedica, Università del Connecticut, Storrs, Connecticut
Un microscopio elettronico a scansione (SEM) è uno strumento che utilizza un fascio di elettroni per immagini e caratterizzare in modo non distruttivo i materiali conduttivi nel vuoto. Per analogia, un fascio di elettroni sta al SEM come la luce sta al microscopio ottico. La differenza è che il microscopio elettronico produce immagini di risoluzione e ingrandimento molto più elevati. I migliori microscopi ottici hanno in genere una risoluzione fino a 200 nm, mentre i SEM di solito rivendicano una risoluzione di 0,5 nm. Ciò è dovuto al fatto che i microscopi ottici sono limitati dalla diffrazione delle onde, una funzione della lunghezza d'onda, che è di circa 500 nm per la luce visibile. Al contrario, il SEM utilizza un fascio di elettroni energizzato, che come lunghezza d'onda di 1 nm. Questa caratteristica li rende strumenti molto affidabili per lo studio di nano e microstrutture. I microscopi elettronici consentono anche lo studio di campioni biologici con dimensioni delle caratteristiche troppo piccole per la microscopia ottica.
Questa dimostrazione fornisce un'introduzione alla preparazione del campione e all'acquisizione iniziale dell'immagine di campioni biologici utilizzando un microscopio elettronico a scansione. In questo caso, verrà studiato uno scaffold cellulare di collagene-idrossiapatite (HA). L'ambiente di vuoto del SEM e la carica indotta dal fascio di elettroni su campioni non conduttivi (come la materia organica) creano sfide che saranno affrontate nella preparazione. Verranno inoltre discussi i vantaggi e gli svantaggi dei diversi metodi di imaging in relazione alla risoluzione, alla profondità di messa a fuoco e al tipo di campione. Lo scopo di questa dimostrazione è quello di fornire al partecipante maggiori informazioni sulla SEM per determinare se questo modulo di microscopia è la soluzione migliore per un tipo di campione biologico.
Principi
Quando un fascio di elettroni ad alta energia (in genere compreso tra 5 e 30 keV) colpisce un campione, dal campione viene emessa una serie di segnali. Queste interazioni possono essere utilizzate per studiare topografia, cristallografia, potenziale elettrico e campi magnetici locali. Gli elettroni subiscono due tipi di scattering: elastico e anelastico. Lo scattering anelastico provoca l'emissione di elettroni secondari. Questi elettroni a bassa energia (~50 eV) sono gli elettroni del guscio esterno degli atomi campione che acquisiscono energia appena sufficiente per lasciare la superficie dell'atomo. La dispersione degli elettroni secondari fornisce informazioni topografiche, poiché il livello di energia degli elettroni che lasciano l'atomo campione non è abbastanza alto da viaggiare attraverso il campione. Pertanto, solo le informazioni sul livello superficiale vengono raccolte dal rilevatore.
Lo scattering elastico, d'altra parte, non è causato da elettroni spostati dagli atomi del campione. È il principale fascio di elettroni dopo l'interazione con il nucleo, come si vede nella Figura 1. Questi elettroni non cambiano la loro energia o velocità, ma cambiano la loro direzione in base alla loro interazione con il nucleo. Il rilevamento di questi elettroni fornisce informazioni compositime e il loro contrasto variabile all'interazione con atomi di diversi pesi atomici consente all'utente di distinguere le differenze nella composizione del campione. Nei campioni biologici, questo può essere utilizzato per studiare nanoparticelle e nanostrutture incorporate o attaccate con pesi atomici più pesanti, come oro o ferro.
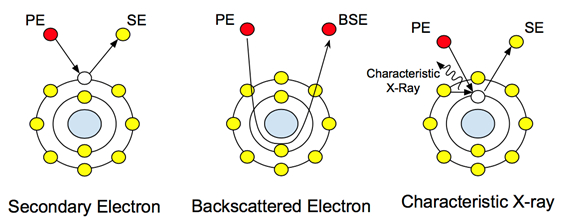
Figura 1: Interazioni atomiche con gli elettroni principali (PE) e come creano i diversi segnali.
La preparazione del campione è una procedura importante, soprattutto per i campioni biologici. Per ottenere immagini SEM ad alta risoluzione, gli elettroni devono raggiungere il campione. Quindi, i segnali che sono il risultato dell'interazione tra gli elettroni e il campione devono raggiungere i rivelatori. Ciò significa che lo strumento deve lavorare sotto un alto vuoto per prevenire la dispersione di elettroni prima che il fascio raggiunga il campione e i segnali raggiungano i rivelatori. Questo vuoto è altamente sensibile e può estrarre il particolato dal campione, il che significa che è importante assicurarsi che il campione sia asciutto e privo di particolato.
Un'altra considerazione nella preparazione del campione è la natura del fascio di elettroni. Poiché il fascio è composto da particelle altamente cariche, quando un campione non conduttivo viene bombardato con particelle altamente cariche dal fascio di elettroni, c'è un accumulo di cariche sulla superficie che influenzano la deflessione del fascio di elettroni e causano un grande aumento della dispersione del fascio. Rivestendo il campione con uno strato conduttivo prima dell'imaging, questi artefatti di carica nell'immagine possono essere evitati.
I metodi qui descritti sono applicabili alla maggior parte dei materiali non conduttivi. Un rivestimento è necessario per mitigare gli artefatti di ricarica. L'impalcatura cellulare collagen-HA è stata realizzata con le seguenti fasi di sintesi: co-precipitazione del collagene con HA nel gel composito, creazione di liquami e fusione di liofilizzazione, reticolazione dell'impalcatura e asciugatura finale. Questa essiccazione finale viene completata nell'arco di 5 giorni in un essiccatore sottovuoto e asciuga sufficientemente il campione per l'analisi SEM senza influire sulle proprietà strutturali degli scaffold. Tuttavia, durante l'imaging delle cellule,la preoccupazione principale durante la preparazione del campione è preservare la struttura cellulare. I metodi di fissazione chimici e basati sulla resina sono comunemente usati per osservare le cellule preservando la struttura delle cellule, come la fissazione della glutaraldeide e le resine epossidiche e acriliche. Tipicamente, la glutaraldeide viene utilizzata come fissativo che crea reticolazioni nel citoplasma delle cellule, ma provoca anche un calo del pH. Pertanto, il buffering è necessario quando si preparano campioni con glutaraldeide. L'aggiunta di queste tecniche permette alla struttura della cellula di assomigliare maggiormente alla sua struttura quando era viva [3].

Figura 2: Sputter coater oro-palladio che mostra la camera del campione (recipiente d'argento in alto) e i misuratori di vuoto (a sinistra) e corrente (a destra). In questo modello, viene utilizzata una corrente di 2 mA con un vuoto a camera di 0,1 torr, che viene mantenuto costante utilizzando una valvola di perdita di argon.
Procedura
1. Preparazione del campione
- Indossare guanti e prendere precauzioni per evitare la contaminazione durante la manipolazione del campione.
- Assicurarsi che il campione sul vetrino sia asciutto e che non vi sia contaminazione sul campione. Questo perché SEM misura la caratterizzazione della superficie e questi difetti possono ostacolare gravemente il segnale.
- Se il campione viene caricato su una slitta di vetro standard, ridurre le dimensioni del campione segnando la diapositiva con una fresa per vetro con punta di diamantata in linea retta e spingere delicatamente sulla linea segnata lontano dal corpo fino a quando il vetro non si frattura.
- A seconda del campione, scegliere un rivestimento che non abbia la stessa composizione elementare (ostacolerebbe il segnale ricevuto da EDS). Per questa dimostrazione viene utilizzato un rivestimento oro-palladio.
- Utilizzare il coater sputter come indicato. Lasciare che la macchina sputter il campione per circa 40 s per un rivestimento sottile con una copertura adeguata.
- Montare il campione su uno stub SEM utilizzando nastro conduttivo a doppia faccia in carbonio. Questo nastro deve anche essere posizionato dal palco alla parte superiore della diapositiva che è stata sputata per mettere a terra il campione se è montato su una diapositiva non conduttiva. Un sottile strato di vernice d'argento conduttiva potrebbe anche essere utilizzato per aumentare la conduttività del campione allo stadio.
- Montare il mozzicone sul palco e stringere la vite sul lato.
2. Procedura di imaging
- Caricare il palco nella camera. Chiudi e sigilla la porta. Quindi premere il pulsante "Trasferisci" per aprire il passaggio dalla camera di carico al vuoto.
- Una volta che il pulsante di trasferimento smette di lampeggiare e la porta interna è aperta, il campione può essere spostato nella camera a vuoto avvitando le aste metalliche e spingendo il campione nella camera.
- Svitare l'asta, ritrarre e fissare completamente l'asta nella camera di carico e premere "store" per chiudere la camera di carico dalla camera a vuoto. L'esempio viene ora caricato e il resto del processo viene eseguito dalla workstation del computer.
- Spostare lo stage utilizzando il controller e aprendo il pannello di navigazione dello stage fino a quando non si trova nel campo visivo.
- Spostare il campione verticalmente fino a quando la distanza di lavoro è di 5-10 mm. Quando si sposta il palco nella direzione z, accendere la telecamera della camera per assicurarsi che il campione non si avvicini alla pistola elettronica.
- Accendere il fascio ad altissima tensione (EHT). Tieni presente che potrebbe anche essere necessario aprire la colonna se è stata spenta per un po '.
- Selezionare il segnale SE2 dalle opzioni del rilevatore.
- Utilizzare un'impostazione kV di circa 5 kV per l'imaging iniziale, quindi aumentare a 20-30 kV per un maggiore segnale utilizzando la modalità back-scatter. Se il campione non è stato rivestito, mantenere il keV basso per evitare troppi artefatti di carica nell'immagine e per evitare danni al campione.
- Se non è presente un'immagine chiara, ruotare le manopole di messa a fuoco, luminosità e contrasto fino a quando una struttura non è visibile. Questo sarà un riferimento per il perfezionamento.
- Ruotare la manopola di messa a fuoco in modalità grossolana fino a quando un'immagine non è visibile. Quindi passa a fine per trovare la messa a fuoco migliore.
- Usa la navigazione sul palco (non nella direzione z) e l'ingrandimento per trovare un'area da cui salvare un'immagine.
- Riduci la velocità di scansione e attiva la media in linea per acquisire un'immagine migliore per il salvataggio.
- Salva l'immagine facendo clic con il pulsante destro del mouse e salvando in una posizione di file.
- Inserire il BSD e riportare lo stage in una posizione z in cui il campione è focalizzato.
- Ripetere i passaggi 8-11 mentre si cercano aree di contrasto che indicano un numero atomico più elevato.
- Rimuovere il BSD al termine.
- Quando sei pronto per rimuovere il campione, premi il pulsante "scambia".
- Spostare il campione nella camera di carico e premere "store", quindi "vent".
Risultati
Le immagini SEM nelle figure 3 e 4 mostrano che la struttura dell'immagine è altamente tridimensionale con caratteristiche su microscala. La qualità dell'immagine è influenzata dalla messa a fuoco e dallo spessore del rivestimento sputter.

Figura 3: Le immagini seguenti illustrano in che modo la messa a fuoco di esempio può influire sulla qualità dell'immagine. Nell'immagine a destra, l'intero campo visivo è a fuoco, mentre è sfocato a sinistra. Giocare con parametri come la messa a fuoco può fornire un'immagine molto migliore.
Figura 4: Immagini del campione di collagene-idrossiapatite.
Applicazione e Riepilogo
Qui abbiamo dimostrato la profondità di messa a fuoco, il campo visivo e la massima risoluzione e ingrandimento di un microscopio elettronico e come queste proprietà possono essere utilizzate per visualizzare campioni biologici. Questa dimostrazione è stata progettata per aiutare gli spettatori a decidere quale modulo di microscopia è il migliore per una determinata applicazione. Come dimostrato, SEM ha una profondità di messa a fuoco molto elevata, una risoluzione molto più elevata e ingrandimenti maggiori. Tuttavia, non è appropriato per tutti i tipi di campione.
Questa dimostrazione ha introdotto i principi della microscopia elettronica e ha mostrato molte delle loro applicazioni nei laboratori di ricerca. I microscopi elettronici sono utilizzati per l'ispezione, la caratterizzazione e il controllo qualità. Ad esempio, vengono utilizzati per visualizzare circuiti integrati, circuiti stampati, propagazione delle cricche e sistemi nano-elettromeccanici. Anche nel campo della biologia questi strumenti svolgono un ruolo chiave. Esistono anche microscopi elettronici appositamente progettati per ospitare campioni biologici umidi. Questi campioni biologici vanno dai tessuti alle ossa, alle cellule e ai microrganismi. L'utilizzo di rilevatori aggiuntivi può consentire ancora più analisi, come un'analisi precisa della superficie.
Elenco dei materiali
| Nome | Società | Numero di catalogo | Commenti |
| Attrezzatura | |||
| Biocampione | |||
| Rivestimento in carbonio o oro | |||
| Traversa-SEM | ZEISS | ||
| Scaffold cellulari collagene-idrossiappetite | Sviluppato da Wei Laboratory presso l'Università del Connecticut |
Tags
Vai a...
Video da questa raccolta:

Now Playing
Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Biomedical Engineering
24.1K Visualizzazioni

Imaging di campioni biologici con microscopia ottica e confocale
Biomedical Engineering
36.3K Visualizzazioni

Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Biomedical Engineering
9.5K Visualizzazioni

Imaging a ultrasuoni ad alta frequenza dell'aorta addominale
Biomedical Engineering
14.8K Visualizzazioni

Mappatura quantitativa della deformazione di un aneurisma dell'aorta addominale
Biomedical Engineering
4.6K Visualizzazioni

Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Biomedical Engineering
5.9K Visualizzazioni

Imaging a risonanza magnetica cardiaca
Biomedical Engineering
15.0K Visualizzazioni

Simulazioni fluidodinamiche computazionali del flusso sanguigno in un aneurisma cerebrale
Biomedical Engineering
11.9K Visualizzazioni

Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Biomedical Engineering
8.4K Visualizzazioni

Tecniche non invasive di misurazione della pressione sanguigna
Biomedical Engineering
12.1K Visualizzazioni

Acquisizione e analisi di un segnale ECG (elettrocardiogramma)
Biomedical Engineering
106.9K Visualizzazioni

Resistenza alla trazione dei biomateriali riassorbibili
Biomedical Engineering
7.7K Visualizzazioni

Imaging micro-CT di un midollo spinale di topo
Biomedical Engineering
8.3K Visualizzazioni

Visualizzazione della degenerazione dell'articolazione del ginocchio dopo lesione del LCA non invasiva nei ratti
Biomedical Engineering
8.3K Visualizzazioni

Imaging combinato SPECT e CT per la visualizzazione della funzionalità cardiaca
Biomedical Engineering
11.2K Visualizzazioni