Prélèvement d'échantillons de sang II
Vue d'ensemble
Source : Kay Stewart, RVT, RLATG, CMAR ; Valerie A. Schroeder, RVT, RLATG. Université de Notre Dame, Indiana
La collecte du sang de souris et les rats pour l’analyse peut se faire par le biais de diverses méthodes. Chaque méthode de collection a des variations dans le type de contrainte nécessaire, le caractère invasif de la procédure et la nécessité d’une anesthésie générale. 1 Historiquement, l’utilisation de la cavité du sinus rétro-orbitaire a été utilisée, mais pas sans débat. La controverse concernant les dommages potentiels des tissus, ou même la cécité, causée par rétro-orbitaire saigne a conduit au développement de la veine faciale et sous-mandibulaire saignement méthodes chez les souris. Collecte de sang de la veine saphène dans les souris et les rats est une autre technique qui a été développée. Ces procédures ne nécessitent pas d’anesthésie et sont donc indiquées lors de l’utilisation d’anesthésiques peut-être entraîner des résultats de sang ou d’autres données.
Principles
Il y a une veine faciale chez la souris qui relie le plexus oculaire à travers la joue et une veine sous-maxillaire qui court le long de la mâchoire inférieure. Les deux bateaux convergence dans la veine jugulaire, juste en dessous de la ligne de la mâchoire, ce qui les rend facilement accessibles. Série échantillons peuvent être prélevés de chaque navire en alternant le côté utilisé. Toutefois, aucune des deux parties doivent être utilisé plus souvent que tous les 5-7 jours. 2
Des précautions doivent être prises lors de l’exécution d’un saignement de la veine faciale. Car le conduit auditif est situé près de la veine faciale, si la pointe de la lancette est dirigée en direction caudale, le canal soit percé. Cela se traduira par un effet de siphon causant sang à venir de l’oreille. Malgré cela, le sang peut encore être recueilli, et la souris ne peut pas supporter des dommages permanents. Toutefois, cela peut provoquer l’animal à sa bougé la tête, éclaboussures de sang dans la cage.
Lorsque le saignement de la veine sous-mandibulaire, la profondeur d’insertion de l’aiguille est critique. Un traumatisme peut entraîner une profondeur d’insertion supérieure à 4-5. 5 mm pour les muscles, les nerfs et autres navires qui se trouvent dans la tête, le cou et la cavité buccale. Des complications ultérieures comprennent l’hémorragie excessive entraînant une hypovolémie, noyade causée par le fluide dans la bouche et des dommages à des structures orales qui interfèrent avec le manger et boire.
Retenue de l’animal est crucial pour un saignement réussi pour veine faciale et procédures veine sous-maxillaire. Si la poignée sur la peau du cou est trop serrée, le débit sanguin dans la veine faciale peut être restreint. Cela se traduira par une réduction du volume collecté. Volumes de la collection peut varier sur la veine faciale et sous-mandibulaire veine saigner. Il est impératif de limiter les volumes de la collection afin qu’elles ne dépassent pas le volume maximum pour la collecte de sang de survie conformément aux politiques institutionnelles et un protocole approuvé animal. Assurant l’hémostase dès lors que la quantité désirée est collectée permettra d’éviter la perte de sang supplémentaires ou excessive. 2
Collecte de sang de la veine saphène est une autre alternative viable pour les saignements de série. La veine saphène latérale est un navire superficiel qui s’exécute sur le dos, et puis latéralement, à travers l’articulation du tarse. 3 Bien que cette procédure peut être plus esthétiquement acceptable que la purge de la rétro-orbitaire, à cause de la préparation nécessaire- et aucune utilisation de l’anesthésie pour cette méthode qu’il ne peut effectivement être plus stressante pour l’animal. Les complications qui peuvent en découler un saignement saphène sont liées à la ponction. Si la piqûre de l’aiguille n’est pas directement sur le navire, sang peut mettre en commun par voie sous-cutanée, entraînant un hématome. Hématomes, infection possible et favorisant de la branche sont les autres problèmes possibles. Cette méthode nécessite une formation, mais elle est facilement actionnée. Les volumes collectés grâce à cette méthode sont entre 10-150 µL, selon la fréquence d’échantillonnage. 4 les échantillons sont variables en qualité car elles peuvent contenir des produits tissues. Pas plus de quatre échantillons de sang doivent être prélevés dans un délai de 24 heures de la même jambe.
La veine fémorale est une autre option pour le prélèvement sanguin sur un rat. La veine fémorale commune s’étend sur la face médiale de la patte de l’aine à l’articulation de genou avant de traverser le genou et devenir le latéral saphène, facilement accessible. Bien que cette procédure peut être faite sans l’utilisation d’un anesthésique, il ne requiert deux personnes une personne tiendra la jambe au moment où la jambe et l’abdomen se connectent à occlure la veine, tandis que l’autre exécute la ponction veineuse et recueille le sang.
L’avantage d’utiliser la veine fémorale est qu’un plus grand volume est plus facilement collecté depuis que la veine de la saphène. Cependant, parce que la veine fémorale est grande, c’est sujette à la formation d’un hématome. Cela peut être aggravé par une prise trop ferme sur la jambe, ce qui peut causer des ecchymoses supplémentaires. Avec cette méthode de collecte de sang, il y a variation d’un montant de sang collecté en raison de saignements après le retrait de l’aiguille. Il est impératif d’assurer l’hémostase pour empêcher cette perte de sang excessive.
Procédure
1. du visage veine saigner chez la souris
- Matériel
- Collecte de sang est d’une prise libre dans un tube de sang ou un tube Eppendorf. Dans certains cas, il convient de prélever le sang directement dans les tubes de l’hématocrite.
- Lancettes de verge d’or seront choisis en fonction de la taille appropriée pour l’animal selon l’âge et le sexe.
- Les lancettes sont choisis selon l’âge et la taille des souris comme suit :
lancet 4mm : 3-4-week-old souris (moins de 15 grammes de poids corporel)
lancet 5mm : souris femelles de moins de 10 semaines (moins de 20 grammes de poids corporel)
lancet 5mm : souris mâles de moins de 6 semaines (moins de 20 grammes de poids corporel)
lancet 5mm : pour les échantillons de goutte à goutte (pour les frottis sanguins)
lancet 5,5 mm : souris femelles de plus de 10 semaines (plus environ 20 grammes de poids corporel)
lancet 5,5 mm : souris mâles pendant 6 semaines (plus environ 20 grammes de poids corporel)
lancet 5,5 mm : grands échantillons
- Les lancettes sont choisis selon l’âge et la taille des souris comme suit :
- Dispositif de retenue pour
- Souris sont immobilisées à l’aide de la technique scruffing.
- Il est important que le mouvement à côté de la tête être minimisé. Cela garantit une ponction précise et sûre avec la lancette.
- Prélèvement de sang
- La lancette de bonne taille est tenue perpendiculairement à la surface de la peau.
- Le point de la lancet est légèrement incliné, avec la pointe tournée vers le nez.
- La lame de bistouri est mieux utilisée en position verticale.
- Tout en retenant la souris, localisez la superficie approximative de la veine faciale en mesurant la longueur de le œil sous le canthus latéral et la largeur de l’oeil direction caudale.
- Avec la pointe de la lancette, doucement sentir pour le point où se termine la mâchoire.
- Pour une meilleure précision en perforant le navire, positionnez la souris en décubitus latéral.
- Percer la peau de l’épaule de la lancette à ce moment-là. Cela se fait avec une pression ferme et non comme lancer une fléchette.
- Lors du retrait de la lancette, sang commencera à couler.
- Pour aider la circulation sanguine, positionnez la souris avec la tête plus bas que le coeur.
- Recueillir le sang dans le vaisseau de la collection désirée.
- Épongez la pression de site et de la libération de ponction sur la peau du cou pour l’hémostase.
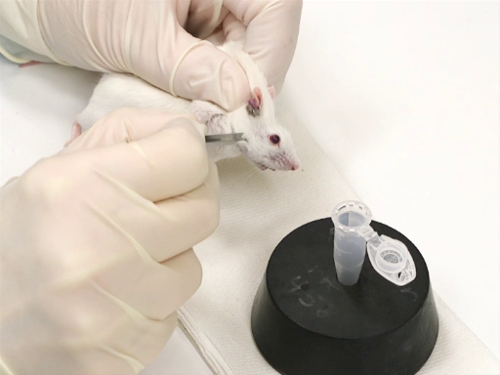
La figure 1. Purge de veine faciale chez les souris.
2. sous-maxillaire saigner chez la souris : bien que très similaire à la technique pour la purge de la veine faciale, il y a des variations dans l’équipement et des différences subtiles dans cette procédure de purge.
- Matériel
- Collecte du sang est d’une prise libre dans un tube de sang ou un tube Eppendorf. Dans certains cas, il est souhaitable de recueillir directement dans des tubes de l’hématocrite.
- aiguilles de calibre 18-22 sont choisis en fonction de la taille appropriée pour l’animal selon l’âge et le sexe.
- Aiguilles sont choisis selon l’âge et la taille des souris comme suit :
calibre 22 : souris vieux de 3 à 4 semaines (moins de 15 grammes de poids corporel)
calibre 20 : souris femelles de moins de 10 semaines (moins de 20 grammes de poids corporel)
calibre 20 : souris mâles de moins de 6 semaines (moins de 20 grammes de poids corporel)
calibre 20 : pour les échantillons de goutte à goutte (pour les frottis sanguins)
calibre 18 : souris femelles de plus de 10 semaines (plus environ 20 grammes de poids corporel)
calibre 18 : souris mâles pendant 6 semaines (plus environ 20 grammes de poids corporel)
calibre 18 : grands échantillons
- Aiguilles sont choisis selon l’âge et la taille des souris comme suit :
- Dispositif de retenue pour
- Souris sont immobilisées à l’aide de la technique scruffing.
- Il est important que le mouvement à côté de la tête être minimisé. Cela garantit la ponction veineuse précise et sûre avec l’aiguille.
- Prélèvement de sang
- L’aiguille est tenue perpendiculairement à la surface de la peau.
- Tout en retenant la souris, localisez la zone approximative de la veine sous-maxillaire par le point d’intersection de ligne en partant du coin de la bouche sur une ligne allant du canthus latéral de le œil. Cela coïncide avec une fossette petite, glabre, trouvée caudale à l’angle de la bouche et un peu au-dessous de la ligne de la mâchoire.
- Pour une meilleure précision en perforant le navire, positionnez la souris en décubitus latéral.
- Percer la peau avec la pointe de l’aiguille à ce moment-là. Cela se fait avec une pression ferme et non comme lancer une fléchette.
- L’aiguille n’est pas insérée au-delà de l’extrémité du biseau.
- Lors du retrait de l’aiguille, le sang commencera à couler.
- Pour aider la circulation sanguine, positionnez la souris avec la tête plus bas que le coeur.
- Recueillir le sang dans le vaisseau de la collection désirée.
- Épongez le site de ponction et relâcher la pression sur la peau du cou pour l’hémostase.

La figure 2. Purge de veine sous-mandibulaire chez la souris.
3. saphène purge
- Matériel
- Cônes en plastique transparent, souple retenue peuvent être utilisés pour la souris ou le rat. Pour les souris, mis à jour le 50 millilitre de tubes coniques en plastique peuvent être utilisés à la retenue. Pour les rats, modifiée tubes retenue en Plexiglas-avec une fente large assez pour étendre la jambe arrière-peut être utilisé.
- Lorsque vous utilisez le cône en plastique, il est mesuré la longueur du corps de l’animal, et un trou ovale est coupé au niveau de la cuisse.
- Un tube conique peut être modifié pour une souris pour cette méthode de collecte de sang en coupant l’extrémité du tube pour permettre un trou de respiration. Une fente est coupée de la fin de la PAC de la tube d’environ ½ pouce de large et 2 pouces de long. Les bords sont couverts de ruban de toile ou lissées pour la sécurité des animaux.
- Un garrot est fabriqué à l’aide d’une seringue cc 3 et une longueur de suture de 2-0. 3
- Onguent antibiotique triple ou gelée de pétrole blanche est utilisée comme une barrière étanche à l’humidité sur la peau.
- Une aiguille de 22 calibre est la taille par défaut pour la ponction veineuse.
- Sang est prélevé directement dans les tubes de l’hématocrite.
- Dispositif de retenue pour
- Cônes en plastique souples
- La souris ou le rat est placé dans le cône de nez en avant.
- L’extrémité du cône est pliée et fermé à l’aide d’une pince-petites notes pour empêcher l’animal de quitter le cône de retenue.
- La patte est légèrement aspirée dans l’ovale ouvrant à l’aine.
- Tube conique pour souris
- La souris est placée dans le nez en tube avant.
- La patte est guidée doucement dans la fente.
- Le doigt du milieu est placé au-dessus de l’extrémité du tube pour empêcher la souris de quitter le tube.
- L’index et le pouce stabilisent la jambe de la souris.
- Tube de retenue de plexiglas pour les rats
- Le rat est placé dans le nez en tube avant.
- La patte est guidée doucement dans la fente.
- L’extrémité du tube est sécurisée afin d’empêcher le rat de sauvegarder et quitter le tube.
- L’index et le pouce stabilisent la jambe de rat.
- Cônes en plastique souples
- Prélèvement de sang
- Le poil est prélevé à la face latérale de la jambe de la pointe du jarret à l’articulation fémoro. Cela peut être fait par la cueillette, rasage ou à l’aide d’une crème dépilatoire.
- Après avoir retiré les cheveux, une petite quantité d’onguent est appliquée et répandue en une couche très mince sur la zone chauve.
- Le Garrot est appliqué comme beaucoup parotidien que possible et serrés.
- Le navire saphène courir à travers la surface extérieure de la jambe depuis le genou jusqu'à la cheville va commencer à remplir et deviendra surélevé et facile à visualiser.
- Directement sur les vaisseaux sanguins, l’aiguille est maintenu perpendiculaire à la surface de la peau. Perforer le navire. Veillez à ne pas introduire l’aiguille profondément dans la jambe, afin d’éviter toute perforation du muscle ou de frapper des os.
- Le sang sera billes vers le haut sur la surface de la jambe pour la collection avec le tube de l’hématocrite.
- Une fois que le sang a été prélevé, desserrer le garrot et appliquer une pression sur la piqûre pour l’hémostase.
- Une fois que le saignement a cessé, retirer l’animal de la retenue et le retourner à la cage.
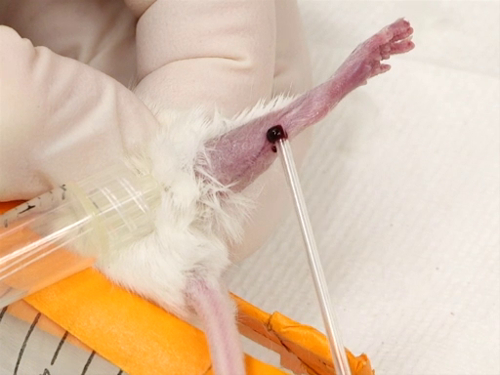
La figure 3. Veine saphène saigner chez la souris.
4. fémorale veine pour les rats
- Matériel
- Le sang est recueilli dans un tube de l’hématocrite.
- Onguent antibiotique triple est nécessaire pour créer une barrière entre la peau et les cheveux et la goutte de sang.
- Une aiguille de 22 calibre est utilisée pour la ponction de la veine.
- Une tondeuse à cheveux petite, portable avec environ une 1" lame large est utilisée pour couper les cheveux de la jambe.
- Dispositif de retenue pour
- Des rats sont retenus à l’aide d’un cône de retenue en plastique clair et flexible.
- Les cônes en plastique sont évalués en fonction de la longueur du corps et un trou ovale coupé au niveau de la cuisse. Le cône est coupé telle que la patte arrière peut être extériorisée avec accès à la veine.
- Prélèvement de sang
- Le poil est rasé de la surface interne de la jambe de l’aine au genou.
- Onguent antibiotique triple s’applique en fine couche sur le site de ponction.
- La personne retenue pour occlusion de la veine et détient le rat avec la surface interne de la jambe vers le prélèvement.
- Utilisez l’aiguille à ponction de la veine. L’aiguille est perpendiculaire au vaisseau sanguin et la ponction se faite directement sur la veine.
- La ponction est faite au plus près du genou que possible, permettant des prélèvements complémentaires avant le premier site de collecte de sang.
- Le navire est superficiel. Par conséquent, la profondeur de la ponction ne doit pas être supérieure à la longueur du biseau de l’aiguille.
- Pour aider la circulation sanguine, placez le rat avec la jambe inférieure à cœur.
- Recueillir le sang dans les tubes d’hématocrite comme il perle sur la surface de la peau.
- Relâcher la pression sur la jambe et appliquer une pression sur le site de ponction pour atteindre l’hémostase.
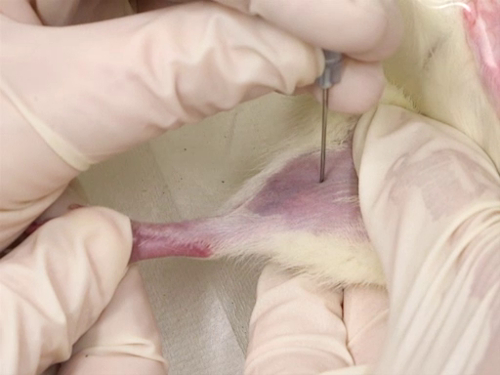
La figure 4. Purge de la veine fémorale chez les rats.
Applications et Résumé
La méthode de collecte de sang peut provoquer une variation dans l’analyse de l’échantillon. Le niveau de compétence du technicien effectuant le prélèvement des échantillons a un impact sur la qualité de l’échantillon et le bien-être de l’animal. L’utilisation d’anesthésiques peut également affecter la qualité de l’échantillon. Les méthodes décrites ici sont toutes effectuées sans l’utilisation de l’anesthésie, donc cette variable a été éliminée. En outre, toutes ces techniques peuvent être utilisé pour la série d’échantillonnage avec un inconfort minimal à l’animal.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Prélèvement d'échantillons de sang II
Lab Animal Research
74.0K Vues

Techniques de manipulation et de contention des rongeurs
Lab Animal Research
175.9K Vues

Soins de base
Lab Animal Research
28.1K Vues

Principes fondamentaux de l'élevage et du sevrage
Lab Animal Research
35.9K Vues

Techniques d'identification des rongeurs I
Lab Animal Research
55.1K Vues

Techniques d'identification des rongeurs II
Lab Animal Research
25.7K Vues

Administration d'agents expérimentaux I
Lab Animal Research
101.3K Vues

Administration d'agents expérimentaux II
Lab Animal Research
35.2K Vues

Administration d'agents expérimentaux III
Lab Animal Research
31.7K Vues

Administration d'agents expérimentaux IV
Lab Animal Research
52.1K Vues

Prélèvement d'échantillons de sang I
Lab Animal Research
172.8K Vues

Induction et maintien de l’anesthésie
Lab Animal Research
51.1K Vues

Recommandations pour la chirurgie des rongeurs
Lab Animal Research
22.6K Vues

Autopsie et prélèvement des tissus
Lab Animal Research
58.5K Vues

Prélèvement de tissus en conditions stériles
Lab Animal Research
35.0K Vues