Extracción de sangre II
Fuente: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidad de Notre Dame, en
La recolección de sangre de ratones y ratas para el análisis puede realizarse a través de una variedad de métodos. Cada método de colección tiene variaciones en el tipo de retención requerida, la invasividad del procedimiento y la necesidad de anestesia general. 1 Históricamente, el uso de la cavidad sinusal retro-orbitales se ha utilizado, pero no sin debate. La controversia relacionada con el potencial daño de tejido, o incluso ceguera, causada por hemorragias retro-orbital ha llevado al desarrollo de la vena facial y submaxilar sangrado métodos en ratones. Colección de la sangre de la vena safena en ratones y ratas es otra técnica que se ha desarrollado. Estos procedimientos no requieren anestesia y por lo tanto están convenientes el uso de anestésicos puede confundir los resultados de sangre u otros datos.
Hay una vena facial en el ratón que se extiende desde el plexo ocular por la mejilla y una vena submaxilar que corre a lo largo de la mandíbula inferior. Ambos vasos confluyen en la vena yugular justo debajo de la línea de la mandíbula, que sean fácilmente accesibles. Pueden tomar muestras de serie de cualquier recipiente alternando el lado utilizado. Sin embargo, ninguna de las partes utilizará más a menudo que cada 5-7 días. 2
Las precauciones deben tomarse al realizar un sangrado de la vena facial. Como el canal auditivo se encuentra situado cerca de la vena facial, si la extremidad de la lanceta se dirige caudalmente, el canal será traspasado. Esto resultará en un efecto de sifón, haciendo que la sangre de la oreja. A pesar de esto, todavía se puede recoger sangre, y el ratón no sufra ningún daño permanente. Sin embargo, esto puede causar el animal a su agitar la cabeza, salpicaduras de sangre en la jaula.
Cuando una hemorragia de la vena submaxilar, la profundidad de inserción de la aguja es fundamental. Una profundidad de inserción superior a 4-5.5 mm puede causar trauma a los músculos, nervios y otros recipientes que están en la cabeza, cuello y cavidad bucal. Complicaciones posteriores incluyen hemorragia excesiva que resulta en hipovolemia, ahogamiento causado por el líquido en la boca y dañan en las estructuras orales que interfiere con comer y beber.
Sujeción del animal es fundamental para un exitoso sangrado de la vena facial y la vena submaxilar procedimientos. Si la empuñadura en el pescuezo está demasiado apretada, puede restringir el flujo sanguíneo hacia la vena facial. Esto resultará en una reducción en el volumen recogido. Volúmenes de la colección varían en la vena facial y la vena submaxilar sangrado. Es imprescindible para limitar los volúmenes de la colección para que no sobrepase el volumen máximo para recolección de sangre de supervivencia según las políticas institucionales y un protocolo de animales aprobado. Garantizar la hemostasia cuando se recoge la cantidad deseada evitará la pérdida de sangre adicional o excesiva. 2
Colección de la sangre de la vena safena es otra alternativa viable para serie sangra. La vena safena lateral es un recipiente superficial que corre dorsalmente, y luego lateralmente, a través de la articulación tarsal. 3 Aunque este procedimiento puede ser estéticamente más aceptable que el sangrado retro orbitario, debido a la preparación necesaria- y uso de anestesia para este método es en realidad no puede ser más estresante para el animal. Las complicaciones que pueden surgir de una safena hemorragia están relacionados con el sitio de punción. Si la punción de la aguja no está directamente en el vaso, sangre piscina mayo subcutáneo, dando por resultado un hematoma. Hematomas, infección y favoreciendo de la extremidad son otros posibles problemas. Este método requiere entrenamiento, pero es fácilmente captado. Volúmenes recogidos con este método son entre 10-150 μL, dependiendo de la frecuencia de muestreo. 4 las muestras son variables en calidad ya que pueden contener productos de tejido. No más de cuatro muestras de sangre deben tomarse dentro de un período de 24 horas de la misma pierna.
La vena femoral es otra opción para recolección de sangre de una rata. La vena femoral corre en el aspecto medial de la pierna trasera desde la ingle a la rodilla antes de cruzar la rodilla y cada vez el lateral safeno, lo que es fácilmente accesible. Aunque este procedimiento puede realizarse sin el uso de un anestésico, requieren dos personas una persona tendrá la pierna en el punto donde la pierna y el abdomen se conectan para ocluir la vena, mientras que el otro realiza la venopunción y recoge la sangre.
La ventaja de utilizar la vena femoral es que un volumen más grande es más fácilmente de él que de la safena vena. Sin embargo, debido a la vena femoral es grande, es propensa a la formación del hematoma. Esto puede exacerbado por demasiado agarre en la pierna, que puede causar la contusión adicional. Con este método de colección de sangre, hay variación en la cantidad de sangre recogida por sangrado después del retiro de la aguja. Es imprescindible para asegurar la hemostasia para evitar esta pérdida de sangre excesiva.
1. sangrado de la vena facial en ratones
- Equipo
- Colección de sangre es de una pesca libre en un tubo de sangre o un tubo de Eppendorf. En algunos casos, es deseable recoger la sangre directamente en tubos de hematocrito.
- Lancetas de vara de oro se seleccionará en función del tamaño apropiado para el animal según edad y sexo.
- Lancetas se seleccionan según el tamaño y edad de ratones como sigue:
lanceta de 4mm: ratones de 3-4 semanas de edad (menos de 15 gramos de peso corporal)
lanceta de 5mm: ratones femeninos menores de 10 semanas (menos de 20 gramos de peso corporal)
lanceta de 5mm: ratones machos menores de 6 semanas (menos de 20 gramos de peso corporal)
lanceta de 5mm: para colocar solo muestras (frotis)
lanceta de 5.5mm: ratones hembra durante 10 semanas (más de 20 gramos de peso corporal)
lanceta de 5.5mm: ratones machos durante 6 semanas (más de 20 gramos de peso corporal)
lanceta de 5.5mm: muestras grandes
- Lancetas se seleccionan según el tamaño y edad de ratones como sigue:
- Sistema de seguridad para
- Ratones son asegurados mediante la técnica de scruffing.
- Es importante minimizar movimiento de lado a lado de la cabeza. Esto asegura la venopunción precisa y segura con la lanceta.
- Retiro de la sangre
- La lanceta de tamaño adecuado se mantiene perpendicular a la superficie de la piel.
- El punto de punción es ligeramente inclinado, con la punta hacia la nariz.
- La lámina de la lanceta se utiliza mejor en posición vertical.
- Mientras el ratón, coloque el área aproximada de la vena facial por la medición de la longitud del ojo debajo del canto lateral y el ancho del ojo caudalmente.
- Con la punta de la lanceta, suavemente siento el punto en que termina la mandíbula.
- Para mayor precisión en pinchar el vaso, coloque el ratón en recumbency lateral.
- Perforar la piel en el hombro de la lanceta en ese momento. Esto se hace con una presión firme y no como lanzando un dardo.
- Al retirar la lanceta, sangre comenzará a fluir.
- Para ayudar al flujo sanguíneo, coloque el ratón con la cabeza más baja que el corazón.
- Recoger la sangre en el vaso de la colección deseada.
- Seque la presión del sitio y liberación de punción en el pescuezo para la hemostasia.
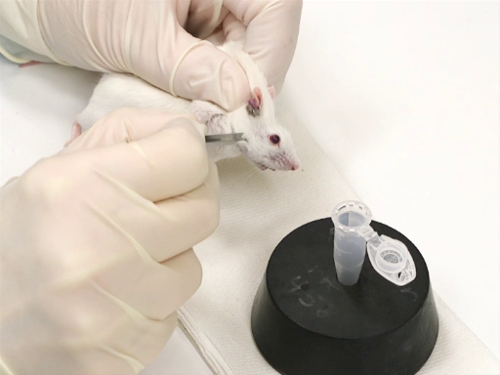
Figura 1. Sangrado de la vena facial en ratones.
2. submaxilar purga en los ratones: aunque muy similar a la técnica para el sangrado de la vena facial, hay variaciones en el equipo y las diferencias sutiles en este procedimiento de purga.
- Equipo
- Colección de la sangre es de una pesca libre en un tubo de sangre o un tubo de Eppendorf. En algunos casos, es deseable recoger directamente en los tubos de hematocrito.
- agujas de calibre 18-22 se seleccionan según el tamaño adecuado para los animales según edad y sexo.
- Las agujas se seleccionan según el tamaño y edad de ratones como sigue:
calibre 22: ratones de 3-4 semanas de edad (menos de 15 gramos de peso corporal)
calibre 20: ratones femeninos menores de 10 semanas (menos de 20 gramos de peso corporal)
calibre 20: ratones machos menores de 6 semanas (menos de 20 gramos de peso corporal)
calibre 20: para colocar solo muestras (frotis)
calibre 18: ratones hembra durante 10 semanas (más de 20 gramos de peso corporal)
calibre 18: ratones machos durante 6 semanas (más de 20 gramos de peso corporal)
calibre 18: muestras grandes
- Las agujas se seleccionan según el tamaño y edad de ratones como sigue:
- Sistema de seguridad para
- Ratones son asegurados mediante la técnica de scruffing.
- Es importante minimizar movimiento de lado a lado de la cabeza. Esto asegura la venopunción precisa y segura con la aguja.
- Retiro de la sangre
- La aguja se mantiene perpendicular a la superficie de la piel.
- Mientras el ratón, coloque el área aproximada de la vena submaxilar por el punto donde una línea desde la esquina de la boca se cruza con una línea desde el ángulo lateral del ojo. Esto coincide con un hoyuelo pequeño, lampiño encontrado caudal a la esquina de la boca y ligeramente por debajo de la línea de la mandíbula.
- Para mayor precisión en pinchar el vaso, coloque el ratón en recumbency lateral.
- Perforar la piel con la punta de la aguja en ese punto. Esto se hace con una presión firme y no como lanzando un dardo.
- No se inserta la aguja más allá de la punta del bisel.
- Al retirar la aguja, sangre comenzará a fluir.
- Para ayudar al flujo sanguíneo, coloque el ratón con la cabeza más baja que el corazón.
- Recoger la sangre en el vaso de la colección deseada.
- Absorba hasta el sitio de punción y librar la presión sobre el pescuezo para la hemostasia.

Figura 2. Sangrado de la vena submaxilar en ratones.
3. safena purga
- Equipo
- Conos de sujeción de plástico transparente y flexible se pueden utilizar el ratón o la rata. Para los ratones, tubos cónicos plásticos modificados mililitro 50 pueden utilizarse para sujeción. Para las ratas, modificado tubos de sujeción de plexiglás-con una ranura de ancho suficiente para extender la pierna trasera-puede ser utilizado.
- Cuando se utiliza el cono de plástico, se mide contra la longitud del cuerpo del animal, y se corta un agujero oval a nivel del muslo.
- Un tubo cónico puede modificarse para un ratón para este método de recolección de sangre por el corte del extremo del tubo para permitir que un agujero de respiración. Se corta una ranura desde el extremo de la tapa del tubo de 1/2 pulgada de ancho y 2 pulgadas de largo. Los bordes son cubiertos de cinta del paño o suavizados para la seguridad del animal.
- Un torniquete es manufacturado usando una jeringa de cc de 3 y una longitud de sutura no absorbible 2-0. 3
- Triple ungüento antibiótico o vaselina blanca se utiliza como una barrera a prueba de humedad en la piel.
- Una aguja de 22 calibre es el tamaño preferido para la punción venosa.
- Sangre se obtiene directamente en los tubos de hematocrito.
- Sistema de seguridad para
- Conos de plástico flexibles
- El ratón o rata se coloca en el cono de nariz primero.
- El extremo del cono se dobla y cierra con una abrazadera pequeña carpeta para impedir que el animal sale del cono de retención.
- La pierna trasera se tira suavemente a través del oval abertura hasta la ingle.
- Tubo cónico para los ratones
- El ratón se coloca en el primer nariz de tubo.
- La pierna trasera es guiada suavemente en la ranura.
- El dedo medio se coloca sobre el extremo del tubo para evitar que el ratón sale del tubo.
- El dedo índice y el pulgar estabilizan la pata del ratón.
- Tubo de sujeción de plexiglás para las ratas
- La rata se coloca en el primer nariz de tubo.
- La pierna trasera es guiada suavemente en la ranura.
- El extremo del tubo se fija para evitar que la rata de copia de seguridad y salir del tubo.
- El dedo índice y el pulgar estabilizan la pata de la rata.
- Conos de plástico flexibles
- Retiro de la sangre
- El pelo se quita de la cara lateral de la pata desde el corvejón a la Babilla. Esto puede hacerse por punteo, afeitarse o usar una crema depilatoria.
- Después de quitar el pelo, una pequeña cantidad de ungüento se aplica y se extendió en una capa muy delgada sobre la zona sin pelo.
- El torniquete se aplica como ahora cranially posible y apretados.
- El buque safeno corriendo por la superficie externa de la pierna desde la rodilla hasta el tobillo comenzará a llenar y se convertirá en elevado y fácil de visualizar.
- La aguja se mantiene perpendicular a la superficie de la piel directamente sobre el vaso sanguíneo. Pinchar el vaso. Tenga cuidado de no insertar la aguja profundamente en la pierna, para evitar pinchar el músculo o hueso de golpear.
- La sangre se grano para arriba en la superficie de la pierna para la colección con el tubo de hematocrito.
- Una vez que se ha recogido la sangre, afloje el torniquete y aplique presión sobre la punción para la hemostasia.
- Una vez que el sangrado se ha detenido, quitar el animal de la restricción y volver a la jaula del hogar.
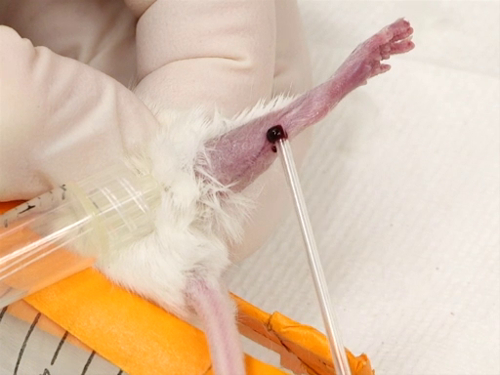
Figura 3. Sangrado de la vena safena en ratones.
4. femoral vena para las ratas
- Equipo
- Sangre se recoge en un tubo de hematocrito.
- Ungüento antibiótico triple es necesario para crear una barrera entre el piel/del pelo y la gota de sangre.
- Una aguja de 22 calibre se utiliza para punzar la vena.
- Una recortadora de pelo pequeño, portable con aproximadamente 1" amplia hoja se utiliza para recortar el pelo de la pierna.
- Sistema de seguridad para
- Las ratas están sujetos mediante un cono de sujeción plástico transparente, flexible.
- Los conos de plástico son medidos contra la longitud del cuerpo y un orificio oval a nivel del muslo. El cono se corta tales que la pierna trasera puede ser exteriorizada con acceso a la vena.
- Retiro de la sangre
- Se afeita el pelo de la superficie interna de la pierna desde la ingle hasta la rodilla.
- Ungüento antibiótico triple se aplica en una capa delgada en el sitio de punción.
- La persona de alojamiento ocluye la vena y tiene la rata con la superficie interna de la pierna hacia al flebotomista.
- Usar la aguja para perforar la vena. La aguja se mantiene perpendicular a los vasos sanguíneos y la punción se realiza directamente en la vena.
- La punción se hace como cerca de la rodilla como sea posible, permitiendo para el muestreo adicional anterior el primer sitio de colección de sangre.
- El buque es superficial. Por lo tanto, la profundidad de la punción no debe ser más profunda que la longitud del bisel de la aguja.
- Para ayudar al flujo sanguíneo, coloque la rata con la pierna más baja que el corazón.
- Recoger la sangre en los tubos de hematocrito como granos en la superficie de la piel.
- Liberar la presión en la pierna y aplique presión sobre el sitio de punción para conseguir la hemostasia.
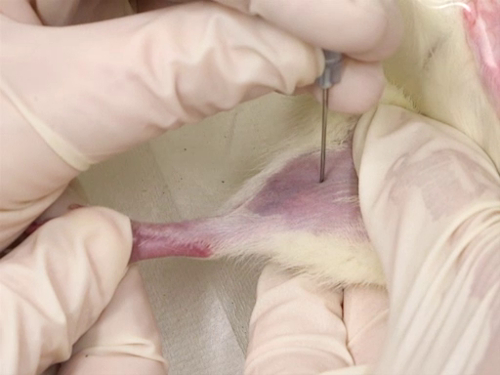
Figura 4. Sangrado de la vena femoral en ratas.
El método de colección de la sangre puede causar una variación en el análisis de la muestra. El nivel de habilidad del técnico que realiza la recogida de la muestra tiene un impacto sobre la calidad de la muestra y el bienestar del animal. El uso de anestésicos también puede afectar la calidad de la muestra. Los métodos descritos aquí se realizan sin el uso de la anestesia, por lo tanto esa variable ha sido eliminada. Además, todas estas técnicas pueden utilizarse para el muestreo serial con mínimas molestias para el animal.
- Fernandez, I., Arantza, P., Del Teso, N., Perez, V. and Rodriguez-Cuesta, J. 2010. Clinical biochemistry parameters in C57BL/6J mice after blood collection from the submandibular vein and retroorbital plexus. Journal of American Association of Laboratory Animal Science. 49:2. 202-210.
- Joslin, O.T. 2009. Blood collection techniques in exotic small animals. Journal of Exotic Pet Medicine. 18:2. 117-139.
- Hem, A., Smith, A.J. and Solberg, P. 1998. Saphenous vein puncture for blood sampling of the mouse, rat, hamster, gerbil, guinea pig, ferret and mink. Laboratory Animals. 32. 364-368.
- Diehl, K-H., Hull, R., Morton, D., Pfister, R. Rabemampianina, Y., Smith, D., Vidal, J-M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
Saltar a...
Vídeos de esta colección:

Now Playing
Extracción de sangre II
Lab Animal Research
72.7K Vistas

Técnicas de manipulación y sujeción de roedores
Lab Animal Research
173.2K Vistas

Procedimientos de atención básica
Lab Animal Research
27.6K Vistas

Fundamentos de la crianza y destete
Lab Animal Research
35.5K Vistas

Identificación de roedores I
Lab Animal Research
54.4K Vistas

Identificación de roedores II
Lab Animal Research
25.5K Vistas

Administración de compuestos I
Lab Animal Research
99.9K Vistas

Administración de compuestos II
Lab Animal Research
34.6K Vistas

Administración de compuestos III
Lab Animal Research
31.2K Vistas

Administración de compuestos IV
Lab Animal Research
51.2K Vistas

Extracción de sangre I
Lab Animal Research
170.7K Vistas

Mantenimiento e inducción de la anestesia
Lab Animal Research
50.0K Vistas

Consideraciones para la cirugía de roedores
Lab Animal Research
22.3K Vistas

Necropsia diagnóstica y recolección de tejidos
Lab Animal Research
57.8K Vistas

Recolección de tejidos estériles
Lab Animal Research
34.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados