Metodo delle aggiunte standard
Panoramica
Fonte: Laboratorio del Dr. Paul Bower - Purdue University
Il metodo delle aggiunte standard è un metodo di analisi quantitativa, che viene spesso utilizzato quando il campione di interesse ha più componenti che si traducono in effetti matriciali, in cui i componenti aggiuntivi possono ridurre o migliorare il segnale di assorbanza dell'analita. Ciò si traduce in errori significativi nei risultati dell'analisi.
Le aggiunte standard sono comunemente usate per eliminare gli effetti della matrice da una misurazione, poiché si presume che la matrice influenzi tutte le soluzioni allo stesso modo. Inoltre, viene utilizzato per correggere le separazioni di fase chimiche eseguite nel processo di estrazione.
Il metodo viene eseguito leggendo l'intensità sperimentale (in questo caso fluorescente) della soluzione sconosciuta e quindi misurando l'intensità dell'ignoto con quantità variabili di standard noto aggiunto. I dati sono tracciati come intensità di fluorescenza rispetto a. la quantità dello standard aggiunto (l'ignoto stesso, senza standard aggiunto, è tracciato SULL'asse y). La linea dei minimi quadrati interseca l'asse x al negativo della concentrazione dell'ignoto, come mostrato in Figura 1.
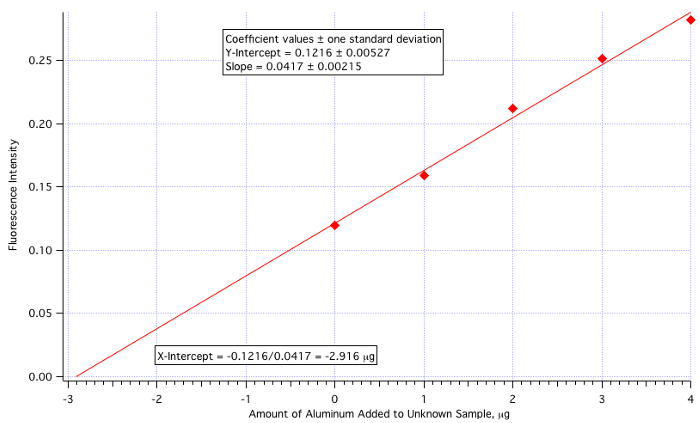
Figura 1. Rappresentazione grafica del metodo di aggiunta standard.
Principi
In questo esperimento, il metodo delle aggiunte standard è dimostrato come strumento analitico. Il metodo è una procedura per l'analisi quantitativa di una specie senza la generazione di una tipica curva di calibrazione. L'analisi di addizione standard viene eseguita misurando l'intensità spettroscopica prima e dopo l'aggiunta di aliquote precise di una soluzione standard nota dell'analita.
Questo esperimento studia le specie non fluorescenti facendole reagire in modo tale da formare un complesso fluorescente. Questo approccio è comunemente usato nello studio degli ioni metallici. Gli ioni di alluminio (Al3+) saranno determinati formando un complesso con 8-idrossichinolina (8HQ). L'Al3+ viene precipitato di 8HQ da soluzione acquosa e quindi viene estratto in cloroformio; la fluorescenza della soluzione di cloroformio viene misurata e correlata alla concentrazione della soluzione originale di Al3+. Per questo esperimento è prevista una sensibilità nell'intervallo parte per milione (ppm o μg/mL).
La reazione è

La quantità di alluminio in ciascun campione durante questo esperimento è calcolata come segue:
| Vuoto | 0 | ||
| Sconosciuto + 0 mL Standard | VSconosciuto(CSconosciuto)= 25 mL(CSconosciuto) | ||
| Sconosciuto + 1 mL Standard | VSconosciuto(CSconosciuto)+ VStandard(CStandard) = 25 mL(CSconosciuto)+ 1 mL(1 μg/mL) | ||
| Sconosciuto + 2 mL Standard | VSconosciuto(CSconosciuto)+VStandard(CStandard) =25 mL(CSconosciuto)+2 mL(1 μg/mL) | ||
| Sconosciuto + 3 mL Standard | VSconosciuto(CSconosciuto)+VStandard(CStandard) =25 mL(CSconosciuto)+3 mL(1 μg/mL) | ||
| Sconosciuto + 4 mL Standard | VSconosciuto(CSconosciuto)+VStandard(CStandard) =25 mL(CSconosciuto)+4 mL(1 μg/mL) | ||
Procedura
1. Preparazione dei reagenti
- Soluzione standard Al3+ da 100 ppm: sciogliere 0,9151 g di nitrato di alluminio (Al(NO3)3•9H 2O) in un matraccio volumetrico da 1-L con acqua DI.
- Soluzione 8HQ in acido acetico 1 M (2% wt/vol): aggiungere 2,0 g di 8-idrossichinolina in un matraccio volumetrico da 100 mL.
- Aggiungere con cautela 5,74 mL di acido acetico glaciale al matraccio da 100 mL, quindi diluire fino al segno con acqua DI. Ciò consente all'8-idrossichinolina di dissolversi in fase acquosa.
- Tampone 1 M NH4+/NH3 (pH~8): aggiungere 20 g di acetato di ammonio (NH4OAc) a un flacone da 100 mL.
- Aggiungere 7 mL di idrossido di ammonio al 30% a questa bottiglia da 100 mL e diluire fino al segno con acqua DI. Questo aiuta a neutralizzare l'acido nella soluzione 8HQ quando combinato.
- Altri reagenti includono solfato disodioanidro (Na 2 SO4) e cloroformio (grado spec).
2. Preparazione dei campioni
- Preparare una soluzione Standard Al3+ da 1,00 ppm aggiungendo 1,0 mL della soluzione Al3+ da 100 ppm con una pipetta a un matraccio tarare da 100 ml.
- Posizionare sei imbuti di separazione da 125 ml sugli anelli che si trovano su un grande supporto ad anello situato nel cofano. Dovrebbero essere etichettati come segue: BL, 0, 1, 2, 3, 4. Assicurarsi che tutti gli oggetti di vetro siano scrupolosamente puliti, in quanto è difficile ottenere risultati quantitativi se piccole perle di cloroformio si attaccano alle pareti della vetreria.
- Aggiungere 25,00 ml della soluzione sconosciuta di Al3+ ai cinque imbuti separatori etichettati 0, 1, 2, 3 e 4. In questo esempio, la concentrazione sconosciuta è 0,110 ppm.
- Aggiungere 0, 1,00, 2,00, 3,00 e 4,00 ml della soluzione standard Al3+ da 1,00 ppm, rispettivamente, ai 5 imbuti con una pipetta da 1 mL.
- Preparare un BLANK aggiungendo 25,00 ml di acqua distillata all'imbuto separatore etichettato BL.
- Aggiungere 1,0 ml della soluzione di 8-idrossichinolina con una pipetta a ciascuna delle sei soluzioni.
- Aggiungere 3,0 ml di soluzione tampone con una pipetta a ciascuna delle sei soluzioni.
- Estrarre ogni soluzione due volte con 10 ml di cloroformio, agitando vigorosamente per 1 minuto ogni volta. Ricordarsi di sfogare occasionalmente l'imbuto separatore per rilasciare l'accumulo di pressione. (NOTA: Una buona estrazione avviene solo quando c'è molto contatto liquido-liquido tra le fasi).
- Raccogliere il cloroformio in un becher pulito e asciutto da 100 ml etichettato. Il cloroformio ha una densità vicina a 1,5 g / cm3, quindi è lo strato inferiore. Non dovrebbe esserci traccia di colore giallo lasciato nella fase acquosa dopo una completa estrazione.
- Trasferire l'estratto combinato di cloroformio da ciascun becher nel rispettivo matraccio volumetrico da 25 mL e diluire fino al marchio con cloroformio. Assicurarsi di posizionare i tappi in ogni pallone volumetrico per evitare che il cloroformio evapori.
- Aggiungere ~ 1 g di solfato di sodio anidro (Na2SO4) a ciascuno dei sei becchi da 100 ml dal passaggio 2.9. Il solfato di sodio aiuta a rimuovere qualsiasi traccia di acqua che può essere presente nell'estratto di cloroformio.
- Trasferisci le soluzioni ai loro becchi rispettati. Ruotare con attenzione per facilitare la disidratazione di qualsiasi acqua nel campione.
- Decantare gli estratti di cloroformio in una cella fluorimetrica di quarzo (Nota: il cloroformio dissolverà una cella di polistirene plastico).
3. Selezione della lunghezza d'onda di eccitazione
Determinare le lunghezze d'onda di eccitazione ed emissione eseguendo scansioni, quindi è sufficiente leggere e registrare l'intensità di fluorescenza di tutti i campioni a tali valori. Le larghezze di banda di eccitazione ed emissione sono preimpostate a 5 nm. Il complesso assorbe nel vicino UV, quindi la lunghezza d'onda di eccitazione dovrebbe essere di circa 385 nm. Inizialmente, monitorare la fluorescenza a 500 nm nel ramo di emissione.
- Sul fluorimetro, verificare che le ventole di raffreddamento interne ed esterne del fluorimetro siano accese prima di accendere la lampada allo xeno. La lampada allo xeno diventa molto calda e richiede un raffreddamento continuo.
- Accendere l'alta tensione (HV) al rilevatore PMT a 400 V.
- Apri entrambe le persiane.
- Apri il programma di acquisizione dati sul computer, eccolo "100nmFluorScan".
- Posizionare la soluzione "Campione + 2 mL aggiunto" (2) nella cella di quarzo da utilizzare per determinare le migliori lunghezze d'onda di eccitazione ed emissione.
- Con la lunghezza d'onda di emissione inizialmente impostata a 500 nm, eseguire una scansione di eccitazione da 335-435 nm con una velocità di scansione di 2 nm / s.
- Dal grafico di fluorescenza risultante, determinare la lunghezza d'onda massima di eccitazione della fluorescenza (EXλmax) e impostare lo strumento su tale valore.
4. Selezione della lunghezza d'onda di emissione
- Impostare la lunghezza d'onda di emissione del fluorimetro su 450 nm.
- Impostare l'intervallo di lunghezze d'onda di emissione per eseguire una scansione a 100 nm da 450-550 nm.
- Per avviare la scansione, fare clic sul pulsante "avvia prova" sul programma contemporaneamente alla pressione del pulsante "START" sul pannello frontale del fluorimetro.
- Dal grafico di fluorescenza risultante, determinare la lunghezza d'onda massima di emissione di fluorescenza (EMλmax) e impostare lo strumento su tale valore (Figura 2).
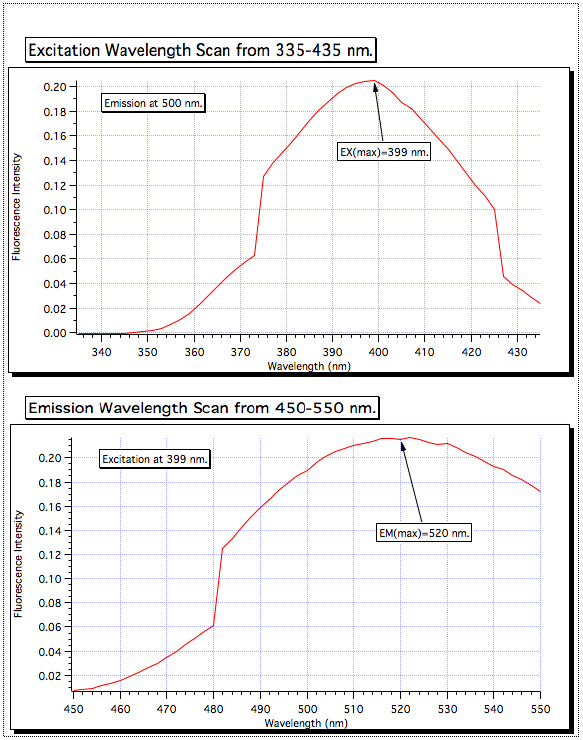
Figura 2. Determinazione delle lunghezze d'onda ottimali EXλ max ed EMλmax.
5. Misurazione della fluorescenza dei campioni
- Tutti i campioni vengono eseguiti a EMλmax e EXλmax. Le scansioni non sono necessarie per ogni campione, ma solo il valore di fluorescenza in queste condizioni. Iniziando con il campione più diluito (vuoto), mettere in una cella di quarzo e poi nello strumento. Registrare l'intensità fluorescente nel quaderno di laboratorio.
- Ripetere l'operazione per tutti gli altri campioni.
- Tenere presente che l'intensità relativa vuota deve essere sottratta dalle intensità relative di ciascuna soluzione prima di creare la tabella di calibrazione.
6. Creazione del plottaggio di addizione standard
- Traccia l'intensità di fluorescenza rispetto a μg di Al3+ aggiunto.
- Determinare il valore dei minimi quadrati del plottaggio risultante e registrare sia la pendenza che l'intercetta.
- Determinare la μg di Al3+ nel campione sconosciuto dall'equazione μg di Al3+ = -b/m
- Sapendo che l'alluminio sconosciuto aveva un volume di 25,0 ml aggiunto a ciascun campione, determinare la concentrazione dell'alluminio nell'ignoto.
Risultati
Una scansione della lunghezza d'onda di eccitazione da 335-435 ha mostrato il più alto assorbimento a 399 nm, quindi il monocromatore di eccitazione è stato impostato per quel valore. Quindi la scansione dell'emissione è stata eseguita da 450-550 nm e il segnale più forte è risultato essere a 520 nm. Queste sono le lunghezze d'onda utilizzate per tutti i campioni.
| Campione | Intensità di fluorescenza | Intensità di fluorescenza corretta |
| Vuoto | 0.008 | 0.000 |
| Campione | 0.128 | 0.120 |
| Campione + 1 mL | 0.167 | 0.159 |
| Campione + 2 ml | 0.220 | 0.212 |
| Campione + 3 mL | 0.260 | 0.252 |
| Campione + 4 ml | 0.290 | 0.282 |
Un grafico di fluorescenza (Figura 3) rispetto a μg di Al3+ aggiunto (Figura 4) ha prodotto una linea dei minimi quadrati di:
Intensità di fluorescenza = 0,0417 x (μg di Al3+ aggiunto) + 0,1216
Quantità di Al3+ = -(Y-Int)/Pendenza = -0,1216/0,0417 = -2,916 μg/mL
Poiché la quantità di incognita aggiunta era di 25 ml, il valore di 2,916 μg/mL deve essere diviso per 25.
Concentrazione sconosciuta di alluminio = 2,916 μg/mL / 25,0 mL = 0,117 μg/mL = 0,117 ppm
che è abbastanza vicino al valore effettivo di 0,110 ppm (errore del 6,4%).

Figura 3. Fluorescenza dei campioni.
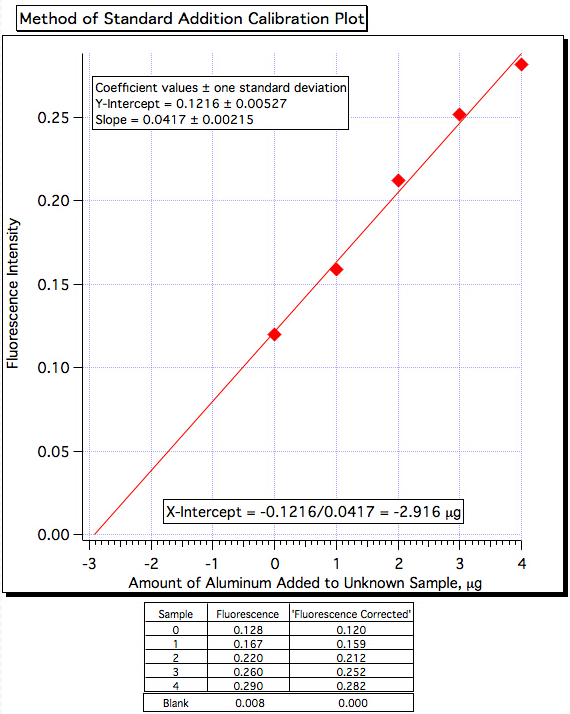
Figura 4. Grafico di calibrazione dell'aggiunta standard.
Applicazione e Riepilogo
Il metodo delle aggiunte standard è spesso la tecnica utilizzata quando si desiderano risultati quantitativi accurati, utilizzata in analisi analitiche come l'assorbimento atomico, la spettroscopia di fluorescenza, l'ICP-OES e la gascromatografia. Questo viene spesso utilizzato quando ci sono altri componenti nel campione di interesse che causano una riduzione o un miglioramento dell'assorbanza desiderata per risultati quantitativi. Quando questo è il caso, non si può semplicemente confrontare il segnale degli analiti con gli standard utilizzando l'approccio tradizionale della curva di calibrazione. In effetti, la valutazione dell'effetto matrice dovrebbe essere una parte obbligatoria della procedura di convalida.
Un altro esempio in cui è possibile utilizzare aggiunte standard è quando si estrae argento da vecchi rifiuti fotografici. I rifiuti contengono alogenuri d'argento e possono essere estratti in modo che l'argento possa essere recuperato. Aumentando i "rifiuti" sconosciuti con quantità note di argento, questo metodo può prevedere la quantità di argento ottenuta dalla pellicola fotografica.
I lavoratori che sono esposti agli impianti di produzione di benzene sono spesso testati per verificare che siano al di sotto dei livelli accettati di benzene. La loro urina viene testata per la sostanza chimica, e questa è la matrice biologica. Inoltre, la quantità di soppressione dell'analita varia a livello di persone diverse, quindi un singolo kit di calibrazione non funzionerà. Con il metodo di aggiunta standard, ogni dipendente può essere testato e valutato con precisione.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Metodo delle aggiunte standard
Analytical Chemistry
319.9K Visualizzazioni

Preparazione del campione per la caratterizzazione analitica
Analytical Chemistry
84.6K Visualizzazioni

Standard interni
Analytical Chemistry
204.7K Visualizzazioni

Curve di calibrazione
Analytical Chemistry
796.4K Visualizzazioni

Spettroscopia ultravioletta/visibile (UV-VIs)
Analytical Chemistry
623.2K Visualizzazioni

Spettroscopia Raman per analisi chimiche
Analytical Chemistry
51.2K Visualizzazioni

Fluorescenza a raggi X (XRF)
Analytical Chemistry
25.4K Visualizzazioni

Gascromatografia con rivelatore a ionizzazione di fiamma
Analytical Chemistry
281.9K Visualizzazioni

Cromatografia liquida ad alta prestazione (HPLC)
Analytical Chemistry
384.3K Visualizzazioni

Cromatografia a scambio ionico
Analytical Chemistry
264.4K Visualizzazioni

Elettroforesi capillare
Analytical Chemistry
93.8K Visualizzazioni

Introduzione alla spettrometria di massa
Analytical Chemistry
112.2K Visualizzazioni

Microscopia elettronica a scansione (SEM)
Analytical Chemistry
87.1K Visualizzazioni

Misurazioni elettrochimiche di catalizzatori supportati mediante l'utilizzo di un potenziometro/galvanometro
Analytical Chemistry
51.4K Visualizzazioni

Voltammetria ciclica
Analytical Chemistry
125.1K Visualizzazioni