Method Article
ניתוח כמותי של ייצוב קרום הרשתית האנדופלזמית (MAM) הקשור למיטוכונדריה במודל עצבי של מחלת אלצהיימר (AD)
In This Article
Summary
כאן, אנו מתארים את מדידת קצב ההובלה האקסונלית של מייצבים מכוננים של ממברנות רשתית אנדופלזמית (ER) הקשורות למיטוכונדריה (MAMs) על ידי הגדלה או שמירה על יצירת β-עמילואיד (Aβ) נוירוטוקסית מנוירונים של מחלת אלצהיימר (AD) בזמן אמת כדי לשמש כמדד ישיר וכמותי למדידת ייצוב MAM ולסייע בפיתוח טיפולים במחלת אלצהיימר.
Abstract
שיטה לכימות הייצוב של ממברנות רשתית אנדופלזמיות הקשורות למיטוכונדריה (MAMs) במודל עצבי תלת מימדי (תלת מימדי) של מחלת אלצהיימר (AD) מוצגת כאן. בתור התחלה, תאי ReN נוירו-אב אנושיים טריים המבטאים חלבון מבשר β-עמילואיד (APP) המכילים מחלת אלצהיימר משפחתית (FAD) או תאי ReN נאיביים גדלים בצלחות תרבית רקמה דקות (1:100) מצופות מטריג'ל. לאחר שהתאים מגיעים למפגש, אלה עוברים אלקטרופוציה עם פלסמידים ביטוי המקודדים רצף קשירת מיטוכונדריה מצומד של חלבון פלואורסצנטי אדום (RFP) של AKAP1 (34-63) (Mito-RFP) המזהה מיטוכונדריה או מייצבי MAM מכוננים MAM 1X או MAM 9X המייצבים MAMs הדוקים (רוחב פער של 6 ננומטר ± 1 ננומטר) או רופפים (רוחב פער של 24 ננומטר ± 3 ננומטר) בהתאמה. לאחר 16-24 שעות, התאים נקצרים ומועשרים על ידי ממיין תאים המופעל על ידי פלואורסצנטי (FACS). מספר זהה של תאים מועשרים ב-FACS נזרעים במטריצה התלת-ממדית (1:1 Matrigel) ומאפשרים להם להתמיין לנוירונים בוגרים למשך 10 ימים. תמונות תאים חיות של התאים הממוינים של 10 ימים המבטאים את מייצבי ה-MAM המצומדים ל-RFP נלכדות תחת מיקרוסקופ פלואורסצנטי המצויד בתא תרבית הדמיה של תאים חיים השומר על CO2 (5%), טמפרטורה (37 מעלות צלזיוס) ולחות (~90%). לשם כך, ביצענו הדמיה של תאים חיים וניתוחים קימוגרפיים כדי למדוד את התנועתיות של מיטוכונדריה חופשית המסומנת במיטוכונדריה קשורה ל-Mito-RFP או ER ברוחב מרווח הדוק או רופף המיוצב על ידי MAM 1X או MAM 9X, בהתאמה, בתהליך העצבי המורחב ביותר של כל נוירון ReN GA שאורכו לפחות 500 ננומטר, בהתחשב בהם כאקסונים.
Introduction
עדויות מתפתחות מצביעות על כך שמגעי הרטיקולום האנדופלזמיים המיוחדים הקשורים למיטוכונדריה (MERCs), שנקטפו ביוכימית כממברנות ER הקשורות למיטוכונדריה, המכונים לעתים קרובות MAMs 1,2 ממלאים תפקיד במספר מחלות ניווניות, כולל AD 3,4. MAMs אלה מורכבים ממיקרו-דומיינים דמויי רפסודת שומנים עשירים בכולסטרול ב-ER ובממברנה החיצונית של המיטוכונדריה הקשורה על ידי סדרה של חלבונים היוצרים גיוון מבני ותפקודי בין ה-MAMs 5,6,7. השערת ה-MAM שנטבעה לאחרונה מניחה כי העלייה ב-MAMs מובילה לייצור מוגבר של Aβ ולמפל הפתוגני של אלצהיימר, כולל היווצרות סבך נוירו-פיברילרי (NFT), דישומאוסטזיס סידן ודלקת עצבית 3,8. כ-5%-20% מהמיטוכונדריה יוצרים מגע פיזי עם חדר המיון ליצירת MAMs9. רוחב הפער של MAMs נקבע על ידי ה-ER החלק והמחוספס (sER ו-rER, בהתאמה). רוחב הפער המשתנה בין sER-mitochondria (10-50 ננומטר) ל-rER-מיטוכונדריה (50-80 ננומטר) מצביע על כך שלרוחב הפער של MAMs יש ספקטרום ארוך שנע בין הדוק (~10 ננומטר) לרופף (~80 ננומטר)10,11,12,13. רוחב פער MAM קובע פונקציות MAT, כגון הומאוסטזיס סידן והובלת שומנים 1,14. דו"ח שפורסם לאחרונה הראה כי ה-MAMs שנוצרו בין ER המחוברים היטב (~10 ננומטר) למיטוכונדריה, הנקראים MAMs מלאים, הם אפופטוטיים. לעומת זאת, MAMs הנוצרים בין ER המחוברים באופן רופף (~25 ננומטר) למיטוכונדריה, המכונים MAMs פגומים או בינוניים, הם אנטי-אפופטוטיים 14,15,16. ייצוב של MAMs עם רוחב פער של 6 ננומטר ± 1 ננומטר הגדיל את יצירת ה-Aβ ממודל תרבית עצבית תלת מימדית (תלת מימדי) חדש של אלצהיימר. לעומת זאת, לייצוב של MAMs עם רוחב פער של 24 ננומטר ± 3 ננומטר אין השפעה על דור Aβ17. ממצא זה מצביע לראשונה על כך שוויסות מידת ייצוב ה-MAM, אך לא ערעור יציבות, הוא המפתח לוויסות יצירת Aβ. לניסיון לערער לחלוטין את היציבות של MAMs עלולות להיות השלכות לא רצויות מכיוון ש-MAMs שומרים על מספר אירועים תאיים קריטיים להישרדות התאים12.
אפנון MAMs הוא תחום מחקר מתפתח עם השלכות פוטנציאליות על הפרעות שונות, כולל סרטן, הפרעות מטבוליות ומחלות ניווניות18. למרות זמינותם של מאפנני MAM רבים, עד כה לא נעשה ניסיון משמעותי לבחון את יכולותיהם לערער את יציבות ה-MAMs ולהפחית את הפתולוגיה של AD, בעיקר מכיוון שהגיוון המבני של MAMs הופך אותם למערכת מורכבת ביותר לגילוי תרופות. אבל, פרמקולוגיה של מערכות מבניות שפותחה לאחרונה, הלוקחת בחשבון את המאפיינים הספציפיים של מטרות התרופות וסביבתן18,19 אמורה להתגבר על הקשיים ולפתח תרופות חזקות ביותר המכוונות ל-MAMs או חלבונים הקשורים ל-MAM במחלת אלצהיימר. עם זאת, החיפוש אחר מודולטור יעיל של ייצוב MAM דורש שיטות לכמת במדויק את מידת ייצוב ה-MAM. לטכניקות מסורתיות כמו מיקרוסקופ אלקטרונים (EM) או מיקרוסקופיה ברזולוציה גבוהה יש מגבלות בקביעת ייצוב MAM. התגברות על אתגרים אלה תדרוש ככל הנראה פיתוח של טכניקות הדמיה חדשות ודינמיות יותר או בדיקות ביוכימיות שיכולות לספק מדדים כמותיים של ייצוב MAM בתאים חיים. מיקרוסקופ אלקטרונים ממוקד של סריקת קרן יונים (FIB-SEM) של נוירונים ראשוניים גילה כי ה-ER נוטה ליצור רשת סביב המיטוכונדריה שעשויה להגביל את תנועתיות המיטוכונדריה20,21. לשיבוש מערכות ההובלה המיטוכונדריאליות, בין אם רטרוגרדיות, אנטרוגרדיות או שניהם, הייתה השפעה עמוקהעל התפקוד הסינפטי והנוירוני. לפיכך, הדמיית תאים חיים חדשנית וניתוח מבוסס קימוגרפיה של מהירות אקסונלית של מיטוכונדריה קשורה ל-ER המתוארת כאן כמדד למדידה כמותית של ייצוב MAM יקל על זיהוי מאפנן/ים MAM שיכולים להחליף את סף הייצוב של MAM לכזה ששומר או אולי מוריד בניגוד להגברת ייצור Aβ.
Protocol
מודלים של תרבות עצבית של אלצהיימר: מחקר זה השתמש בתאי עצב שמקורם בתאי ReN עצביים אנושיים [ReN נאיבי (Millipore)] או תאי ReN המבטאים מוטציות AD משפחתיות (fAD) בגן חלבון מבשר עמילואיד (APP) (APPSwe/Lon), תאי ReN GA. מערכת תרבית תלת מימדית (תלת מימדית) ReN-GA מסכמת את הפתולוגיה של אלצהיימר, כלומר סבכים נוירו-פיברילריים מונעי אוליגומר Aβ (NFTs) 23,24. תאי ReN נאיביים זמינים מסחרית. קווי ReN GA התקבלו מד"ר דו י. קים, פרופסור חבר, בית החולים הכללי של מסצ'וסטס (MGH)23,24,25.
פלסמידים של ביטוי: AKP1 (34-63) ורצף מכוון-ER של חלבוני Ubc 6 (283-303) המקושרים ישירות ל-RFP (Mito-RFP-ER מסומן כ-MAM 1X) או מכילים מקשר של 9 חומצות אמינו (Mito-9X-RFP-ER מסומן כ-MAM 9X) שנועד לייצב MAMs של רוחבי מרווח של 6 ננומטר ±-1 ננומטר או 24 ננומטר + 3 ננומטר, בהתאמה15,26 (איור 1A).
1. אלקטרופורציה
- העברת התאים עם מייצבי MAM (1-2 שעות)
הערה: עקוב אחר הפרוטוקול המתואר על ידי יצרן ערכת הנוקלאופקטור (טבלת חומרים). לפני שמתחילים, הכינו כלי תרבית עם תחתית זכוכית עם 6 בארות מצופים מראש ב-DMEM/F12 המכילים 1% מטריג'ל (מכאן ואילך מכונה מטריצת ממברנת הבסיס [BMM]). השתמש ב-2 מ"ל של BMM כדי לצפות כל באר. יש לדגור לפחות שעה אחת בטמפרטורה של 37 מעלות צלזיוס. יש לקרר מראש את BMM, המדיה, קצות הפיפטות והפיפטות לפני הערבוב כדי למנוע התמצקות של BMM.- שואבים את תערובת ה-BMM. החלף ב-2 מ"ל של טמפרטורת החדר (RT) DMEM/F12 בכל באר.
- שלב את Nucleofector עם Supplement 1 ביחס של 4.5:1 (82 μL:18 μL של יחס Nucleofector/Supplement עבור 100 μL של תמיסה). עבור כל טרנספקציה רצויה, יש צורך ב-100 מיקרוליטר של נוקלאופקטור.
- DNA מערבולת. לאחר מכן, הוסף 1-5 מיקרוגרם DNA (לכל טיפול) בצינורות מיקרו-צנטריפוגה של 1 מ"ל עבור כל טרנספקציה.
- השתמש באקוסטאז כדי לקצור צלחת של תאי ReN-GA בריאים.
הערה: תאי צלחת באמצעי הרחבה (טבלה 1) בצלחות תרבית רקמה של 100 מ"מ והמתינו עד שהמפגש יגיע ל-70-80%.- שאפו את המדיה הקיימת ושטפו פעם אחת עם 10 מ"ל PBS.
- הוסיפו 1 מ"ל של אקוטאז ישירות לתאים ודגרו במשך 5-10 דקות בטמפרטורה של 37 מעלות צלזיוס.
- עקור תאים מהצלחת על ידי הקשה עדינה על צד המנה. בדוק תחת מיקרוסקופ כדי לוודא שהתאים משוחררים וזורמים בחופשיות.
- לנטרל אקוטאז עם 10 מ"ל DMEM/F12 ולהעביר לצינור נקי של 15 מ"ל.
- צנטריפוגה את מספר התאים הנדרש ב-274 x g למשך 5 דקות ולשאוף את הסופרנטנט להסרת תאים מתים. לאחר מכן, השעו מחדש את הגלולה ב-10 מ"ל של DMEM/F12.
- ספור את התאים כדי לקבוע צפיפות.
הערה: במחקר זה, נעשה שימוש במונה תאים אוטומטי כדי לספור את מספר התאים. לכל אלקטרופורציה, יש צורך ב-3-5 X 106 תאים (למשל, 5 טיפולים ידרשו 15-25 X 106 תאים).- קח 10 מיקרוליטר מהתאים התלויים והוסף לצד A של תא ספירת תאים. לאחר מכן הוסף 10 מיקרוליטר לצד B.
הערה: הוסף את מתלה התא על ידי זווית הפיפטה הצידה. הימנע מבועות על ידי לא לדחוף מעבר לתחנה הראשונה בבוכנה של הפיפטה. - קח את תא הספירה המלא לדלפק התאים והכנס את צד A לחריץ הראשי בחזית.
- לאחר לחיצה על מדידה, שים לב למספר התאים למ"ל.
- הוצא את החדר, הפוך לצד B וחזור על שלבים 1.1.5.2-1.1.5.3.
- חבר את שני המספרים האלה יחד, ואז חלק ב-4 (אם לא באמצעות טריפן כחול), ואז הכפל את המספר במיליליטר הנוזל שבו התאים תלויים כדי לקבל את המספר הכולל של התאים בתרחיף.
- קח 10 מיקרוליטר מהתאים התלויים והוסף לצד A של תא ספירת תאים. לאחר מכן הוסף 10 מיקרוליטר לצד B.
- צנטריפוגה את מספר התאים הנדרש ב 274 x g למשך 5 דקות ולשאוף את הסופרנטנט.
- השהה את הגלולה ב-100 מיקרוליטר של תערובת נוקלאופקטור לכל אלקטרופורציה. (למשל, 500 מיקרוליטר ל-5 טיפולים).
הערה: השארת התאים בתמיסת ה-Nucleofector למשך יותר מ-15 דקות עלולה להפחית את כדאיות התא ואת היעילות הכוללת. - הוסף 100 מיקרוליטר מתרחיף התא לאחד הצינורות המכילים DNA וערבב על ידי פיפטינג.
- העבירו את תערובת ה-DNA לקוביית אלקטרופורציה ואוטמים עם המכסה המצורף. כדי להימנע מיצירת בועות, יש לכוון את הקובט כלפי מטה ולסובב את הפיפטה לאט.
- בחר את תוכנית ה-Nucleofector המתאימה להתקן שבו נעשה שימוש. עבור המכשיר ששימש במחקר זה, השתמש בתוכנית A-033 לטרנספקציה. כדי לבצע אופטימיזציה, נסה את כל 5 תוכניות Nucleofector כדי לקבוע את התוכנית המתאימה ביותר לכל סוג תא.
הערה: אישור לאלקטרופורציה מוצלחת הוא קצף גלוי בחלק העליון של התערובת. - מיד, בעזרת הפיפטות הסטריליות המסופקות, הוסף ~500 מיקרוליטר של ה-DMEM מצלחת 6 הבארות הממולאת מראש לתוך הקובטה. מערבבים בעדינות פעם אחת ואז מעבירים את התאים האלקטרופוטיים והמדיום לבאר המתאימה.
הערה: לאחר אלקטרופורציה, התאים רגישים ביותר, ולכן העברת המדיה במהירות ופיפטינג בזהירות היא חיונית. - חזור על שלבים 1.1.8-1.1.11 עבור כל טיפולי ה-DNA הנותרים.
- דגרו על התאים בטמפרטורה של 37 מעלות צלזיוס בנוכחותCO 2 ( 5%) למשך הלילה.
- למחרת, החליפו מדיה עם אמצעי התמיינות טריים (טבלה 2) ואפשרו לתאים להתמיין במשך 10 ימים. כל 2-3 ימים, החלף במדיה טרייה.
2. הדמיית תאים חיים
- הכנת תאים למיקרוסקופ תאים חיים (30 דקות)
- הכנת תא תא חי (לפני העברת תאים לתא)
- ודא שמיכל CO2 ומכשיר האדים מחוברים לתא, השסתומים פתוחים והמיכלים מלאים.
- הגדר את הטמפרטורה ל-37 מעלות צלזיוס, את ה-CO2 עד 5% ואת הלחות ל-95%. (ייתכן שיחלוף זמן מה עד שהרמות יתאזנו).
- הניחו צלחת עם 6 בארות המכילה תאים בתא והתאימו את מיקוד המיקרוסקופ עד שהתאים נראים לעין.
- הפעל את הלייזר (טבלת החומרים).
- כדי ללכוד את אות ה-RFP, עורר את הפלואורופור באמצעות לייזר 594 ננומטר והשתמש בפליטה של 570-640 ננומטר. עבור GFP, השתמש בלייזר 488 ננומטר לעירור ופליטה של 510-540 ננומטר.
- באמצעות מסנן הפלואורסצנט המובנה, כוונן את עוצמת האות עד שאות הרקע יתפוגג (אמור להיות כמעט שחור מלא).
- צילום וידאו חי של אקסונים (10 שעות עד 15 שעות בסך הכל)
הערה: מיקרוסקופ קונפוקלי הפוך Nikon C2 Eclipse Ti2 שימש לצילום תמונות פלואורסצנטיות באמצעות תוכנת NIS Element AR. השתמש בהגדלה של פי 60 ברזולוציה של 512 פיקסלים, וצלם סרטונים בפריים אחד לשנייה למשך 3 דקות של קימוגרפיות נקיות יותר.- מצא תא המבטא חיישנים ביולוגיים RFP. ייצא תמונה של התא לעיון מאוחר יותר לפני צילום וידאו.
- חתכו את אזור הסריקה כך שיתאים סביב האקסון. שימוש בשטח סריקה קטן יותר מפחית את זמן העיבוד של המיקרוסקופ ומקל על יצירת קימוגרפיה.
- כבה את כל מכשירי הלייזר כדי לסייע לתוכנה לפעול בצורה חלקה יותר. שימו לב, כאשר התוכנית מופעלת כאשר כל הלייזרים פעילים, לא כל הפריימים נלכדים.
הערה: האות הפלואורסצנטי האדום מהסומה הרבה יותר בהיר מאשר באקסון. לכן, הסומה אינה נכללת כדי להגביר את עוצמת האות הכוללת באקסון. עבור לכרטיסייה מדידת זמן . - הגדר את המרווח לפריים אחד לשנייה והגדר את הזמן הכולל על 181 שניות.
- לחץ על הפעל.
- שמור קובץ זה כקובץ .nds (מסומן כהלכה) וחזור על התהליך ~ 10 פעמים לכל מייצבי MAM (MAM 1X או MAM 9X).
הערה: חוזק הלייזר ייצר לפעמים אפקט הלבנה ניכר על אות ה-RFP אם נסרק זמן רב מדי. חשוב לקחת בחשבון עבודה מהירה לצילום סרטונים.
3. לאחר עיבוד (7 ימים)
הערה: כדי לנתח תעבורה וליצור קימוגרפיות, נעשה שימוש בפקודות מאקרו של Fiji ImageJ. שלפוחיות שנעו פחות מ-0.1 מ"מ לשנייה סווגו כנייחות. תדירות תנועת החלקיקים חושבה על ידי חלוקת מספר החלקיקים הנעים בכיוון נתון (אנטרוגרדי, נסיגה) או לא נעים (נייחים) במספר הכולל של החלקיקים שנותחו בקימוגרף. הזמן שכל שלפוחית בילתה בעצירה או בתנועה חושב על ידי ממוצע אחוז הזמן שהושקע בכל מצב עבור כל השלפוחיות בכל נוירון שנותח. התפלגות התדרים עבור מהירות ואורך ריצה חושבה באמצעות שלפוחיות נעות בלבד עבור כל תנאי ניסוי. הניתוח בוצע על מסלולים אקסונליים של 100 מ"מ למשך 3 דקות.
- יצירת קימוגרף
- פתח את קובץ ה- .nds ב- Fiji ImageJ.
- עבור אל הכרטיסיה תמונה ולחץ על מאפיינים. רשום את יחס הפיקסלים למיקרון. זה נחוץ לחישוב מאוחר יותר.
- לחץ על קובץ > שמור בשם > Tiff כדי לשמור את הקובץ .tiff בתיקיה שלו (המאקרו ישמור אוטומטית את כל מה שנוצר בתיקיה זו).
- גרור את המאקרו של Kymo לתוך ImageJ. הקוד מסופק בקובץ קידוד משלים 1. לחץ על הפעל.
- אל תלחץ על אישור. עבור לחלון MAX_raw. לחץ ידנית באמצעות לחצן העכבר השמאלי לאורך האקסון ולחץ פעמיים כדי לסיים את המעקב.
הערה: הקפד לעקוב אחר האקסון מהסומה כך שמסוף האקסון. בדרך זו החישובים האנטרוגרדיים והנסיגתיים יהיו נכונים. - לחץ על הפקודה T או הוסף במנהל ה-ROI.
- כעת לחץ על אישור. קימוגרף ייווצר בתיקיה שנעשתה קודם לכן. (ציר ה-X הוא אורך האקסון במיקרונים, וציר ה-Y הוא זמן בשניות).
- מעקב אחר הקימוגרף
- גרור את הקימוגרף לתוך Fiji Image J (יש למקם אותו אוטומטית בתיקייה שנוצרה קודם לכן).
- גרור את המאקרו 'רצועה' לתמונה J.
- בהנחיה הבאה, לחץ על אישור. אם אתה מחדש את העבודה מקודם, הזן את נקודת המספר שממנה יש להמשיך ולאחר מכן הקש אישור.
- היעזרו בכלי מלבן בחלונית 'בחירה ', ובחרו אזור באמצע הקימוגרף שגובהו 60 פיקסלים ורוחבו תמיד 100 מיקרומטר. לשם כך, חלקו 100 ביחס פיקסל למיקרו שנרשם בשלב 3.1.2.
- לאחר בחירת אזור, לחץ על Ctrl T כדי להוסיף את ההחזר על ההשקעה ולשמור את ההחזר על ההשקעה בתיקיה בה עובדים (לחץ על עוד בתפריט החזר ההשקעה ולאחר מכן שמור).
הערה: היפוך האזור שנבחר על-ידי הקשה על Ctrl+Shift+I יקל על המעקב. - כדי לעקוב אחר תנועת שלפוחית בודדת, החזק את מקש Ctrl תוך כדי לחיצה שמאלית מלמעלה למטה.
- כדי לסיים, החזק את Ctrl תוך כדי לחיצה ימנית ויופיע חלון המראה היכן עוקבים אחר האקסונים. אם זה נראה טוב, לחץ על אישור.
- כדי להמשיך ולבחור שלפוחית אחרת, לחץ על כן וחזור על התהליך משלבים 3.2.6-3.2.8. לאחר מעקב אחר כל שלפוחית נראית לעין, לחץ על לא. פעולה זו תשמור באופן אוטומטי את שכבת העל במעקב ידני באותה תיקיה.
- מדידת נתוני הקימוגרף
- צור תיקיה חדשה. גרור כל קובץ טקסט שנוצר לתוך התיקיה.
- פתח את קובץ הקימוגרף ורשום את המידות.
- גררו את המאקרו 'מדידה' לתמונה J.
- הזן את יחס המיקרון לפיקסל שנרשם קודם לכן ב- PixelScale.
- שנה את המהירות המותרת נמוכה ל-0.1. (שלפוחיות הנעות מתחת לגבול זה נחשבות נייחות).
- הזן את מידות הקימוגרף שתועדו קודם לכן. קובץ הסיכום ייווצר אוטומטית בתיקיית הטקסט שנוצרה. כל מילוי סיכום יכיל % זמן נסיעה, מהירות כוללת (מיקרומטר לשנייה), מרחק כולל, מקטע ממוצע שנסע, מספר הפעמים שנעצר ומספר הפעמים שנסעו. הקוד להפקה, מעקב ומדידה של נתוני הקימוגרף מסופק כקובץ קידוד משלים 1.
תוצאות
הדמיה של תאים חיים וניתוחים קימוגרפיים בוצעו כדי למדוד את התנועתיות של מיטוכונדריה חופשית המסומנת במיטוכונדריה קשורה ל-Mito-RFP או ER של רוחבי מגע הדוקים (6 ננומטר ±-1 ננומטר) או רופפים (24 ננומטר ±-3 ננומטר) המיוצבים על ידי MAM 1X או MAM 9X, בהתאמה, בתהליך העצבי הארוך ביותר של כל נוירון ReN GA (AD) או ReN (נאיבי) שאורכו לפחות 500 ננומטר, בהתחשב בכך כאקסון (איור 1 ואיור 2). תדירות התנועות (כוללת, נסיגה ואנטרוגרדית) חושבו על ידי חלוקת מספר הפונקטה הנעה או הנייחת המסומנת ב-RFP (MAMs) במספר הכולל בקימוגרפים (איור 1A-E). המהירות האקסונלית הכוללת של המיטוכונדריה הקשורה ל-ER המסומנת על ידי MAM 1X ירדה באופן דרמטי ב-~50% בהשוואה למיטוכונדריה נטולת ER המסומנת על ידי Mito-RFP או מיטוכונדריה קשורה ל-ER עם תווית MAM 9X (איור 1B). ניתוח כמותי חשף גם הבדלים דרמטיים בין התנועות הכוללות והנסיגה של המיטוכונדריה המקושרת ל-ER המיוצבת על ידי MAM 1X בהשוואה למיטוכונדריה החופשית (Mito-RFP) או מיוצבת MAM 9X. בעוד ש-53.82% ±-3.3% מהמיטוכונדריה נטולת ה-ER (Mito-RFP) היו ניידים, רק 26.6% ±-3.4% מהמיטוכונדריה המסומנים ב-MAM 1X היו ניידים, מה שמצביע על כך שהייצוב של ה-MAMs הפחית באופן משמעותי את הניידות האקסונלית הכוללת של המיטוכונדריה, הקשורה באופן הדוק ל-ER, בהשוואה למיטוכונדריה לא קשורה או קשורה באופן רופף ל-ER (44.79% ±-2.6% מ-MAM 9X לעומת 53.82% ±-3.3% מ-Mito RFP, בהתאמה) (איור 1C). באופן עקבי, הן התנועות הרטרוגרדיות והן האנטרוגרדיות של מיטוכונדריה קשורות ל-ER המסומנות על ידי MAM 1X היו נמוכות משמעותית בהשוואה למיטוכונדריה החופשית (Mito-RFP) (רטרוגרד: 12.33% ±-2.55% עבור MAM 1X לעומת 25.78% ±-2.31% עבור Mito RFP; אנטרוגרד: 14.27% ±-2.81% עבור MAM 1X לעומת 28.04% ±-2.48% עבור Mito RFP) (איור 1D ו-E). טבלה 3 מספקת את המהירויות האקסונליות המדויקות של המיטוכונדריה החופשית או אלה הקשורות בחוזקה או באופן רופף ל-ER. ערכים אלה יכולים לשמש כאמצעי כמותי יוצא דופן להערכת מידת ייצוב ה-MAM הנעה בין ה-MAMs ההדוקים והרופפים, מה שמוביל להפחתת ייצור ה-Ab. שיעורי ההובלה האקסונלית המיטוכונדריאלית עם ייצוב ה-MAMs ההדוקים והרופפים בתאי ReN נאיביים שיקפו את דפוסי ההובלה שנצפו בתאי עצב ReN GA (איור 1F-G). התוצאות העקביות בין נוירוני ReN נאיביים לבין נוירוני ReN GA AD המבטאים APPSwe/Lon מצביעות על כך שההשפעה על הובלה אקסונלית מיוחסת בעיקר למצב של ייצוב MAM, ללא תלות בנוכחות APPSwe/Lon או ייצור Aβ כתוצאה מכך.
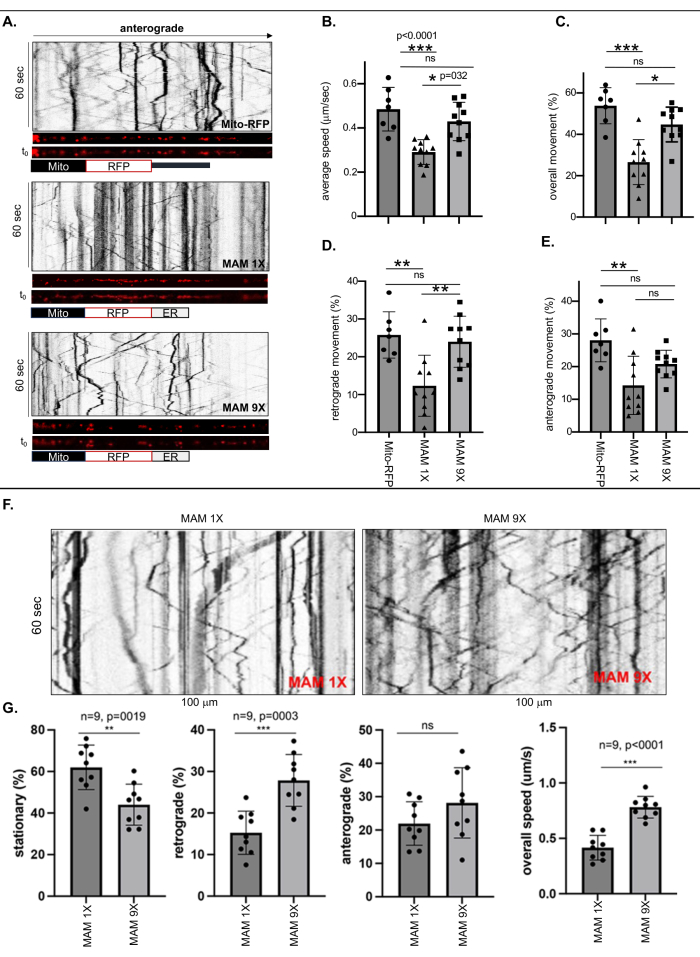
איור 1: ייצוב של MAMs על ידי MAM 1X הפחית את המהירות והתנועה הממוצעת (כוללת, נסיגה ואנטרוגרדית) של מיטוכונדריה קשורה ל-ER באקסונים של ReN GA מובחן ותאי ReN נאיביים. (A) קימוגרפים מייצגים של הפונקטה המסומנת ב-RFP המייצגת מיטוכונדריה חופשית (Mito-RFP) או מיטוכונדריה קשורה-ER המיוצבת על ידי MAM 1X (MAMs הדוקים, רוחב מגע של 6 ננומטר ± 1 ננומטר) או MAM 9X (MAMs רופפים, רוחב מגע של 24 ננומטר ± 3 ננומטר) בתוך אקסונים (~100 ננומטר). (ב-ה) ניתוח כמותי של (B) המהירות והתנועה הממוצעת [(C) בסך הכל, (D) נסיגה, ו-(E) אנטרוגרדית] של Mito-RFP, MAM 1X או MAM 9X בתוך אקסונים של תאי Ren-GA מובחנים של 10 ימים. n>7; בוצע ANOVA דו-כיווני. *עמ' < 0.05, **עמ' < 0.001. נציג של שלושה ניסויים עצמאיים. (F) קימוגרפים מייצגים של התנועה של MAM 1X או MAM 9X בתוך אקסונים של תאי ReN נאיביים מובחנים של 10 ימים. (G) ניתוח כמותי של אחוז (%) תנועה (נייחת, נסיגה ואנטרוגרדית) ומהירות כוללת (מיקרומטר/שנייה; מיקרומטר/שנייה) של MAMs מיוצבים MAM 1X או MAM 9X בתוך האקסונים של תאי ReN נאיביים. n = 9; בוצע ANOVA דו-כיווני. עמ' < 0.0001. נתון זה הותאם באישור של Zellmer et al.17. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תמונות תאים חיים של אקסונים של תאי ReN נאיביים המבטאים MAM 1X או MAM 9X. תמונות וידאו מייצגות של תאים חיים המציגות את תנועות ה-MAMs המיוצבות על ידי MAM 1X או MAM 9X בתוך אקסונים באורך 100 מיקרומטר של תאי ReN ממוינים המבטאים GFP למשך 10 ימים. n > 10 תמונות מניסויים כפולים. החצים מצביעים על הובלה אנטרוגרדית. סרגל קנה מידה: 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מגיב | ריכוז סופי | כמות |
| DMEM עם L-גלוטמין | לא ישים | 500 מ"ל |
| הפארין | 2 מיקרוגרם/מ"ל | 0.5 מ"ל |
| ב27 | 1x | 10 מ"ל |
| bFGF | 20 ננוגרם/מ"ל | 0.4 מ"ל |
| EGF | 20 ננוגרם/מ"ל | 0.5 מ"ל |
| פניצילין/סטרפטומיצין | 100 יחידות/מ"ל | 5 מ"ל |
| סך | 516.4 מ"ל | |
| סנן מדיה לפני הוספת פניצילין/סטרפטומיצין. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס למשך עד חודש. | ||
טבלה 1: הרכב אמצעי הרחבה.
| מגיב | ריכוז סופי | כמות |
| DMEM עם L-גלוטמין | לא ישים | 500 מ"ל |
| הפארין | 2 מיקרוגרם/מ"ל | 0.5 מ"ל |
| ב27 | 1x | 10 מ"ל |
| פניציליון/סטרפטומיצין | 100 יחידות/מ"ל | 5 מ"ל |
| סך | 515.5 מ"ל | |
| סנן מדיה לפני הוספת פניצילין/סטרפטומיצין. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס עד חודש | ||
טבלה 2: הרכב אמצעי התמיינות.
| ReN GA | ReN (נאיבי) | ReN GA (תלת מימד) | |||||
| בסך הכל (%) | נסיגה (%) | אנטרוגרדי (%) | מהירות ממוצעת (מ"מ לשנייה) | Ab40 (חלקיקים לדקה) | Ab42 (pM) | ||
| מיטו-RFP | 53.82 ± 3.3% | 25.78 ± 2.31% | 28.04 ± 2.48% | 0.66 ± 0.03 | 0.69 ± 0.07 | 241.7 ± 26.74 | 13.77 ± 1.52 |
| MAM 1X | 26.6 ± 3.4% *** | 12.33 ± 2.5% *** | 14.27 ± 2.81% *** | 0.3 ± 0.02*** | 0.43 ± 0.04*** | 377.2 ± 76.87* | 26.62 ± 3.86* |
| מאם 9X | 44.79 ± 2.6% NS | 23.99 ± 2.17%ns | 20.80 ± 1.33%ns | 0.59 ± 0.02 ns | 0.62 ± 0.02 ns | 158.8 ± 3.27* | 17.01 ± 2.02* |
טבלה 3: ניתוח כמותי. הדמיה של תאים חיים וניתוח כמותי מבוסס קימוגרפיה של המהירות הממוצעת (מהירות) והתנועות האקסונליות (כולל, נסיגה ואנטרוגרדית) של Mito-RFP, MAM 9X ו-MAM 1X. ANOVA דו-כיווני בוצע עבור מהירות אקסונלית או תנועה (%). n = 9. עבור Aβ, בוצעה ANOVA חד-כיוונית רגילה; n = 3, שלושה ניסויים בלתי תלויים. המובהקות נמדדת כנגד תאי ReN GA לא טרנספקטים (בקרה). **עמ' < 0.0001; *עמ' < 0.05; לא משמעותי (ns). טבלה זו הותאמה באישור של Zellmer et al.17.
קובץ קידוד משלים 1: הקוד להפקה, מעקב ומדידה של נתוני הקימוגרף. אנא לחץ כאן להורדת קובץ זה.
Discussion
עיכוב של קולטן סיגמא-1 (S1R) הפחית את ייצוב ה-MAM בתהליכים העצביים והפחית באופן דרמטי (~90%) את יצירת ה-Aβ מאקסונים אך לא מסומה של מערכת תרבית תלת מימדית (תלת מימדית) של תאי אב עצביים אנושיים (ReN) המבטאים מוטציות משפחתיות של AD [FAD] בגן חלבון מבשר עמילואיד [APP] (ReN GA)23,24,25,27. מייצבי MAM מכוננים מסומנים RFP (MAM 1X ו-MAM 9X) המיועדים לייצב MAMsהדוקים (6 ננומטר ± 1 ננומטר) ורופפים (24 ננומטר ± 3 ננומטר) הם כלים יוצאי דופן למדידה כמותית של ייצוב MAT. שני המייצבים לא רק מציגים ביטוי שווה ויציב בתאי ReN GA המובחנים במטריצה תלת מימדית במשך ~10 ימים, אלא גם זיהו MAMs בפונקטה בדידה בסומה ובאקסונים. והכי חשוב, בעוד שהביטוי היציב של MAM 1X ב-3D ReN GA מועשר ב-FACS הגדיל משמעותית את יצירת ה-Aβ, לביטוי MAM 9X לא הייתה השפעה17. בדקנו גם את ההשפעה של מייצב MAM מכונן המכיל 18 חומצות אמינו (MAM 18X) המזהה ומייצב MAMs >25 ננומטר. בניגוד ל-MAM 1X או MAM 9X, MAM 18X סומן באופן בלעדי כ-MAMs סומליים. נוירוני ReN GA מועשרים ב-FACS המבטאים 18X, הפחיתו את דור Aβ17. ממצאים אלה הציעו את האפשרות של סף יציבות MAM שנקבע על ידי רוחב הפער שלהם שנע בין MAMs הדוקים פתוגניים (הגדלת ייצור Aβ) ל-MAMs רופפים לא פתוגניים (שמירה או הפחתת ייצור Aβ). מציאת מודולטור MAM יעיל והריכוז האופטימלי שלו שיכול להשיג את ייצוב ה-MAM האופטימלי הנדרש כדי לחצות את הסף מ-MAMs פתוגניים ולא פתוגניים יחשוף דרך טיפולית יוצאת דופן להורדת Aβ אקסונלי או עצבי דור במוח.
שלוש גישות שונות הופעלו לפיתוח מאפנני MAM: (1) מודולטורים המכוונים לחלבוני קשירה של MAM, (2) מודולטורים המשנים את רמות הביטוי של חלבונים תושבי MAM, ו-(3) מודולטורים של מבני MAM18. למרות גישות אלה, המכשול העיקרי במציאת מודולטורים יעילים לייצוב MAM הוא היעדר שיטות למדידה כמותית של מידת ייצוב ה-MAM. לטכניקות מסורתיות כמו מיקרוסקופ אלקטרונים (EM) או מיקרוסקופיה ברזולוציה גבוהה יש מגבלות בלכידת שינויים בזמן אמת או מתן פירוט מספיק כדי להעריך את הייצוב של MAM (נסקרב-28).
השיטה המתוארת כאן תתגבר על המכשול ותספק תובנות מפתח לגבי הקשר בין ייצוב MAM לייצור Aβ. התוצאות מראות כי MAMs בעובי של 6 ננומטר ± 1 ננומטר, המציגים תנועה כוללת של 26.6% ±-3.4% (טבלה 3), קשורים ליצירת Aβ. לעומת זאת, MAMs בעובי של 24 ננומטר ±-3 ננומטר, המציגים תנועה כוללת של 44.79% ±-2.6% (טבלה 3), אינם משפיעים על יצירת Aβ. התנועה הכוללת של המיטוכונדריה (Mito-RFP) הייתה 53.82% ±-3.3%. בהתחשב בכך שעובי MAM נע בדרך כלל בין 6 ננומטר ל-80 ננומטר, ממצאים אלה מתארים את הגבולות העליונים והתחתונים של ייצוב MAM ביחס לייצור Aβ. כתוצאה מכך, שיטה זו יכולה להנחות את הזיהוי והאופטימיזציה של מודולטור/ים לייצוב MAM. המטרה תהיה לשנות את התנועה הכוללת של MAMs מ-26.6% ±-3.4% ל-53.82% ±-3.3%, או את המהירות הממוצעת שלהם מ-0  . 4 מיקרומטר לשנייה ל-0
. 4 מיקרומטר לשנייה ל-0  . 7 מיקרומטר לשנייה (טבלה 3), ולמקם מודולטורים כאלה כסוכנים טיפוליים פוטנציאליים כנגד ייצור Aβ.
. 7 מיקרומטר לשנייה (טבלה 3), ולמקם מודולטורים כאלה כסוכנים טיפוליים פוטנציאליים כנגד ייצור Aβ.
השימוש במאפנני MAM מכוננים המכילים מקשרים סינתטיים באורכים הולכים וגדלים (0-18 חומצות אמינו) הוא שיטה רבת עוצמה לקביעה כמותית של סף ייצוב ה-MAM כדי להעביר את ייצוב ה-MAM לכזה ששומר או אולי מוריד בניגוד להגברת ייצור Aβ. עם זאת, כדי להעריך את היעילות או היעילות של מאפנני MAM, יידרשו מייצבי MAM הניתנים להשראה. קיימים מייצבי MAM מבוססי מיקרוסקופיית הדמיה לכל החיים (FRET/FLIM) המבוססים על מיקרוסקופיית תהודה Förster הניתנת להשראה שהם פלסמידים המקודדים רצף מיקוד OMM התמזג YFP של mAKAP1 (34-63) ופוספטאז Sac1 מכוון ER התמזג CFP (521-587). יתר על כן, המייצבים המכוננים עשויים שלא לייצג את ה-MAMs הפיזיולוגיים, בעוד שמייצבי FRET/FLIM MAM, לעומת זאת, יזהו את ה-MAMs הפיזיולוגיים. ניתן להשתמש גם בבדיקות GFP המפוצלות שבהן GFP מפוצל לשני מקטעים לא פלואורסצנטיים הקשורים לחלבוני ER או מיטוכונדריאלים תושבים ER-GFP (1-10) ו-Mito-GFP11 המייצרים השלמה פלואורסצנטית ביו-מולקולרית (BiFC) עם היווצרות MAMs27. למרות ששברי ה-GFP נוטים להרכבה ספונטנית, ל-BiFC יש את הקריאה הפשוטה ביותר, האות הברור ביותר והכי פחות ניתוח הקשור לרעש. יתר על כן, האינטראקציה בין ה-GFP המפוצל היא הפיכה מאוד28, ולכן היתרונות שלהם עולים על החסרונות והופכים את שיטת ה-BiFC למתאימה לזיהוי מודולטורים של ייצוב MAM.
Acknowledgements
אנו מודים לד"ר György Hajnóczky, פרופסור באוניברסיטת תומאס ג'פרסון, פילדלפיה על שסיפק לנו בנדיבות פלסמידים המקודדים RFP-Mito, MAM 1X, MAM 9X ו-MAM 18X. תודה מיוחדת לד"ר לאי דינג, מדען הדמיה בכיר, בית החולים בריגהם ונשים על שעזר לנו לכתוב את הקוד להפקה, מעקב ומדידה של נתוני הקימוגרף. מחקר זה נתמך על ידי קרן ריפוי אלצהיימר ל-RB ומענק NIH 5R01NS045860-20 ל-RET.
Materials
| Name | Company | Catalog Number | Comments |
| 6 Well Glass Bottom Plate | Cellvis | P06-1.5H-N | |
| B-27 Supplement (50X), serum free | Gibco/Thermo Fisher Scientific | 17504044 | |
| bFGF | R&D System | 233-FB | |
| BSA | Fisher Scientific | 501781532 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| DMEM/F12 with L-glutamine | Gibco/Thermo Fisher Scientific | 11320-033 | |
| EDTA | Life Technologies | 41116134 | |
| EGF | Sigma-Aldrich | 92090408 | |
| Falcon 6 Well Plates | VWR International | 41122107 | |
| GAPDH Polyclonal Antibody | Thermo Fisher Scientific | PA1-988 | |
| Gelatin | VWR International | 9000-70-8 | |
| Graphpad Prism N/A | Prism 9, version 9.5.0 | N/A | |
| Heparin | Sigma-Aldrich | H0200000 | |
| ImageJ Software | ImageJ 1.53a | N/A | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| mCherry Polyclonal Antibody | Invitrogen | PA5-34974 | |
| MS Excel | Microsoft Excel, version 2302 | N/A | |
| Multi-array electrochemiluminescence assay kit | Meso Scale Diagnostics (MSD) | K15200E-2 | V-PLEX Aβ Peptide Panel 1 (6E10) kit |
| NaCl | Fisher Scientific | 7647145 | |
| NuPAGE 4–12% Bis-Tris gel | Invitrogen | NP0321BOX | |
| Penicillin/Streptomycin/Amphotericin B | Lonza | 17-745E | |
| Photoshop | Adobe Photoshop CC 20.0.10 | N/A | |
| Rat Neuron Nucleofector Kit | Lonza | VPG-1003 | |
| StemPro Accutase | Gibco | A1110501 | |
| Tris-HCL, pH 7.6 | Boston BioProducts | 42000000 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Fisher Scientific | 501657287 |
References
- Giacomello, M., Pellegrini, L. The coming of age of the mitochondria-ER contact: a matter of thickness. Cell Death Differ. 23 (9), 1417-1427 (2016).
- Degechisa, S. T., Dabi, Y. T., Gizaw, S. T. The mitochondrial associated endoplasmic reticulum membranes: A platform for the pathogenesis of inflammation-mediated metabolic diseases. Immun Inflamm Dis. 10 (7), e647 (2022).
- Schon, E. A., Area-Gomez, E. Mitochondria-associated ER membranes in Alzheimer disease. Mol Cell Neurosci. 55, 26-36 (2013).
- Erpapazoglou, Z., Mouton-Liger, F., Corti, O. From dysfunctional endoplasmic reticulum-mitochondria coupling to neurodegeneration. Neurochem Int. 109, 171-183 (2017).
- Sala-Vila, A., et al. Interplay between hepatic mitochondria-associated membranes, lipid metabolism and caveolin-1 in mice. Sci Rep. 6, 27351 (2016).
- Fujimoto, M., Hayashi, T. New insights into the role of mitochondria-associated endoplasmic reticulum membrane. Int Rev Cell Mol Biol. 292, 73-117 (2011).
- Hung, V., et al. Proteomic mapping of cytosol-facing outer mitochondrial and ER membranes in living human cells by proximity biotinylation. eLife. 6, e24463 (2017).
- Area-Gomez, E., Schon, E. A. On the pathogenesis of Alzheimer's disease: The MAM hypothesis. FASEB J. 31 (3), 864-867 (2017).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280 (5370), 1763-1766 (1998).
- Sukhorukov, V. S., et al. Molecular mechanisms of interactions between mitochondria and the endoplasmic reticulum: A new look at how important cell functions are supported. Mol Biol. 56 (1), 59-71 (2022).
- Zhang, P., Konja, D., Zhang, Y., Wang, Y. Communications between Mitochondria and endoplasmic reticulum in the regulation of metabolic homeostasis. Cells. 10 (9), 2195 (2021).
- Ziegler, D. V., Martin, N., Bernard, D. Cellular senescence links mitochondria-ER contacts and aging. Commun Biol. 4 (1), 1323 (2021).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. J Cell Biol. 174 (7), 915-921 (2006).
- Cieri, D., et al. SPLICS: a split green fluorescent protein-based contact site sensor for narrow and wide heterotypic organelle juxtaposition. Cell Death Differ. 25 (6), 1131-1145 (2018).
- Carpio, M. A., et al. BOK controls apoptosis by Ca(2+) transfer through ER-mitochondrial contact sites. Cell Rep. 34 (10), 108827 (2021).
- Prudent, J., et al. MAPL SUMOylation of Drp1 stabilizes an ER/mitochondrial platform required for cell death. Mol Cell. 59 (6), 941-955 (2015).
- Zellmer, J. C., Tarantino, M. B., et al. Stabilization of mitochondria-associated endoplasmic reticulum membranes regulates Abeta generation in a three-dimensional neural model of Alzheimer’s disease. Alzheimer’s Dement. , 1-20 (2024).
- Magalhaes Rebelo, A. P., et al. Chemical modulation of mitochondria-endoplasmic reticulum contact sites. Cells. 9 (7), 1637 (2020).
- Berger, S. I., Iyengar, R. Role of systems pharmacology in understanding drug adverse events. Wiley Interdiscip Rev Syst Biol Med. 3 (2), 129-135 (2011).
- Friedman, J. R., Webster, B. M., Mastronarde, D. N., Verhey, K. J., Voeltz, G. K. ER sliding dynamics and ER-mitochondrial contacts occur on acetylated microtubules. J Cell Biol. 190 (3), 363-375 (2010).
- Wu, Y., et al. Contacts between the endoplasmic reticulum and other membranes in neurons. Proc Natl Acad Sci U S A. 114 (24), E4859-E4867 (2017).
- Cagin, U., et al. Mitochondrial retrograde signaling regulates neuronal function. Proc Natl Acad Sci U S A. 112 (44), E6000-E6009 (2015).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Kim, Y. H., et al. A 3D human neural cell culture system for modeling Alzheimer's disease. Nat Protoc. 10 (7), 985-1006 (2015).
- Kwak, S. S., et al. Amyloid-beta42/40 ratio drives tau pathology in 3D human neural cell culture models of Alzheimer's disease. Nat Commun. 11 (1), 1377 (2020).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39 (1), 121-132 (2010).
- Bhattacharyya, R., et al. Axonal generation of amyloid-beta from palmitoylated APP in mitochondria-associated endoplasmic reticulum membranes. Cell Rep. 35 (7), 109134 (2021).
- Tebo, A. G., Gautier, A. A split fluorescent reporter with rapid and reversible complementation. Nat Commun. 10 (1), 2822 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved