Method Article
التحليل الكمي لاستقرار غشاء الشبكة الإندوبلازمية المرتبط بالميتوكوندريا (MAM) في نموذج عصبي لمرض الزهايمر (AD)
In This Article
Summary
هنا ، نصف قياس معدل النقل المحوري للمثبتات التأسيسية لأغشية الشبكة الإندوبلازمية المرتبطة بالميتوكوندريا (ER) عن طريق زيادة أو الحفاظ على توليد β-أميلويد (Aβ) السامة للأعصاب من الخلايا العصبية لمرض الزهايمر (AD) في الوقت الفعلي لتكون بمثابة مقياس مباشر وكمي لقياس استقرار MAM والمساعدة في تطوير علاجات مرض الزهايمر.
Abstract
يتم هنا عرض طريقة لقياس استقرار أغشية الشبكة الإندوبلازمية المرتبطة بالميتوكوندريا (MAMs) في نموذج عصبي ثلاثي الأبعاد (3D) لمرض الزهايمر (AD). للبدء ، تزرع خلايا ReN السلفية العصبية البشرية الجديدة التي تعبر عن بروتين سلائف الأميلويد β (APP) الذي يحتوي على مرض الزهايمر العائلي (FAD) أو خلايا ReN الساذجة في صفائح زراعة الأنسجة الرقيقة (1: 100) المغلفة ب Matrigel. بعد أن تصل الخلايا إلى التقاء ، يتم تكوينها بالكهرباء باستخدام بلازميدات التعبير التي تشفر تسلسل ربط الميتوكوندريا المترافق بالبروتين الأحمر (RFP) ل AKAP1 (34-63) (Mito-RFP) الذي يكتشف الميتوكوندريا أو مثبتات MAM التأسيسية MAM 1X أو MAM 9X التي تستقر بإحكام (6 نانومتر ± عرض فجوة 1 نانومتر) أو فضفاضة (24 نانومتر ± عرض فجوة 3 نانومتر) MAMs ، على التوالي. بعد 16-24 ساعة ، يتم حصاد الخلايا وإثرائها بواسطة فارز الخلايا المنشط بالفلورة (FACS). يتم زرع عدد متساو من الخلايا المخصبة ب FACS في المصفوفة ثلاثية الأبعاد (1: 1 Matrigel) ويسمح لها بالتمايز إلى خلايا عصبية ناضجة لمدة 10 أيام. يتم التقاط صور الخلايا الحية للخلايا المتمايزة لمدة 10 أيام التي تعبر عن مثبتات MAM المترافقة ب RFP تحت مجهر فلوري مجهز بغرفة ثقافة تصوير الخلايا الحية تحافظ على ثاني أكسيد الكربون2 (5٪) ودرجة الحرارة (37 درجة مئوية) والرطوبة (~ 90٪). تحقيقا لهذه الغاية ، أجرينا تصوير الخلايا الحية وتحليلات التصوير الحركي لقياس حركة الميتوكوندريا الحرة المسماة ب Mito-RFP أو الميتوكوندريا المرتبطة ب ER ذات عرض الفجوة الضيقة أو الفضفاضة التي تم تثبيتها بواسطة MAM 1X أو MAM 9X ، على التوالي ، في العملية العصبية الأكثر امتادا لكل خلية عصبية ReN GA التي لا يقل طولها عن 500 نانومتر ، مع الأخذ في الاعتبار هذه المحاور.
Introduction
تشير الأدلة الناشئة إلى أن اتصالات الشبكة الإندوبلازمية المتخصصة المرتبطة بالميتوكوندريا (MERCs) ، والتي يتم حصادها كيميائيا حيويا باسم أغشية ER المرتبطة بالميتوكوندريا ، والتي يشار إليها غالبا باسم MAMs1،2 تلعب دورا في العديد من الأمراض التنكسية العصبية ، بما في ذلك AD3،4. تتكون هذه MAMs من مجالات دقيقة تشبه طوف الدهون الغنية بالكوليسترول في غرفة الطوارئ والغشاء الخارجي للميتوكوندريا المربوطة بسلسلة من البروتينات التي تخلق تنوعا هيكليا ووظيفيا بين MAMs5،6،7. تفترض فرضية MAM التي تمت صياغتها مؤخرا أن زيادة MAMs تؤدي إلى تعزيز إنتاج Aβ والسلسلة المسببة للأمراض من مرض الزهايمر ، بما في ذلك تكوين التشابك الليفي العصبي (NFT) ، وخلل التباطؤ في الكالسيوم ، والالتهاب العصبي3،8. حوالي 5٪ -20٪ من الميتوكوندريا تتواصل جسديا مع غرفة الطوارئ لتشكيل MAMs9. يتم تحديد عرض الفجوة في MAMs بواسطة ER السلس والخشن (sER و rER ، على التوالي). يشير عرض الفجوة المتغير بين sER-mitochondria (10-50 نانومتر) و rER-mitochondria (50-80 نانومتر) إلى أن عرض الفجوة في MAMs له طيف طويل يتراوح بين ضيق (~ 10 نانومتر) إلى فضفاض (~ 80 نانومتر) 10،11،12،13. يحدد عرض فجوة MAM وظائف MAM ، مثل توازن الكالسيوم ونقل الدهون1،14. أظهر تقرير حديث أن MAMs المتكونة بين ER المتصلة بإحكام (~ 10 نانومتر) والميتوكوندريا ، والتي تسمى MAMs الكاملة ، هي موت الخلايا المبرمج. في المقابل ، فإن MAMs التي تشكلت بين ER متصلة بشكل فضفاض (~ 25 نانومتر) والميتوكوندريا ، والتي تسمى MAMs المعيبة أو المتوسطة ، هي مضادة لموت الخلايا المبرمج14،15،16. أدى تثبيت MAMs بعرض فجوة 6 نانومتر ± 1 نانومتر إلى زيادة توليد Aβ من نموذج ثقافة عصبية ثلاثي الأبعاد (ثلاثي الأبعاد) من AD. في المقابل ، فإن تثبيت MAMs بعرض فجوة 24 نانومتر ± 3 نانومتر ليس له أي تأثير على الجيل Aβ17. تشير هذه النتيجة لأول مرة إلى أن تنظيم درجة استقرار MAM ، ولكن ليس مزعزعة استقرار MAMs ، هو المفتاح لتنظيم توليد Aβ. قد يكون لمحاولة زعزعة استقرار MAMs تماما عواقب غير مرغوب فيها لأن MAMs تحافظ على العديد من الأحداث الخلوية الحاسمة لبقاء الخلية12.
يعد تعديل MAMs مجالا بحثيا ناشئا له آثار محتملة على اضطرابات مختلفة ، بما في ذلك السرطان واضطرابات التمثيل الغذائي والأمراض التنكسيةالعصبية 18. على الرغم من توفر العديد من معدلات MAM ، لم يتم اتخاذ أي محاولة كبيرة حتى الآن لاختبار قدراتها على زعزعة استقرار MAM وتقليل أمراض AD ، ويرجع ذلك أساسا إلى أن التنوع الهيكلي ل MAM يجعلها نظاما معقدا للغاية لاستهداف اكتشاف الأدوية. ولكن ، فإن علم الأدوية للأنظمة الهيكلية المطورة حديثا ، والذي يأخذ في الاعتبار الخصائص المحددة لأهداف الدواء وبيئتها18،19 يجب أن يتغلب على الصعوبات ويطور أدوية عالية الفعالية تستهدف MAMS أو البروتينات المرتبطة ب MAM في AD. ومع ذلك ، فإن البحث عن معدل فعال لتثبيت MAM يتطلب طرقا لتحديد درجة استقرار MAM بدقة. التقنيات التقليدية مثل المجهر الإلكتروني (EM) أو الفحص المجهري فائق الدقة لها قيود في تحديد استقرار MAM. من المحتمل أن يتطلب التغلب على هذه التحديات تطوير تقنيات تصوير جديدة أكثر ديناميكية أو فحوصات كيميائية حيوية يمكن أن توفر مقاييس كمية لتثبيت MAM في الخلايا الحية. كشف المجهر الإلكتروني لمسح الحزمة الأيونية المركزة (FIB-SEM) للخلايا العصبية الأولية أن ER يميل إلى تكوين شبكة حول الميتوكوندريا من المحتمل أن يحد من حركة الميتوكوندريا20،21. كان لاضطراب أنظمة نقل الميتوكوندريا ، سواء كانت رجعية أو متقدمة أو كليهما ، تأثير عميق على الوظيفة المشبكية والعصبية22. وبالتالي ، فإن التصوير الجديد للخلايا الحية والتحليل القائم على التصوير الوكيموغرافي للسرعة المحورية للميتوكوندريا المرتبطة ب ER الموصوفة هنا كمقياس لقياس استقرار MAM كميا سيسهل تحديد معدل (مغيرات) MAM الذي يمكنه تحويل عتبة تثبيت MAM إلى عتبة يحافظ على أو ربما يقلل بدلا من زيادة توليد Aβ.
Protocol
نماذج الثقافة العصبية AD: استخدمت هذه الدراسة الخلايا العصبية المشتقة من خلايا ReN السلفية العصبية البشرية [ReN الساذجة (Millipore)] أو خلايا ReN التي تعبر عن طفرات AD العائلية (fAD) في جين بروتين سلائف الأميلويد (APP) (APPSwe / Lon) ، خلايا ReN GA. يلخص نظام الثقافة ثلاثي الأبعاد (3D) ReN-GA أمراض مرض الزهايمر ، وهي التشابك الليفي العصبي (NFTs) الذي يحركها القلة Aβ 23،24. خلايا ReN الساذجة متاحة تجاريا. تم الحصول على خطوط ReN GA من الدكتور دو واي كيم ، أستاذ مشارك ، مستشفى ماساتشوستس العام (MGH) 23،24،25.
بلازميدات التعبير: AKP1 (34-63) وتسلسل استهداف ER لبروتينات Ubc 6 (283-303) المرتبطة مباشرة ب RFP (Mito-RFP-ER يشار إليها باسم MAM 1X) أو تحتوي على رابط 9 أحماض أمينية (Mito-9X-RFP-ER يشار إليه باسم MAM 9X) مصمم لتثبيت MAMs من 6 نانومتر ± 1 نانومتر أو 24 نانومتر + 3 نانومتر عرض الفجوة ، على التوالي15،26 (الشكل 1 أ).
1. التثقيب الكهربائي
- نقل الخلايا بمثبتات MAM (1-2 ساعة)
ملاحظة: اتبع البروتوكول الموصوف من قبل الشركة المصنعة لمجموعة nucleofector (جدول المواد). قبل البدء ، قم بإعداد أطباق ثقافة ذات قاع زجاجي من 6 آبار مغطاة مسبقا ب DMEM / F12 تحتوي على 1٪ Matrigel (يشار إليها من الآن فصاعدا باسم مصفوفة الغشاء القاعدي [BMM]). استخدم 2 مل من BMM لتغليف كل بئر. احتضنها لمدة ساعة واحدة على الأقل عند 37 درجة مئوية. يجب تبريد جميع BMM والوسائط وأطراف الماصات والماصات مسبقا قبل الخلط لمنع BMM من التصلب.- استنشق خليط BMM. استبدل ب 2 مل من درجة حرارة الغرفة (RT) DMEM / F12 في كل بئر.
- اجمع بين Nucleofector مع الملحق 1 بنسبة 4.5: 1 (82 ميكرولتر: 18 ميكرولتر من نسبة Nucleofector / Supplement ل 100 ميكرولتر من المحلول). لكل تعداء مرغوب فيه ، هناك حاجة إلى 100 ميكرولتر من Nucleofector.
- الحمض النووي الدوامة. ثم أضف 1-5 ميكروغرام من الحمض النووي (لكل معالجة) في أنابيب الطرد المركزي الدقيقة سعة 1 مل لكل تعداد.
- استخدم أكوستاز لحصاد صفيحة من خلايا ReN-GA السليمة.
ملاحظة: خلايا الصفائح في وسائط التمدد (الجدول 1) في أطباق زراعة الأنسجة مقاس 100 مم وانتظر حتى يصل الالتقاء إلى 70-80٪.- استنشق الوسائط الموجودة واغسلها مرة واحدة باستخدام 10 مل من PBS.
- أضف 1 مل من أكوتاز مباشرة إلى الخلايا واحتضنه لمدة 5-10 دقائق عند 37 درجة مئوية.
- قم بإزاحة الخلايا من الطبق عن طريق النقر برفق على جانب الطبق. تحقق تحت المجهر للتأكد من أن الخلايا مرتخة وتتدفق بحرية.
- قم بتحييد أكوتاز ب 10 مل من DMEM / F12 وانقله إلى أنبوب نظيف سعة 15 مل.
- جهاز الطرد المركزي العدد المطلوب من الخلايا عند 274 × جم لمدة 5 دقائق وشفط المادة الطافية لإزالة الخلايا الميتة. ثم, أعد تعليق الحبيبات في 10 مل من DMEM / F12.
- عد الخلايا لتحديد الكثافة.
ملاحظة: في هذه الدراسة ، تم استخدام عداد خلوي آلي لحساب عدد الخلايا. لكل التثقيب الكهربائي ، هناك حاجة إلى 3-5 × 106 خلايا (على سبيل المثال ، تتطلب 5 علاجات 15-25 × 106 خلايا).- خذ 10 ميكرولتر من الخلايا العالقة وأضفها إلى الجانب A من غرفة عد الخلايا. ثم أضف 10 ميكرولتر إلى الجانب B.
ملاحظة: أضف تعليق الخلية عن طريق تحريك الماصة بزاوية إلى الجانب. تجنب الفقاعات من خلال عدم تجاوز المحطة الأولى على مكبس الماصة. - خذ غرفة العد المملوءة إلى عداد الخلايا وأدخل الجانب A في الفتحة الرئيسية في المقدمة.
- بعد الضغط على القياس ، لاحظ عدد الخلايا لكل مل.
- أخرج الغرفة ، واقلبها إلى الجانب B ، وكرر الخطوات 1.1.5.2-1.1.5.3.
- اجمع هذين الرقمين معا ، ثم اقسم على 4 (إذا لم يكن باستخدام Trypan Blue) ، ثم اضرب الرقم في المليلتر من السائل الذي تم تعليق الخلايا فيه للحصول على العدد الإجمالي للخلايا في المعلق.
- خذ 10 ميكرولتر من الخلايا العالقة وأضفها إلى الجانب A من غرفة عد الخلايا. ثم أضف 10 ميكرولتر إلى الجانب B.
- جهاز الطرد المركزي العدد المطلوب من الخلايا عند 274 × جم لمدة 5 دقائق وشفط المادة الطافية.
- أعد تعليق الحبيبات في 100 ميكرولتر من مزيج Nucleofector لكل تثقيب كهربائي. (على سبيل المثال ، 500 ميكرولتر ل 5 علاجات).
ملاحظة: يمكن أن يؤدي ترك الخلايا في محلول Nucleofector لمدة تزيد عن 15 دقيقة إلى تقليل قابلية الخلية للحياة والفعالية الإجمالية. - أضف 100 ميكرولتر من معلق الخلية إلى أحد الأنابيب التي تحتوي على الحمض النووي واخلطها عن طريق سحب العينات.
- انقل خليط الحمض النووي إلى كوفيت كهربائي وأغلقه بالغطاء المرفق. لتجنب تكوين فقاعات، قم بتوجيه الكوفيت لأسفل وقم بتدوير الماصة ببطء.
- حدد برنامج Nucleofector المناسب للجهاز المستخدم. بالنسبة للجهاز المستخدم في هذه الدراسة ، استخدم البرنامج A-033 للتعداد. للتحسين ، جرب جميع برامج Nucleofector الخمسة لتحديد الأنسب لكل نوع من أنواع الخلايا.
ملاحظة: تأكيد التثقيب الكهربائي الناجح هو رغوة مرئية في الجزء العلوي من الخليط. - على الفور، باستخدام الماصات المعقمة المرفقة، أضف ~ 500 ميكرولتر من DMEM من الصفيحة المكونة من 6 آبار مملوءة مسبقا إلى الكوفيت. تخلط برفق مرة واحدة ثم تنقل الخلايا الكهربائية والوسيط إلى البئر المقابل.
ملاحظة: بعد التثقيب الكهربائي، تكون الخلايا حساسة للغاية، لذا من الضروري نقل الوسائط بسرعة وسحب العينة بعناية. - كرر الخطوات 1.1.8-1.1.11 لجميع علاجات الحمض النووي المتبقية.
- احتضان الخلايا عند 37 درجة مئوية في وجود ثاني أكسيد الكربون2 (5٪) بين عشية وضحاها.
- في اليوم التالي ، تبادل الوسائط مع وسائط التمايز الجديدة (الجدول 2) واسمح للخلايا بالتمايز لمدة 10 أيام. كل 2-3 أيام ، استبدلها بوسائط جديدة.
2. تصوير الخلايا الحية
- تحضير الخلايا للفحص المجهري للخلايا الحية (30 دقيقة)
- تحضير غرفة الخلية الحية (قبل نقل الخلايا إلى الغرفة)
- تأكد منتوصيل خزان ثاني أكسيد الكربون 2 والمرطب بالغرفة ، وفتح الصمامات ، وملء الخزانات.
- اضبط درجة الحرارة على 37 درجة مئوية ، وثاني أكسيد الكربون2 إلى 5٪ ، والرطوبة على 95٪. (قد يستغرق هذا بعض الوقت حتى تتوازن المستويات).
- ضع صفيحة من 6 آبار تحتوي على خلايا في الغرفة واضبط تركيز المجهر حتى تصبح الخلايا مرئية.
- قم بتشغيل الليزر (جدول المواد).
- لالتقاط إشارة RFP ، قم بإثارة الفلوروفور باستخدام ليزر 594 نانومتر واستخدم انبعاث 570-640 نانومتر. بالنسبة إلى GFP ، استخدم ليزر 488 نانومتر للإثارة وانبعاث 510-540 نانومتر.
- باستخدام مرشح الفلورسنت المدمج ، اضبط شدة الإشارة حتى تتبدد إشارة الخلفية (يجب أن تكون سوداء صلبة تقريبا).
- التقاط فيديو مباشر للمحاور (10 ساعات - 15 ساعة في المجموع)
ملاحظة: تم استخدام مجهر متحد البؤر المقلوب من نيكون C2 Eclipse Ti2 لالتقاط صور الفلورسنت باستخدام برنامج NIS Element AR. استخدم تكبيرا بمعدل 60 ضعفا بدقة 512 بكسل ، والتقاط مقاطع فيديو بمعدل 1 إطار في الثانية لمدة 3 دقائق أنظف من التصوير الوغرافي أنظف.- ابحث عن خلية تعبر عن أجهزة الاستشعار الحيوية RFP. قم بتصدير صورة للخلية للرجوع إليها لاحقا قبل التقاط مقطع فيديو.
- قم بقص منطقة المسح لتلائم المحور العصبي. يقلل استخدام منطقة مسح أصغر من وقت معالجة المجهر ويجعل إنشاء التصوير الكيموغرافي أسهل بكثير.
- قم بإيقاف تشغيل جميع أجهزة الليزر لمساعدة البرنامج على العمل بسلاسة أكبر. يرجى ملاحظة أنه عند تشغيل البرنامج مع جميع أشعة الليزر نشطة ، لا يتم التقاط جميع الإطارات.
ملاحظة: إشارة الفلورسنت الحمراء من سوما أكثر إشراقا مما هي عليه في المحور العصبي. لذلك ، يتم استبعاد soma لزيادة شدة الإشارة الإجمالية في المحور العصبي. انتقل إلى علامة التبويب قياس الوقت . - اضبط الفاصل الزمني على 1 إطار في الثانية واضبط الوقت الإجمالي على 181 ثانية.
- انقر فوق تشغيل.
- احفظ هذا الملف كملف .nds (مسمى بشكل صحيح) وكرر العملية ~ 10 مرات لكل مثبتات MAM (MAM 1X أو MAM 9X).
ملاحظة: أنتجت قوة الليزر أحيانا تأثير تبييض ملحوظ على إشارة RFP إذا تم مسحها ضوئيا لفترة طويلة. من المهم مراعاة العمل بسرعة لالتقاط مقاطع الفيديو.
3. المعالجة اللاحقة (7 أيام)
ملاحظة: لتحليل النقل وإنشاء أجهزة الكيموغراف ، تم استخدام وحدات ماكرو Fiji ImageJ. تم تصنيف الحويصلات التي تحركت أقل من 0.1 مم / ثانية على أنها ثابتة. تم حساب تواتر حركة الجسيمات بقسمة عدد الجسيمات التي تتحرك في اتجاه معين (الأمامية ، الرجعية) أو غير المتحركة (الثابتة) على العدد الإجمالي للجسيمات التي تم تحليلها في التصوير الحاربي. تم حساب الوقت الذي تقضيه كل حويصلة في التوقف مؤقتا أو التحرك عن طريق حساب متوسط النسبة المئوية للوقت الذي تقضيه في كل حالة لجميع الحويصلات في كل خلية عصبية تم تحليلها. تم حساب توزيع التردد للسرعة وطول التشغيل باستخدام حويصلات متحركة فقط لكل حالة تجريبية. تم إجراء التحليل على المسالك المحورية 100 مم لمدة 3 دقائق.
- إنشاء مخطط حركي
- افتح ملف .nds في Fiji ImageJ.
- انتقل إلى علامة التبويب صورة وانقر فوق خصائص. سجل نسبة البكسل إلى الميكرون. هذا ضروري للحساب لاحقا.
- انقر فوق ملف > حفظ باسم > Tiff لحفظ الملف ك.tiff في مجلده (سيقوم الماكرو تلقائيا بحفظ كل شيء تم إنشاؤه في هذا المجلد).
- اسحب ماكرو Kymo إلى ImageJ. يتم توفير الرمز في ملف الترميز التكميلي 1. انقر فوق تشغيل.
- لا تضغط على "موافق". قم بالتبديل إلى نافذة MAX_raw. انقر يدويا بزر الماوس الأيسر على طول المحور العصبي وانقر نقرا مزدوجا لإنهاء التتبع.
ملاحظة: تأكد من تتبع المحور العصبي من soma حتى محطة المحور العصبي. بهذه الطريقة ستكون حسابات المقدمات والارتدادية صحيحة. - اضغط على الأمر T أو إضافة على مدير عائد الاستثمار.
- الآن انقر فوق موافق. سيتم إنشاء جهاز حركي في المجلد الذي تم إنشاؤه مسبقا. (المحور X هو طول المحور العصبي بالميكرون ، والمحور Y هو الوقت بالثواني).
- تتبع الكيموغراف
- اسحب الطابع الاحترافي إلى Fiji Image J (يجب وضعه تلقائيا في المجلد الذي تم إنشاؤه مسبقا).
- اسحب ماكرو المسار إلى الصورة J.
- في المطالبة التالية، انقر فوق موافق. إذا كنت تستأنف العمل من قبل، فأدخل نقطة الرقم للمتابعة منها ثم اضغط على موافق.
- باستخدام أداة Rectangle في لوحة Select ، حدد منطقة بالقرب من منتصف الكيموغراف يبلغ ارتفاعها 60 بكسل وعرضها دائما 100 ميكرومتر. للقيام بذلك ، اقسم 100 على نسبة البكسل إلى الميكرو التي تم تسجيلها في الخطوة 3.1.2.
- بعد تحديد منطقة، اضغط على Ctrl T لإضافة i t إلى عائد الاستثمار وحفظ عائد الاستثمار في المجلد الذي يتم العمل فيه (اضغط على المزيد في قائمة ROI ثم Save).
ملاحظة: سيؤدي عكس المنطقة المحددة بالضغط على Ctrl + Shift + I إلى تسهيل التتبع. - لتتبع حركة حويصلة فردية ، اضغط مع الاستمرار على Ctrl أثناء النقر بزر الماوس الأيسر من أعلى إلى أسفل.
- للقيام بذلك ، اضغط مع الاستمرار على Ctrl أثناء النقر بزر الماوس الأيمن وستظهر نافذة توضح مكان تتبع المحاور. إذا كان هذا يبدو جيدا، فاضغط على موافق.
- للمتابعة وتحديد حويصلة أخرى، انقر فوق نعم وكرر العملية من الخطوات 3.2.6-3.2.8. بمجرد تتبع كل حويصلة مرئية ، اضغط على لا. سيؤدي هذا تلقائيا إلى حفظ التراكب المتعقب يدويا في نفس المجلد.
- قياس بيانات التصوير الاحترافي
- قم بإنشاء مجلد جديد. اسحب كل ملف نصي تم إنشاؤه إلى المجلد.
- افتح ملف kymograph وسجل الأبعاد.
- اسحب ماكرو القياس إلى الصورة J.
- أدخل نسبة الميكرون إلى البكسل المسجلة مسبقا في PixelScale.
- قم بتغيير الحد الأقصى للسرعة إلى 0.1. (تعتبر الحويصلات التي تتحرك تحت هذا الحد ثابتة).
- أدخل أبعاد الكيموغراف المسجلة مسبقا. سيتم إنشاء ملف الملخص تلقائيا في المجلد النصي الذي تم إنشاؤه. سيحتوي كل تعبئة ملخص على ٪الوقت المقطوعة، والسرعة الإجمالية (ميكرومتر/ثانية)، وإجمالي المسافة، ومتوسط المقطع المقطوعة، وعدد مرات التوقف، وعدد المرات التي تم عكسها. يتم توفير رمز إنشاء بيانات التصوير الحركي وتتبعها وقياسها كملف تشفير تكميلي 1.
النتائج
تم إجراء تصوير الخلايا الحية والتحليلات الكيموغرافية لقياس حركة الميتوكوندريا الحرة المسماة ب Mito-RFP أو الميتوكوندريا المرتبطة ب ER الضيقة (6 نانومتر ± 1 نانومتر) أو فضفاضة (24 نانومتر ± 3 نانومتر) التي استقرت بواسطة MAM 1X أو MAM 9X ، على التوالي ، في أطول عملية عصبية لكل خلية عصبية ReN GA (AD) أو ReN (ساذجة) والتي لا يقل طولها عن 500 نانومتر ، بالنظر إلى هذا كمحور عصبي (الشكل 1 والشكل 2). تم حساب ترددات الحركات (بشكل عام ، رجعي ، وتقدمي) بقسمة عدد النقاط المتحركة أو الثابتة المسماة ب RFP (MAMs) على العدد الإجمالي في التصوير الحربي (الشكل 1A-E). انخفضت السرعة المحورية الإجمالية للميتوكوندريا المرتبطة ب ER المسماة MAM 1X بشكل كبير بنسبة ~ 50٪ مقارنة بالميتوكوندريا الخالية من ER المسماة Mito-RFP أو الميتوكوندريا المرتبطة ب ER المسمى MAM 9X (الشكل 1 ب). كشف التحليل الكمي أيضا عن اختلافات كبيرة بين الحركات الإجمالية والرجعية للميتوكوندريا المرتبطة ب MAM 1X المستقرة مقارنة بالميتوكوندريا الحرة (Mito-RFP) أو MAM 9X المرتبطة ب ER. في حين أن 53.82٪ ± 3.3٪ من الميتوكوندريا الخالية من ER (Mito-RFP) كانت متنقلة ، إلا أن 26.6٪ فقط ± 3.4٪ MAM 1X كانت الميتوكوندريا المرتبطة ب ER متحركة ، مما يشير إلى أن استقرار MAMs قلل بشكل كبير من الحركة المحورية الإجمالية للميتوكوندريا ، المرتبطة ارتباطا وثيقا ب ER ، مقارنة بالميتوكوندريا غير المرتبطة أو المرتبطة بشكل فضفاض ب ER (44.79٪ ± 2.6٪ من MAM 9X مقابل 53.82٪ ± 3.3٪ من Mito RFP ، على التوالي) (الشكل 1 ج). باستمرار ، كانت كل من الحركات الرجعية والتقدمية للميتوكوندريا المرتبطة ب ER المسماة MAM 1X أقل بكثير مقارنة بالميتوكوندريا الحرة أو الحرة (Mito-RFP) (الرجعية: 12.33٪ ± 2.55٪ ل MAM 1X مقابل 25.78٪ ± 2.31٪ ل Mito RFP ؛ anterograde: 14.27٪ ± 2.81٪ ل MAM 1X مقابل 28.04٪ ± 2.48٪ ل Mito RFP) (الشكل 1D و E). يقدم الجدول 3 السرعات المحورية الدقيقة للميتوكوندريا الحرة أو تلك المرتبطة بإحكام أو فضفاض بغرفة الطوارئ. يمكن استخدام هذه القيم كوسيلة كمية رائعة لتقييم درجة استقرار MAM التي تتراوح بين MAM الضيقة والسائبة ، مما يؤدي إلى تقليل توليد Ab. عكست معدلات النقل المحوري للميتوكوندريا عند استقرار MAMs الضيقة والفضفاضة في خلايا ReN الساذجة أنماط النقل التي لوحظت في الخلايا العصبية ReN GA (الشكل 1F-G). تشير النتائج المتسقة بين الخلايا العصبية ReN الساذجة والخلايا العصبية ReN GA AD التي تعبر عن APPSwe / Lon إلى أن التأثير على النقل المحوري يعزى في الغالب إلى حالة استقرار MAM ، بغض النظر عن وجود APPSwe / Lon أو إنتاج Aβ الناتج.
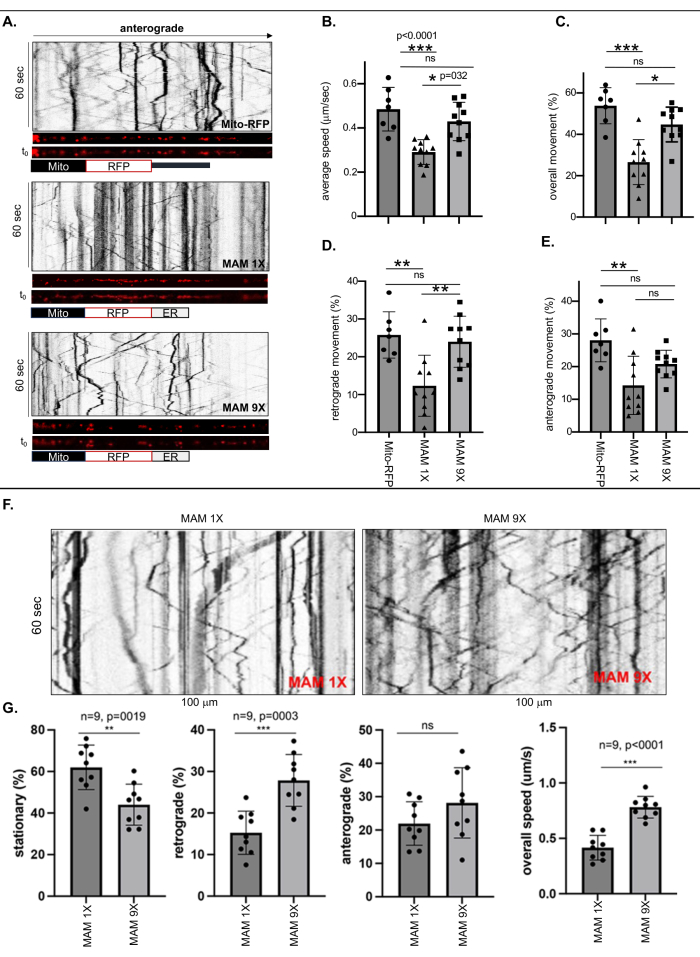
الشكل 1: أدى استقرار MAMs بواسطة MAM 1X إلى تقليل متوسط السرعة والحركة (بشكل عام ، إلى الوراء ، والأمامية) للميتوكوندريا المرتبطة ب ER في محاور ReN GA المتمايزة وخلايا ReN الساذجة. (أ) الكيموغرافات التمثيلية للنقط المسمى RFP التي تمثل الميتوكوندريا الحرة (Mito-RFP) أو الميتوكوندريا المرتبطة ب ER التي تم تثبيتها بواسطة MAM 1X (MAMs ضيقة ، 6 نانومتر ± عرض تلامس 1 نانومتر) أو MAM 9X (MAM فضفاضة ، 24 نانومتر ± عرض تلامس 3 نانومتر) داخل المحاور (~ 100 نانومتر). (ب - ه) التحليل الكمي لمتوسط السرعة والحركة (B) [(C) بشكل عام ، (D) إلى الوراء ، و (E) anterograde] ل Mito-RFP أو MAM 1X أو MAM 9X داخل محاور خلايا Ren-GA المتمايزة لمدة 10 أيام. ن>7; تم إجراء ANOVA ثنائي الاتجاه. * ص < 0.05 ، ** ص < 0.001. ممثل ثلاث تجارب مستقلة. (و) التصوير الدوراني التمثيلي لحركة MAM 1X أو MAM 9X داخل محاور خلايا ReN الساذجة المتمايزة لمدة 10 أيام. (ز) التحليل الكمي للنسبة المئوية (٪) الحركة (الثابتة ، والرجعية ، والتقدمية) والسرعة الإجمالية (ميكرومتر / ثانية ؛ ميكرومتر / ثانية) من MAM 1X أو MAM 9X المستقرة داخل محاور خلايا ReN الساذجة. ن = 9 ؛ تم إجراء ANOVA ثنائي الاتجاه. ص < 0.0001. تم تكييف هذا الرقم بإذن من Zellmer et al.17. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور الخلايا الحية لمحاور خلايا ReN الساذجة التي تعبر عن MAM 1X أو MAM 9X. صور فيديو الخلية الحية التمثيلية التي تعرض حركات MAMs التي تم تثبيتها بواسطة MAM 1X أو MAM 9X داخل محاور بطول 100 ميكرومتر من خلايا ReN المتمايزة التي تعبر عن GFP لمدة 10 أيام. ن > 10 صور من تجارب مكررة. تشير الأسهم إلى النقل الأمامي. شريط المقياس: 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكاشف | التركيز النهائي | مبلغ |
| DMEM مع L-glutamine | غير متاح | 500 مل |
| الهيبارين | 2 ميكروغرام / مل | 0.5 مل |
| ب 27 | 1x | 10 مل |
| bFGF | 20 نانوغرام / مل | 0.4 مل |
| EGF | 20 نانوغرام / مل | 0.5 مل |
| البنسلين / الستربتومايسين | 100 وحدة / مل | 5 مل |
| مجموع | 516.4 مل | |
| قم بتصفية الوسائط قبل إضافة البنسلين / الستربتومايسين. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى شهر واحد. | ||
الجدول 1: تكوين وسائط التوسعة.
| الكاشف | التركيز النهائي | مبلغ |
| DMEM مع L-glutamine | غير متاح | 500 مل |
| الهيبارين | 2 ميكروغرام / مل | 0.5 مل |
| ب 27 | 1x | 10 مل |
| البنسيليون / الستربتومايسين | 100 وحدة / مل | 5 مل |
| مجموع | 515.5 مل | |
| قم بتصفية الوسائط قبل إضافة البنسلين / الستربتومايسين. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى شهر واحد | ||
الجدول 2: تكوين وسائط التمايز.
| رين جي إيه | ReN (ساذج) | رين جي إيه (3D) | |||||
| بشكل عام (٪) | الرجوع إلى الوراء (٪) | أنتيروغراد (٪) | متوسط السرعة (مم / ثانية) | أب40 (جزء من المليون) | أب42 (م) | ||
| ميتو RFP | 53.82 ± 3.3٪ | 25.78 ± 2.31٪ | 28.04 ± 2.48٪ | 0.66 ± 0.03 | 0.69 ± 0.07 | 241.7 ± 26.74 | 13.77 ± 1.52 |
| مام 1 إكس | 26.6 ± 3.4٪ *** | 12.33 ± 2.5٪ *** | 14.27 ± 2.81٪ *** | 0.3 ± 0.02*** | 0.43 ± 0.04*** | 377.2 ± 76.87* | 26.62 ± 3.86* |
| مام 9X | 44.79 ± 2.6٪ نانوثانية | 23.99 ± 2.17٪ns | 20.80 ± 1.33٪ns | 0.59 ± 0.02 نانوثانية | 0.62 ± 0.02 نانوثانية | 158.8 ± 3.27* | 17.01 ± 2.02* |
الجدول 3: التحليل الكمي. تصوير الخلايا الحية والتحليل الكمي القائم على التصوير الوكيموغرافي لمتوسط السرعة (السرعة) والحركات المحورية (بشكل عام ، إلى الوراء ، والأمامية) ل Mito-RFP و MAM 9X و MAM 1X. تم إجراء ANOVA ثنائي الاتجاه للسرعة المحورية أو الحركة (٪). ن = 9. بالنسبة إلى Aβ ، تم إجراء ANOVA عادي أحادي الاتجاه. ن = 3 ، ثلاث تجارب مستقلة. يتم قياس الأهمية مقابل خلايا ReN GA غير المنقولة (التحكم). ** ص < 0.0001 ؛ * ص < 0.05 ؛ غير مهم (ns). تم تكييف هذا الجدول بإذن من Zellmer et al.17.
ملف الترميز التكميلي 1: رمز إنشاء وتتبع وقياس بيانات الكيموغراف الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
أدى تثبيط مستقبلات سيجما -1 (S1R) إلى تقليل استقرار MAM في العمليات العصبية وتقليل توليد Aβ بشكل كبير (~ 90٪) من المحاور ولكن ليس من سوما لنظام ثقافة ثلاثي الأبعاد (3D) لخلايا السلف العصبية البشرية (ReN) التي تعبر عن طفرات AD العائلية [FAD] في جين بروتين سلائف الأميلويد [APP] (ReN GA) 23،24،25،27. مثبتات MAM التأسيسية المسماة RFP (MAM 1X و MAM 9X) المصممة لتثبيت المحكم (6 نانومتر ± 1 نانومتر) والسائبة (24 نانومتر ± 3 نانومتر)MAMs 15،26 هي أدوات رائعة لقياس استقرار MAM كميا. لا يظهر كلا المثبتين تعبيرا متساويا ومستقرا في خلايا ReN GA المتمايزة في مصفوفة ثلاثية الأبعاد لمدة ~ 10 أيام فحسب ، بل اكتشفا أيضا MAMs في النقاط الفاصلة في soma والمحاور. الأهم من ذلك ، في حين أن التعبير المستقر ل MAM 1X في 3D ReN GA المخصب ب FACS زاد بشكل كبير من توليد Aβ ، لم يكن لتعبير MAM 9X أي تأثير17. اختبرنا أيضا تأثير مثبت MAM التأسيسي الذي يحتوي على 18 رابط من الأحماض الأمينية (MAM 18X) الذي يكتشف ويثبته MAMs >25 نانومتر. على عكس MAM 1X أو MAM 9X ، تم تصنيف MAM 18X حصريا على MAMs الصومالية. الخلايا العصبية RN GA MAM 18X المخصبة ب FACS ، خفضت الجيل Aβ17. اقترحت هذه النتائج إمكانية وجود عتبة استقرار MAM تحددها عرض الفجوة التي تتراوح بين MAM الضيقة المسببة للأمراض (زيادة توليد Aβ) إلى غير المسببة للأمراض (الحفاظ على أو تقليل توليد Aβ) السائبة MAMs.إن العثور على معدل MAM فعال وتركيزه الأمثل الذي يمكن أن يحقق استقرار MAM الأمثل المطلوب لعبور العتبة من MAMS المسببة للأمراض وغير المسببة للأمراض سيكشف عن طريق علاجي رائع لخفض Aβ المحوري أو العصبي الجيل في الدماغ.
تم استخدام ثلاثة طرق مختلفة لتطوير معدلات MAM: (1) المعدلات التي تستهدف بروتينات ربط MAM ، (2) المعدلات التي تغير مستويات التعبير عن البروتينات المقيمة في MAM ، و (3) معدلات هياكل MAM18. على الرغم من هذه الأساليب ، فإن العقبة الرئيسية أمام إيجاد معدلات فعالة لتثبيت MAM هي عدم وجود طرق لقياس درجة استقرار MAM كميا. التقنيات التقليدية مثل المجهر الإلكتروني (EM) أو الفحص المجهري فائق الدقة لها قيود في التقاط التغييرات في الوقت الفعلي أو توفير تفاصيل كافية لتقييم استقرار MAM (تمت مراجعته في28).
ستتغلب الطريقة الموضحة هنا على العقبة وتوفر رؤى رئيسية حول العلاقة بين استقرار MAM وإنتاج Aβ. تظهر النتائج أن MAMs بسمك 6 نانومتر ± 1 نانومتر ، وتظهر حركة إجمالية تبلغ 26.6٪ ± 3.4٪ (الجدول 3) ، مرتبطة بتوليد Aβ. على النقيض من ذلك ، فإن MAMs بسمك 24 نانومتر ± 3 نانومتر ، والتي تظهر حركة إجمالية تبلغ 44.79٪ ± 2.6٪ (الجدول 3) ، لا تؤثر على توليد Aβ. كانت الحركة الإجمالية للميتوكوندريا (Mito-RFP) 53.82٪ ± 3.3٪. بالنظر إلى أن سمك MAM يتراوح عادة بين 6 نانومتر و 80 نانومتر ، فإن هذه النتائج تحدد الحدود العلوية والسفلية لتثبيت MAM فيما يتعلق بإنتاج Aβ. وبالتالي ، يمكن أن توجه هذه الطريقة تحديد وتحسين المغير (المغيرات) لتثبيت MAM. سيكون الهدف هو تغيير الحركة الإجمالية ل MAMs من 26.6٪ ± 3.4٪ إلى 53.82٪ ± 3.3٪ ، أو متوسط سرعتها من  0. 4 ميكرومتر / ثانية إلى
0. 4 ميكرومتر / ثانية إلى  0. 7 ميكرومتر / ثانية (الجدول 3) ، ووضع مثل هذا المعدل (المغيرات) كعوامل علاجية محتملة ضد إنتاج Aβ.
0. 7 ميكرومتر / ثانية (الجدول 3) ، ووضع مثل هذا المعدل (المغيرات) كعوامل علاجية محتملة ضد إنتاج Aβ.
يعد استخدام معدلات MAM التأسيسية التي تحتوي على روابط اصطناعية ذات أطوال متزايدة (0-18 من الأحماض الأمينية) طريقة قوية لتحديد عتبة تثبيت MAM كميا لتحويل استقرار MAM إلى تثبيت يحافظ على أو ربما يخفض بدلا من زيادة توليد Aβ. ومع ذلك ، لتقييم كفاءة أو فعالية معدلات MAM ، ستكون هناك حاجة إلى مثبتات MAM المحفزة. تتوفر مثبتات MAM القائمة على نقل طاقة رنين Förster المحفز / الفحص المجهري للتصوير مدى الحياة الفلورية (FRET/FLIM) وهي عبارة عن بلازميدات تعبيرية تشفر تسلسل استهداف OMM المنصهر ب YFP ل mAKAP1 (34-63) وفوسفاتيز Sac1 الذي يستهدف ER المنصهر ب CFP (521-587). علاوة على ذلك ، قد لا تمثل المثبتات التأسيسية MAMs الفسيولوجية ، في حين أن مثبتات FRET / FLIM MAM ، من ناحية أخرى ، ستكتشف MAMs الفسيولوجية. يمكن أيضا استخدام مجسات GFP المنقسمة حيث يتم تقسيم GFP إلى جزأين غير فلوريين مرتبطين إما ببروتينات ER أو الميتوكوندريا المقيمة ER-GFP (1-10) و Mito-GFP11 التي تولد تكملة مضان جزيئي حيوي (BiFC) عند تكوين MAMs27. على الرغم من أن شظايا GFP عرضة للتجميع التلقائي ، إلا أن BiFC لديها أبسط قراءة وأوضح إشارة وأقل تحليل مرتبط بالضوضاء. علاوة على ذلك ، فإن التفاعل بين GFP المنقسم قابل للانعكاسبدرجة كبيرة 28 ، وبالتالي فإن مزاياها تفوق العيوب وتجعل طريقة BiFC مناسبة لتحديد معدلات تثبيت MAM.
Acknowledgements
نشكر الدكتور György Hajnóczky ، الأستاذ ، جامعة توماس جيفرسون ، فيلادلفيا لتزويدنا بسخاء ببلازميدات التعبير التي تشفر RFP-Mito و MAM 1X و MAM 18X. شكر خاص للدكتورة لاي دينغ، كبيرة علماء التصوير في مستشفى بريغهام والنساء لمساعدتنا في كتابة الكود لإنشاء بيانات التصوير الاحترازي وتتبعها وقياسها. تم دعم هذه الدراسة من قبل صندوق علاج الزهايمر إلى RB ومنحة المعاهد الوطنية للصحة 5R01NS045860-20 إلى RET.
Materials
| Name | Company | Catalog Number | Comments |
| 6 Well Glass Bottom Plate | Cellvis | P06-1.5H-N | |
| B-27 Supplement (50X), serum free | Gibco/Thermo Fisher Scientific | 17504044 | |
| bFGF | R&D System | 233-FB | |
| BSA | Fisher Scientific | 501781532 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| DMEM/F12 with L-glutamine | Gibco/Thermo Fisher Scientific | 11320-033 | |
| EDTA | Life Technologies | 41116134 | |
| EGF | Sigma-Aldrich | 92090408 | |
| Falcon 6 Well Plates | VWR International | 41122107 | |
| GAPDH Polyclonal Antibody | Thermo Fisher Scientific | PA1-988 | |
| Gelatin | VWR International | 9000-70-8 | |
| Graphpad Prism N/A | Prism 9, version 9.5.0 | N/A | |
| Heparin | Sigma-Aldrich | H0200000 | |
| ImageJ Software | ImageJ 1.53a | N/A | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| mCherry Polyclonal Antibody | Invitrogen | PA5-34974 | |
| MS Excel | Microsoft Excel, version 2302 | N/A | |
| Multi-array electrochemiluminescence assay kit | Meso Scale Diagnostics (MSD) | K15200E-2 | V-PLEX Aβ Peptide Panel 1 (6E10) kit |
| NaCl | Fisher Scientific | 7647145 | |
| NuPAGE 4–12% Bis-Tris gel | Invitrogen | NP0321BOX | |
| Penicillin/Streptomycin/Amphotericin B | Lonza | 17-745E | |
| Photoshop | Adobe Photoshop CC 20.0.10 | N/A | |
| Rat Neuron Nucleofector Kit | Lonza | VPG-1003 | |
| StemPro Accutase | Gibco | A1110501 | |
| Tris-HCL, pH 7.6 | Boston BioProducts | 42000000 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Fisher Scientific | 501657287 |
References
- Giacomello, M., Pellegrini, L. The coming of age of the mitochondria-ER contact: a matter of thickness. Cell Death Differ. 23 (9), 1417-1427 (2016).
- Degechisa, S. T., Dabi, Y. T., Gizaw, S. T. The mitochondrial associated endoplasmic reticulum membranes: A platform for the pathogenesis of inflammation-mediated metabolic diseases. Immun Inflamm Dis. 10 (7), e647 (2022).
- Schon, E. A., Area-Gomez, E. Mitochondria-associated ER membranes in Alzheimer disease. Mol Cell Neurosci. 55, 26-36 (2013).
- Erpapazoglou, Z., Mouton-Liger, F., Corti, O. From dysfunctional endoplasmic reticulum-mitochondria coupling to neurodegeneration. Neurochem Int. 109, 171-183 (2017).
- Sala-Vila, A., et al. Interplay between hepatic mitochondria-associated membranes, lipid metabolism and caveolin-1 in mice. Sci Rep. 6, 27351 (2016).
- Fujimoto, M., Hayashi, T. New insights into the role of mitochondria-associated endoplasmic reticulum membrane. Int Rev Cell Mol Biol. 292, 73-117 (2011).
- Hung, V., et al. Proteomic mapping of cytosol-facing outer mitochondrial and ER membranes in living human cells by proximity biotinylation. eLife. 6, e24463 (2017).
- Area-Gomez, E., Schon, E. A. On the pathogenesis of Alzheimer's disease: The MAM hypothesis. FASEB J. 31 (3), 864-867 (2017).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280 (5370), 1763-1766 (1998).
- Sukhorukov, V. S., et al. Molecular mechanisms of interactions between mitochondria and the endoplasmic reticulum: A new look at how important cell functions are supported. Mol Biol. 56 (1), 59-71 (2022).
- Zhang, P., Konja, D., Zhang, Y., Wang, Y. Communications between Mitochondria and endoplasmic reticulum in the regulation of metabolic homeostasis. Cells. 10 (9), 2195 (2021).
- Ziegler, D. V., Martin, N., Bernard, D. Cellular senescence links mitochondria-ER contacts and aging. Commun Biol. 4 (1), 1323 (2021).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. J Cell Biol. 174 (7), 915-921 (2006).
- Cieri, D., et al. SPLICS: a split green fluorescent protein-based contact site sensor for narrow and wide heterotypic organelle juxtaposition. Cell Death Differ. 25 (6), 1131-1145 (2018).
- Carpio, M. A., et al. BOK controls apoptosis by Ca(2+) transfer through ER-mitochondrial contact sites. Cell Rep. 34 (10), 108827 (2021).
- Prudent, J., et al. MAPL SUMOylation of Drp1 stabilizes an ER/mitochondrial platform required for cell death. Mol Cell. 59 (6), 941-955 (2015).
- Zellmer, J. C., Tarantino, M. B., et al. Stabilization of mitochondria-associated endoplasmic reticulum membranes regulates Abeta generation in a three-dimensional neural model of Alzheimer’s disease. Alzheimer’s Dement. , 1-20 (2024).
- Magalhaes Rebelo, A. P., et al. Chemical modulation of mitochondria-endoplasmic reticulum contact sites. Cells. 9 (7), 1637 (2020).
- Berger, S. I., Iyengar, R. Role of systems pharmacology in understanding drug adverse events. Wiley Interdiscip Rev Syst Biol Med. 3 (2), 129-135 (2011).
- Friedman, J. R., Webster, B. M., Mastronarde, D. N., Verhey, K. J., Voeltz, G. K. ER sliding dynamics and ER-mitochondrial contacts occur on acetylated microtubules. J Cell Biol. 190 (3), 363-375 (2010).
- Wu, Y., et al. Contacts between the endoplasmic reticulum and other membranes in neurons. Proc Natl Acad Sci U S A. 114 (24), E4859-E4867 (2017).
- Cagin, U., et al. Mitochondrial retrograde signaling regulates neuronal function. Proc Natl Acad Sci U S A. 112 (44), E6000-E6009 (2015).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Kim, Y. H., et al. A 3D human neural cell culture system for modeling Alzheimer's disease. Nat Protoc. 10 (7), 985-1006 (2015).
- Kwak, S. S., et al. Amyloid-beta42/40 ratio drives tau pathology in 3D human neural cell culture models of Alzheimer's disease. Nat Commun. 11 (1), 1377 (2020).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39 (1), 121-132 (2010).
- Bhattacharyya, R., et al. Axonal generation of amyloid-beta from palmitoylated APP in mitochondria-associated endoplasmic reticulum membranes. Cell Rep. 35 (7), 109134 (2021).
- Tebo, A. G., Gautier, A. A split fluorescent reporter with rapid and reversible complementation. Nat Commun. 10 (1), 2822 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved