Method Article
הדמיה וכימות של TGFβ/BMP/SMAD איתות בתנאי לחץ שונים של גיסת נוזלים באמצעות קרבה-קשירה-אסאי
In This Article
Summary
כאן, אנו מקימים פרוטוקול כדי לדמיין ולנתח בו זמנית מתחמי SMAD מרובים באמצעות בדיקת קשירת קרבה (PLA) בתאי אנדותל החשופים לתנאי לחץ גזיר נוזלים פתולוגיים ופיזיולוגיים.
Abstract
שינוי גורם גדילה β (TGFβ)/חלבון מורפוגנטי עצם (BMP) איתות מוסדר ומאוזן היטב במהלך הפיתוח וההומאוסטזיס של מערכת כלי הדם ולכן, הסרת הפיקוח במסלול איתות זה גורמת לפתולוגיות כלי דם חמורות, כגון יתר לחץ דם בעורק הריאות, טלנגיקטזיה דימומית תורשתית וטרשת עורקים. תאי אנדותל (ECs), כמו השכבה הפנימית ביותר של כלי הדם, חשופים כל הזמן ללחץ גיסת נוזלים (SS). דפוסים חריגים של SS נוזל הוכחו כדי לשפר את זהות TGFβ/BMP, אשר, יחד עם גירויים אחרים, לגרום טרוגנזה. ביחס לכך, atheroprone, למינאר נמוך SS נמצא כדי לשפר את זהות TGFβ / BMP בעוד SS atheroprotective, למינר גבוה, מפחית איתות זה. כדי לנתח ביעילות את ההפעלה של מסלולים אלה, עיצבנו זרימת עבודה כדי לחקור את היווצרות מתחמי גורם התמלול תחת SS למינאר נמוך ותנאי SS למינאר גבוהים באמצעות מערכת משאבה פנאומטית זמינה מסחרית ובוח קשירת קרבה (PLA).
איתות TGFβ/BMP פעיל דורש היווצרות מתחמי SMAD טרימרים המורכבים משני SMAD רגולטוריים (R-SMAD); SMAD2/3 ו- SMAD1/5/8 עבור איתות TGFβ ו- BMP, בהתאמה) עם מתווך נפוץ SMAD (SMAD משותף; SMAD4). באמצעות PLA מיקוד subunits שונים של קומפלקס SMAD טרימר, כלומר, או R-SMAD / co-SMAD או R-SMAD / R-SMAD / R-SMAD, היווצרות של מתחמי גורם שעתוק SMAD פעיל ניתן למדוד כמותית מרחבית באמצעות מיקרוסקופיה פלואורסצנטית.
השימוש בשקופיות זרימה עם 6 ערוצים מקבילים קטנים, שניתן לחבר בסדרה, מאפשר לחקור את גורם התמלול היווצרות מורכבת והכלה של פקדים נחוצים.
זרימת העבודה המוסברת כאן יכולה להיות מותאמת בקלות למחקרים המתמקדים בקרבה של SMADs לגורמי שעתוק אחרים או למתחמי גורם תמלול שאינם SMADs, בתנאי SS זורמים שונים. זרימת העבודה המוצגת כאן מציגה דרך מהירה ויעילה ללמוד את האיתות TGFβ/BMP המושרה ב- SS הנוזלי ב- ECs, הן כמותית והן מרחבית.
Introduction
חלבונים של גורמי גדילה משתנים בטא (TGFβ) superfamily הם ציטוקינים pleiotropic עם מגוון רחב של חברים, כולל TGFβs, חלבונים מורפוגנטיים עצם (BMPs), ו Activins1,2. כריכת ליגנד גורמת להיווצרות של אוליגומרים קולטנים המובילים לזרחן, ובכך, הפעלה של SMAD רגולטורי ציטוטולי (R-SMAD). בהתאם למשפחת המשנה של ליגנדים, R-SMADs שונים מופעלים1,2. בעוד TGFβs ו Activins בעיקר לגרום זרחן של SMAD2/3, BMPs לגרום SMAD1/5/8 זרחן. עם זאת, ישנן עדויות מצטברות כי BMPs ו- TGFβs/Activins מפעילים גם R-SMADs של תת-המשפחה האחרת בהתאמה, בתהליך המכונה 'איתות לרוחב'3,4,5,6,7,8 וכי ישנם מתחמי SMAD מעורבים המורכבים משניהם, SMAD1/5 ו- SMAD2/3, חברים3,9 . שני R-SMADs מופעלים לאחר מכן יוצרים מתחמים טרימרים עם המתווך המשותף SMAD4. מתחמי גורמי שעתוק אלה מסוגלים לאחר מכן להעביר את ההקצאה לגרעין ולווסת את שעתוק הגנים היעד. SMADs יכול לקיים אינטראקציה עם מגוון של מפעילי שיתוף תעתיק שונים ומדכאים משותפים, מה שמוביל לגיוון האפשרויות לווסת את הגנים היעד10. הסרת הפיקוח על איתות SMAD יש השלכות חמורות במגוון מחלות. בהתאם לכך, איתות TGFβ/BMP לא מאוזן עלול להוביל לפתולוגיות כלי דם חמורות, כגון יתר לחץ דם בעורק הריאות, טלנגיקטזיה דימומית תורשתית, או טרשת עורקים3,11,12,13,14.
תאי אנדותל (ECs) יוצרים את השכבה הפנימית ביותר של כלי הדם ולכן הם חשופים ללחץ גזוז (SS), כוח חיכוך המופעל על ידי הזרימה הצמיגית של הדם. מעניין, ECs המתגוררים בחלקים של vasculature, אשר חשופים לרמות גבוהות של מדים, למינאר SS, נשמרים במצב הומיאוסטטי ורגיע. לעומת זאת, ECs שחווים SS נמוך, לא אחיד, למשל, ב bifurcations או עקמומיות פחותה של קשת אב העורקים, הם שגשוג ולהפעיל מסלולים דלקתיים15. בתורו, אתרים של ECs מתפקד נוטים לפתח טרשת עורקים. באופן מעניין, מחשבים אלקטרוניים באזורים אלה של אתראופרון מציגים רמות גבוהות באופן חריג של SMAD2/3 ו- SMAD1/516,17,18. בהקשר זה, איתות TGFβ/BMP משופר נמצא כאירוע מוקדם בהתפתחות נגעים טרשת עורקים19 והפרעה לאיתות BMP נמצאה כמפחיתה באופן משמעותי דלקת כלי דם, היווצרות אתראומה והסתיידות נלווית20.
קרבה קשירת Assay (PLA) היא טכניקה ביוכימית לחקר אינטראקציות חלבון חלבון במקום 21,22. הוא מסתמך על הספציפיות של נוגדנים של מינים שונים שיכולים לקשור חלבונים ממוקדים של עניין, ומאפשר זיהוי ספציפי מאוד של אינטראקציות חלבון אנדוגני ברמה של תא אחד. כאן, נוגדנים ראשוניים צריכים להיקשר לאפיטופ היעד שלהם במרחק של פחות מ -40 ננומטר כדי לאפשר את הגילוי23. לכן, PLA מועיל מאוד על גישות אימונו-immunoprecipitation מסורתיות, שבו כמה מיליוני תאים נדרשים כדי לזהות אינטראקציות חלבון אנדוגני. ב- PLA, נוגדנים משניים ספציפיים למינים, המקושרים באופן קוולנטי לרסיסי DNA (המכונים בדיקות פלוס ומינוס), קושרים את הנוגדנים העיקריים ואם חלבוני העניין מתקשרים, בדיקות פלוס ומינוס מגיעות בסמיכות. הדנ"א נקשר בשלב הבא והגברת המעגל המתגלגל של הדנ"א המעגלי מתאפשרת. במהלך ההגברה, oligonucleotides משלימים שכותרתו פלואורסצנטרית נקשרים לדנ"א המסונתז, ומאפשרים לאינטראקציות חלבון אלה להיות חזותיות על ידי מיקרוסקופיה פלואורסצנטית קונבנציונלית.
הפרוטוקול המתואר כאן מאפשר למדענים להשוות כמותית את מספר מתחמי שעתוק SMAD הפעילים בתנאי Atheroprotective ו atheroprone SS במבחנה באמצעות PLA. SS נוצר באמצעות מערכת משאבה פנאומטית ניתנת לתכנות המסוגלת ליצור זרימה חד-כיוונית למינארית של רמות מוגדרות ומאפשרת עלייה צעדים של קצבי הזרימה. שיטה זו מאפשרת זיהוי של אינטראקציות בין SMAD1/5 או SMAD2/3 עם SMAD4, כמו גם מתחמי R-SMAD מעורבים. ניתן להרחיב אותו בקלות כדי לנתח אינטראקציות של SMADs עם רגולטורים משותפים תמלול או כדי לתמלול גורמים מתחמים אחרים מלבד SMADs. איור 1 מציג את השלבים העיקריים של הפרוטוקול המוצג להלן.

איור 1: ייצוג סכמטי של הפרוטוקול המתואר. (A) תאים הנזרעים בשקופיות של 6 ערוצים חשופים ללחץ גניסיה עם מערכת משאבה פנאומטית. (B) תאים קבועים משמשים לניסוי PLA או לתנאי בקרה. (C) תמונות של ניסויי PLA נרכשות באמצעות מיקרוסקופ פלואורסצנטי ומנותחות באמצעות תוכנת ניתוח ImageJ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. תרבית התא וחשיפה ללחץ גזל
הערה: ECs וריד טבור אנושי (HUVECs) שימשו כדוגמה לחקר אינטראקציה המושרה SS של SMADs. ניתן להחיל את הפרוטוקול המתואר להלן על כל סוג תא רספונסיבי של SS.
- מעיל שקופית 6 ערוצים עם 0.1% ג'לטין עור חזירי PBS במשך 30 דקות ב 37 °C (7 °F).
- זרע HUVECs בשקופיות 6 ערוצים מצופות מראש בצפיפות של 2.5 x 106 תאים למ"ל ב- 30 μL של M199 בינוני מלא.
הערה: לקבלת מידע נוסף אודות אופן הזרימה של תאים בשקופית הזרימה, ראה reference24. - תן לתאים לדבוק במשך 1 שעות ב 37 °C בחממה לחה.
- הוסף 60 μL של M199 בינוני מלא מחומם מראש לכל אחד מהמאגרים.
- תרבות במשך יומיים, עם חילופי בינוני עדין פעם ביום, ב 37 °C (50 °F) בחממה לחה.
- שאפו את המאגרים לחלוטין, הוסיפו 120 מיקרו-אל של M199 בינוני מלא התחמם מראש באחד המאגרים, ושאפו מהצד השני.
- הוסף 60 μL של M199 בינוני מלא מחומם מראש לשני המאגרים.
- הרכב והתחל את הגדרת הזרימה כמפורט בהפניה25.
- הר צינורות על יחידות נוזלים. כאן, צינורות סיליקון בקוטר של 0.8 מ"מ ו 1.6 מ"מ משמשים כדי להחיל מתח גיהה של 1 דיין / cm2 ו 30 ין / cm2, בהתאמה.
הערה: החומר ואורך הצינורות צריכים להישאר קבועים, שכן שינויים יכולים להשפיע על הלחץ הגומרי הנובע מכך. באופן כללי, שילובים אחרים של מערכות משאבה צינורות ניתן להשתמש, כל עוד הלחץ הגיאה וכתוצאה מכך ידוע, ואת המשאבה יוצרת זרימת למינאר יציבה. - מלאו את המאגרים בכמות מתאימה של M199 בינוני מלא (מינימום 10 מ"ל).
- חבר יחידות נוזליות עם הצינורות למערכת המשאבה ובצע ריצה מוקדמת ללא תאים כדי שיווי משקל המדיום ולהסיר את כל האוויר הנותר 25.
- חבר באופן סדרתי את הערוצים הבודדים בשקופית בת 6 הערוצים זה לזה באמצעות צינורות חיבור סידוריים. הערוץ הראשון והאחרון בשקופית יתחברו לצינורות שהורכבו ב- 1.6.1 (ראה איור 1A לקבלת ערכה). היזהר לא להכניס כל אוויר לתוך המערכת כמו זה יכול לפגוע קשות בתאים. מידע נוסף על החיבור הסידורי ניתן למצוא בהפניה26.
- לחשיפת תאים לרמות גבוהות של לחץ גזוז (>20 דיס/ס"מ2), יש להשתמש בשלב הרמפה, כלומר להגביר את הלחץ הגזוז בשלבי הסתגלות. ניתן להגדיר את השלבים במרווחים של 5 דקה/cm2 ל-30 דקות.
- הר צינורות על יחידות נוזלים. כאן, צינורות סיליקון בקוטר של 0.8 מ"מ ו 1.6 מ"מ משמשים כדי להחיל מתח גיהה של 1 דיין / cm2 ו 30 ין / cm2, בהתאמה.
2. קיבעון
- נתק שקופיות מהמשאבות לאחר חשיפת ה-SS הנוזלי. השתמש מלחציים על הצינורות בעת ניתוק, כדי למנוע לשפוך בינוני באינקובטור.
- העבר מיד שקופיות זרימה על קרח, בעוד הצינורות הנותרים מנותקים ברצף. בעת הסרת הצינורות ממאגרים, המאגר בצד השני צריך להישמר סגור עם אצבע כדי למנוע לכידת בועות אוויר בערוץ. הדבר עלול להפריע לשלבי הקיבעון.
- שמירה על התאים על קרח, לשאוף למדיום בזהירות מן המאגרים אבל לא מן הערוץ שבו התאים שוכנים. לאחר מכן, לשטוף דגימות עם PBS סטרילי קר (4 °C) עם שלוש פעמים נפח הערוץ (90 μL). הוסיפו PBS למאגר אחד ושאפו בזהירות מהמאגר השני. חזור על שלב זה בכל אחד מ- 6 הערוצים לכל שקופית.
הערה: עבור כל שלבי הכביסה והדגירה הפתרון המתאים מתווסף באחד המאגרים המוביל לחילופי פתרונות בערוץ. כדי לאפשר החלפה מלאה של פתרונות בערוץ, הפתרון העודף הוא שאיפה אז מן המאגר האחר. הפתרון בחלק העליון של התאים בערוץ אינו מוסר. תאים לא צריכים להתייבש בכל עת. לכן, חשוב לשטוף בזהירות ללא כל החדרת בועת אוויר לתוך השקופיות. - תקן את התאים על ידי הוספת 90 μL של פתרון PFA 4% במאגר שבו ה- PBS נוספה מראש ושאף באופן דומה את הנוזל מהמאגר האחר. חזור על שלב זה בכל ערוץ בכל שקופית. לאחר הוספת פתרון PFA, להעביר את הדגימות מקרח לטמפרטורת החדר (RT) ודגרה במשך 20 דקות.
זהירות: PFA רעיל ויש לטפל בו בזהירות. השתמש בכפפות ועבוד מתחת למכסה המנוע. - לשטוף תאים 3x עם PBS (RT) על ידי הוספתו במאגר אחד ושאיפה בזהירות מן המאגר השני. רוקן רק את המאגרים, והבטיח לא לייבש את הערוץ. חזור על שלב זה עבור כל אחד מ- 6 הערוצים בכל שקופית.
- להרוות את קיבעון PFA על ידי הוספת 90 μL של כלוריד אמוניום 50 מ"מ הסביבה ב- PBS באחד המאגרים. שאפו פתרון עודף מהמאגר השני. חזור על הפעולה עבור כל ערוץ בשקופית. לדגור על הדגימות במשך 10 דקות ב RT.
- לשטוף כמתואר בשלב 2.5.
הערה: בשלב זה, הדגימות עשויות להיות מאוחסנות ב 4 °C (4 °F) לילה, או הפרוטוקול ניתן להמשיך מיד עם חסימה ודגורת נוגדנים ראשונית (ראה שלב 3).
3. חסימה ודגרת נוגדנים ראשונית
- כדי לחלחל לתאים, הוסף 90 μL של 0.3% טריטון-X-100 ב- PBS במאגר ריק, ושאף מהמאגר השני עבור כל ערוץ. דגירה במשך 10 דקות ב RT.
- לשטוף כמתואר בשלב 2.5.
- הוסף 90 μL של פתרון חסימת PLA סטרילי במאגר אחד של ערוץ ושאף מהצד השני. חזור על שלב זה עבור כל ערוץ. לחסום במשך 1 שעות ב 37 °C (50 °F) בתא לח.
- כדי להפוך תא לח, להשתמש צלחת 10 ס"מ עם רקמה רטובה אטומה עם סרט שעווה ומניחים את המנה באינקובטור. לחלופין, ניתן להשתמש בפורמטים אחרים של תאי לחות המספקים אווירה לחה.
הערה: לחלופין, פתרון חסימה מתוצרת עצמית ניתן להשתמש (למשל, 3% (w/v) BSA ב- PBS, סינון סטרילי).
- כדי להפוך תא לח, להשתמש צלחת 10 ס"מ עם רקמה רטובה אטומה עם סרט שעווה ומניחים את המנה באינקובטור. לחלופין, ניתן להשתמש בפורמטים אחרים של תאי לחות המספקים אווירה לחה.
- הכן נוגדנים ראשוניים (1:100) בדילול נוגדנים PLA. הכן 30 μL של הפתרון לכל ערוץ. מוסיפים את שני הנוגדנים העיקריים בו זמנית ואת המערבולת.
הערה: לחלופין, ניתן להשתמש בדלל נוגדנים מתוצרת עצמית (למשל, 1% (w/v) BSA ב- PBS). נוגדנים המשמשים כאן הם שילובים של SMAD1-SMAD2/3, SMAD2/3-SMAD4 ופוספו-SMAD1/5-SMAD4. מידע מפורט ניתן למצוא בטבלת החומרים. - לפני היישום של נוגדנים ראשוניים, לשאוף את פתרון חסימה מן המאגרים, וגם, בזהירות מן הערוץ. Pipette 30 μL של פתרון הנוגדנים העיקרי מיד לתוך הערוץ הריק על ידי הטיית הערוץ תוך הוספת הפתרון.
הערה: בצע את הסרת פתרון החסימה ותוספת של ערוץ אחר ערוץ פתרון נוגדנים כדי להבטיח שתאים לא יתייבשו ביניהם. - דגימות דגירה עם הנוגדנים העיקריים לילה בתאים לחים ב 4 °C (50 °F).
הערה: הדגירה יכולה להתבצע גם במשך שעה אחת בטמפרטורת החדר, אם מעוניין להמשיך עם השלבים הבאים באותו יום.
4. דגירה של גשושית PLA
הערה: עבור כל השלבים בסעיף 4.1-7.3, מאגרי הכביסה A ו- B מאוחסנים ב 4 °C (7 °F) ויש לחמם אותם ל- RT לפני השימוש.
- לדלל PLA-בדיקות (+)-עכבר ו --)ארנב ל 1:5 ב PLA נוגדן דילול (או 1% BSA) פתרון. הכן 30 μL לערוץ.
- לשטוף דגימות 2x במשך 5 דקות באמצעות 90 μL של חוצץ לשטוף A ב RT על ידי הוספת אותו באחד המאגרים ושאיפה בזהירות מן המאגר השני. חזור על שלב זה עבור כל אחד מ- 6 הערוצים בכל שקופית.
- שאפו את מאגר הכביסה בזהירות והוסיפו 30 μL של פתרון בדיקה PLA (מוכן בשלב 4.1), בדומה לתוספת של נוגדנים ראשוניים בשלב 3.5.
- דגימות דגירה עבור 1 שעה ב 37 °C (50 °F) בתא לח.
5. קשירה
- לשטוף דגימות 2x במשך 5 דקות באמצעות 90 μL של חוצץ לשטוף A ב RT, כמתואר 4.2.
- הכן דילול 1:5 של מאגר הקשירה במים דה-יעומת. השתמש במאגר זה כדי לדלל את האנזים ליגאז ל 1:40 (על קרח). השתמש ב- 30 μL לערוץ.
- שאפו את מאגר הכביסה A לחלוטין והוסיפו את תמסת קשירה כמתואר ב-3.5.
- דגימות דגירה במשך 30 דקות ב 37 °C (50 °F) בתא לח.
6. הגברה
- לשטוף דגימות 2x במשך 2 דקות באמצעות 90 μL של חוצץ לשטוף A ב RT, כמתואר 4.2.
- הכן את מאגר ההגברה על ידי דילולו 1:5 במים דה-יונים והשתמש בו כדי לדלל את האנזים פולימראז ל-1:80 (על הקרח). הגן מפני אור. הכן 30 μL לערוץ.
- שאפו את מאגר הכביסה A הוסיפו באופן מלא ומיידי את פתרון ההגברה המוכן לערוץ הריק, כמתואר ב-3.5. דגימות דגירה במשך 100 דקות ב 37 °C (50 °F) בתא לח.
7. הרכבה
- לשטוף דגימות 2x במשך 10 דקות באמצעות 90 μL של לשטוף חוצץ B ב RT כמתואר 4.2. הוסף DAPI (1:500) מפתרון מלאי מ"ג /מ"ל אחד (במים דה-יושפזים) בשטיפה הראשונה כדי להכתים גרעינים. אין לייבש את הערוץ.
- לדלל את חוצץ לשטוף B במים deionized (1:10) ולשטוף 1x עם 90 μL של 0.1x חוצץ B פתרון כמתואר 4.2.
- שואפים את חוצץ הכביסה B לחלוטין ומיד להוסיף 2-3 טיפות של נוזל הרכבה בינונית למאגר אחד. פזר אותו בערוץ על-ידי הטיית השקופית. יש לאחסן דגימות במהירות של 4 °C (7%), בסביבה לחה עד להדמיה.
8. רכישת תמונות
- השג תמונות באמצעות מיקרוסקופ פלואורסצנטי. ודא כי המסננים המתאימים לבדיקות PLA פלואורסצנטיות זמינים.
הערה: זה מועיל לעשות שימוש במיקרוסקופ קונפוקלי, אם אפשר, כמו כתמי PLA שהושגו מוגדרים יותר. הדבר תומך גם בעיבוד תמונה נוסף וניתוח נתונים.
9. ניתוח וכימות תמונה באמצעות ImageJ/FIJI
- עבד תמונות מיוצאות (.tiff) עם תוכנית לעיבוד תמונה, כגון ImageJ27.
הערה: כל התסריטים המשמשים במחקר זה והם נחוצים לספירה אוטומטית של תאיים, גרעיניים וכל אירועי PLA (לכל תא) ניתן למצוא במאגר GitHub: https://github.com/Habacef/Proximity-Ligation-Assay-analysis. בצע ניתוח סטטיסטי באמצעות כל תוכנית או כלי מתאימים.
תוצאות
השתמשנו בעבר PLA כדי לזהות אינטראקציות של חלבוני SMAD שונים3 וניתחנו שינויים המושרה מתח גיזה בזרחן SMAD28.
כאן, שתי השיטות שולבו עם הפרוטוקול שתואר לעיל. HUVECs היו נתונים ללחץ גיסת של 1 גוון / cm2 ו 30 גוון / cm2 ונותחו עבור אינטראקציות של גורמי שעתוק SMAD. אנו מראים כי בהשוואה ללחץ הגיסה הגבוה (30 גוון/cm2), מתח הגיסה הנמוך (1 גוון/cm2) מוביל לעלייה משמעותית באינטראקציות SMAD1-SMAD2/3, מה שנקרא מתחמי SMAD מעורבים בשניהם, הציטוסול והגרעין של תאים מנותחים (איור 2A, פאנל תחתון). אירועי PLA נראים כנקודות נפרדות בשתי הדגימות, ואפשר להבחין בין אירועים ציטוטוסוליים לגרעין בהתייחס להכתמת DAPI (איור 2A, פאנל עליון). לעומת זאת, בקרות נוגדנים, שבהן רק אחד משני הנוגדנים העיקריים אך עדיין שתי בדיקות PLA דוגרו, הראו מספרים זניחים של אותות PLA (איור 2B). לכן, ניתן להסיק כי הניסוי היה מוצלח.

איור 2: SMAD2/3-SMAD1 PLA המשווה ריכוזי נוגדנים שונים. (A) תמונות פלואורסצנטיות קונפוקליות וכימות של SMAD2/3-SMAD1-PLA ב- HUVECs חשופים ל- 24 שעות של רמות האס.אס המצוינות. יחס דילול נוגדנים: 1:100. (B) תמונות קונפוצליות של פקדי נוגדנים בודדים עבור PLA בתמונות פלואורסצנטיות קונפוקליות A. (C) וכימות של SMAD2/3-SMAD1-PLA ב- HUVECs חשופים ל- 24 שעות של רמות SS שצוינו. יחס דילול נוגדנים: 1: 50. סרגלי קנה מידה עבור A-C: 20 מיקרומטר ו 10 מיקרומטר בזום. דיין שווה צביעה/cm2. נוגדנים בשימוש היו ארנב נגד SMAD2/3 ועכבר אנטי SMAD1 (ראה טבלת חומרים). עבור כל תנאי 5 אזורים אקראיים לאורך מרכז ערוץ הזרימה שימשו לרכישת תמונה. N = 1 שכפול ביולוגי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי להראות כיצד ריכוזים שונים של נוגדנים משנים את תוצאות PLA, אותו ניסוי בוצע עם 1:50 במקום דילול של 1:100 של נוגדנים. בתנאים אלה, כמות כפולה של נוגדנים גורמת לאותות PLA גבוהים פי ארבעה לתא (השווה איור 2A ואיור 2C). ההבדל באותות בין 1 גוון/cm2 ל-30 גוון/cm2 פוחת כאשר משתמשים בריכוז נוגדנים גבוה יותר ומשמעות סטטיסטית הולכת לאיבוד עבור האירועים הכוללים והציטוזוליים PLA (איור 2A, פאנל תחתון; איור 2C, חלונית תחתונה). ייתכן שהסיבה לכך היא התמזגות האות ובעיות של הבחנה בין אירועי PLA. אם הצטברות כזו של אותות מתרחשת, ריכוזי נוגדנים יש להקטין.
יתר על כן, הראינו כי מאגרים מתוצרת עצמית לחסימה ודילול נוגדנים יכולים לשמש כחלופה למאגרים מסחריים הכלולים בערכות פלטה. אירועי PLA לתא הושוו עבור SMAD1-SMAD2/3 (איור 3A לעומת איור 3D), SMAD2/3-SMAD4 (איור 3B לעומת איור 3E) ו-pSMAD1/5-SMAD4 (איור 3C לעומת איור 3F) מתחמים מתחת ל-1 גוון/cm2 ו-30 גוון/cm2 באמצעות פתרונות מסחריים (איור 3A-C) או פתרונות מבוססי BSA/PBS מתוצרת עצמית (איור 3D-F ). כימותים לפתרונות דילול/ חסימה מתוצרת עצמית מראים את אותה מגמה של אותות PLA באזורים ציטוטוסוליים וגרעיניים. עם זאת, המספר הכולל של אירועי PLA לכל תא גבוה יותר בעת שימוש בפתרונות מסחריים (איור 3A-C, חלוניות נמוכות יותר לעומת איור 3D-F, חלוניות נמוכות יותר).
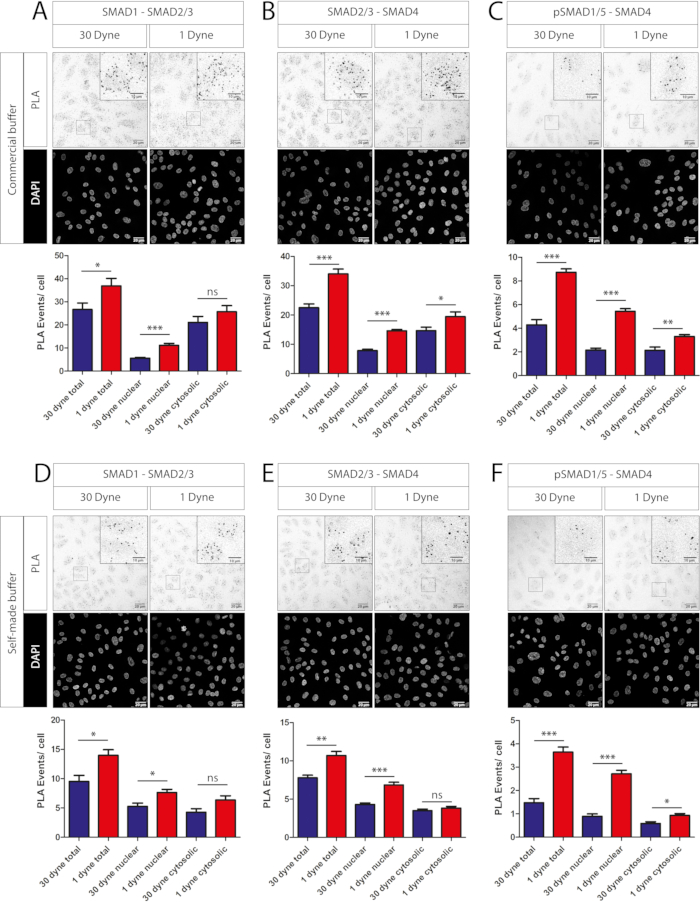
איור 3: ניסוי PLA המשווה מאגרי נוגדנים מסחריים מתוצרת עצמית. תמונות קונפוקליות (החלק העליון של כל פאנל) וכימות (חלק תחתון של כל פאנל) של PLAs SMAD-SMAD שונים ב- HUVECs חשופים ל-24 שעות של רמות לחץ הטיה שצוינו. (א-ג) מאגרים מסחריים (ראה טבלת חומרים). (D-F) מאגרים מתוצרת עצמית (3% BSA ב- PBS לחסימה, 1 % BSA ב- PBS לדילול נוגדנים). כל הנוגדנים העיקריים היו מדוללים 1: 100. סרגל קנה מידה, 20 מיקרומטר (10 מיקרומטר להגדלה). המשמעות הסטטיסטית חושבה באמצעות מבחן T דו-צדדי. ns - לא משמעותי, *P<0.05, **P<0.01, ***P<0.001. ערכים מתוארים כממוצע + SEM. Dyne שווה צביעה / cm2. נוגדנים בשימוש היו ארנב נגד SMAD2/3, עכבר אנטי SMAD1, ארנב אנטי phospho SMAD1/5 ועכבר אנטי SMAD4 (ראה טבלת חומרים). עבור כל תנאי 5 אזורים אקראיים לאורך מרכז ערוץ הזרימה שימשו לרכישת תמונה. N = 1 שכפול ביולוגי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כללנו גם דוגמה לניסוי PLA כושל. כאן, שילוב של נוגדני SMAD2/3-SMAD4 שימש שבו נוגדן SMAD4 לא היה מתאים לביצוע ניסויים אימונופלואורסצנטיים. בהשוואה לבקרות נוגדנים בודדות, לא נצפתה עלייה בנקודות בדגימות 1 דיין/cm2 או 30 צביעה/cm2 (איור 4A לעומת איור 4B). כמו היווצרות של מתחמי SMAD2/3-SMAD4 נגרמת על ידי מתח גיזה (ראה איור 3B,E), ניתן להסיק כי ניסוי PLA זה לא הצליח. זה מדגיש את החשיבות של בחירת שילובי נוגדנים נכונים כדי לזהות אירועי PLA, כמו אוריינטציה ומרחק של נוגדנים מאוגדים עשוי להיות חיוני עבור חישול מוצלח של בדיקות אוליגונוקלאוטיד.
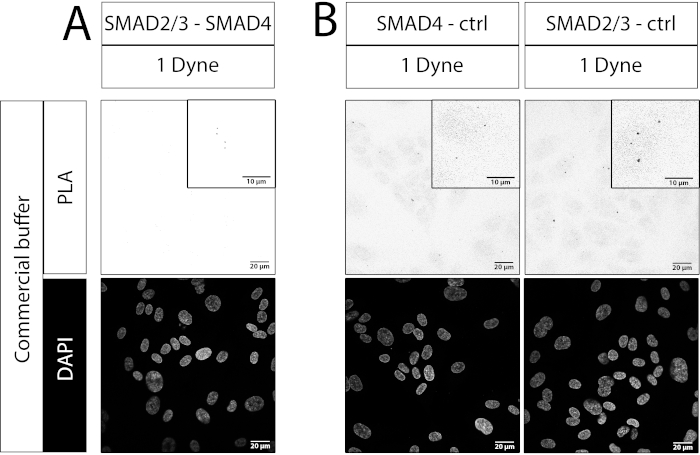
איור 4: דוגמה לניסוי PLA שנכשל. תמונות קונפוקליות, סרגל קנה מידה: 20 מיקרומטר ו- 10 מיקרומטר בהגדלה. (A) SMAD2/3-SMAD4 PLA. (B) פקדי נוגדנים בודדים. נוגדנים בשימוש היו עכבר נגד SMAD2/3 וארנב אנטי SMAD4 (ראה טבלה של חומרים). דיין שווה צביעה/cm2. עבור כל תנאי 5 אזורים אקראיים לאורך מרכז ערוץ הזרימה שימשו לרכישת תמונה. N = 1 שכפול ביולוגי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הפרוטוקול מבוסס PLA המתואר כאן מציע דרך יעילה לקבוע קרבה של שני חלבונים (למשל, האינטראקציה הישירה שלהם) ב- ECs החשופים ללחץ גיסת עם רזולוציה כמותית ומרחבית. באמצעות שקופיות זרימה עם ערוצים מקבילים מרובים, ניתן לבחון מספר אינטראקציות חלבון שונות בו זמנית בתאים בתנאים מכניים זהים. לעומת זאת, מערכות תא זרימה בהתאמה אישית עושות לעתים קרובות שימוש בערוץ יחיד הבנוי סביב כיסוי זכוכית, מה שיאפשר ניסוי PLA יחיד בלבד ללא הפקדים הדרושים לכל שקופית ומשאבה. למרות פרוטוקול זה מתמקד בזיהוי של אינטראקציות SMAD, זה יכול להיות מותאם כדי לזהות כל אינטראקציות חלבון אחרות. עם זאת, ניתוח התוצאות חייב להיעשות בזהירות כמו שני חלבונים עשויים גם להתגורר בסמיכות מבלי ליצור קומפלקסים. אם יש להצהרות ברורות על אינטראקציות של חלבונים, ניסויי PLA צריכים להיות משלימים עם שיטות נוספות כגון אימונופרנציות משותפות. בנוסף, PLA לא יכול לשמש כדי לזהות את האינטראקציה חלבון חלבון בתאים חיים מאז דגימות צריך להיות קבוע עבור איגוד נוגדנים הבאים צעדי הגברה DNA.
לגילוי מוצלח של אינטראקציות חלבון על ידי PLA, הצעד הקריטי ביותר הוא לבחור שילוב של נוגדנים ראשוניים הממלאים מספר קריטריונים: (1) הנוגדנים המזהים את שותפי החלבון הבודדים חייבים להיווצר במינים שונים (למשל, עכבר או ארנב) מכיוון שהנוגדנים המשניים הם ספציפיים למינים; באופן אידיאלי, נוגדנים כבר נבדקו בהצלחה על ידי מיקרוסקופיה אימונופלואורסצנטית קונבנציונלית; (2) המרחק בין נוגדנים הקשורים לאפיטופ צריך להיות <40 nm23; (3) מכיוון שהזיקה לכריכת נוגדנים-אפיטופ עשויה להיות שונה, יש להתאים את הריכוז הסופי של נוגדנים משומשים לכל הגדרה ניסיונית, כפי שמוצג כאן (איור 2A, פאנל תחתון לעומת איור 2C, פאנל תחתון). לכן, אם מעט מאוד אירועי PLA אבל ספציפי מזוהים, זה עשוי להיות שווה להגדיל את כמות הנוגדן בשימוש. עם זאת, יש לצייץ זאת בקפידה כדי למנוע רוויית יתר ואירועים מחייבים לא מוגדרים. כמו כן, ריכוז הנוגדנים המשמש בדגימות בקרה חייב להתאים לריכוז המשמש בדגימות PLA.
באשר לכל מדיקה ביוכימית אחרת, בקרות מתאימות חיוניות ב- PLA. כריכה לא סימויה של הנוגדנים המשומשים עשויה, למשל, להוביל לאותות PLA שמקורם בנוגדן ראשוני אחד בלבד. לכן, בקרות נוגדנים חיוניות לניסויי PLA צריכות לכלול תוספת של רק אחד משני הנוגדנים העיקריים אך הן בדיקות PLA (פלוס ומינוס). יתר על כן, פקדים ללא נוגדנים נוספו ניתן להשתמש כדי לקבוע כריכה לא פתירה של בדיקות PLA לדגימה. באופן כללי, פקדים טכניים אלה צריכים להניב לא מעט מאוד אותות PLA. אם נצפים מספר אותות, ריכוז הנוגדן העיקרי המשמש, ויש לשקול מחדש את הספציפיות שלו. בנוסף, כדאי לכלול שליטה ביולוגית חיובית, במידת האפשר. בפרוטוקול שתואר לעיל, זה יכול להיות גירוי עם ליגנד BMP כי ידוע לגרום זרחן של SMADs, ולכן, היווצרות קומפלקס טרימרי עם SMAD4.
עבור ניסויי PLA, מומלץ בדרך כלל להשתמש בתאים כי הם 50-70% מפגש, שכן זה מפשט את החדירה של ריאגנטים. עם זאת, בעת ביצוע ניסויים עם ECs, היינו טוענים בקפדנות נגד זה, אלא אם מפגש למחצה הוא חלק מההקמה הניסיונית. In vivo מחשבים אלקטרוניים יוצרים מונוניירס עם צמתים הדוקים בין תא לתא, החיוניים להומיוסטזיס של EC ולתמרת mechano-transduction29. לכן, ניסויים על ECs שאינם במפגש יכול להוליד תוצאות כוזבות. יתר על כן, תאים שאינם משוחחים נוטים יותר להתנתק משקופיות ערוץ הזרימה אם משתמשים ברמות גבוהות של לחץ גיסת במהלך הניסוי. אנו ממליצים לזרוע תאים (2-2.5 x 106 תאים / מ"ל, לראות פרוטוקול שלב 1.2) יומיים עד שלושה ימים לפני התחלה ניסיונית כמו monolayers EC צריך זמן כדי ליצור ולפתח צמתים בוגרים. לכן, לא היינו ממליצים לזרוע מספר גבוה יותר של תאים (>2.5 x 106 תאים / מ"ל) בערוצי זרימה רק יום אחד לפני הניסוי כדי להשיג monolayer confluent.
למרות שקיימת מדיית הרכבה נוזלית שונים המכילה DAPI, כדאי לכלול שלב הכתמה נפרד של DAPI ולהרכיב את התאים עם מדיום הרכבה נוזלי ללא DAPI, לפחות אם נעשה שימוש בשקופיות זרימה מבוססות פולימר. פעולה זו מונעת אותות רקע כבדים במהלך רכישת תמונה. תמונות יש לרכוש מעמדות במרכז הערוץ ולא את הקצוות מאז מתח גיסת הוא inhomogeneous בקירות הערוץ. אנו ממליצים לצלם לפחות 5-10 תמונות לכל שכפול ביולוגי ומצב של אזורים אקראיים לאורך אזור המרכז. 3 או יותר שכפולים ביולוגיים משמשים בדרך כלל כדי להשיג רלוונטיות סטטיסטית. לניתוח תמונה אנו ממליצים להשתמש בפונקציית המאקרו ImageJ/FIJI. בפרוטוקול לעיל, הזכרנו מאקרו ImageJ שמתאים לספור אירועי PLA ציטוטוסוליים גרעיים המבוססים על כתמי DAPI. משתמשים צריכים להיות מודעים לכך פרמטרים כמו גודל החלקיקים צריך להיות מותאם בהתאם לגודל גרעיני או נקודות PLA גדולות / קטנות יותר. המאקרו שומר את הסף תמונות ומסיכות PLA שיש להשוות לתמונות גולמיות כדי להעריך את הספציפיות של זיהוי אותות PLA.
לסיכום, השיטה המוצגת כאן מאפשרת ניתוח מרחבי וכמותי מהיר ויעיל של היווצרות מורכבת של גורם שעתוק בתנאי אס.אס אתרופוניים ואתרפיים. זה יאפשר למדענים לפענח עוד יותר את ההשפעה של היווצרות מורכבת SMAD אצל ארוגנזה ומחלות כלי דם בכלל. זה יכול, יתר על כן, להיות מותאם כדי לחקור את ההשלכות של קרבה של חלבונים שונים אלה פתולוגיות כלי דם.
Disclosures
המחברים מצהירים שאין ניגוד אינטרסים.
Acknowledgements
אנו מודים לד"ר מריה רייכנבך ולט"ר כריסטיאן הייפן על תמיכתם במערכת הזרימה ואלינור פוקס ויוניון שיאו על שקראו את כתב היד בביקורתיות. P-L.M. מומן על ידי בית הספר הבינלאומי מקס פלאנק מחקר IMPRS-ביולוגיה וחישוב (IMPRS-BAC). PK קיבלה מימון על ידי DFG-SFB1444. איור 1 נוצר באמצעות BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
References
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557(2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756(2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T. Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. Dijke, P. T., Heldin, C. -H. , Springer Netherlands. Dordrecht. 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989(2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980(2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58(2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi. , Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012).
- Application Note 13: HUVECs under perfusion. ibidi. , Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019).
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051(2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved