Method Article
使用接近-连接-测定法对不同流体剪切应力条件下TGFβ/BMP/SMAD信号传导的可视化和定量
摘要
在这里,我们建立了一个方案,使用暴露于病理和生理流体剪切应激条件下的内皮细胞中的接近连接测定(PLA)同时可视化和分析多个SMAD复合物。
摘要
转化生长因子β(TGFβ)/骨形态发生蛋白(BMP)信号传导在脉管系统的发展和稳态期间受到严格调节和平衡因此,该信号通路中的失调导致严重的血管病变,例如肺动脉高血压,遗传性出血性毛细血管扩张症和动脉粥样硬化。内皮细胞(EC)作为血管的最内层,不断暴露于液体剪切应激(SS)。液体SS的异常模式已被证明可以增强TGFβ / BMP信号传导,其与其他刺激一起诱导动脉粥样硬化发生。与此相关,发现低层流SS的动脉粥样硬化素可以增强TGFβ / BMP信号传导,而动脉粥样硬化保护,高层流SS可以减少这种信号传导。为了有效地分析这些途径的激活,我们设计了一个工作流程,使用市售的气动泵系统和接近连接测定(PLA)研究在低层流SS和高层流SS条件下转录因子复合物的形成。
活性TGFβ / BMP信号传导需要形成由两个调节性SMAD(R-SMAD)组成的三聚体SMAD复合物;分别用于TGFβ和BMP信号传导的SMAD2 / 3和SMAD1 / 5 / 8,具有共同介质SMAD(co-SMAD;SMAD4)。使用PLA靶向三聚体SMAD复合物的不同亚基,即R-SMAD / co-SMAD或R-SMAD / R-SMAD,可以使用荧光显微镜定量和空间测量活性SMAD转录因子复合物的形成。
使用具有6个小平行通道的流动载玻片,可以串联连接,允许研究转录因子复合物的形成并包含必要的对照。
这里解释的工作流程可以很容易地适应针对SMADs与其他转录因子或转录因子复合物的接近性的研究,在不同的流体SS条件下。本文介绍的工作流程展示了一种快速有效的方法,可以从定量和空间上研究EC中的流体SS诱导的TGFβ / BMP信号传导。
引言
转化生长因子β(TGFβ)超家族的蛋白质是多效性细胞因子,具有多种成员,包括TGFβ,骨形态发生蛋白(BMP)和Activins1,2。配体结合诱导受体低聚物的形成,导致磷酸化,从而激活细胞质调节性SMAD(R-SMAD)。根据配体的亚家族,激活不同的R-SMAD1,2。虽然TGFβs和激活素主要诱导SMAD2 / 3的磷酸化,但BMP诱导SMAD1 / 5 / 8磷酸化。然而,越来越多的证据表明,BMPs和TGFβs/Activins也激活了各自其他亚家族的R-SMAD,其过程称为"横向信号传导"3,4,5,6,7,8,并且存在由SMAD1 / 5和SMAD2 / 3组成的混合SMAD复合物,成员3,9.两个活化的R-SMAD随后与共同介质SMAD4形成三聚体复合物。然后,这些转录因子复合物能够易位到细胞核中并调节靶基因的转录。SMAD可以与各种不同的转录共激活剂和共抑制剂相互作用,从而导致调节靶基因的可能性多样化10。SMAD信号传导的放松管制对多种疾病都有严重影响。与此一致,不平衡的 TGFβ/BMP 信号传导可能导致严重的血管病变,例如肺动脉高压、遗传性出血性毛细血管扩张症或动脉粥样硬化3,11,12,13,14。
内皮细胞(EC)形成血管的最内层,因此暴露于剪切应力(SS),这是由血液粘性流动施加的摩擦力。有趣的是,居住在脉管系统部分的EC暴露于高水平的均匀层流SS,保持稳态和静止状态。相反,经历低、不均匀 SS 的 EC(例如,在主动脉弓的分叉或较小曲率处)会增殖并激活炎症通路15。反过来,功能失调的EC的部位容易发生动脉粥样硬化。有趣的是,这些动脉粥样硬化区域中的EC显示出异常高水平的激活SMAD2 / 3和SMAD1 / 516,17,18。在这种情况下,发现增强的TGFβ / BMP信号传导是动脉粥样硬化病变发展的早期事件19 ,并且发现对BMP信号传导的干扰可显着减少血管炎症,动脉粥样硬化形成和相关钙化20。
邻近连接测定(PLA)是一种原位研究蛋白质 - 蛋白质相互作用的生化技术21,22。它依赖于可以结合目标蛋白的不同物种抗体的特异性,从而允许在单细胞水平上高度特异性地检测内源性蛋白质相互作用。在这里,一抗必须在小于40nm的距离内与其靶表位结合,以允许检测23。因此,PLA与传统的共免疫沉淀方法相比非常有益,因为传统共免疫沉淀方法需要数百万个细胞来检测内源性蛋白质相互作用。在PLA中,物种特异性二抗与DNA片段共价连接(称为加号和减号探针),与一抗结合,如果感兴趣的蛋白质相互作用,加号和减号探针非常接近。DNA在下一步中结扎,并且使环状DNA的滚动圆扩增成为可能。在扩增过程中,荧光标记的互补寡核苷酸与合成的DNA结合,允许通过常规荧光显微镜观察这些蛋白质相互作用。
这里描述的方案使科学家能够使用PLA定量比较体 外 动脉粥样硬化保护和阿瑟罗普酮SS条件下活性SMAD转录复合物的数量。SS通过可编程气动泵系统产生,该系统能够产生定义水平的层流单向流量,并允许逐步增加流速。该方法允许检测SMAD1 / 5或SMAD2 / 3与SMAD4之间的相互作用,以及混合R-SMAD复合物。它可以很容易地扩展到分析SMAD与转录共调节因子的相互作用或SMAD以外的转录因子复合物。 图 1 显示了下面显示的协议的主要步骤。

图1:所描述的协议的示意图。 (A)接种在6通道载玻片中的细胞暴露于气动泵系统的剪切应力。(B)固定电池用于PLA实验或用于对照条件。(C)使用荧光显微镜获取PLA实验的图像,并使用ImageJ分析软件进行分析。 请点击此处查看此图的放大版本。
研究方案
1. 细胞培养和流体剪切应力暴露
注:以人脐静脉EC(HUVECs)为例研究SS诱导的SMAD相互作用。下面描述的方案可以应用于每种SS响应细胞类型。
- 在37°C下用0.1%猪皮明胶在PBS中涂覆6通道载玻片30分钟。
- 在预包被的6通道载玻片中以每mL2.5×10 6 个细胞的密度在30μL M199全培养基中接种HUVECs。
注:有关如何在流动载玻片中播种细胞的更多信息,请参见参考文献24。 - 让细胞在37°C下在加湿的培养箱中粘附1小时。
- 向每个储液槽中加入60μL预热的M199全培养基。
- 在37°C下在加湿的培养箱中培养2天,每天一次,温和地交换培养基。
- 完全吸出储液槽,在其中一个储液槽中加入120μL预热的M199全培养基,然后从另一侧吸出。
- 向两个储液槽中加入60μL预热的M199全培养基。
- 组装并启动流程设置,详见参考文献25。
- 将卡套管安装在流体装置上。在这里,直径为0.8 mm和1.6 mm的硅胶管分别用于施加1 dyn/cm2 和30 dyn/cm2的剪切应力。
注:材料和卡套管长度应保持不变,因为变化可能会影响产生的剪切应力。通常,可以使用泵系统和管道的其他组合,只要知道产生的剪切应力,并且泵产生稳定的层流。 - 用适量预热的M199全培养基(至少10 mL)填充储液槽。
- 将流体装置与管道连接到泵系统,并在没有电池的情况下进行预运行,以平衡介质并除去任何剩余的空气25。
- 使用串行连接管将 6 通道滑台上的单个通道串行连接到另一个通道。幻灯片上的第一个和最后一个通道将连接到1.6.1中组装的管道(有关方案,请参见 图1A )。注意不要将任何空气引入系统,因为这可能会严重损害细胞。有关串行连接的更多信息,请参见参考26。
- 对于细胞暴露于高水平的剪切应力(>20 dyn/cm2),使用斜坡相,即通过适应阶段逐步增加剪切应力。步长可以设置为每 30 分钟 5 个 dyn/cm2 的增量。
- 将卡套管安装在流体装置上。在这里,直径为0.8 mm和1.6 mm的硅胶管分别用于施加1 dyn/cm2 和30 dyn/cm2的剪切应力。
2. 固定
- 在流体 SS 暴露后,从泵上拆下滑块。拆卸时在管道上使用夹子,以避免培养基溢出到培养箱中。
- 立即在冰上滑动转移流,而其余的管道则按顺序分离。从储液槽中取出油管时,另一侧的储液器应用手指保持封闭,以避免将气泡困在通道中。这可能会干扰固定步骤。
- 将细胞保持在冰上,小心地从储液槽中吸出培养基,而不是从细胞所在的通道中吸出。随后,用三倍于通道体积(90μL)的冷无菌PBS(4°C)洗涤样品。在一个储液槽中加入PBS,然后小心地从另一个储液槽吸出。在每张幻灯片的 6 个通道中分别重复此步骤。
注意:对于所有洗涤和孵育步骤,将相应的溶液添加到其中一个储液槽中,从而导致通道中溶液的交换。为了允许通道中溶液的完全替代,然后从另一个储液器中吸出多余的溶液。通道中细胞顶部的溶液不会被移除。细胞在任何时候都不应干燥。因此,重要的是要仔细清洗,不要有任何气泡插入载玻片中。 - 通过在事先添加PBS的同一储液槽中加入90μL缓冲的4%PFA溶液来固定细胞,并同样地从另一个储液槽吸出液体。在每张幻灯片的每个通道中重复此步骤。加入PFA溶液后,将样品从冰转移到室温(RT)并孵育20分钟。
注意:PFA是有毒的,应谨慎处理。戴上手套,在通风橱下工作。 - 用PBS(RT)洗涤细胞3x,将其添加到一个储液槽中,然后小心地从另一个储液槽中吸出。仅清空储液槽,确保通道不会变干。对每张幻灯片的 6 个通道中的每一个重复此步骤。
- 通过在其中一个储液槽中加入90μL环境50 mM氯化铵来淬灭PFA固定。从另一个储液槽中吸出过量的溶液。对幻灯片中的每个通道重复上述步骤。将样品在室温下孵育10分钟。
- 如步骤2.5中所述洗涤。
注意:此时,样品可以在4°C下储存过夜,或者可以立即继续封闭和一抗孵育方案(见步骤3)。
3. 阻断和一抗孵育
- 为了透化细胞,在清空的储液槽中加入PBS中的90μL0.3%Triton-X-100,并从另一个储液槽吸出每个通道。在室温下孵育10分钟。
- 如步骤2.5中所述洗涤。
- 在通道的一个储液槽中加入90μL无菌PLA封闭溶液,并从另一侧吸出。对每个通道重复此步骤。在37°C下在加湿室中阻断1小时。
- 要制作加湿室,请使用10厘米的培养皿,用蜡膜密封的湿纸巾,并将培养皿放入培养箱中。或者,可以使用其他湿度室形式来提供潮湿的气氛。
注意:或者,可以使用自制的封闭溶液(例如,PBS中3%(w / v)BSA,无菌过滤)。
- 要制作加湿室,请使用10厘米的培养皿,用蜡膜密封的湿纸巾,并将培养皿放入培养箱中。或者,可以使用其他湿度室形式来提供潮湿的气氛。
- 在PLA抗体稀释剂中制备一抗(1:100)。每通道准备30μL溶液。同时添加两种一抗并涡旋。
注意:或者,也可以使用自制的抗体稀释剂(例如,PBS中的1%(w / v)BSA)。这里使用的抗体是SMAD1-SMAD2/3、SMAD2/3-SMAD4和磷酸化-SMAD1/5-SMAD4的组合。详细信息可在 材料表中找到。 - 在施用一抗之前,从储液槽中吸出阻断溶液,并且小心地从通道中吸出。在加入溶液的同时,通过倾斜通道,将30μL一抗溶液立即移液到空通道中。
注意:逐个通道地去除封闭溶液并添加抗体溶液,以确保细胞在两者之间不会变干。 - 将样品与一抗在4°C的加湿室中孵育过夜。
注意:如果有兴趣在同一天继续执行以下步骤,也可以在室温下孵育1小时。
4. PLA探针孵育
注意:对于第4.1-7.3节中的所有步骤,洗涤缓冲液A和B储存在4°C,并且在使用前需要加热到室温。
- 将PLA探针(+)-小鼠和(-)兔在PLA抗体稀释剂(或1%BSA)溶液中稀释至1:5。每通道准备30μL。
- 使用90μL洗涤缓冲液A在室温下洗涤样品2x5分钟,方法是将其加入其中一个储液槽中并从另一个储液槽中小心地吸出。对每张幻灯片的 6 个通道中的每一个重复此步骤。
- 小心地吸出洗涤缓冲液A并加入30μLPLA探针溶液(在步骤4.1中制备),类似于在步骤3.5中加入一抗。
- 在37°C下在加湿室中孵育样品1小时。
5. 结扎
- 如4.2中所述,在室温下使用90μL洗涤缓冲液A洗涤样品2x5分钟。
- 在去离子水中制备1:5稀释的连接缓冲液。使用该缓冲液将连接酶稀释至1:40(在冰上)。每通道使用30 μL。
- 完全吸出洗涤缓冲液A并加入3.5中所述的连接溶液。
- 将样品在37°C下在加湿室中孵育30分钟。
6. 扩增
- 如4.2中所述,在室温下使用90μL洗涤缓冲液A洗涤样品2x2分钟。
- 通过将扩增缓冲液在去离子水中以1:5稀释,并用它来将聚合酶稀释至1:80(在冰上)。避光。每通道准备30μL。
- 将洗涤缓冲液A完全吸出,并立即将准备好的扩增溶液加入空通道中,如3.5中所述。将样品在37°C下在加湿室中孵育100分钟。
7. 安装
- 如4.2中所述,使用90μL洗涤缓冲液B在室温下洗涤样品2x10分钟。在第一次洗涤中从1mg / mL储备溶液(在去离子水中)中加入DAPI(1:500)以染色细胞核。不要干燥通道。
- 将洗涤缓冲液B稀释在去离子水(1:10)中,并用90μL0.1x缓冲液B溶液洗涤1x,如4.2中所述。
- 将洗涤缓冲液B完全吸出,并立即将2-3滴液体安装介质加入一个储液罐中。通过倾斜载玻片将其分布在通道中。将样品储存在4°C的加湿环境中,直到成像。
8. 图像采集
- 使用荧光显微镜采集图像。确保适合荧光PLA探头的相应滤光片可用。
注意:如果可能的话,使用共聚焦显微镜是有益的,因为获得的PLA斑点更加明确。这也支持进一步的图像处理和数据分析。
9. 使用ImageJ/FIJI进行图像分析和定量
- 使用图像处理程序(如 ImageJ27)处理导出的图像(.tiff)。
注意:本研究中使用的所有脚本以及自动计数细胞,核和所有PLA事件(每个细胞)所必需的脚本都可以在GitHub存储库中找到:https://github.com/Habacef/Proximity-Ligation-Assay-analysis。使用任何合适的程序或工具执行统计分析。
结果
我们之前使用PLA来检测不同SMAD蛋白3 的相互作用,并分析了剪切应力引起的SMAD磷酸化变化28。
在这里,这两种方法都与上述协议相结合。将HUVECs置于1 dyn/cm2 和30 dyn/cm2 的剪切应力下,并分析SMAD转录因子的相互作用。我们表明,与高剪切应力(30 dyn / cm2)相比,低剪切应力(1 dyn / cm2)导致SMAD1-SMAD2 / 3相互作用显着增加,即所谓的混合SMAD复合物在两者中,细胞质基质和分析细胞的细胞核(图2A,下图)。PLA事件在两个样品中都可见为不同的斑点,并且可以通过DAPI染色来区分胞质和核事件(图2A,上图)。相反,抗体对照,其中只有一种一种一抗,但仍然两个PLA探针被孵育,显示出可忽略不计的PLA信号(图2B)。因此,可以得出结论,实验是成功的。

图2:SMAD2/3-SMAD1 PLA比较不同抗体浓度。(A)暴露于指示SS水平24小时的HUVECs中的SMAD2/3-SMAD1-PLA共聚焦荧光图像和定量。抗体稀释比:1:100。(B)A.(C)暴露于指示SS水平24小时的HUVECs中SMAD2 / 3-SMAD1-PLA的共聚焦荧光图像和定量。抗体稀释比:1:50。用于 A-C 的比例尺:放大时为 20 μm 和 10 μm。Dyne 等于 dyn/cm2。使用的抗体是兔抗SMAD2 / 3和小鼠抗SMAD1(见材料表)。对于每个条件,沿流道中心的5个随机区域用于图像采集。N=1个生物重复。请点击此处查看此图的放大版本。
为了显示不同浓度的抗体如何改变PLA结果,用1:50而不是1:100稀释的抗体进行了相同的实验。在这些条件下,两倍的抗体量导致每个细胞的PLA信号高出四倍以上(比较 图2A 和 图2C)。当使用较高的抗体浓度时,1 dyn/cm2 和30 dyn/cm2 之间的信号差异减小,并且总和胞质PLA事件失去统计学意义(图2A,下图; 图2C,下面板)。这可能是由于信号合并和区分解放军事件的问题。如果发生这种信号积累,应降低抗体浓度。
此外,我们发现用于封闭和抗体稀释的自制缓冲液可用作原位PLA试剂盒中包含的商业缓冲液的替代品。使用商业解决方案(图3A-C)或基于自制BSA/PBS的解决方案(图3D-F)比较SMAD1-SMAD2/3(图3A与图3D)、SMAD2/3-SMAD4(图3B与图3E)和pSMAD1/5-SMAD4(图3C与图3F)复合物在1 dyn/cm2和30 dyn/cm2下的PLA事件。).商用和自制稀释剂/阻断溶液的定量在胞质和核区域显示出相同的PLA信号趋势。但是,使用商业解决方案时,每个单元的 PLA 事件总数较高(图 3A-C,下面板与图 3D-F,下面板)。
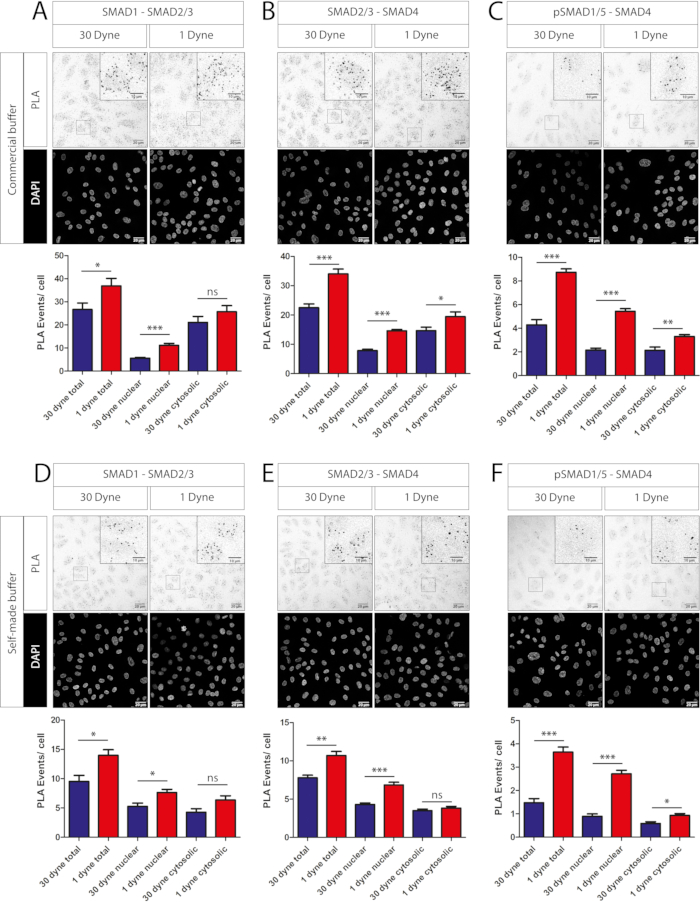
图3:PLA实验比较了商用和自制抗体缓冲液。 暴露于24小时指示剪切应力水平的HUVEC中不同SMAD-SMAD PLA的共聚焦图像(每个面板的上部)和定量(每个面板的下部)。(A-C)商用缓冲液(见 材料表)。(D-F)自制缓冲液(PBS中3%BSA用于封闭,PBS中1%BSA用于抗体稀释)。所有一抗均以1:100稀释。比例尺,20 μM(放大时为 10 μM)。使用双侧 t 检验计算统计学意义。ns - 非显著性, *P<0.05, **P<0.01, ***P<0.001.值表示为均值 + SEM。Dyne 等于 dyn/cm2。使用的抗体是兔抗SMAD2/3、小鼠抗SMAD1、兔抗磷酸化SMAD1/5和小鼠抗SMAD4( 见材料表)。对于每个条件,沿流道中心的5个随机区域用于图像采集。N=1个生物重复。 请点击此处查看此图的放大版本。
我们还举了一个失败的解放军实验的例子。在这里,SMAD2 / 3-SMAD4抗体的组合用于SMAD4抗体不适合进行免疫荧光实验。与单抗体对照相比,在1 dyn/cm2或30 dyn/cm2样品中均未观察到斑点增加(图4A与图4B)。由于SMAD2/3-SMAD4配合物的形成是由剪切应力引起的(见图3B,E),因此可以得出结论,该PLA实验不成功。这凸显了选择正确的抗体组合来检测PLA事件的重要性,因为结合抗体的方向和距离对于寡核苷酸探针的成功退火可能至关重要。
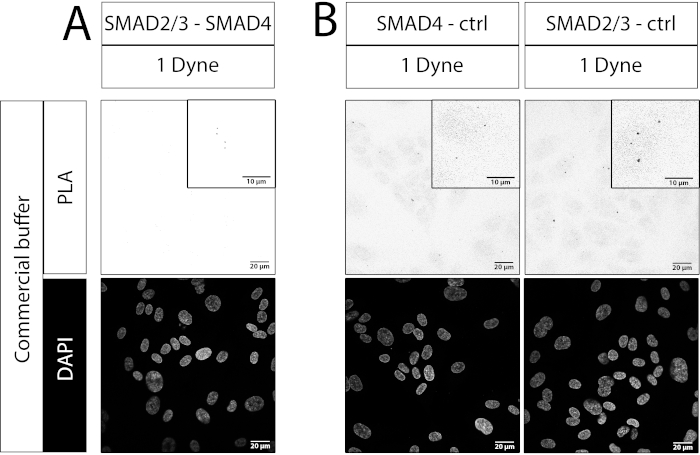
图 4:PLA 实验失败示例。共聚焦图像,比例尺:放大20 μm和10 μm。(B)单抗体对照。使用的抗体是小鼠抗SMAD2 / 3和兔抗SMAD4(见材料表)。Dyne 等于 dyn/cm2。对于每个条件,沿流道中心的5个随机区域用于图像采集。N=1个生物重复。请点击此处查看此图的放大版本。
讨论
这里描述的基于PLA的方案提供了一种有效的方法来确定暴露于剪切应力的EC中两种蛋白质的接近度(例如,它们的直接相互作用),具有定量和空间分辨率。通过使用具有多个平行通道的流动载玻片,可以在相同的机械条件下同时在细胞中检查几种不同的蛋白质相互作用。相比之下,定制的流室系统通常使用围绕玻璃盖玻片构建的单通道,这将只允许一个PLA实验,而无需每个滑块和泵的必要控制。虽然该协议侧重于检测SMAD相互作用,但它可以用于检测任何其他蛋白质相互作用。然而,必须仔细分析结果,因为两种蛋白质也可能非常接近而不形成复合物。如果需要关于蛋白质相互作用的明确陈述,PLA实验应辅以其他方法,如共免疫沉淀。此外,PLA不能用于检测活细胞中的蛋白质 - 蛋白质相互作用,因为需要固定样品以进行随后的抗体结合和DNA扩增步骤。
为了通过PLA成功检测蛋白质相互作用,最关键的步骤是选择满足几个标准的一抗组合:(1)检测单个蛋白质伴侣的抗体必须在不同的物种(例如,小鼠或兔子)中产生,因为二抗是物种特异性的;理想情况下,抗体已经通过常规免疫荧光显微镜成功测试;(2)表位结合抗体之间的距离应<40nm23;(3)由于抗体-表位结合的亲和力可能不同,因此必须针对每个实验设置调整所用抗体的最终浓度,如图2A所示(图2A,下图与 图2C,下图)。因此,如果检测到很少但特异性的PLA事件,则可能值得增加抗体的使用量。但是,必须仔细滴定,以避免过饱和度和不特异性结合事件。此外,对照样品中使用的抗体浓度必须与PLA样品中使用的浓度相匹配。
与任何其他生化测定一样,在PLA中适当的对照是必不可少的。例如,所用抗体的非特异性结合可能导致PLA信号仅来自一种一抗。因此,PLA实验的基本抗体对照应仅包括添加两种一抗中的一种,但应同时添加两种PLA探针(加号和减号)。此外,未添加抗体的对照可用于确定PLA探针与样品的非特异性结合。一般而言,这些技术控制应该不会对极少数解放军信号产生影响。如果观察到多个信号,应重新考虑所用一抗的浓度及其特异性。此外,如果可能的话,包括积极的生物控制是有用的。在上面描述的方案中,这可能是用已知诱导SMADs磷酸化的BMP配体刺激,因此,用SMAD4形成三聚体复合物。
对于PLA实验,通常建议使用汇合度为50-70%的细胞,因为这简化了试剂的渗透。然而,当用EC进行实验时,我们会严格反对这一点,除非半汇合是实验设置的一部分。 体内 EC形成具有紧密细胞间连接的单层,这对于EC稳态和机械转导至关重要29。因此,在非汇合EC上进行实验可能会产生错误的结果。此外,如果在实验过程中使用高水平的剪切应力,非汇合细胞更容易从流道载玻片上脱落。我们建议在实验开始前两到三天接种细胞(2-2.5×10 6 个细胞/ mL,参见实验方案步骤1.2),因为EC单层需要时间来形成和发育成熟的连接。因此,我们不建议在实验前一天在流动通道中接种更多数量的细胞(>2.5 x 106 个细胞/ mL)以获得汇合单层。
尽管存在各种含有DAPI的液体安装介质,但至少如果使用基于聚合物的流动载玻片,则值得包括单独的DAPI染色步骤并使用不含DAPI的液体安装介质安装电池。这可以防止在图像采集过程中出现大量背景信号。影像应从通道中心而不是边缘的位置获取,因为通道壁处的剪切应力是不均匀的。我们建议每个生物复制和中心区域随机区域的状况至少拍摄5-10张图像。通常使用3个或更多个生物重复来获得统计相关性。对于图像分析,我们建议使用ImageJ / FIJI宏功能。在上面的实验方案中,我们提到了一种ImageJ宏,它适合于基于DAPI染色的细胞质和核PLA事件计数。用户应注意,颗粒大小等参数需要根据核大小或更大/更小的PLA点进行调整。该宏保存了阈值 PLA 图像和掩码,应将其与原始图像进行比较,以评估 PLA 信号检测的特异性。
总之,这里介绍的方法允许在动脉粥样硬化和动脉粥样硬化素SS条件下快速有效地对转录因子复合物的形成进行空间和定量分析。它将使科学家能够进一步破译SMAD复合物形成对动脉粥样硬化发生和血管疾病的影响。此外,它可以用于研究这些血管病理学中不同蛋白质接近的后果。
披露声明
作者声明没有利益冲突。
致谢
我们感谢 Maria Reichenbach 博士和 Christian Hiepen 博士对流程设置系统的支持,并感谢 Eleanor Fox 和 Yunyun Xiao 对手稿的批判性阅读。P-L.M.由国际马克斯普朗克研究学院IMPRS-Biology and Computing(IMPRS-BAC)资助。PK获得了DFG-SFB1444的资助。图 1 是使用 BioRender 创建的。
材料
| Name | Company | Catalog Number | Comments |
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
参考文献
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557(2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756(2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T. Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. Dijke, P. T., Heldin, C. -H. , Springer Netherlands. Dordrecht. 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989(2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980(2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58(2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi. , Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012).
- Application Note 13: HUVECs under perfusion. ibidi. , Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019).
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051(2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。