Method Article
שימוש במכשיר עזר חדרית עורית/אטריום שמאלי למערכת מעקף עורק הירך עבור הלם קרדיוגני
In This Article
Summary
המאמר הבא מתאר את הליך שלב למיקום של מכשיר (למשל, טנדמהארט) בהלם קרדיוגני (CS) שהוא מכשיר עזר לחדר שמאלי עורי (pLVAD) ופרוזדור שמאלי למערכת מעקף עורק הירך (LAFAB) העוקפת ותומכת בחדר השמאלי (LV) ב- CS.
Abstract
מערכת האיזוזים השמאלית לעורק הירך (LAFAB) היא מכשיר תמיכה מכני במחזור הדם (MCS) המשמש בהלם קרדיוגני (CS) העוקף את החדר השמאלי על ידי ניקוז דם מהאטריום השמאלי (LA) והחזרתו למחזור העורקי המערכתי דרך עורק הירך. זה יכול לספק זרימות הנעות בין 2.5-5 ליטר / דקה בהתאם לגודל הצינורית. כאן, אנו דנים במנגנון הפעולה של LAFAB, נתונים קליניים זמינים, אינדיקציות לשימוש בו בהלם קרדיוגני, צעדי השתלה, טיפול פוסט פרוצדורלי וסיבוכים הקשורים לשימוש במכשיר זה ובניהול שלהם.
אנו מספקים גם וידאו קצר של הרכיב הפרוצדורלי של טיפול במכשיר, כולל הכנת מיקום מראש, מיקום עורי של המכשיר באמצעות ניקוב טרנסספטלי תחת הדרכה אקוקרדיוגרפית וניהול לאחר הניתוח של פרמטרי המכשיר.
Introduction
הלם קרדיוגני (CS) הוא מצב של תת-לחץ דם של רקמות עם או בלי תת לחץ דם במקביל, שבו הלב אינו מסוגל לספק מספיק דם וחמצן כדי לענות על דרישות הגוף, וכתוצאה מכך אי ספיקת איברים. הוא מסווג לשלבים א' עד ה' על ידי האגודה לאנגיוגרפיה והתערבויות לב וכלי דם (SCAI): שלב A - חולים בסיכון למדעי העיתות; שלב B - חולים בשלב תחילת של CS עם תת לחץ דם או טכיקרדיה ללא hypoperfusion; שלב C - CS קלאסי עם פנוטיפ קר ורטוב הדורש inotropes / vasopressors או תמיכה מכנית כדי לשמור על זלוף; שלב D - הידרדרות בתמיכה הרפואית או המכנית הנוכחית הדורשת הסלמה למכשירים מתקדמים יותר; ושלב E - כולל חולים עם התמוטטות במחזור הדם והפרעות קצב עקשן אשר חווים באופן פעיל דום לב עם החייאה לבבית מתמשכת1. הגורמים הנפוצים ביותר למדעת המחשבים הם MI (AMI) חריף המייצג 81% מהמקרים בניתוח שדווח לאחרונה2, ואי ספיקת לב חריפה (ADHF). CS מאופיין קלאסית על ידי גודש זלוף לקוי, המתבטא בלחצי מילוי גבוהים (לחץ טריז נימי ריאתי [PCWP], לחץ קצה-דיאסטולי בחדר השמאלי [LVEDP], לחץ ורידי מרכזי [CVP], ולחץ קצה-דיאסטולי בחדר הימני [RVEDP]), ירידה בתפוקת הלב (CO), מדד הלב (CI), תפוקת כוח הלב (CPO) ותקלה באיבר הקצה3 . בעבר, הטיפולים הזמינים היחידים עבור AMI מסובך על ידי CS היו revascularization מוקדם וניהול רפואי עם inotropes ו /או vasopressors4. לאחרונה, עם הופעתם של מכשירי תמיכה מכניים במחזור הדם (MCS) וההכרה כי הסלמה של vasopressors קשורה לתמותה מוגברת, חל שינוי פרדיגמה בטיפול הן של AMI ו- ADHF הקשורים CS5,6.
בעידן הנוכחי של התקני סיוע חדרית מלתועים (pVAD), ישנן מספר פלטפורמות / תצורות התקן MCS זמינות, המספקות תמיכה במחזור הדם ובחיקונים חד-חדריים עם ובלי יכולת חמצון7. למרות עלייה מתמדת בשימוש ב-pVADs לטיפול הן ב-AMI והן ב-ADHF CS, שיעורי התמותה נותרו ברובם ללא שינוי5. עם ראיות המתעוררות ליתרונות קליניים אפשריים לפריקה מוקדמת של החדר השמאלי (LV) ב- AMI8 ושימוש מוקדם ב- MCS ב- AMI CS9, השימוש ב- MCS ממשיך לגדול.
התקן MCS של מפרזים שמאליים לעורק הירך (LAFAB) עוקף את ה-LV על ידי ניקוז דם מהאטריום השמאלי (LA) והחזרתו למחזור הדם המערכתי דרך עורק הירך (איור 1). הוא נתמך על ידי משאבה צנטריפוגלית חיצונית המציעה זרימה של 2.5-5.0 ליטר לדקה (L/m) (משאבת דור חדש, המיועדת ל- LifeSPARC, המסוגלת לזרימה של עד 8 ליטר/ מ') בהתאם לגודל הקנולות. ברגע שהדם מופק מלוס אנג'לס דרך הצינורית הוורידית הטרנספטלית, הוא עובר דרך המשאבה הצנטריפוגלית החיצונית אשר מחזירה את הדם לגוף המטופל דרך הצינורית העורקית המונחת בעורק הירך.
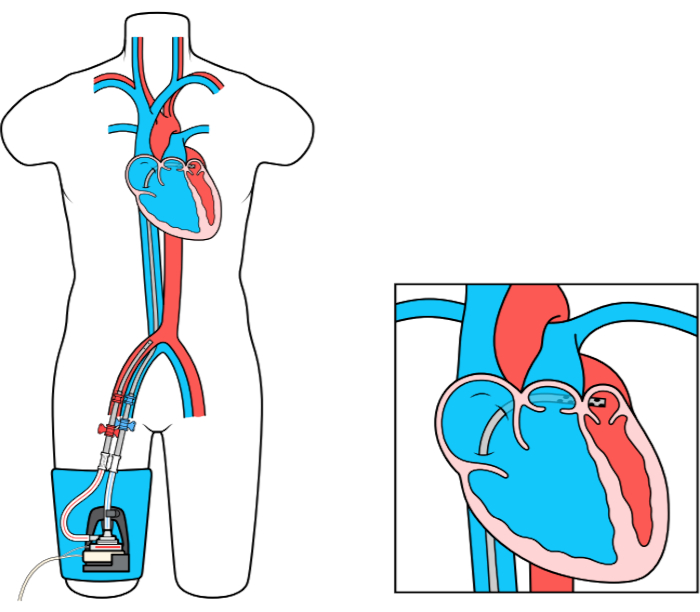
איור 1: הגדרת LAFAB. התמונה באדיבות TandemLife, חברת בת בבעלות מלאה של LivaNova US Inc. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Protocol
הליך ופרוטוקול זה אושרו על ידי ועדת הבדיקה המוסדית ומינהל המזון והתרופות האמריקאי (FDA).
1. קריטריוני מטופל
- כלול חולים עם שלב B של CS ומעלה כפי שהוגדר על ידי הצהרת הקונצנזוס SCAI1.
- כלול כגשר להשתלה או מערכת סיוע עמידה בחדר השמאלי באי ספיקת לב שלב D.
- כלול כגשר להתאוששות ב- AMI מסובך על ידי CS.
- אל תכלול אינדיקציה קונטרה לחיטוי נגד קרישה מערכתי.
- אל תכלול תוחלת חיים <6 חודשים (ממאירות פעילה).
- אל תכלול אם יש את הנוכחות של תרומבוס לוס אנג'לס.
- אל תכלול אם חולים יש מחלת כלי דם היקפית (PVD) עם עורקים קטנים שאינם יכולים להכיל את הקנולות הגדולות.
- אל תכלול אם לחולים יש פגיעה נוירולוגית/תרדמת בלתי הפיכה.
- אל תכלול אם לחולים יש אי ספיקה חמורה באבי העורקים (AI).
- אל תכלול אם לחולים יש פגם במחיצה בחדר (VSD).
הערה: המיקום של מכשיר LAFAB כולל שלושה תהליכים נפרדים: 1) הגדרת הבקר והמשאבה; 2) מיקום של קנולות עורקיות ורידיות וגישה טרנספטלית תחת אקו-לב טראנס-ושט (TEE) או אקו לב (ICE); ו-3) חיבור המערכת למעגל.
2. מיקום האטריום השמאלי למכשיר מעקף עורק הירך
- הגדרת הבקר
הערה: ניתן לבצע שלב זה כאשר המטופל מועבר למעבדה והטבלה מוגדרת להליך. בדרך כלל, נציג המכשיר וצוות perfusionist נוכח כדי לסייע בתהליך.- פתח את התיבה ופתח את הגדרת הבקר בשלבים הבאים.
- לפני הפעלת הבקר, מקם 2 סוללות בבקר על-ידי פתיחת דלת הסוללה. הכנס כל סוללה על-ידי הצבת הסמל הפונה הרחק ממסך הבקר. החריץ בסוללה אמור ליישר קו עם בית הסוללה המרכזי. ודא כי הסוללות יושבות היטב.
- התקן את 2 הסוללות האחרות ברציף לאחר אותו תהליך.
- חבר את הבקר לרציף, ודא שהוא יושב באופן מלא על העגינה וחבר את כבל החשמל לשקע החשמל וחבר אותו לשקע הקיר לקבלת מתח AC. הבקר יכול לפעול ב- Dock המחובר לחשמל AC או כאשר הוא מופרד מהעגינה, הוא יכול לפעול באמצעות מתח סוללה.
- הר את המזח ואת הבקר על מוט תוך ורידי באמצעות מהדק.
- הפעל את הבקר באמצעות הלחצנים בצד.
- הגדרת המשאבה – הקמת המערכת
הערה: תוחם המשאבה דורש שני אנשים - המפעיל הראשי הוא קרצוף (מפעיל סטרילי) ונשאר בשדה סטרילי. האופרטור המשני (אופרטור לא סטרילי) מטפל בבקר בשדה הלא סטרילי. הפחתת אוויר של המשאבה היא צעד מכריע ויש לבצעה בזהירות רבה.- תגיש לאופרטור המשני לפתוח את החבילה ולהציג את מגש הפרימינג לאופרטור הראשי. יש המפעיל הראשי ולאחר מכן לפתוח את וילון סטרילי לפרוס את הרכיבים של מגש priming על השולחן סטרילי. המשאבה, החמצון וצינורות החמצן הירוק כלולים במגש.
- תן לאופרטור הראשי להעביר את קו הכונן של המשאבה למפעיל המשני אשר מחבר אותו לבקר.
- יש המפעיל סטרילי להסיר את כובעי המגן על הצינורות ומכניס את הקצוות לאגן. הצינורות הכחולים הם צינורות הזרימה שנכנסים לנמל הכחול. הצינורות האדומים הם צינורות היציאה שנכנסים לנמל האדום של האגן.
- מניחים את האגן בתנוחה מוכנה למילוי מוטה לאחור והרחק מהיציאה הכחולה.
- יש המפעיל המשני למלא את האגן עם 4 ליטר של מלוחים.
- תפעיל הראשי ירים את האגן ותטה אותו בחזרה לעמדה מוכנה לכבידה.
- ודא כי כל האוויר הוסר מן הצינורות ואת המשאבה. הקש בעדינות על הצינורות ועל המשאבה כדי להסיר את כל בועות האוויר הקטנות. זהו צעד מכריע.
- ואז להפעיל את המשאבה מהקצה הלא סטרילי.
- הסר את כל בועות האוויר הזעירות במחמצן על ידי הקשה עדינה על המחומצן והצבת צינורות היציאה ברמה גבוהה יותר (מיקום השעה 12) כדי שבועות האוויר יעלו מעל ויברחו החוצה.
- עצור את המשאבה ברגע שכל בועות האוויר יוסרו.
- מהדקים את הזרימה ויוצאים מהצינורות. הסר את הזרימה ואת צינורות זרימה מן האגן ולאחר מכן לצרף את צינורות אספקת חמצן ירוק לגז בנמל על חמצון. המעגל מוכן עכשיו.
- גישה טרנסספטל10,32
- הכן ועטוף את המטופל בצורה סטרילית.
- בצע את ההליך תחת הרדמה כללית עם צוות ההרדמה.
- ברגע שהמטופל הוא צנרר ומנומס כראוי, להעביר את הבדיקה TEE לתוך הוושט ולקבל את התמונות הבסיסיות. אם אתם משתמשים ב-ICE, השיגו את התמונות לאחר גישה לוורידים.
- זהה את המקום האידיאלי לתרגוטומיה במחיצה הבין-ארצית (IAS) באמצעות TEE או ICE. השתמש בתצוגה הביקאבלית ב- TEE המציגה את החלק הממברני של ה- IAS באזור הפוסה אובליס כדי לחשוף את ה- IAS טוב יותר.
- אשר את היעדרו של כל פקקת בלוס אנג'לס שבו צינורית הזרימה תמוצב באמצעות TEE או ICE.
- להשיג גישה ורידית הירך באמצעות הדרכת אולטרסאונד עם טכניקת סלדינגר שונה ולהכניס 0.035 "מדריך
- לקדם את המדריך אל הוועד הנביא הנחות (IVC) – צומת פרוזדורים ימני ולאחר מכן כוון אותו לכיוון ה- IAS תחת הדרכה פלואורוסקופית ו- TEE או ICE. באמצעות תחזיות אנגיוגרפיות מרובות (אלקטרוק ימני או שמאלי), זהה את האתר האופטימלי לנקב טרנספטלי. באופן אידיאלי, זה צריך להיעשות באזור של השחלה foramen כדי למזער סיבוכים. בחולים עם ספטה עבה או מפרצת או IAS אשר תוקן בעבר או מכשיר כירורגי או סגור באופן עורי, ניתן לשקול שימוש במחט טרנסספטלית אנרגטי או גלי רדיו כדי להבטיח ניקוב מדויק ללא הסטת מחט.
- נוגד קרישה לחולה (ACT יותר מ 250 שניות). בצע ניקור טרנסספטאלי באמצעות מחט טרנסספטל, הכנס חוט מדריך ללוס אנג'לס.
- להרחיב את הגישה לווריידי ואת IAS עם מרחיב דו שלבי. הכנס את הצינורית הטרנסספטית וקדם אותה ללוס אנג'לס, הסר את המציג ואת חוט ההדרכה, המתן לדימום בגב ומהדק. אבטחו את הצינורית למטופל.
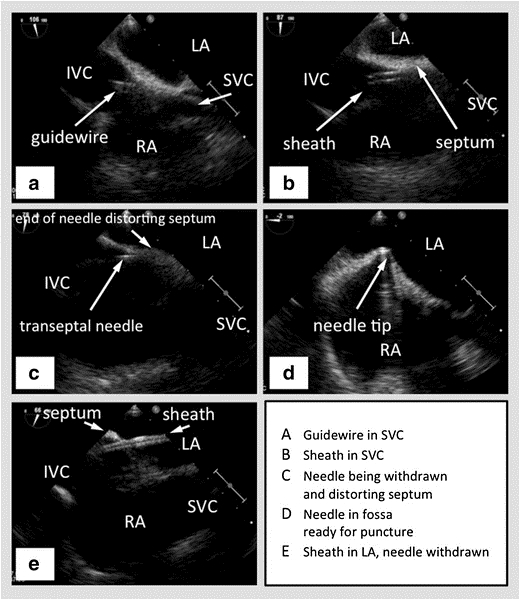
איור 2: TEE עם דו-כנפי בתצוגת הביקאוול המציג את ה-SVC מימין, המחיצה הבין-ארצית אופקית באמצע עם האטריום השמאלי מעל והאטריום הימני למטה, וה- IVC לכיוון השמאלי. (א) - מדריך עובר לתוך SVC. (B) - נדן עובר מעל החוט לתוך SVC. (C) - מחט טרנסספטל עובר דרך הנדן. (ד) - מחט טרנסספטלית אוהל המחיצה הבין-ארצית. (ה) - נדן עובר דרך המחיצה הבין-ארצית לתוך האטריום השמאלי, לאחר המחט כבר נסוג. תמונה באדיבות47
SVC – מעולה Vena Cava, IVC – וונה קאווה נחותה, RA – אטריום ימני, לוס אנג'לס – אטריום שמאלי
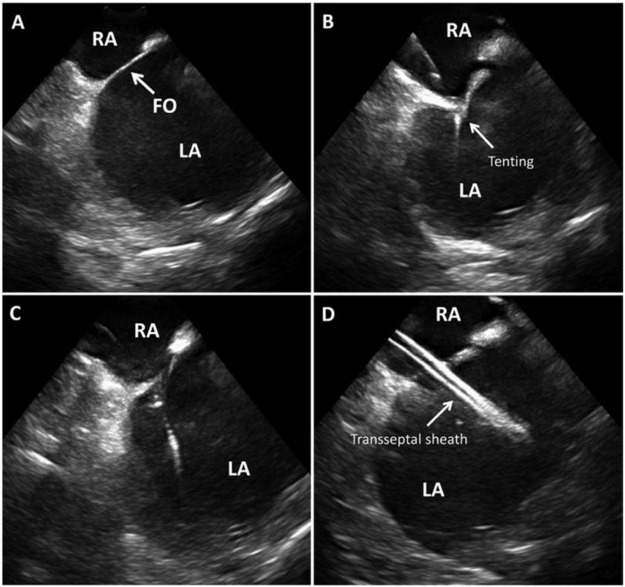
איור 3: ICE לגישה טרנס-אנטלית גישה טרנס-ספיגה מונחית ICE המציגה מחיצה בין-ארצית ופוסה אובליס (FO) ב- (A), אוהל מחיצה כשהמחט עוסקת (B), אובדן אוהלים כשהמחט חוצה פנימה (C), נדן טרנסספטלי באטריום השמאלי ב- D. תמונה באדיבות48 .
RA – אטריום ימני, לוס אנג'לס – אטריום שמאלי, FO – פורם אובלה
-
גישה עורקית
- להשיג גישה עורקית הירך באמצעות טכניקת סלדינגר שונה באמצעות אולטרסאונד והדרכה אנגיוגרפית ברמה של ראש הירך. הוסף חוט מדריך של 0.035".
- שקול להשתמש בטכניקת "טרום סגירה" באמצעות התקני סגירת כלי דם זמינים מסחרית שונים לפני שינוי הגישה לעורקים.
- להרחיב באופן סדרתי את אתר הגישה לעורקים המתאים לגודל הצינורית העורקים שנבחרה. הכנס את הצינורית העורקים, להסיר את המציג ואת מדריך, לחכות בחזרה לדמם, ולאחר מכן להדק. אבטחו את הצינורית למטופל באמצעות המחזיקים.
-
חיבור הרכיבים
- ליצור קשרים רטובים עד רטובים כדי למנוע הקדמה של כל בועות אוויר במעגל. זהו צעד מכריע.
- השתמש טבילה מלוחה או עירוי מתמיד של תמיסת מלח ("מפל") על שני הקצוות של קנולה כפי שהם מחוברים.
- חבר את הצינורית הטרנס-ספטל (ורידים) למפזר המשאבה המסומנת בכחול ואת הצינורית העורקים לשקע המשאבה המסומן באדום.
- ראשית, להסיר את מלחציים ורידים ולהתחיל את המשאבה (מתיבת הבקר). ואז לשחרר את מלחציים אחרים ברצף, כל הזמן בודק כל אוויר, שחרור מלחציים עורקים אחרון.
- התאם את מהירות המשאבה (על-ידי התאמת ה-RPMs) כדי למטב את הזרימה. אשר את המיקום של הצינורית תחת פלואורוסקופיה ו- TEE או ICE ולאבטח את המעגל למטופל.
- לשמור על קרישה טיפולית (פעיל זמן קרישה ACT ב 180-220s או מופעל פקקת חלקית זמן aPTT ב 65-80s) כל עוד המשאבה היא במקום כדי למנוע פקקת משאבה ושבץ. זהו צעד מכריע.
3. אטריום ימני למיקום מערכת מעקף עורק ריאות (RAPAB)
- ליזום את הבקר, ראש התא התחתון של המשאבה ולבדוק אם יש בועות אוויר - אותם צעדים המתוארים כנ"ל.
- פתחו את התא העליון של המשאבה, בדקו אם יש אוויר ומהדקים אותו - אותם צעדים המתוארים כנ"ל.
- הליך המטופל
- להשיג גישה ורידית בווריד הצוואר הפנימי הימני (RIJ) באמצעות טכניקת סלדינגר שונה תחת הדרכת אולטרסאונד.
- הכנס קטטר עורק ריאות (PA) עם לומן "0.035 וקדם אותו לרשות הפלסטינית הראשית ממש לפני ההפריה. הכנס חוט מדריך בגודל 0.035" נוקשה והסר את קטטר הרשות הפלסטינית.
- נוגד קרישה לחולה (ACT > 250 s).
- להרחיב את אתר הגישה לוורידים ברצף באמצעות מרחיבי הצעדים המסופקים בחבילה עד להגעה לגודל הרצוי (29 צרפתית או 31 צרפתית).
- הכנס את הצינורית ורידית (למשל, ProtekDuo) מעל חוט המדריך.
- הסר את חוט הנחיה, המתן לדמם לאחור ולאחר מכן הידק את היציאה הדיסטלית המסומנת כ"דיסטל".
- הסר את כובע ההמוסטזיס, המתן לדימום בגב, והדק את היציאה הפרוקסימלית המסומנת כ"פרוקסימלית". אבטחו את הצינורית למטופל באמצעות תפרים.
- אמת את הקנולות ובצע חיבורים רטובים עד רטובים מהמשאבה אל הצינורית.
- חבר את הצינורית הפרוקסימלית למפזר המשאבה המסומנת בכחול ואת הצינורית הדיסטלית לשקע המשאבה המסומנת באדום. הפעל את המשאבה (מהבקר).
- שחרר מלחציים ברצף, כל הזמן בודק אם יש בועות אוויר. התאם את מהירות המשאבה (על-ידי שליטה ב-RPMs) כדי למטב את הזרימה.
- אשר מיקום צינורית תחת פלואורוסקופיה (עשוי להשתמש בהנחיית TEE כדי לאשר מיקום ברשות הפלסטינית הראשית) ולאבטח את המעגל למטופל. לשמור על קרישה טיפולית (ACT ב 180-220 s; aPTT ב 65-80 s).
4. הסרת מכשירים
הערה: לאחר שתפקוד איבר הקצה של המטופל השתפר והמודינמיקה נשארה יציבה עם התאוששות LV או טיפולים מתקדמים כגון מיקום / השתלה LVAD עמיד, ניתן להסיר את המכשיר.
- לפני הסרת המכשיר, לאט להנמיך את המהירות על ידי 0.5 L / min בצורה צעד, התבוננות בזהירות המודינמיקה כדי לוודא שיש CO נאות ולחצי מילוי נורמלי עם פחות תמיכה (הידוע גם בשם הרמפה למטה או לדחות את המחקר).
- כבה את המשאבה ברגע שמחקר ההסתה יצליח.
- ודא ACT הוא < 150 שניות לפני הסרת הצינורית העורקים. הדק את התפר התוך-וסקולרי שהוצב בעבר כדי לאטום את אתר arteriotomy או לחץ ידני ניתן להחזיק לפחות 40 דקות כדי להבטיח hemostasis.
- למשוך את הצינורית transseptal לתוך IVC ולהסיר אותו לאט מן הווריד הירך. החל דמות של 8 תפירה לאתר ורידים ובנוסף, להחזיק לחץ ידני על האתר כדי להשיג hemostasis.
הערה: פגם במחיצה הפרוזלית (ASD) הוא בדרך כלל קטן ואינו סגור באופן שגרתי. - לאחר ההליך, בצע ניטור רציף של המודינמיקה של המטופל ותפקוד איברי הקצה כדי להבטיח יציבות.
- הסרת ראפאב.
- בדומה להסרת LAFAB, כאשר תפקוד איבר הקצה של המטופל התייצב עם התאוששות או טיפולים מתקדמים, לאט לאט להנמיך את המשאבה על ידי 0.5 L / min, התבוננות בזהירות המודינמיקה.
- כבה את המשאבה כאשר מחקר ההשבתה מצליח.
- לאחר ACT הוא < 150 שניות, להסיר את הצינורית ורידים מהצוואר ומניחים דמות של 8 תפירה כדי לאבטח את אתר הנקב. החזק לחץ ידני בנוסף לתקציר כדי להשיג hemostasis מלא.
- לאחר ההסרה, עקוב מקרוב אחר המודינמיקה של המטופל ותפקוד איבר הקצה כדי להבטיח יציבות.
| סיבוך | גורמי סיכון | תזמון המופע | אמצעי זהירות | ניהול |
| ניקוב לב וטמפונדה | התקדמות בשוגג של מחט או מנדט או נדן לאורך הקיר החופשי האחורי של אטריום שמאל. | במהלך נקב טרנסספט, מיקום של צינורית זרימה | הערכה מדויקת של מחיצה בין-ארצית על TEE או ICE ואופטימיזציה של האתר והזווית של ניקור טרנסספטלי באמצעות אנגיוגרפיה והד. | pericardiocentesis מיידי כדי להקל על טמפונדה. אולי צריך התערבות כירורגית. |
| איסכמיה דיסטלית גפיים חריפות לשיטיון עורקי | כלי קליבר קטנים המאכלסים קנולה גדולה, מחלת עורקים היקפית קיימת | רשום מיד הליך | אנגיוגרמה היקפית לפני הקנולציה. | מיקום של צנתר זלוף דיסטלי, סיוע בניתוחי כלי דם במקרים חמורים. |
| המוליזיס, דימום retroperitoneal, סיבוכים וסקולריים כגון היווצרות פסאודונואוריסמוס. | מהירויות משאבה גבוהות יותר, פקקת משאבה, DIC, קרישה | בכל עת על המשאבה | מטב את מהירות המשאבה עבור כל מטופל בנפרד. הימנע נוגד קרישה על-תעויתי. | הפחתת מהירות המשאבה, שמירה על טווח טיפולי של נוגד קרישה. |
| אתר אופטימלי של גישה עורקית בראש הירך בעורק הירך המשותף. | ||||
| פגם במחיצה של הפרוזה שיורית | ניסיונות מרובים לגישה טרנסספטית | לאחר ההסתה | פגמים משמעותיים מבחינה מודינמית יכולים להיסגר באופן עורי. |
טבלה 1: סיבוכים של התקן LAFAB33.
תוצאות
יישומים קליניים של התקן LAFAB
הטכניקה וההיתכנות של מערכת מעקפים טרנזית-עורית בחדר שמאל תוארו לראשונה בשנות השישים על ידי דניס ואח'. עם זאת, נקב טרנסספטלי לא אומץ בתחילה באופן נרחב עקב סיבוכים עם טכניקת הספיגה. בעשור האחרון, עם התקדמות בתחום ההתערבויות הלוהיות, מפעילים צברו ניסיון עם ספטוסומיה פרוזדורים, מה שהוביל לתחייה של מכשיר סיוע חדרית transseptal או מכשיר LAFAB.
מהמחקרים הקליניים הראשוניים שנערכו בשנות ה-90, אסטרטגיית LAFAB הדגימה רמה גבוהה של שימור שריר הלב עם ירידה גדולה יותר בגודל התוך, ופריקת LV גדולה יותר ב- AMI CS, בהשוואה למשאבת הבלון התוך-אבי העורקים (IABP)13.
מכשיר LAFAB להלם קרדיוגני
מעגל LAFAB נמצא בשימוש הנפוץ ביותר בסביבה של CS, שם הוכח להיות בטוח ויעיל בהגדלת CO14. ניסוי אקראי משנת 2006 המשווה את מכשיר LAFAB ל- IABP ב- CS15 ב- 42 חולים הוכיח כי מכשיר LAFAB יעיל יותר בהורדת PCWP ובשיפור CI (1.2 ± 0.8 [P < .05 לעומת בסיס]), אם כי התמותה לא הייתה שונה בין שתי הקבוצות. השכיחות של תופעות לוואי חמורות לא הייתה שונה באופן משמעותי בין שתי הקבוצות בקבוצה קטנה זו. ניסוי נוסף המשווה IABP ו LAFAB הראה שיפור משמעותי במדד כוח הלב עם מכשיר LAFAB (0.22 עד 0.37 W / m2, p<0.001), אך עם מגמה לקראת סיבוכים נוספים וללא תועלת בתמותה בקבוצת LAFAB16. יותר חולים בקבוצת LAFAB חוו איסכמיה גבוהה יותר באופן משמעותי בגפיים המחייבות שיפוץ כלי דם (n = 7 לעומת n = 0, P = 0.009) וסיבוכי דימום (n = 19 לעומת n = 8, P = 0.002). הייתה גם מגמה של שכיחות מוגברת של קרישה תוך וסקולרית מופצת בקבוצת LAFAB. לאחרונה, Kar et al. פרסם מחקר של 117 חולים אשר עברו השתלת LAFAB עבור עקשן CS חמור לטיפול IABP ו vasopressor18. 80 חולים סבלו מקרדיומיופתיה איסכמית, ול-37 היו קרדיומיופתיה לא איסכמית. בשתי הקבוצות חל שיפור מיידי בהמודינמיקה ובזילוף איברי הסיום. CI עלה מ-0.53 ליטר למילמטר ל-3.0 ליטר/דקה 2, p<0.001 ו-PCWP ירד מ-31.53 ± 10.2 מ"מ ל-17.29 ± 10.82 מ"מ כ"ג, p < 0.001). שיעורי התמותה בחודש ו-6 חודשים היו 40.2% ו-45.3% בהתאמה.
| פרמטר | IABP טרום ההשתלה | VAD טרום ההשתלה | ערך P | IABP לאחר ההשתלה | VAD לאחר ההשתלה | ערך P |
| תפוקת לב (L/min) | 3.0 (2.5–4.0) | 3.5 (3.3–4.2) | 0.29 | 3.3 (2.9–4.3) | 4.5 (4.0–5.4) | 0.007 |
| CI (L/min/m2) | 1.5 (1.3–2.0) | 1.7 (1.5–2.1) | 0.35 | 1.7 (1.5–2.1) | 2.3 (1.9–2.7) | 0.005 |
| ממוצע לחץ דם (mmHg) | 64 (57–74) | 63 (51–70) | 0.50 | 67 (62–84) | 74 (70–84) | 0.38 |
| מדד המחירים לצרכן (W/m2) | 0.22 (0.18–0.30) | 0.22 (0.19–0.30) | 0.72 | 0.28 (0.24–0.36) | 0.37 (0.30–0.47) | 0.004 |
| סו"ר (דיין×× ס"מ−5) | 1440 (1034–1758) | 1049 (852–1284) | 0.16 | 1388 (998–1809) | 1153 (844–1425) | 0.08 |
| קצב לב (פעימות/דקה) | 122 (92–130) | 113 (107–121) | 0.57 | 115 (90–125) | 105 (100–116) | 0.94 |
| PCWP (mmHg) | 27.0 (20.0–30.0) | 20.0 (18.0–23.0) | 0.02 | 21.5 (17.0–26.0) | 16.0 (12.5–19.0) | 0.003 |
| לחץ ורידים מרכזי (mmHg) | 13.0 (11.0–16.5) | 11.0 (9.0–15.3) | 0.29 | 12.0 (10.0–17.5) | 10.0 (8.0–12.0) | 0.06 |
| ממוצע PAP (mmHg) | 32.5 (27.5–38.0) | 28.0 (24.5–34.8) | 0.45 | 28.5 (25.5–33.5) | 24.5 (20.0–26.0) | 0.007 |
| סרום לקטט (mmol/L) | 3.8 (3.5–6.7) | 4.5 (3.1–6.5) | 0.53 | 3.25 (2.7–7.0) | 2.8 (2.3–3.5) | 0.03 |
| עודף בסיס סטנדרטי (mmol/L) | −6.8 [−8.3–(−3.9)] | −5.1 [−7.5–(−4.4)] | 0.74 | −4.3 [−8.8–(−2.3)] | −4.3 [−6.1–(−3.3)] | 0.28 |
| pH | 7.34 (7.28–7.38) | 7.28 (7.24–7.36) | 0.50 | 7.36 (7.28–7.41) | 7.33 (7.31–7.40) | 0.49 |
טבלה 2: טבלת תוצאות לשיפור המודינמי לאחר LAFAB בהשוואה למשאבת בלון תוך אבי העורקים. עיבוד מ-Thiele et al.17.
דו"ח של 10 מטופלים הדגים גם שימוש מוצלח במכשיר LAFAB בחולים עם היצרות אבי העורקים חמורה (AS) ו- CS17. במקרה זה, התקן LAFAB שימש כאמצעי טמפורציה לייצוב המודינמיקה ותפקוד איבר הקצה לפני החלפת שסתום מוחלטת. שמונה חולים קיבלו אותו במעבדת צנתור הלב לפני החלפת שסתום כירורגי עם תפקוד כליות משופר לפני הניתוח ו 2 חולים קיבלו את תמיכת המכשיר בחדר הניתוח לאחר החלפת שסתום. בסך הכל נפטרו 3 חולים.
התקן LAFAB כגשר להשתלה / VAD עמיד
יישום חשוב נוסף של מכשיר LAFAB הוא אי ספיקת לב סופנית, שם הם משמשים גשר לטיפול סופי - מכשיר סיוע חדרי שמאלי עמיד (LVAD) או השתלת לב19.
בסדרה של 25 חולים עם CS20, 44% מהחולים עברו מיקום של LVAD עמיד מתוכם 30% החלימו, ו -36% מתו על תמיכה. משך התמיכה הממוצע של LAFAB היה 4.8 ± 2.1 ימים. חמישים ושישה% מהחולים חוו סיבוכים הקשורים למכשיר, מתוכם 90% היו סיבוכים בגישה לכלי הדם. גרגוריק ואח' דיווחו על סדרה של 9 חולים עם קרדיומיופתיה סופנית והלם עקשן אשר גישור עם מכשיר LAFAB ל LVAD עמיד. שמונה מתוך 9 חולים אלה נתמכו עם IABP לפני המיקום של מכשיר LAFAB. משך הזמן הממוצע ל- LVAD עמיד היה 5.9 ימים. כל 9 החולים עם CS שקיבלו את מכשיר LAFAB הראו שיפור בהמודינמיקה שלהם ובתפקוד איבר הקצה שלהם בתמיכה ב- LAFAB לפני שעברו השתלת LVAD21.
בסדרה אחרת של 5 חולים אנושים עם CS22, מכשיר LAFAB הוצב לתמיכה LV כגשר להשתלה. משך התמיכה הממוצע היה 7.6 ± 3.2 ימים, וכל 5 החולים עברו השתלת לב בהצלחה. לא דווח על סיבוכים הקשורים למכשירים בחבורה זו.
Agarwal ואח ' בשנת 2015 תיאר מקרה נדיר, מעניין של פקקת LVAD עמיד עם CS שטופלו בהצלחה עם טיפול פיברינוליטי ותמיכה זמנית עם LAFAB23.
מכשיר LAFAB להתערבויות עוריות בסיכון גבוה
מכשיר LAFAB נחקר ונוצל בהרחבה עבור התערבויות כלילית עורית בסיכון גבוה (HRPCI)25,26,27,28 עם סיבוכים וסקולריים הקשורים למכשיר בטווחים מקובלים בהשוואה למכשירים דומים אחרים. בסדרה האחרונה של 37 חולים אשר עברו מיקום מכשיר LAFAB עבור CS, 28 חולים עברו HRPCI בהצלחה תוך תמיכה עם מכשיר LAFAB. שבעים ואחד אחוז מהחולים בקוהורטה שוחררו בהצלחה הביתה. ה- EuroSCORE הממוצע היה 11 ± 3.4, מה שמצביע על מורכבות גבוהה של קבוצה חולה אנושה זו. המחברים הגיעו למסקנה כי מכשיר LAFAB יכול לשמש בבטחה וביעילות עבור HRPCI29. בנוסף ל- HRPCI, מכשיר LAFAB שימש גם עבור חולים בסיכון גבוה העוברים החלפת שסתום אבי העורקים עורית, כפי שהודגם בסדרה קטנה אחת30. לבסוף, יש גם דו"ח קטן של 2 חולים של שימוש מוצלח במכשיר LAFAB עבור הלם פוסט-לב קרדיוטומיה31.
Discussion
המודינמיקה של מכשיר LAFAB:
הפרופיל המודינמי של התקן LAFAB נבדל מ- pVAD אחרים. על ידי ניקוז דם ישירות מלוס אנג'לס והחזרתו לעורק הירך, המכשיר עוקף את LV לחלוטין. בכך, הוא מפחית נפח ולחץ דיאסטוליים בקצה LV, תורם לגיאומטריה משופרת של LV, ובכך משפיע על ירידה בעבודת השבץ של LV. עם זאת, על ידי החזרת הדם בחזרה לעורק הכסל / בודי העורקים היורדים, העומס עולה. התוצאה היא טעינה של LV באמצעות לחץ סיסטולי קצה חדרית מוגבהת (LVESP). בסך הכל, לולאת נפח הלחץ מצטמצמת וזזה בצניעות שמאלה34. התוצאה היא ירידה בעומס העבודה בשריר הלב וירידה בצריכת החמצן35. LVEDP ו- LVESP עשויים להיות ממוטבים על ידי הגדלת מהירות המשאבה, פריקה נוספת של LV36.
היתרונות של התקן LAFAB כוללים הפחתת לחץ של LV וירידה בשבץ מוחי, מה שמוביל להתאוששות שריר הלב. LAFAB פורק את LV בעקיפין על ידי אוורור לוס אנג'לס (ואינו דורש מכשיר נפרד עבור LV פריקה). הוא יכול לספק תמיכה לבבית עד 4.5 ליטר לדקה ליד המיטה, ועמידותו נקבעה היטב עד שבועיים ב- vivo37.
החסרונות של LAFAB טמונים בכישורים הפרוצדורליים המתקדמים הנדרשים למיקום המכשיר, שכן ניקור טרנסספטלי אינו מיומנות מעבדת צנתור לב בכל מקום. הצורך TEE או ICE, כמו גם פלואורוסקופיה מגביל את השימוש במכשיר זה ליד המיטה במצבים מתעוררים. גישה לכלי הדם של הירך מונעת אמביציה ומשפיעה לרעה על שיקום המטופל. כמו עם MCS אחרים, הן hemolysis והן סיבוכים באתר גישה עשויים להיות משמעותיים גם כאשר הם מתרחשים. ASD שיורית עלולה להתרחש גם להשפיע לרעה על התוצאות בחולים גישור להחלמה.
התוויות נגד למכשיר LAFAB:
התוויות נגד מוחלטות לשימוש במערכת LAFAB כוללות VSD קיים מראש, בינה מלאכותית חמורה, פקקת לוס אנג'לס, ו- PVD חמור המונע הכנסת התקן38.
אטריום ימני למעקף עורק הריאות (RAPAB) לכשל בחדר הימני:
חדר ימין (RV) דומיננטי או דו-חדרי CS הוא קטלני עם שיעורי תמותה בבית החולים הנעים עד 75%39. מכשירי MCS שונים שימשו בהצלחה בניהול של RV CS. בדומה למערכת LAFAB, יש גם מכשיר תמיכה קרוואנים חדשני ניקוז דם מן RA לרשות הפלסטינית. היא נקראת מערכת ProtekDuo (איור 4), שיכולה לספק עד 4 ליטר של זרימה עבור ה- RV40. הוא מורכב ארוך 31 F (זמין גם בגדלים קטנים יותר) צינורית לומן כפול שניתן למקם מן הווריד הצוואר הפנימי דרך RA ו RV, לתוך PA41 הראשי. המערכת נתמכת על ידי משאבה צנטריפוגלית הדומה למערכת LAFAB. הוא מרוקן דם מה-RA ומחזיר אותו לרשות הפלסטינית הראשית, תוך עקיפת הקרוואן. זה יכול להיות גם מחובר חמצון לתמיכה ריאתית. מערכת RAPAB מסייעת לפרוק את הקרוואן ומפחיתה את עבודת שבץ הקרוואן42. מכשיר זה נמצא בשימוש הולך וגובר ב RV CS43, תסחיף ריאתי מסיבי44, וכשל קרוואנים גלויות לאחר LVAD או transplant45. עיקר הנתונים לתמיכה בקרוונים מגיעים מהרישום TandemHeart חוויות ושיטות (THEME), שבו נעשה שימוש במערכת RAPAB ב -30 חולים עם כשל בקרוונים של אטיולוגיות שונות, עם הישרדות של 30 יום של 72.4%, ורוב החולים מגשרים להחלמה.

איור 4: סכמטי של מערכת ProTek Duo. התמונה באדיבות TandemLife, חברת בת בבעלות מלאה של LivaNova US Inc. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
השימוש במעגל LAFAB עשוי לספק תועלת דיפרנציאלית על פני משאבת זרימה צירית טרנס-ערכית כגון אימפלה במספר תרחישים קליניים ספציפיים. כאמור, משאבת LifeSPARC מסוגלת לספק רמות זרימה על-פיזיולוגיות (עד 8 ליטר/דקה) עם תצורות הצינוריות הנוכחיות ולכן חולים גדולים יותר ואלה שאינם נתמכים כראוי או נפרקים במלואם על משאבות זרימה צירית transvalvular (Impella 2.5 L או CP 4 L) התקנים עשויים להפיק תועלת LAFAB. שנית, חולים עם שסתומי אבי העורקים תותבים או שסתום אבי העורקים שלילי / אנטומיה שורש כגון אלה עם דלקת פנים אנדוקרדיטיס קריטי AS או שסתום אבי העורקים וחולים עם תרומבוס LV עשוי להיחשב מועדף עבור LAFAB. לבסוף, LAFAB עשוי להיות חלק מאסטרטגיית תמיכה מבוימת שהחלה עם TandemLife VA-ECMO לחילוץ קרדיו-ריאות חריף ואחריו ניקוז לוס אנג'לס לאחר מכן לתוך המעגל, ובכך למעשה מתן תמיכה דו-חדרית כמעט מלאה בתוספת חמצון.
התקן LAFAB הוא pVAD יעיל ובטוח שניתן להשתמש בו בכשל LV חריף או כרוני המספק עד 4.5 עד 5 ליטר של תמיכה במחזור הדם, כמו גם פריקה עקיפה של LV באמצעות הפחתת לחץ בלוס אנג'לס. הצורך בגישה טרנסספטית עשוי להגביל את השימוש הנרחב במכשיר זה לתמיכה המתהווה של LV ב- CS. למרות נתונים תצפיתיים מצביעים הן בטיחות ויעילות של המכשיר הן CS ו HRPCI, נערך היטב, ניסויי בקרה גדולים, אקראיים נדרשים. בינתיים, התוצאות של רישום הנושא המתמשך עשויות לשפוך אור נוסף על התוצאות בעולם האמיתי בחולים המנוהלים באמצעות מכשיר LAFAB.
Disclosures
סנדיפ נתן - גילויים: יועץ, אביומד, גינג', CSI, Inc.
אלכסנדר טרוסל - גילויים: יועץ, Abiomed Inc.
פונם ולגפודי - גילויים: הוועדה המייעצת ליוזמת בריאות האישה, אביומד
Acknowledgements
לצוות "טנדם-לב" ב"לייף-ספרק".
Materials
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
References
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved