Method Article
Verwendung eines perkutanen ventrikulären Unterstützungsgeräts / linker Vorhof zu Femurarterien-Bypass-System für kardiogenen Schock
In diesem Artikel
Zusammenfassung
Der folgende Artikel beschreibt das schrittweise Verfahren zur Platzierung eines Geräts (z. B. Tandemherz) bei kardiogenem Schock (CS), bei dem es sich um ein perkutanes linksventrikuläres Unterstützungsgerät (pLVAD) und ein LAFAB-System (Left Atrial to Femoral Arterie Bypass) handelt, das den linken Ventrikel (LV) bei CS umgeht und unterstützt.
Zusammenfassung
Das LAFAB-System (Left Atrial to Femoral Artery Bypass) ist ein mechanisches Kreislaufunterstützungsgerät (MCS), das bei kardiogenem Schock (CS) verwendet wird und den linken Ventrikel umgeht, indem blut aus dem linken Vorhof (LA) abgelassen und über die Oberschenkelarterie in den systemischen arteriellen Kreislauf zurückgeführt wird. Es kann Ströme von 2,5-5 l / min abhängig von der Größe der Kanüle liefern. Hier diskutieren wir den Wirkmechanismus von LAFAB, verfügbare klinische Daten, Indikationen für seine Verwendung bei kardiogenem Schock, Implantationsschritte, postoperative Versorgung und Komplikationen im Zusammenhang mit der Verwendung dieses Geräts und deren Behandlung.
Wir bieten auch ein kurzes Video der prozeduralen Komponente der Gerätetherapie, einschließlich der Vorbereitung vor der Platzierung, der perkutanen Platzierung des Geräts über die transseptale Punktion unter echokardiographischer Anleitung und der postoperativen Verwaltung der Geräteparameter.
Einleitung
Der kardiogene Schock (CS) ist ein Zustand der Gewebehyperfusion mit oder ohne begleitende Hypotonie, bei dem das Herz nicht in der Lage ist, genügend Blut und Sauerstoff zu liefern, um den Bedarf des Körpers zu decken, was zu Organversagen führt. Es wird von der Society of Cardiovascular Angiography and Interventions (SCAI) in die Stadien A bis E eingeteilt: Stadium A - Patienten mit CS-Risiko; Stadium B - Patienten im Anfangsstadium von CS mit Hypotonie oder Tachykardie ohne Hypoperfusion; Stadium C - klassisches CS mit kaltem und nassem Phänotyp, der Inotrope / Vasopressoren oder mechanische Unterstützung zur Aufrechterhaltung der Perfusion erfordert; Stufe D - Verschlechterung der aktuellen medizinischen oder mechanischen Unterstützung, die eine Eskalation auf fortschrittlichere Geräte erfordert; und Stadium E - umfasst Patienten mit Kreislaufkollaps und refraktären Arrhythmien, die aktiv einen Herzstillstand mit laufender Herz-Lungen-Wiederbelebung erleiden1. Die häufigsten Ursachen für CS sind akute MI (AMI), die 81% der Fälle in einer kürzlich berichteten Analyse2 ausmachen, und akute dekompensierte Herzinsuffizienz (ADHF). CS ist klassisch durch Stauung und gestörte Perfusion gekennzeichnet, die sich in erhöhten Fülldrücken (pulmonaler kapillarer Keildruck [PCWP], linksventrikulärer enddiastolischer Druck [LVEDP], zentralvenöser Druck [CVP] und rechtsventrikulärer enddiastolischer Druck [RVEDP]), vermindertem Herzzeitvolumen (CO), Herzindex (CI), Herzleistung (CPO) und Fehlfunktion des Endorgans manifestieren3 . In der Vergangenheit waren die einzigen verfügbaren Behandlungen für AMI, die durch CS kompliziert wurden, die frühe Revaskularisation und die medizinische Behandlung mit Inotropen und / oder Vasopressoren4. In jüngerer Zeit, mit dem Aufkommen von Geräten zur mechanischen Kreislaufunterstützung (MCS) und der Erkenntnis, dass die Eskalation von Vasopressoren mit einer erhöhten Mortalität verbunden ist, gab es einen Paradigmenwechsel in der Behandlung von AMI und ADHF-bezogenem CS5,6.
In der heutigen Ära der perkutanen ventrikulären Unterstützungsgeräte (pVAD) gibt es eine Reihe von MCS-Geräteplattformen/-konfigurationen, die univentrikuläre oder biventrikuläre Kreislauf- und Ventrikelunterstützung mit und ohne Sauerstoffversorgungsfähigkeit bieten7. Trotz stetiger Zunahme der Verwendung von pVADs zur Behandlung von AMI und ADHF CS sind die Sterblichkeitsraten weitgehend unverändert geblieben5. Mit sich abzeichnenden Beweisen für mögliche klinische Vorteile bei der frühzeitigen Entladung des linken Ventrikels (LV) in AMI8 und der frühen Anwendung von MCS in AMI CS9 nimmt die Verwendung von MCS weiter zu.
Das MCS-Gerät (Left Atrial to Femoral Artery Bypass, LAFAB) umgeht die LV, indem es Blut aus dem linken Vorhof (LA) ablässt und über die Oberschenkelarterie in den systemischen arteriellen Kreislauf zurückführt (Abbildung 1). Es wird von einer externen Kreiselpumpe unterstützt, die je nach Größe der Kanülen einen Durchfluss von 2,5-5,0 Litern pro Minute (L / m) bietet (Pumpe der neuen Generation, die als LifeSPARC bezeichnet wird und einen Durchfluss von bis zu 8 l / m erreichen kann). Sobald das Blut über die transseptale Venenkanüle aus der LA extrahiert wurde, durchläuft es die externe Kreiselpumpe, die das Blut über die in der Oberschenkelarterie platzierte arterielle Kanüle in den Körper des Patienten zurückführt.
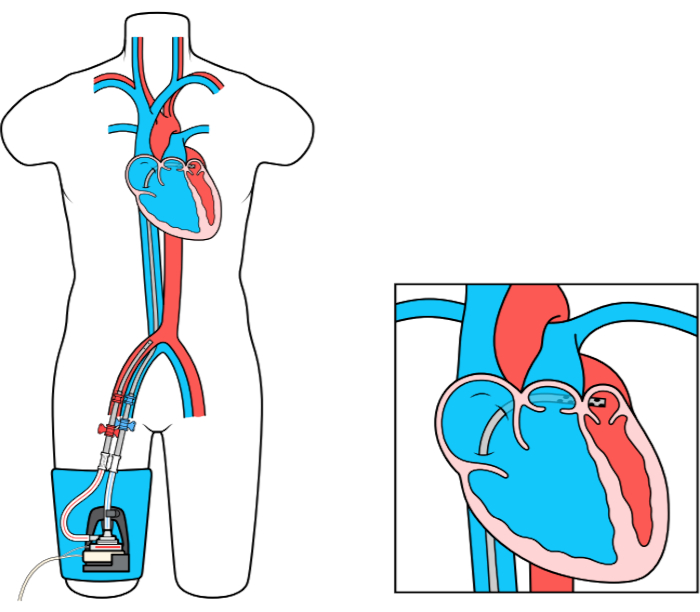
Abbildung 1: LAFAB-Setup. Mit freundlicher Genehmigung von TandemLife, einer hundertprozentigen Tochtergesellschaft von LivaNova US Inc. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Dieses Verfahren und Protokoll wurde vom Institutional Review Board und der US-amerikanischen Food and Drug Administration (FDA) genehmigt.
1. Patientenkriterien
- Umfassen Sie Patienten mit CS-Stadium B und höher gemäß der Definition in der SCAI-Konsensuserklärung1.
- Schließen Sie als Brücke zur Transplantation oder dauerhaftes linksventrikuläres Unterstützungssystem bei Herzinsuffizienz im Stadium D ein.
- Als Brücke zur Wiederherstellung in AMI enthalten, die durch CS kompliziert wird.
- Kontraindikation zur systemischen Antikoagulation ausschließen.
- Lebenserwartung <6 Monate ausschließen (aktive Malignität).
- Ausschließen, wenn LA-Thrombus vorliegt.
- Ausschließen, wenn Patienten eine periphere Gefäßerkrankung (PVD) mit kleinen Arterien haben, die die großen Kanülen nicht aufnehmen können.
- Ausschließen, wenn Patienten eine irreversible neurologische Verletzung / Koma haben.
- Ausschließen, wenn Patienten eine schwere Aorteninsuffizienz (AI) haben.
- Ausschließen, wenn Patienten einen Ventrikelseptumdefekt (VSD) haben.
HINWEIS: Die Platzierung des LAFAB-Geräts umfasst drei separate Prozesse: 1) Einrichten des Controllers und der Pumpe; 2) Platzierung von arteriellen und venösen Kanülen und transeptaler Zugang unter transösophageales Echokardiogramm (TEE) oder intrakardiales Echokardiogramm (ICE); und 3) Verbinden des Systems mit dem Stromkreis.
2. Platzierung des linken Vorhofs auf dem Bypass-Gerät der Oberschenkelarterie
- Einrichten des Controllers
HINWEIS: Dieser Schritt kann ausgeführt werden, wenn der Patient ins Labor transportiert wird und der Tisch für das Verfahren eingerichtet wird. Normalerweise ist der Gerätevertreter und das Perfusionistenteam anwesend, um den Prozess zu unterstützen.- Öffnen Sie die Box und starten Sie die Controller-Einrichtung mit den folgenden Schritten.
- Legen Sie vor dem Einschalten des Controllers 2 Batterien in den Controller ein, indem Sie die Batterieabdeckung öffnen. Legen Sie jede Batterie ein, indem Sie das Logo vom Controller-Bildschirm wegstellen. Die Nut am Akku sollte mit dem Schlüsselgehäuse der Batterie übereinstimmen. Stellen Sie sicher, dass die Batterien gut sitzen.
- Setzen Sie die anderen 2 Batterien nach dem gleichen Vorgang in das Dock ein.
- Schließen Sie den Controller an das Dock an, vergewissern Sie sich, dass er vollständig auf dem Dock sitzt, und schließen Sie das Netzkabel an die Steckdose an und schließen Sie es an die Steckdose an, um es mit Netzstrom zu versorgen. Der Controller kann im Dock betrieben werden, das an das Stromnetz angeschlossen ist, oder wenn er vom Dock getrennt ist, kann er mit Batteriestrom betrieben werden.
- Montieren Sie das Dock und den Controller mit der Klemme an einem intravenösen Mast.
- Schalten Sie den Controller mit den Tasten an der Seite ein.
- Einrichten der Pumpe – Ansaugen des Systems
HINWEIS: Für die Pumpenansaugung sind zwei Personen erforderlich - der Hauptbediener wird geschrubbt (steriler Bediener) und bleibt im sterilen Feld. Der Sekundäroperator (nicht steriler Bediener) bedient die Steuerung im nicht sterilen Bereich. Die Entlüftung der Pumpe ist ein entscheidender Schritt und muss sehr sorgfältig durchgeführt werden.- Lassen Sie den sekundären Bediener die Verpackung öffnen und legen Sie das Grundierungsfach dem primären Bediener vor. Lassen Sie den Primärbediener dann den sterilen Vorhang öffnen und legen Sie die Komponenten der Grundierungsschale auf dem sterilen Tisch aus. Die Pumpe, der Oxygenator und der grüne Sauerstoffschlauch sind im Tray enthalten.
- Lassen Sie den primären Bediener den Pumpenantriebsstrang an den sekundären Bediener übergeben, der ihn dann an die Steuerung anschließt.
- Lassen Sie den sterilen Bediener die Schutzkappen am Schlauch entfernen und die Enden in das Becken einführen. Der blaue Schlauch ist der Zuflussschlauch, der in den blauen Port geht. Der rote Schlauch ist der Ausflussschlauch, der in den roten Port des Beckens führt.
- Stellen Sie das Becken in die füllfertige Position, die nach hinten geneigt und vom blauen Port weg ist.
- Lassen Sie den Sekundärbediener das Becken mit 4 Litern Kochsalzlösung füllen.
- Lassen Sie den Primärbediener das Becken anheben und in die Prime-Ready-Position zurückkippen, um die Pumpe schwerkraftfest zu machen.
- Stellen Sie sicher, dass die gesamte Luft aus dem Schlauch und der Pumpe entfernt wurde. Klopfen Sie vorsichtig auf den Schlauch und die Pumpe, um kleine Luftblasen zu entfernen. Dies ist ein entscheidender Schritt.
- Schalten Sie dann die Pumpe vom unsterilen Ende aus ein.
- Entfernen Sie alle winzigen Luftblasen im Oxygenator, indem Sie vorsichtig auf den Oxygenator klopfen und den Ausflussschlauch auf einer höheren Ebene (12-Uhr-Position) positionieren, damit die Luftblasen darüber aufsteigen und heraustreten.
- Stoppen Sie die Pumpe, sobald alle Luftblasen entfernt sind.
- Klemmen Sie den Ein- und Ausflussschlauch. Entfernen Sie den Zu- und Abflussschlauch aus dem Becken und befestigen Sie dann den grünen Sauerstoffzufuhrschlauch an der Gaszufuhr am Anschluss des Oxygenators. Die Schaltung ist nun fertig.
- Transseptaler Zugang10,32
- Bereiten Sie den Patienten vor und drapieren Sie ihn steril.
- Führen Sie den Eingriff unter Vollnarkose mit dem Anästhesieteam durch.
- Sobald der Patient intubiert und ausreichend sediert ist, übergeben Sie die TEE-Sonde in die Speiseröhre und erhalten Sie die grundlegenden Bilder. Wenn Sie ICE verwenden, erhalten Sie die Bilder nach dem venösen Zugriff.
- Identifizieren Sie den idealen Ort für die Septostomie am interatralen Septum (IAS) mit TEE oder ICE. Verwenden Sie die bicaval-Ansicht auf TEE, die den membranösen Teil der IAS im Bereich der Fossa ovalis zeigt, um die IAS besser zu exponieren.
- Bestätigen Sie das Fehlen eines Thrombus in der LA, wo die Zuflusskanüle mit TEE oder ICE positioniert wird.
- Erhalten Sie femoralvenösen Zugang über Ultraschallführung mit modifizierter Seldinger-Technik und setzen Sie einen 0,035"-Führungsdraht ein
- Führen Sie den Führungsdraht zur unteren Hohlvene (IVC) – rechte Vorhofverbindung vor und richten Sie ihn dann unter fluoroskopischer und TEE- oder ICE-Führung auf die IAS aus. Identifizieren Sie mithilfe mehrerer angiographischer Projektionen (rechts oder links anterior schräg) die optimale Stelle für die transeptale Punktion. Idealerweise sollte es im Bereich des Foramen ovale erfolgen, um Komplikationen zu minimieren. Bei Patienten mit dicken oder aneurysmatischen Septen oder einem IAS, die zuvor chirurgisch gepatcht oder instrumentiert oder perkutan verschlossen wurden, kann die Verwendung einer energetisierten oder hochfrequenten transseptalen Nadel in Betracht gezogen werden, um eine präzise Punktion ohne Nadelablenkung zu gewährleisten.
- Antikoagulanieren Sie den Patienten (ACT mehr als 250 Sekunden). Führen Sie eine transseptale Punktion mit einer transseptalen Nadel durch und führen Sie einen Führungsdraht in die LA ein.
- Erweitern Sie den venösen Zugang und den IAS mit einem 2-stufigen Dilatator. Setzen Sie die Transseptalkanüle ein und führen Sie sie in LA ein, entfernen Sie den Einführer und den Führungsdraht, warten Sie auf die Rückblutung und klemmen Sie sie. Sichere Kanüle für den Patienten.
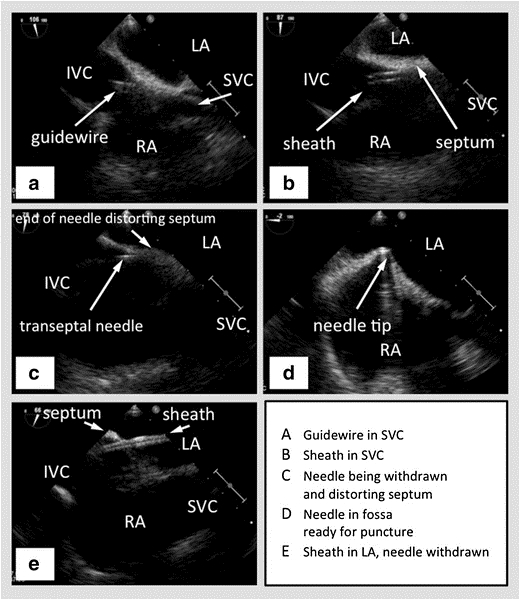
Abbildung 2: TEE mit Doppeldecker in der Bicaval-Ansicht mit dem SVC rechts, dem interatrialen Septum horizontal in der Mitte mit dem linken Vorhof oben und dem rechten Vorhof unten und dem IVC nach links. (A) - Führungsdraht, der in den SVC übergeht. (B) - Mantel, der über den Draht in den SVC geht. (C) - Transseptale Nadel, die durch die Hülle verläuft. (D) - Transseptale Nadel, die das interatriale Septum zeltet. (E) - Scheide, die durch das interatriale Septum in den linken Vorhof verläuft, nachdem die Nadel zurückgezogen wurde. Bild mit freundlicher Genehmigung47
SVC – Superior Vena Cava, IVC – Inferior Vena Cava, RA – Rechter Vorhof, LA – Linker Vorhof
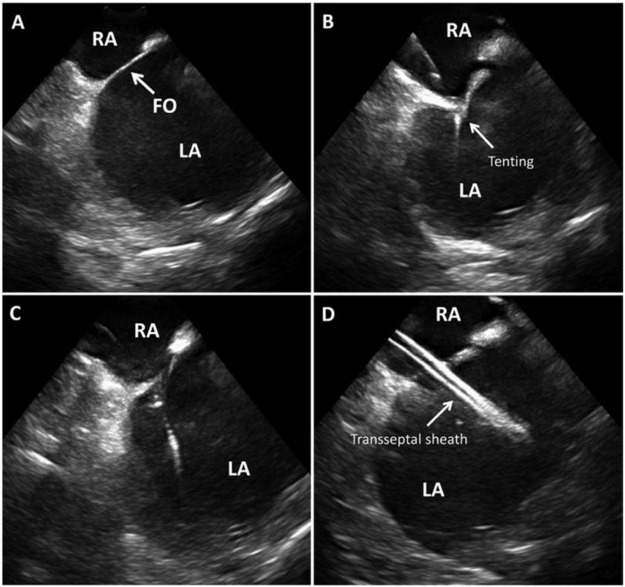
Abbildung 3: ICE für den transeptalen Zugang ICE-geführter transseptaler Zugang zeigt interatriales Septum und Fossa ovalis (FO) in (A), Septum-Tenting, wenn die Nadel eingreift (B), Verlust des Zeltes, wenn sich die Nadel in (C kreuzt), transseptale Hülle im linken Vorhof in D. Bild mit freundlicher Genehmigung48 .
RA – Rechtes Atrium, LA – Linkes Atrium, FO – Foramen Ovale
-
Arterieller Zugang
- Erhalten Sie femoralen arteriellen Zugang über die modifizierte Seldinger-Technik unter Verwendung von Ultraschall und angiographischer Führung auf Höhe des Femurkopfes. Stecken Sie einen 0,035"-Führungsdraht ein.
- Erwägen Sie die Verwendung der "Pre-Closure" -Technik unter Verwendung der verschiedenen kommerziell erhältlichen Gefäßzugangsverschlussvorrichtungen, bevor Sie den arteriellen Zugang vergrößern.
- Erweitern Sie die arterielle Zugangsstelle entsprechend der Größe der ausgewählten arteriellen Kanüle seriell. Führen Sie die arterielle Kanüle ein, entfernen Sie den Introducer und den Führungsdraht, warten Sie auf die Rückblutung und klemmen Sie dann. Befestigen Sie die Kanüle mit den Haltern am Patienten.
-
Anschließen der Komponenten
- Stellen Sie Nass-zu-Nass-Verbindungen zu den Kanülen her, um das Eindringen von Luftblasen in den Kreislauf zu vermeiden. Dies ist ein entscheidender Schritt.
- Verwenden Sie Salzimmersion oder ständige Infusion von Kochsalzlösung ("Wasserfall") über die beiden Enden der Kanülen, während sie verbunden werden.
- Verbinden Sie die transseptale Kanüle (venös) mit dem blau markierten Pumpeneinlass und die arterielle Kanüle mit dem rot markierten Pumpenauslass.
- Entfernen Sie zuerst die Venenklemmen und starten Sie die Pumpe (aus der Controller-Box). Lösen Sie dann die anderen Klemmen nacheinander, überprüfen Sie ständig auf Luft und lösen Sie die arterielle Klemme zuletzt.
- Passen Sie die Pumpendrehzahl an (durch Anpassen der Drehzahl), um den Durchfluss zu optimieren. Bestätigen Sie die Position der Kanüle unter Fluoroskopie und TEE oder ICE und sichern Sie den Stromkreis für den Patienten.
- Aufrechterhaltung der therapeutischen Antikoagulation (aktivierte Gerinnungszeit ACT bei 180-220s oder aktivierte partielle Thromboplastin-Zeit aPTT bei 65-80s), solange die Pumpe vorhanden ist, um Pumpthrombose und Schlaganfall zu verhindern. Dies ist ein entscheidender Schritt.
3. Platzierung des RAPAB-Systems (Right Atrium to Pulmonary Artery Bypass)
- Starten Sie den Regler, saugen Sie die untere Kammer der Pumpe an und überprüfen Sie auf Luftblasen - die gleichen Schritte wie oben beschrieben.
- Primen Sie die obere Kammer der Pumpe, prüfen Sie auf Luft und klemmen Sie sie ein - die gleichen Schritte wie oben beschrieben.
- Ablauf des Patienten
- Erhalten Sie venösen Zugang an der rechten inneren Jugularvene (RIJ) durch modifizierte Seldinger-Technik unter Ultraschallführung.
- Führen Sie einen Lungenarterienkatheter (PA) mit einem 0,035 "Lumen ein und führen Sie ihn kurz vor der Bifurkation zur Haupt-PA vor. Führen Sie einen steifen 0,035-Zoll-Führungsdraht ein und entfernen Sie den PA-Katheter.
- Antikoagulanieren Sie den Patienten (ACT > 250 s).
- Erweitern Sie die venöse Zugangsstelle nacheinander mit den im Paket enthaltenen schrittweisen Dilatatoren, bis die gewünschte Größe erreicht ist (29 Franzosen oder 31 Franzosen).
- Führen Sie die Venenkanüle (z. B. ProtekDuo) über den Führungsdraht ein.
- Entfernen Sie den Führungsdraht, warten Sie auf die Rückblutung und klemmen Sie dann den distalen Port ein, der als "Distal" gekennzeichnet ist.
- Entfernen Sie die Hämostasekappe, warten Sie auf die Rückenblutung und klemmen Sie den proximalen Port, der als "Proximal" gekennzeichnet ist. Befestigen Sie die Kanüle über Nähte für den Patienten.
- Überprüfen Sie die Kanülen und stellen Sie Nass-zu-Nass-Verbindungen von der Pumpe zur Kanüle her.
- Verbinden Sie die proximale Kanüle mit dem blau markierten Pumpeneinlass und die distale Kanüle mit dem rot markierten Pumpenauslass. Schalten Sie die Pumpe ein (über den Controller).
- Lösen Sie die Klemmen nacheinander und überprüfen Sie ständig auf Luftblasen. Passen Sie die Pumpendrehzahl an (durch Steuerung der Drehzahl), um den Durchfluss zu optimieren.
- Bestätigen Sie die Kanülenposition unter der Durchleuchtung (kann die TEE-Anleitung verwenden, um die Position in der Haupt-PA zu bestätigen) und sichern Sie den Stromkreis für den Patienten. Aufrechterhaltung der therapeutischen Antikoagulation (ACT bei 180-220 s; aPTT bei 65-80 s).
4. Entfernen des Geräts
HINWEIS: Sobald sich die Endorganfunktion des Patienten verbessert hat und die Hämodynamik entweder mit LV-Erholung oder neuartigen Therapien wie einer dauerhaften LVAD-Platzierung / -Transplantation stabil geblieben ist, kann das Gerät entfernt werden.
- Bevor Sie das Gerät entfernen, drehen Sie die Geschwindigkeit schrittweise um 0,5 l / min herunter und beobachten Sie sorgfältig die Hämodynamik, um sicherzustellen, dass ausreichende CO- und normale Fülldrücke mit weniger Unterstützung vorhanden sind (auch als Ramp-Down- oder Turn-Down-Studie bezeichnet).
- Schalten Sie die Pumpe aus, sobald die Turndown-Studie erfolgreich ist.
- Stellen Sie sicher, dass der ACT 150 Sekunden < ist, bevor Sie die arterielle Kanüle entfernen. Ziehen Sie die zuvor platzierte intravaskuläre Naht fest, um die Arteriotomiestelle zu verschließen, oder der manuelle Druck kann mindestens 40 Minuten lang gehalten werden, um die Hämostase sicherzustellen.
- Ziehen Sie die transseptale Kanüle in die IVC und entfernen Sie sie langsam aus der Oberschenkelvene. Wenden Sie eine Figur von 8 Naht auf die venöse Stelle an und halten Sie zusätzlich manuellen Druck über die Stelle, um eine Hämostase zu erreichen.
HINWEIS: Der Vorhofseptumdefekt (ASD) ist in der Regel klein und wird nicht routinemäßig geschlossen. - Führen Sie nach dem Eingriff eine kontinuierliche Überwachung der Hämodynamik und der Endorganfunktion des Patienten durch, um die Stabilität zu gewährleisten.
- Entfernung von RAPAB.
- Ähnlich wie bei der LAFAB-Entfernung, wenn sich die Endorganfunktion des Patienten durch Genesung oder neuartige Therapien stabilisiert hat, drehen Sie die Pumpe langsam um 0,5 l / min herunter und beobachten Sie sorgfältig die Hämodynamik.
- Schalten Sie die Pumpe aus, wenn die Turndown-Studie erfolgreich ist.
- Sobald ACT < 150 Sekunden ist, entfernen Sie die Venenkanüle vom Hals und legen Sie eine 8er-Naht, um die Einstichstelle zu sichern. Halten Sie zusätzlich zur Naht manuellen Druck, um eine vollständige Hämostase zu erreichen.
- Überwachen Sie nach der Entfernung die Hämodynamik und die Endorganfunktion des Patienten genau, um die Stabilität zu gewährleisten.
| Komplikation | Risikofaktoren | Zeitpunkt des Auftretens | Vorsichtsmaßnahmen | Management |
| Herzperforation und Tamponade | Unbeabsichtigtes Vorrücken von Nadel oder Dilatator oder Scheide entlang der hinteren freien Wand des linken Vorhofs. | Während der transseptalen Punktion, Platzierung der Zuflusskanüle | Genaue Beurteilung des interatrialen Septums auf TEE oder ICE und Optimierung der Stelle und des Winkels der transseptalen Punktion mittels Angiographie und Echo. | Sofortige Perikardiozentese zur Linderung von Tamponade. Kann einen chirurgischen Eingriff benötigen. |
| Akute Extremitätenischämie distal bis arterielle Kanülierung | Kleinkalibrige Gefäße mit großen Kanülen, bereits bestehende periphere arterielle Verschlusskrankheit | Sofort nach dem Verfahren | Peripheres Angiogramm vor der Kanülierung. | Platzierung des distalen Perfusionskatheters, Gefäßchirurgie in schweren Fällen. |
| Hämolyse, retroperitoneale Blutungen, vaskuläre Komplikationen wie Pseudoaneurysmabildung. | Höhere Pumpendrehzahlen, Pumpenthrombose, DIC, Antikoagulation | Jederzeit an der Pumpe | Optimieren Sie die Pumpendrehzahl für jeden Patienten individuell. Vermeiden Sie supratherapeutische Antikoagulation. | Reduzierung der Pumpendrehzahl, Aufrechterhaltung des therapeutischen Bereichs der Antikoagulation. |
| Optimale Stelle des arteriellen Zugangs am Hüftkopf in der gemeinsamen Oberschenkelarterie. | ||||
| Verbleibender Vorhofseptumdefekt | Mehrere Versuche für transseptalen Zugriff | Nach der Dekannulation | Hämodynamisch signifikante Defekte können perkutan geschlossen werden. |
Tabelle 1: Komplikationen des LAFAB-Geräts33.
Ergebnisse
Klinische Anwendungen des LAFAB-Geräts
Die Technik und Machbarkeit eines perkutanen transatrialen linksventrikulären Bypasssystems wurde erstmals in den 1960er Jahren von Dennis et al.11,12 beschrieben. Die transseptale Punktion war jedoch aufgrund von Komplikationen mit der Septotomietechnik zunächst nicht weit verbreitet. In den letzten zehn Jahren haben die Betreiber mit Fortschritten auf dem Gebiet der perkutanen Eingriffe Erfahrungen mit der Vorhofseptestomie gesammelt, was zu einem Wiederaufleben des transseptalen ventrikulären Unterstützungsgeräts oder LAFAB-Geräts geführt hat.
Aus den ersten klinischen Studien, die in den 1990er Jahren durchgeführt wurden, hat die LAFAB-Strategie ein hohes Maß an Myokarderhaltung mit einer größeren Abnahme der Infarktgröße und einer größeren LV-Entladung in AMI CS im Vergleich zur intraaortalen Ballonpumpe (IABP) gezeigt13.
LAFAB-Gerät für kardiogenen Schock
Die LAFAB-Schaltung wird am häufigsten in der Einstellung von CS verwendet, wo sie sich als sicher und wirksam bei der Erhöhung von CO14 erwiesen hat. Eine randomisierte Studie aus dem Jahr 2006, in der das LAFAB-Gerät mit IABP bei CS15 bei 42 Patienten verglichen wurde, zeigte, dass das LAFAB-Gerät bei der Senkung des PCWP und der Verbesserung des CI wirksamer war (1,2 ± 0,8 [P < 0,05 vs. Ausgangswert]), obwohl sich die Mortalität zwischen den beiden Gruppen nicht unterschied. Die Inzidenz schwerer unerwünschter Ereignisse unterschied sich nicht signifikant zwischen den beiden Gruppen in dieser kleinen Kohorte. Eine weitere Studie, in der IABP und LAFAB verglichen wurden, zeigte eine signifikante Verbesserung des Herzleistungsindex mit dem LAFAB-Gerät (0,22 bis 0,37 W/m2, S<0,001), jedoch mit einem Trend zu mehr Komplikationen und keinem Mortalitätsvorteil in der LAFAB-Gruppe16. Mehr Patienten in der LAFAB-Gruppe erlebten eine signifikant höhere akute Extremitätenischämie, die eine Revaskularisation (n = 7 vs. n = 0, P = 0,009) und Blutungskomplikationen (n = 19 vs. n = 8, P = 0,002) erforderte. Es gab auch einen Trend zu einer erhöhten Inzidenz von disseminierter intravaskulärer Koagulopathie in der LAFAB-Gruppe. In jüngerer Zeit veröffentlichten Kar et al. eine Studie mit 117 Patienten, die sich einer LAFAB-Implantation wegen schwerer CS-refraktärer IABP- und Vasopressortherapie unterzogen hatten18. Achtzig Patienten hatten eine ischämische Kardiomyopathie und 37 hatten eine nicht-ischämische Kardiomyopathie. Es gab eine sofortige Verbesserung der Hämodynamik und der Endorganperfusion in beiden Gruppen. Das KI stieg von 0,53 l/min·m2 auf 3,0 l/min·m2, p<0,001 und das PCWP sank von 31,53 ± 10,2 mmHg auf 17,29 ± 10,82 mmHg, p < 0,001). Die Sterblichkeitsraten nach 1 und 6 Monaten betrugen 40,2% bzw. 45,3%.
| Parameter | Präimplantation IABP | Präimplantations-VAD | P-Wert | IABP nach der Implantation | VAD nach der Implantation | P-Wert |
| Herzzeitvolumen (L/min) | 3.0 (2.5–4.0) | 3.5 (3.3–4.2) | 0.29 | 3.3 (2.9–4.3) | 4.5 (4.0–5.4) | 0.007 |
| KI (L/min/m2) | 1.5 (1.3–2.0) | 1.7 (1.5–2.1) | 0.35 | 1.7 (1.5–2.1) | 2.3 (1.9–2.7) | 0.005 |
| Blutdruckmittelwert (mmHg) | 64 (57–74) | 63 (51–70) | 0.50 | 67 (62–84) | 74 (70–84) | 0.38 |
| VPI (W/m2) | 0.22 (0.18–0.30) | 0.22 (0.19–0.30) | 0.72 | 0.28 (0.24–0.36) | 0.37 (0.30–0.47) | 0.004 |
| SVR (dyn×s×cm−5) | 1440 (1034–1758) | 1049 (852–1284) | 0.16 | 1388 (998–1809) | 1153 (844–1425) | 0.08 |
| Herzfrequenz (Schläge/min) | 122 (92–130) | 113 (107–121) | 0.57 | 115 (90–125) | 105 (100–116) | 0.94 |
| PCWP (mmHg) | 27.0 (20.0–30.0) | 20.0 (18.0–23.0) | 0.02 | 21.5 (17.0–26.0) | 16.0 (12.5–19.0) | 0.003 |
| Zentralvenöser Druck (mmHg) | 13.0 (11.0–16.5) | 11.0 (9.0–15.3) | 0.29 | 12.0 (10.0–17.5) | 10.0 (8.0–12.0) | 0.06 |
| PAP-Mittelwert (mmHg) | 32.5 (27.5–38.0) | 28.0 (24.5–34.8) | 0.45 | 28.5 (25.5–33.5) | 24.5 (20.0–26.0) | 0.007 |
| Serumlactat (mmol/L) | 3.8 (3.5–6.7) | 4.5 (3.1–6.5) | 0.53 | 3.25 (2.7–7.0) | 2.8 (2.3–3.5) | 0.03 |
| Standard-Basenüberschuss (mmol/L) | −6,8 [−8,3–(−3,9)] | −5,1 [−7,5–(−4,4)] | 0.74 | −4,3 [−8,8–(−2,3)] | −4,3 [−6,1–(−3,3)] | 0.28 |
| Ph | 7.34 (7.28–7.38) | 7.28 (7.24–7.36) | 0.50 | 7.36 (7.28–7.41) | 7.33 (7.31–7.40) | 0.49 |
Tabelle 2: Ergebnistabelle zur hämodynamischen Verbesserung nach LAFAB im Vergleich zur intraaortalen Ballonpumpe. Adaptiert von Thiele et al.17.
Ein Bericht mit 10 Patienten zeigte auch die erfolgreiche Verwendung von LAFAB-Geräten bei Patienten mit schwerer Aortenstenose (AS) und CS17. In dieser Fallserie wurde das LAFAB-Gerät als temporisierende Maßnahme zur Stabilisierung der Hämodynamik und der Endorganfunktion vor dem endgültigen Klappenersatz verwendet. Acht Patienten erhielten es im Herzkatheterlabor vor dem chirurgischen Klappenersatz mit verbesserter Nierenfunktion vor der Operation und 2 Patienten erhielten die Geräteunterstützung im Operationssaal nach dem Klappenersatz. Insgesamt starben 3 Patienten17.
LAFAB-Gerät als Brücke zur Transplantation/langlebigen VAD
Eine weitere wichtige Anwendung des LAFAB-Geräts ist die Herzinsuffizienz im Endstadium, wo sie als Brücke zur endgültigen Therapie eingesetzt werden - dauerhaftes linksventrikuläres Unterstützungsgerät (LVAD) oder Herztransplantation19.
In einer Serie von 25 Patienten mit CS20 wurden 44% der Patienten einer dauerhaften LVAD unterzogen, von der sich 30% erholten und 36% auf Unterstützung starben. Die durchschnittliche Dauer der LAFAB-Unterstützung betrug 4,8 ± 2,1 Tage. Sechsundfünfzig % der Patienten erlebten gerätebedingte Komplikationen, von denen 90% vaskuläre Zugangskomplikationen waren. Gregoric et al. berichteten über eine Serie von 9 Patienten mit Kardiomyopathie im Endstadium und refraktärem Schock, die mit dem LAFAB-Gerät zu einem dauerhaften LVAD überbrückt wurden. Acht dieser 9 Patienten wurden vor der Platzierung des LAFAB-Geräts mit IABP unterstützt. Die mittlere Dauer bis zur dauerhaften LVAD betrug 5,9 Tage. Alle 9 Patienten mit CS, die das LAFAB-Gerät erhielten, zeigten eine Verbesserung ihrer Hämodynamik und Endorganfunktion unter LAFAB-Unterstützung, bevor sie sich einer LVAD-Implantation unterzogen21.
In einer weiteren Serie von 5 kritisch kranken Patienten mit CS22 wurde das LAFAB-Gerät emergent zur LV-Unterstützung als Brücke zur Transplantation eingesetzt. Die mittlere Dauer der Unterstützung betrug 7,6 ± 3,2 Tage, und alle 5 Patienten unterzogen sich erfolgreich einer Herztransplantation. In dieser Kohorte wurden keine gerätebedingten Komplikationen berichtet.
Agarwal et al. beschrieben 2015 einen seltenen, interessanten Fall einer dauerhaften LVAD-Thrombose mit CS, die erfolgreich mit fibrinolytischer Therapie und vorübergehender Unterstützung mit LAFAB23 behandelt wurde.
LAFAB-Gerät für perkutane Eingriffe mit hohem Risiko
Das LAFAB-Gerät wurde ausgiebig für perkutane Koronarinterventionen mit hohem Risiko (HRPCI) untersucht und eingesetzt 25,26,27,28 mit gerätebedingten vaskulären Komplikationen innerhalb akzeptabler Bereiche im Vergleich zu anderen vergleichbaren Geräten. In einer kürzlich durchgeführten Serie von 37 Patienten, die sich einer LAFAB-Geräteplatzierung für CS unterzogen hatten, unterzogen sich 28 Patienten erfolgreich HRPCI, während sie mit dem LAFAB-Gerät unterstützt wurden. Einundsiebzig Prozent der Patienten in der Kohorte wurden erfolgreich nach Hause entlassen. Der mittlere EuroSCORE lag bei 11 ± 3,4, was auf eine hohe Komplexität dieser kritisch kranken Kohorte hinweist. Die Autoren folgerten, dass das LAFAB-Gerät sicher und effektiv für HRPCI29 verwendet werden könnte. Zusätzlich zu HRPCI wurde das LAFAB-Gerät auch für Hochrisikopatienten eingesetzt, die sich einem perkutanen Aortenklappenersatz unterziehen, wie in einer kleinen Serie gezeigt30. Schließlich gibt es auch einen kleinen 2-Patienten-Bericht über die erfolgreiche Verwendung von LAFAB-Geräten für den Schock nach der Kardiotomie31.
Diskussion
Hämodynamik des LAFAB-Geräts:
Das hämodynamische Profil des LAFAB-Geräts unterscheidet sich von anderen pVADs. Indem Blut direkt aus dem LA abgelassen und in die Oberschenkelarterie zurückgeführt wird, umgeht das Gerät die LV vollständig. Auf diese Weise reduziert es das LV-Enddiastolische Volumen und den Druck, was zu einer verbesserten LV-Geometrie beiträgt und dadurch eine Verringerung der LV-Hubarbeit bewirkt. Durch die Rückführung des Blutes in die Arteria iliaca / absteigende Aorta nimmt die Nachlast jedoch zu. Dies führt zu einer Belastung des LV über erhöhten linksventrikulären endsystolischen Druck (LVESP). Insgesamt verengt sich die Druck-Volumen-Schleife und verschiebt sich leicht nach links34. Das Ergebnis ist eine Verringerung der Myokardbelastung und ein verringerter Sauerstoffverbrauch35. Die LVEDP und LVESP können durch Erhöhung der Pumpendrehzahl optimiert werden, wodurch der LV36 weiter entladen wird.
Zu den Vorteilen des LAFAB-Geräts gehören die Dekompression des LV und eine verminderte Schlaganfallarbeit, die zu einer Myokarderholung führt. LAFAB entlädt den LV indirekt durch Entlüften des LA (und benötigt keine separate Vorrichtung für die LV-Entladung). Es kann Herzunterstützung bis zu 4,5 l / min am Krankenbett bieten, und seine Haltbarkeit ist bis zu 2 Wochen in vivo37 gut etabliert.
Die Nachteile von LAFAB liegen in den fortgeschrittenen prozeduralen Fähigkeiten, die für die Geräteplatzierung erforderlich sind, da die transseptale Punktion keine allgegenwärtige Herzkatheterlaborfähigkeit ist. Die Notwendigkeit von TEE oder ICE sowie Fluoroskopie begrenzt die Verwendung dieses Geräts am Krankenbett in aufstrebenden Situationen. Der femorale Gefäßzugang verhindert die Gehfähigkeit und beeinträchtigt die Rehabilitation des Patienten. Wie bei anderen MCS können sowohl Hämolyse- als auch Zugangsklappenkomplikationen ebenfalls signifikant sein, wenn sie auftreten. Rest-ASD kann auch auftreten und die Ergebnisse bei Patienten, die zur Genesung überbrückt sind, beeinträchtigen.
Kontraindikationen für LAFAB-Gerät:
Zu den absoluten Kontraindikationen für die Verwendung des LAFAB-Systems gehören bereits vorhandene VSD, schwere KI, LA-Thrombus und schwere PVD, die das Einsetzen des Geräts ausschließen38.
Rechter Vorhof zu Lungenarterienbypass (RAPAB) bei rechtsventrikulärem Versagen:
Rechtsventrikuläre (RV) dominante oder biventrikuläre CS ist tödlich mit Sterblichkeitsraten im Krankenhaus von bis zu 75%39. Verschiedene MCS-Geräte wurden erfolgreich bei der Verwaltung von RV CS eingesetzt. Ähnlich wie beim LAFAB-System gibt es auch ein neuartiges RV-Unterstützungsgerät, das Blut von der RA zur PA ableitet. Es wird als ProtekDuo-System bezeichnet (Abbildung 4), das bis zu 4 Lpm Durchfluss für den RV40 bereitstellen kann. Es besteht aus einer langen 31 F (auch in kleineren Größen erhältlichen) Dual-Lumen-Kanüle, die von der internen Jugularvene durch ra und RV in die Haupt-PA41 positioniert werden kann. Unterstützt wird das System von einer Kreiselpumpe ähnlich dem LAFAB-System. Es entleert Blut aus der RA und gibt es an die Haupt-PA zurück, wobei das RV umgangen wird. Es kann auch an einen Oxygenator zur Lungenunterstützung angeschlossen werden. Das RAPAB-System hilft beim Entladen des Wohnmobils und reduziert den RV-Hub42. Dieses Gerät wird zunehmend bei RV CS43, massiver Lungenembolie44 und Postpositotomie-RV-Versagen nach LVAD oder Transplantation45 eingesetzt. Der Großteil der Daten für die RV-Unterstützung stammt aus dem TandemHeart Experiences and Methods (THEME) -Register46, wo das RAPAB-System bei 30 Patienten mit RV-Versagen verschiedener Ätiologien mit einem 30-Tage-Überleben von 72,4% und den meisten Patienten verwendet wurde, die zur Genesung überbrückt wurden.

Abbildung 4: Schematische Darstellung des ProTek Duo-Systems. Mit freundlicher Genehmigung von TandemLife, einer hundertprozentigen Tochtergesellschaft von LivaNova US Inc. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Verwendung des LAFAB-Schaltkreises kann in einer Reihe spezifischer klinischer Szenarien einen differenziellen Nutzen gegenüber einer transvalvulären Axialpumpe wie Impella bieten. Wie bereits erwähnt, ist die LifeSPARC-Pumpe in der Lage, supraphysiologische Durchflussmengen (bis zu 8 l/min) mit aktuellen Kanülenkonfigurationen zu liefern, so dass größere Patienten und solche, die auf transvalvulären Axialpumpen (Impella 2,5 L oder CP 4 L) -Geräten nicht ausreichend unterstützt oder vollständig entladen werden, von LAFAB profitieren können. Zweitens können Patienten mit prothetischen Aortenklappen oder ungünstiger Aortenklappen-/Wurzelanatomie wie patienten mit kritischer AS- oder Aortenklappenendokarditis und Patienten mit LV-Thrombus bevorzugt für LAFAB in Betracht gezogen werden. Schließlich kann LAFAB Teil einer abgestuften Unterstützungsstrategie sein, die mit TandemLife VA-ECMO für die akute kardiopulmonale Rettung begann, gefolgt von einer anschließenden LA-Drainage in den Kreislauf, wodurch effektiv eine nahezu vollständige biventrikuläre Unterstützung plus Sauerstoffversorgung bereitgestellt wird.
Das LAFAB-Gerät ist ein effektives und sicheres pVAD, das bei akutem oder chronischem LV-Versagen eingesetzt werden kann und bis zu 4,5 bis 5 Lpm Kreislaufunterstützung sowie eine indirekte LV-Entladung über LA-Dekompression bietet. Die Notwendigkeit eines transseptalen Zugangs kann die weit verbreitete Verwendung dieses Geräts für die unterstützung von emergenter LV in CS einschränken. Obwohl Beobachtungsdaten sowohl auf die Sicherheit als auch auf die Wirksamkeit des Geräts sowohl bei CS als auch bei HRPCI hindeuten, sind gut durchgeführte große, randomisierte Kontrollstudien erforderlich. In der Zwischenzeit könnten die Ergebnisse des laufenden THEME-Registers mehr Licht auf die realen Ergebnisse bei Patienten werfen, die mit dem LAFAB-Gerät behandelt werden.
Offenlegungen
Sandeep Nathan - Offenlegungen: Berater, Abiomed, Getinge, CSI, Inc.
Alexander Truesdell - Offenlegungen: Berater, Abiomed Inc.
Poonam Velagapudi - Offenlegungen: Beirat für die Womens' Health Initiative, Abiomed
Danksagungen
An das TandemHeart-Team von LifeSparc.
Materialien
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Referenzen
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten