Method Article
Uso de un dispositivo de asistencia ventricular percutánea / sistema de derivación de la aurícula izquierda a la arteria femoral para el shock cardiogénico
En este artículo
Resumen
El siguiente artículo describe el procedimiento gradual para la colocación de un dispositivo (por ejemplo, Tandemheart) en el shock cardiogénico (CS) que es un dispositivo percutáneo de asistencia ventricular izquierda (pLVAD) y un sistema de derivación de la arteria auricular izquierda a femoral (LAFAB) que evita y apoya el ventrículo izquierdo (VI) en CS.
Resumen
El sistema de derivación de la arteria auricular izquierda a la arteria femoral (LAFAB) es un dispositivo de soporte circulatorio mecánico (SQM) utilizado en el shock cardiogénico (CS) que evita el ventrículo izquierdo drenando sangre de la aurícula izquierda (LA) y devolviéndola a la circulación arterial sistémica a través de la arteria femoral. Puede proporcionar flujos que van desde 2.5-5 L / min dependiendo del tamaño de la cánula. Aquí, discutimos el mecanismo de acción de LAFAB, los datos clínicos disponibles, las indicaciones para su uso en el shock cardiogénico, los pasos de implantación, la atención post-procedimiento y las complicaciones asociadas con el uso de este dispositivo y su manejo.
También proporcionamos un breve video del componente de procedimiento de la terapia del dispositivo, incluida la preparación previa a la colocación, la colocación percutánea del dispositivo a través de la punción transseptal bajo guía ecocardiográfica y el manejo postoperatorio de los parámetros del dispositivo.
Introducción
El shock cardiogénico (SC) es un estado de hipoperfusión tisular con o sin hipotensión concomitante, en el que el corazón no puede suministrar suficiente sangre y oxígeno para satisfacer las demandas del cuerpo, lo que resulta en insuficiencia orgánica. Se clasifica en estadios A a E por la Society of Cardiovascular Angiography and Interventions (SCAI): estadio A - pacientes en riesgo de SC; estadio B - pacientes en la etapa inicial de CS con hipotensión o taquicardia sin hipoperfusión; estadio C - SC clásico con fenotipo frío y húmedo que requiere inotropos/vasopresores o soporte mecánico para mantener la perfusión; etapa D: deterioro en el soporte médico o mecánico actual que requiere escalamiento a dispositivos más avanzados; y estadio E: incluye pacientes con colapso circulatorio y arritmias refractarias que están experimentando activamente un paro cardíaco con reanimación cardiopulmonar en curso1. Las causas más comunes de SC son el IM agudo (IAM), que representa el 81% de los casos en un análisis notificado recientemente2, y la insuficiencia cardíaca aguda descompensada (ADHF). El SC se caracteriza clásicamente por congestión y alteración de la perfusión, que se manifiesta por presiones de llenado elevadas (presión de cuña capilar pulmonar [PCWP], presión diastólica final del ventrículo izquierdo [LVEDP], presión venosa central [CVP] y presión diastólica final del ventrículo derecho [RVEDP]), disminución del gasto cardíaco (CO), índice cardíaco (IC), gasto de potencia cardíaca (CPO) y mal funcionamiento del órgano final3 . En el pasado, los únicos tratamientos disponibles para el IAM complicado por SC eran la revascularización temprana y el tratamiento médico con inotropos y/o vasopresores4. Más recientemente, con el advenimiento de los dispositivos de soporte circulatorio mecánico (SQM) y el reconocimiento de que la escalada de vasopresores se asocia con un aumento de la mortalidad, se ha producido un cambio de paradigma en el tratamiento de la CS5 relacionada con el IAM y la ADHF5,6.
En la era actual de los dispositivos de asistencia ventricular percutánea (pVAD), hay una serie de plataformas/configuraciones de dispositivos MCS disponibles, que proporcionan soporte circulatorio y ventricular univentricular o biventricular con y sin capacidad de oxigenación7. A pesar de los aumentos constantes en el uso de pVAD para tratar tanto el IAM como el SC ADHF, las tasas de mortalidad se han mantenido en gran medida sin cambios5. Con la evidencia emergente de posibles beneficios clínicos para la descarga temprana del ventrículo izquierdo (VI) en AMI8 y el uso temprano de MCS en AMI CS9, el uso de MCS continúa aumentando.
El dispositivo MCS de derivación de la arteria auricular izquierda a femoral (LAFAB) evita el VI drenando la sangre de la aurícula izquierda (LA) y devolviéndola a la circulación arterial sistémica a través de la arteria femoral (Figura 1). Está soportado por una bomba centrífuga externa que ofrece un flujo de 2.5-5.0 litros por minuto (L / m) (bomba de nueva generación, designada como LifeSPARC, capaz de hasta 8 L / m de flujo) dependiendo del tamaño de las cánulas. Una vez que la sangre se extrae de la LA a través de la cánula venosa transseptal, pasa a través de la bomba centrífuga externa que recircula la sangre de nuevo en el cuerpo del paciente a través de la cánula arterial colocada en la arteria femoral.
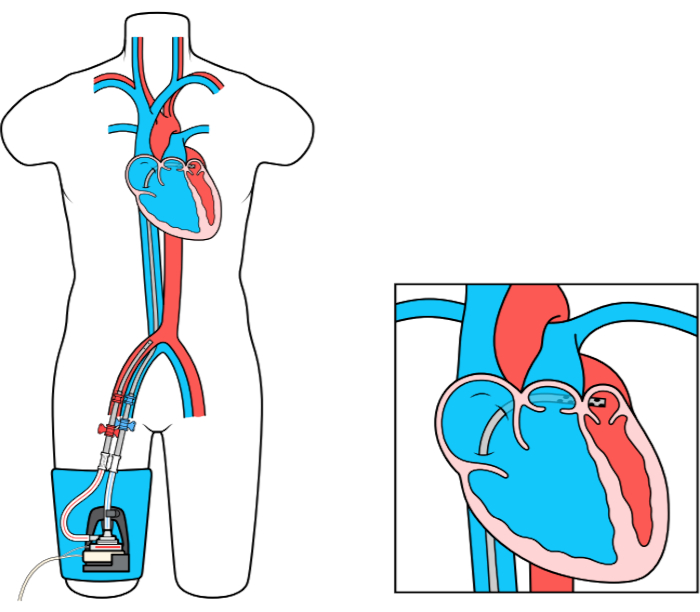
Figura 1: Configuración de LAFAB. Imagen cortesía de TandemLife, una subsidiaria de propiedad total de LivaNova US Inc. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Este procedimiento y protocolo han sido aprobados por la junta de revisión institucional y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).
1. Criterios del paciente
- Incluya a los pacientes con CS en estadio B y superior según lo definido por la declaración de consenso de SCAI1.
- Incluir como puente al trasplante o sistema duradero de asistencia ventricular izquierda en la etapa D de insuficiencia cardíaca.
- Incluir como puente a la recuperación en AMI complicado por CS.
- Excluir la contraindicación a la anticoagulación sistémica.
- Excluir la esperanza de vida <6 meses (neoplasia maligna activa).
- Excluir si hay presencia de trombo la lano.
- Excluir si los pacientes tienen enfermedad vascular periférica (PVD) con arterias pequeñas que no pueden acomodar las cánulas grandes.
- Excluir si los pacientes tienen una lesión neurológica irreversible / coma.
- Excluir si los pacientes tienen insuficiencia aórtica (IA) grave.
- Excluir si los pacientes tienen una comunicación interventricular (CIV).
NOTA: La colocación del dispositivo LAFAB incluye tres procesos separados: 1) configuración del controlador y la bomba; 2) colocación de cánulas arteriales y venosas y acceso transefectal bajo ecocardiograma transesofágico (TEE) o ecocardiograma intracardíaco (ICE); y 3) conectar el sistema al circuito.
2. Colocación de la aurícula izquierda al dispositivo de derivación de la arteria femoral
- Configuración del controlador
NOTA: Este paso se puede realizar a medida que el paciente está siendo transportado al laboratorio y la mesa se está configurando para el procedimiento. Por lo general, el representante del dispositivo y el equipo perfusionista están presentes para ayudar con el proceso.- Abra la caja e inicie la configuración del controlador con los siguientes pasos.
- Antes de encender el controlador, coloque 2 baterías en el controlador abriendo la puerta de la batería. Inserte cada batería colocando el logotipo mirando hacia afuera de la pantalla del controlador. La ranura de la batería debe alinearse con la carcasa clave de la batería. Asegúrese de que las baterías estén bien asentadas.
- Instale las otras 2 baterías en la base siguiendo el mismo proceso.
- Conecte el controlador a la base, verifique que esté completamente asentado en la base y conecte el cable de alimentación a la toma de corriente y conéctelo a la toma de corriente de la pared para obtener alimentación de CA. El controlador puede funcionar en la base conectada a la alimentación de CA o, cuando se separa de la base, puede funcionar con energía de la batería.
- Monte la base y el controlador en un poste intravenoso con la abrazadera.
- Encienda el controlador usando los botones laterales.
- Configuración de la bomba – Cebado del sistema
NOTA: El cebado de la bomba requiere dos personas: el operador principal se frota (operador estéril) y permanece en el campo estéril. El operador secundario (operador no estéril) maneja el controlador en el campo no estéril. La desaireación de la bomba es un paso crucial y debe realizarse con mucho cuidado.- Haga que el operador secundario abra el paquete y presente la bandeja de cebado al operador principal. Haga que el operador primario abra la cortina estéril y coloque los componentes de la bandeja de cebado en la mesa estéril. La bomba, el oxigenador y el tubo de oxígeno verde están incluidos en la bandeja.
- Haga que el operador primario entregue la línea de transmisión de la bomba al operador secundario, quien luego la conecta al controlador.
- Haga que el operador estéril retire las tapas protectoras del tubo e inserte los extremos en el recipiente. El tubo azul es el tubo de entrada que entra en el puerto azul. El tubo rojo es el tubo de salida que entra en el puerto rojo de la cuenca.
- Coloque el lavabo en la posición lista para rellenar inclinada hacia atrás y lejos del puerto azul.
- Haga que el operador secundario llene el recipiente con 4 litros de solución salina.
- Haga que el operador principal levante el lavabo e inclínelo hacia atrás a la posición óptima para cebar por gravedad la bomba.
- Asegúrese de que se haya eliminado todo el aire del tubo y la bomba. Golpee suavemente el tubo y la bomba para eliminar cualquier pequeña burbuja de aire. Este es un paso crucial.
- A continuación, encienda la bomba desde el extremo no estéril.
- Retire cualquier pequeña burbuja de aire en el oxigenador golpeando suavemente el oxigenador y colocando el tubo de salida en un nivel más alto (posición de las 12 en punto) para que las burbujas de aire se eleven por encima y escapen.
- Detenga la bomba una vez que se hayan eliminado todas las burbujas de aire.
- Sujete el tubo de entrada y salida. Retire el tubo de entrada y salida del recipiente y luego conecte el tubo de suministro de oxígeno verde al puerto de entrada de gas en el oxigenador. El circuito ya está listo.
- Acceso transseptal10,32
- Preparar y cubrir al paciente de manera estéril.
- Realice el procedimiento bajo anestesia general con el equipo de anestesia.
- Una vez que el paciente está intubado y sedado adecuadamente, pase la sonda TEE al esófago y obtenga las imágenes básicas. Si usa ICE, obtenga las imágenes después del acceso venoso.
- Identifique el lugar ideal para la septostomía en el tabique interauricular (IAS) utilizando TEE o ICE. Utilice la vista bicaval en TEE que muestra la parte membranosa de la IAS en la región de la fosa oval para exponer mejor la IAS.
- Confirme la ausencia de cualquier trombo en los Al donde se colocará la cánula de entrada utilizando TEE o ICE.
- Obtener acceso venoso femoral mediante guía ecográfica con técnica seldinger modificada e insertar un alambre guía de 0,035"
- Avance el alambre guía hacia la vena cava inferior (IVC) – unión auricular derecha y luego diríjalo hacia el IAS bajo guía fluoroscópica y TEE o ICE. Utilizando múltiples proyecciones angiográficas (oblicua anterior derecha o izquierda), identifique el sitio óptimo para la punción transeptal. Idealmente, debe hacerse en la región del foramen oval para minimizar las complicaciones. En pacientes con septos gruesos o aneurismáticos o un IAS que ha sido previamente parcheado o instrumentado quirúrgicamente o cerrado percutáneamente, se puede considerar el uso de una aguja transseptal energizada o de radiofrecuencia para asegurar una punción precisa sin deflexión de la aguja.
- Anticoagulado del paciente (ACT más de 250 segundos). Realice la punción transseptal con una aguja transseptal, inserte el alambre guía en el LA.
- Dilate el acceso venoso y el IAS con un dilatador de 2 etapas. Inserte la cánula transseptal y avance hacia La, retire el introductor y el cable guía, espere el sangrado hacia atrás y pinza. Cánula segura al paciente.
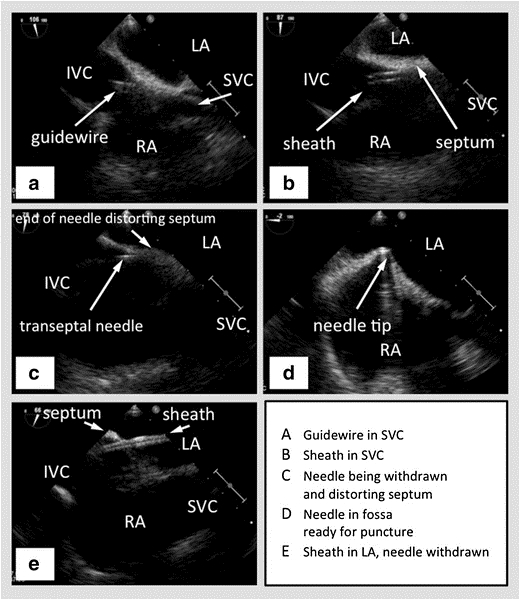
Figura 2: TEE con biplano en la vista bicaval que muestra el SVC a la derecha, el tabique interauricular horizontal en el medio con la aurícula izquierda arriba y la aurícula derecha abajo, y el IVC hacia la izquierda. (A) - Guidewire pasando al SVC. (B) - Vaina que pasa por encima del cable hacia el SVC. (C) - Aguja transseptal que pasa a través de la vaina. (D) - Aguja transseptal que coloca el tabique interauricular. (E) - Vaina que pasa a través del tabique interauricular hacia la aurícula izquierda, después de que se haya retirado la aguja. Imagen cortesía47
SVC – Vena Cava Superior, IVC – Vena Cava Inferior, RA – Atrio Derecho, LA – Atrio Izquierdo
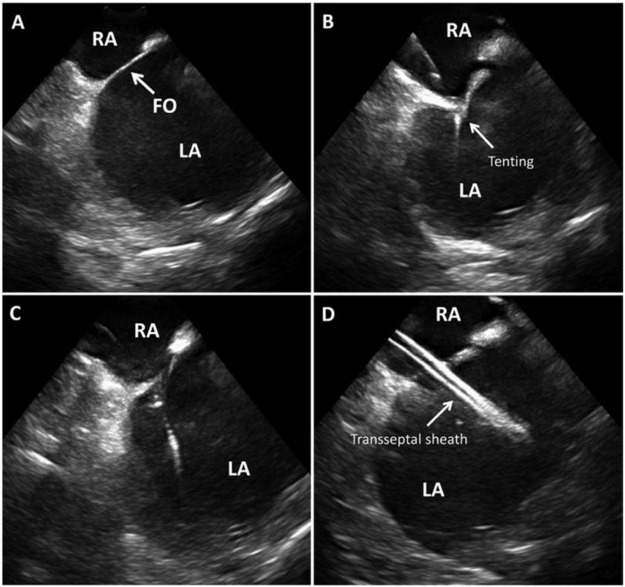
Figura 3: ICE para el acceso transeptal Acceso trans septal guiado por ICE que muestra el tabique interauricular y la fosa oval (FO) en (A), carpas septales a medida que la aguja se engancha en (B), pérdida de tiendas de campaña a medida que la aguja cruza en (C), vaina transseptal en la aurícula izquierda en D. Imagen cortesía48 .
RA – Aurícula derecha, LA – Aurícula izquierda, FO – Foramen Oval
-
Acceso arterial
- Obtener acceso arterial femoral mediante la técnica de Seldinger modificada mediante ecografía y guía angiográfica a nivel de la cabeza femoral. Inserte un cable guía de 0,035".
- Considere el uso de la técnica de "pre-cierre" utilizando los diversos dispositivos de cierre de acceso vascular disponibles comercialmente antes de aumentar el tamaño del acceso arterial.
- Dilatar en serie el sitio de acceso arterial adecuado al tamaño de la cánula arterial seleccionada. Inserte la cánula arterial, retire el introductor y el alambre guía, espere a que se sangre en la espalda y luego sujete. Asegure la cánula al paciente usando los soportes.
-
Conexión de los componentes
- Realice conexiones húmedas a húmedas a las cánulas para evitar la introducción de burbujas de aire en el circuito. Este es un paso crucial.
- Use inmersión salina o infusión constante de solución salina ("cascada") sobre los dos extremos de las cánulas a medida que se conectan.
- Conecte la cánula transseptal (venosa) a la entrada de la bomba que está marcada en azul y la cánula arterial a la salida de la bomba que está marcada en rojo.
- Primero, retire las abrazaderas venosas y arranque la bomba (desde la caja del controlador). Luego suelte las otras abrazaderas secuencialmente, verificando constantemente si hay aire, liberando la pinza arterial en último lugar.
- Ajuste la velocidad de la bomba (ajustando las RPM) para optimizar el flujo. Confirme la posición de la cánula bajo fluoroscopia y TEE o ICE y asegure el circuito al paciente.
- Mantener la anticoagulación terapéutica (tiempo de coagulación activado ACT a 180-220s o tiempo de tromboplastina parcial activada aPTT a 65-80s) durante el tiempo que la bomba esté en su lugar para prevenir la trombosis de la bomba y el accidente cerebrovascular. Este es un paso crucial.
3. Colocación del sistema de derivación de la aurícula derecha a la arteria pulmonar (RAPAB)
- Inicie el controlador, prepare la cámara inferior de la bomba y verifique si hay burbujas de aire, los mismos pasos descritos anteriormente.
- Cebar la cámara superior de la bomba, comprobar si hay aire y sujetarlo, los mismos pasos descritos anteriormente.
- Procedimiento del paciente
- Obtener acceso venoso en la vena yugular interna derecha (RIJ) mediante la técnica de Seldinger modificada bajo guía ecográfica.
- Inserte un catéter de arteria pulmonar (AP) con un lumen de 0.035" y avance a la AP principal justo antes de la bifurcación. Inserte un alambre guía de 0.035" de cuerpo rígido y retire el catéter pa.
- Anticoagulado del paciente (ACT > 250 s).
- Dilate el sitio de acceso venoso secuencialmente utilizando los dilatadores escalonados proporcionados en el paquete hasta que se alcance el tamaño deseado (29 franceses o 31 franceses).
- Inserte la cánula venosa (por ejemplo, ProtekDuo) sobre el alambre guía.
- Retire el cable guía, espere a que se sangre hacia atrás y luego sujete el puerto distal que está marcado como "Distal".
- Retire la tapa de la hemostasia, espere el sangrado hacia atrás y sujete el puerto proximal que está marcado como "Proximal". Asegure la cánula al paciente a través de suturas.
- Verifique las cánulas y realice conexiones de húmedo a húmedo desde la bomba hasta la cánula.
- Conecte la cánula proximal a la entrada de la bomba que está marcada en azul y la cánula distal a la salida de la bomba que está marcada en rojo. Encienda la bomba (desde el controlador).
- Suelte las abrazaderas secuencialmente, verificando constantemente si hay burbujas de aire. Ajuste la velocidad de la bomba (controlando las RPM) para optimizar el flujo.
- Confirme la posición de la cánula bajo fluoroscopia (puede usar la guía TEE para confirmar la posición en la AF principal) y asegure el circuito al paciente. Mantener la anticoagulación terapéutica (ACT a 180-220 s; aPTT a 65-80 s).
4. Eliminación del dispositivo
NOTA: Una vez que la función del órgano final del paciente ha mejorado y la hemodinámica se ha mantenido estable con la recuperación del VI o terapias avanzadas como la colocación / trasplante duradero de DAVI, el dispositivo se puede quitar.
- Antes de retirar el dispositivo, baje lentamente la velocidad en 0,5 L/min de manera escalonada, observando cuidadosamente la hemodinámica para asegurarse de que haya CO adecuado y presiones de llenado normales con menos soporte (también conocido como estudio de rampa hacia abajo o hacia abajo).
- Apague la bomba una vez que el estudio de reducción sea exitoso.
- Asegúrese de que el ACT esté < 150 segundos antes de retirar la cánula arterial. Apriete la sutura intravascular previamente colocada para ocluir el sitio de la arteriotomía o la presión manual se puede mantener durante al menos 40 minutos para garantizar la hemostasia.
- Retire la cánula transseptal en el IVC y retírela lentamente de la vena femoral. Aplique una figura de 8 suturas al sitio venoso y, además, mantenga la presión manual sobre el sitio para lograr la hemostasia.
NOTA: La comunicación interauricular (TEA) suele ser pequeña y no se cierra de forma rutinaria. - Después del procedimiento, realice un monitoreo continuo de la hemodinámica del paciente y la función del órgano final para garantizar la estabilidad.
- Eliminación de RAPAB.
- Similar a la extracción de LAFAB, cuando la función del órgano final del paciente se ha estabilizado con la recuperación o las terapias avanzadas, baje lentamente la bomba en 0,5 L / min, observando cuidadosamente la hemodinámica.
- Apague la bomba cuando el estudio de reducción sea exitoso.
- Una vez que ACT esté < 150 segundos, retire la cánula venosa del cuello y coloque una figura de 8 suturas para asegurar el sitio de la punción. Mantenga la presión manual además de la sutura para lograr una hemostasia completa.
- Después de la extracción, controle de cerca la hemodinámica del paciente y la función del órgano final para garantizar la estabilidad.
| Complicación | Factores de riesgo | Momento de ocurrencia | Precaución | Administración |
| Perforación cardíaca y taponamiento | Avance inadvertido de la aguja o dilatador o vaina a lo largo de la pared libre posterior de la aurícula izquierda. | Durante la punción transseptal, colocación de la cánula de entrada | Evaluación precisa del tabique interauricular en TEE o ICE y optimización del sitio y ángulo de la punción transseptal a través de angiografía y eco. | Pericardiocentesis inmediata para aliviar el taponamiento. Puede necesitar intervención quirúrgica. |
| Isquemia aguda de las extremidades distal a la canulación arterial | Vasos de pequeño calibre que albergan cánulas grandes, enfermedad arterial periférica preexistente | Inmediatamente después del procedimiento | Angiografía periférica previa a la canulación. | Colocación de catéter de perfusión distal, asistencia de cirugía vascular en casos graves. |
| Hemólisis, sangrado retroperitoneal, complicaciones vasculares como formación de pseudoaneurismas. | Velocidades de bomba más altas, trombosis de la bomba, CID, anticoagulación | En cualquier momento en la bomba | Optimice la velocidad de la bomba para cada paciente individualmente. Evitar la anticoagulación supraterapéutica. | Reducción de la velocidad de la bomba, manteniendo el rango terapéutico de anticoagulación. |
| Sitio óptimo de acceso arterial en la cabeza femoral en la arteria femoral común. | ||||
| Comunicación interauricular residual | Múltiples intentos de acceso transseptal | Después de la decanulación | Los defectos hemodinámicamente significativos pueden cerrarse percutáneamente. |
Tabla 1: Complicaciones del dispositivo LAFAB33.
Resultados
Aplicaciones clínicas del dispositivo LAFAB
La técnica y viabilidad de un sistema percutáneo de bypass transauricular del ventrículo izquierdo fueron descritas por primera vez en la década de 1960 por Dennis et al.11,12. Sin embargo, la punción transseptal no fue inicialmente ampliamente adoptada debido a complicaciones con la técnica de septostomía. Durante la última década, con los avances en el campo de las intervenciones percutáneas, los operadores han acumulado experiencia con la septostomía auricular, lo que ha llevado a un resurgimiento del dispositivo de asistencia ventricular transseptal o dispositivo LAFAB.
A partir de los estudios clínicos iniciales realizados en la década de 1990, la estrategia LAFAB ha demostrado un alto nivel de preservación miocárdica con una mayor disminución en el tamaño del infarto y una mayor descarga del VI en ami CS, en comparación con la bomba de balón intraaórtico (IABP)13.
Dispositivo LAFAB para choque cardiogénico
El circuito LAFAB es el más utilizado en el entorno de CS, donde se ha demostrado que es seguro y eficaz para aumentar el CO14. Un ensayo aleatorizado de 2006 que comparó el dispositivo LAFAB con IABP en CS15 en 42 pacientes demostró que el dispositivo LAFAB fue más efectivo para reducir el PCWP y mejorar el IC (1,2 ± 0,8 [P < ,05 vs basal]), aunque la mortalidad no difirió entre los dos grupos. La incidencia de eventos adversos graves no fue significativamente diferente entre los dos grupos de esta pequeña cohorte. Otro ensayo que comparó IABP y LAFAB mostró una mejoría significativa en el índice de potencia cardíaca con el dispositivo LAFAB (0,22 a 0,37 W/m2, p<0,001), pero con una tendencia hacia más complicaciones y ningún beneficio de mortalidad en el grupo LAFAB16. Más pacientes en el grupo LAFAB experimentaron isquemia aguda de extremidades significativamente más alta que requirió revascularización (n = 7 vs. n = 0, P = 0.009) y complicaciones hemorrágicas (n = 19 vs. n = 8, P = 0.002). También hubo una tendencia hacia el aumento de la incidencia de coagulopatía intravascular diseminada en el grupo LAFAB. Más recientemente, Kar et al. publicaron un estudio de 117 pacientes que se sometieron a la implantación de LAFAB para el SC grave refractario a la IABP y la terapia vasopresora18. Ochenta pacientes tenían miocardiopatía isquémica y 37 tenían miocardiopatía no isquémica. Hubo una mejoría inmediata en la hemodinámica y la perfusión de órganos finales en ambos grupos. Ic aumentó de 0,53 L/min·m2 a 3,0 L/min·m2, p<0,001 y pcWP disminuyó de 31,53 ± 10,2 mmHg a 17,29 ± 10,82 mmHg, p < 0,001). Las tasas de mortalidad a los 1 y 6 meses fueron de 40,2% y 45,3% respectivamente.
| Parámetro | IABP preimplantacional | VAD preimplantacional | Valor P | IABP post-implantación | VAD post-implantación | Valor P |
| Gasto cardíaco (L/min) | 3.0 (2.5–4.0) | 3.5 (3.3–4.2) | 0.29 | 3.3 (2.9–4.3) | 4.5 (4.0–5.4) | 0.007 |
| IC (L/min/m2) | 1.5 (1.3–2.0) | 1.7 (1.5–2.1) | 0.35 | 1.7 (1.5–2.1) | 2.3 (1.9–2.7) | 0.005 |
| Presión arterial media (mmHg) | 64 (57–74) | 63 (51–70) | 0.50 | 67 (62–84) | 74 (70–84) | 0.38 |
| IPC (W/m2) | 0.22 (0.18–0.30) | 0.22 (0.19–0.30) | 0.72 | 0.28 (0.24–0.36) | 0.37 (0.30–0.47) | 0.004 |
| SVR (dyn×s×cm−5) | 1440 (1034–1758) | 1049 (852–1284) | 0.16 | 1388 (998–1809) | 1153 (844–1425) | 0.08 |
| Frecuencia cardíaca (latidos/min) | 122 (92–130) | 113 (107–121) | 0.57 | 115 (90–125) | 105 (100–116) | 0.94 |
| PCWP (mmHg) | 27.0 (20.0–30.0) | 20.0 (18.0–23.0) | 0.02 | 21.5 (17.0–26.0) | 16.0 (12.5–19.0) | 0.003 |
| Presión venosa central (mmHg) | 13.0 (11.0–16.5) | 11.0 (9.0–15.3) | 0.29 | 12.0 (10.0–17.5) | 10.0 (8.0–12.0) | 0.06 |
| Media de PAP (mmHg) | 32.5 (27.5–38.0) | 28.0 (24.5–34.8) | 0.45 | 28.5 (25.5–33.5) | 24.5 (20.0–26.0) | 0.007 |
| Lactato sérico (mmol/L) | 3.8 (3.5–6.7) | 4.5 (3.1–6.5) | 0.53 | 3.25 (2.7–7.0) | 2.8 (2.3–3.5) | 0.03 |
| Exceso de base estándar (mmol/L) | −6.8 [−8.3–(−3.9)] | −5.1 [−7.5–(−4.4)] | 0.74 | −4.3 [−8.8–(−2.3)] | −4.3 [−6.1–(−3.3)] | 0.28 |
| pH | 7.34 (7.28–7.38) | 7.28 (7.24–7.36) | 0.50 | 7.36 (7.28–7.41) | 7.33 (7.31–7.40) | 0.49 |
Tabla 2: Tabla de resultados para la mejoría hemodinámica post LAFAB en comparación con la bomba de balón intraaórtico. Adaptado de Thiele et al.17.
Un informe de 10 pacientes también demostró el uso exitoso del dispositivo LAFAB en pacientes con estenosis aórtica (EA) grave y CS17. En esta serie de casos, el dispositivo LAFAB se utilizó como una medida de temporización para estabilizar la hemodinámica y la función del órgano final antes del reemplazo definitivo de la válvula. Ocho pacientes lo recibieron en el laboratorio de cateterismo cardíaco antes del reemplazo quirúrgico de la válvula con una función renal mejorada antes de la cirugía y 2 pacientes recibieron el soporte del dispositivo en la sala de operaciones después del reemplazo de la válvula. En total, 3 pacientes fallecieron17.
Dispositivo LAFAB como puente hacia el trasplante/VAD duradero
Otra aplicación importante del dispositivo LAFAB es en la insuficiencia cardíaca en etapa terminal, donde se utilizan como un puente hacia la terapia definitiva: dispositivo de asistencia ventricular izquierda (DAVI) duradero o trasplante cardíaco19.
En una serie de 25 pacientes con CS20, el 44% de los pacientes se sometieron a la colocación de LVAD duradero, de los cuales el 30% se recuperó y el 36% murió con apoyo. La duración media del soporte laFAB fue de 4,8 ± 2,1 días. Cincuenta y seis % de los pacientes experimentaron complicaciones relacionadas con el dispositivo, de las cuales el 90% fueron complicaciones de acceso vascular. Gregoric et al. informaron una serie de 9 pacientes con miocardiopatía en etapa terminal y shock refractario que fueron conectados con el dispositivo LAFAB a un DAVI duradero. Ocho de estos 9 pacientes fueron apoyados con IABP antes de la colocación del dispositivo LAFAB. La duración media del DAVI duradero fue de 5,9 días. Los 9 pacientes con SC que recibieron el dispositivo LAFAB mostraron mejoría en su hemodinámica y función del órgano final en el soporte LAFAB antes de someterse a la implantación de DAVI21.
En otra serie de 5 pacientes en estado crítico con CS22, el dispositivo LAFAB se colocó de forma emergente para el soporte del VI como un puente hacia el trasplante. La duración media del apoyo fue de 7,6 ± 3,2 días, y los 5 pacientes se sometieron a un trasplante cardíaco con éxito. No se informaron complicaciones relacionadas con el dispositivo en esta cohorte.
Agarwal et al. en 2015 describieron un caso raro e interesante de trombosis duradera del DAVI con SC tratada con éxito con terapia fibrinolítica y apoyo temporal con LAFAB23.
Dispositivo LAFAB para intervenciones percutáneas de alto riesgo
El dispositivo LAFAB ha sido estudiado y utilizado ampliamente para intervenciones coronarias percutáneas de alto riesgo (HRPCI)25,26,27,28 con complicaciones vasculares relacionadas con el dispositivo dentro de rangos aceptables en comparación con otros dispositivos comparables. En una serie reciente de 37 pacientes que se sometieron a la colocación de dispositivos LAFAB para CS, 28 pacientes se sometieron a HRPCI con éxito mientras recibían apoyo con el dispositivo LAFAB. El setenta y uno por ciento de los pacientes de la cohorte fueron dados de alta con éxito en casa. La media de EuroSCORE fue de 11 ± 3,4, lo que indica una alta complejidad de esta cohorte críticamente enferma. Los autores concluyeron que el dispositivo LAFAB podría usarse de manera segura y efectiva para HRPCI29. Además de HRPCI, el dispositivo LAFAB también se ha utilizado para pacientes de alto riesgo sometidos a reemplazo percutáneo de la válvula aórtica, como se demostró en una pequeña serie30. Finalmente, también hay un pequeño informe de 2 pacientes sobre el uso exitoso del dispositivo LAFAB para el shock post-cardiotomía31.
Discusión
Hemodinámica del dispositivo LAFAB:
El perfil hemodinámico del dispositivo LAFAB es distinto de otros pVAD. Al drenar la sangre directamente de la LA y devolverla a la arteria femoral, el dispositivo evita el VI por completo. Al hacerlo, reduce el volumen y la presión diastólica del extremo del VI, lo que contribuye a mejorar la geometría del VI y, por lo tanto, realiza una disminución en el trabajo de carrera del VI. Sin embargo, al devolver la sangre a la arteria ilíaca / aorta descendente, la carga posterior aumenta. Esto resulta en la carga del VI a través de la presión sistólica terminal del ventrículo izquierdo elevada (LVESP). En general, el bucle presión-volumen se estrecha y se desplaza modestamente hacia la izquierda34. El resultado es una reducción de la carga de trabajo miocárdica y una disminución del consumo de oxígeno35. El LVEDP y el LVESP pueden optimizarse aumentando la velocidad de la bomba, descargando aún más el LV36.
Las ventajas del dispositivo LAFAB incluyen la descompresión del VI y la disminución del trabajo del accidente cerebrovascular, lo que lleva a la recuperación del miocardio. LAFAB descarga el LV indirectamente ventilando el LA (y no requiere un dispositivo separado para la descarga del LV). Puede proporcionar soporte cardíaco de hasta 4,5 L/min al lado de la cama, y su durabilidad ha sido bien establecida hasta 2 semanas in vivo37.
Las desventajas de LAFAB radican en las habilidades avanzadas de procedimiento requeridas para la colocación del dispositivo, ya que la punción transseptal no es una habilidad ubicua del laboratorio de cateterismo cardíaco. La necesidad de TEE o ICE, así como de fluoroscopia, limita el uso de este dispositivo al lado de la cama en situaciones emergentes. El acceso vascular femoral previene la deambulación y afecta negativamente a la rehabilitación del paciente. Al igual que con otros SQM, tanto la hemólisis como las complicaciones del sitio de acceso también pueden ser significativas cuando ocurren. El TEA residual también puede ocurrir y afectar negativamente los resultados en pacientes tendidos a la recuperación.
Contraindicaciones para el dispositivo LAFAB:
Las contraindicaciones absolutas para el uso del sistema LAFAB incluyen VSD preexistente, IA severa, trombo LA y PVD severa que impide la inserción del dispositivo38.
Derivación de la aurícula derecha a la arteria pulmonar (RAPAB) para la insuficiencia ventricular derecha:
El SC ventricular derecho (RV) dominante o biventricular es mortal con tasas de mortalidad hospitalaria que oscilan hasta el 75%39. Varios dispositivos MCS se han utilizado con éxito en la gestión de RV CS. Similar al sistema LAFAB, también hay un nuevo dispositivo de soporte de RV que drena la sangre de la AR a la PA. Se llama sistema ProtekDuo (Figura 4), que puede proporcionar hasta 4 Lpm de flujo para el RV40. Consiste en una larga cánula de doble luz de 31 F (también disponible en tamaños más pequeños) que se puede colocar desde la vena yugular interna a través de la RA y RV, en el PA41 principal. El sistema está soportado por una bomba centrífuga similar al sistema LAFAB. Vacía la sangre de la AR y la devuelve a la AP principal, evitando la RV. También se puede conectar a un oxigenador para el soporte pulmonar. El sistema RAPAB ayuda a descargar el RV y reduce el trabajo de carrera del RV42. Este dispositivo se está utilizando cada vez más en RV CS43, embolia pulmonar masiva44 y fallo de RV de postcardiotomía después de LVAD o trasplante45. La mayor parte de los datos para el soporte de RV provienen del registro TandemHeart Experiences and Methods (THEME)46, donde se utilizó el sistema RAPAB en 30 pacientes con fracaso de RV de diversas etiologías, con una supervivencia a 30 días del 72,4%, y la mayoría de los pacientes se unieron a la recuperación.

Figura 4: Esquema del sistema ProTek Duo. Imagen cortesía de TandemLife, una subsidiaria de propiedad total de LivaNova US Inc. Haga clic aquí para ver una versión más grande de esta figura.
El uso del circuito LAFAB puede proporcionar un beneficio diferencial sobre una bomba de flujo axial transvalvular como Impella en una serie de escenarios clínicos específicos. Como se indicó anteriormente, la bomba LifeSPARC es capaz de entregar niveles suprafisiológicos de flujo (hasta 8 L / min) con configuraciones de cánula actuales y, por lo tanto, los pacientes más grandes y aquellos que no están adecuadamente soportados o completamente descargados en bombas de flujo axial transvalvular (Impella 2.5 L o CP 4 L) dispositivos pueden beneficiarse de LAFAB. En segundo lugar, los pacientes con válvulas aórticas protésicas o anatomía desfavorable de la válvula aórtica / raíz, como aquellos con AS crítica o endocarditis de la válvula aórtica y pacientes con trombo del VI pueden considerarse preferentemente para LAFAB. Finalmente, LAFAB puede ser parte de una estrategia de apoyo por etapas que comenzó con TandemLife VA-ECMO para el rescate cardiopulmonar agudo seguido de un drenaje posterior de LA en el circuito, proporcionando así de manera efectiva un soporte biventricular casi completo más oxigenación.
El dispositivo LAFAB es un pVAD eficaz y seguro que se puede utilizar en la insuficiencia aguda o crónica del VI que proporciona hasta 4,5 a 5 Lpm de soporte circulatorio, así como la descarga indirecta del VI a través de la descompresión de LA. La necesidad de acceso transseptal puede limitar el uso generalizado de este dispositivo para el soporte emergente de BT en CS. Aunque los datos observacionales sugieren tanto la seguridad como la eficacia del dispositivo tanto en CS como en HRPCI, se necesitan ensayos de control aleatorios grandes y bien realizados. Mientras tanto, los resultados del registro THEME en curso pueden arrojar más luz sobre los resultados del mundo real en pacientes tratados con el dispositivo LAFAB.
Divulgaciones
Sandeep Nathan - Divulgaciones: Consultor, Abiomed, Getinge, CSI, Inc.
Alexander Truesdell - Divulgaciones: Consultor, Abiomed Inc.
Poonam Velagapudi - Divulgaciones: Consejo asesor para la Iniciativa de Salud de la Mujer, Abiomed
Agradecimientos
Al equipo de TandemHeart en LifeSparc.
Materiales
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Referencias
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados