Method Article
Utilisation d’un dispositif d’assistance ventriculaire percutanée / système de pontage de l’oreillette gauche à l’artère fémorale pour le choc cardiogénique
Dans cet article
Résumé
L’article suivant décrit la procédure par étapes pour la mise en place d’un dispositif (par exemple, Tandemheart) en choc cardiogénique (CS) qui est un dispositif d’assistance ventriculaire gauche percutané (pLVAD) et un système de pontage auriculaire gauche à l’artère fémorale (LAFAB) qui contourne et soutient le ventricule gauche (LV) dans le CS.
Résumé
Le système de pontage auriculaire gauche à fémoral (LAFAB) est un dispositif de soutien circulatoire mécanique (MCS) utilisé dans le choc cardiogénique (CS) qui contourne le ventricule gauche en drainant le sang de l’oreillette gauche (LA) et en le renvoyant dans la circulation artérielle systémique via l’artère fémorale. Il peut fournir des débits allant de 2,5 à 5 L / min en fonction de la taille de la canule. Ici, nous discutons du mécanisme d’action du LAFAB, des données cliniques disponibles, des indications de son utilisation dans le choc cardiogénique, des étapes d’implantation, des soins post-procéduraux et des complications associées à l’utilisation de ce dispositif et à leur prise en charge.
Nous fournissons également une brève vidéo de la composante procédurale de la thérapie par dispositif, y compris la préparation pré-placement, la mise en place percutanée de l’appareil par ponction transseptale sous guidage échocardiographique et la gestion postopératoire des paramètres de l’appareil.
Introduction
Le choc cardiogénique (CS) est un état d’hypoperfusion tissulaire avec ou sans hypotension concomitante, dans lequel le cœur est incapable de fournir suffisamment de sang et d’oxygène pour répondre aux demandes du corps, entraînant une défaillance d’organe. Il est classé en stades A à E par la Society of Cardiovascular Angiography and Interventions (SCAI): stade A - patients à risque de CS; stade B - patients au stade précoce de la CS avec hypotension ou tachycardie sans hypoperfusion; stade C - CS classique avec phénotype froid et humide nécessitant des inotropes / vasopresseurs ou un soutien mécanique pour maintenir la perfusion; stade D - détérioration du support médical ou mécanique actuel nécessitant une escalade vers des dispositifs plus avancés; et stade E - comprend les patients présentant un collapsus circulatoire et des arythmies réfractaires qui subissent activement un arrêt cardiaque avec réanimation cardiorespiratoire en cours1. Les causes les plus courantes de CS sont l’IM aiguë (AMI) représentant 81 % des cas dans une analyse récemment rapportée2, et l’insuffisance cardiaque aiguë décompensée (ADHF). Le CS est classiquement caractérisé par une congestion et une altération de la perfusion, qui se manifestent par des pressions de remplissage élevées (pression de coin capillaire pulmonaire [PCWP], pression diastolique terminale ventriculaire gauche [LVEDP], pression veineuse centrale [CVP] et pression diastolique terminale ventriculaire droite [RVEDP]), diminution du débit cardiaque (CO), de l’indice cardiaque (IC), de la puissance cardiaque (CPO) et dysfonctionnement de l’organe final3 . Dans le passé, les seuls traitements disponibles pour l’AMI compliquée par la CS étaient la revascularisation précoce et la prise en charge médicale avec des inotropes et/ou des vasopresseurs4. Plus récemment, avec l’avènement des dispositifs de soutien circulatoire mécanique (MCS) et la reconnaissance que l’escalade des vasopresseurs est associée à une mortalité accrue, il y a eu un changement de paradigme dans le traitement de l’AMI et de l’ADHF CS5,6.
À l’ère actuelle des dispositifs d’assistance ventriculaire percutanée (pVAD), il existe un certain nombre de plates-formes /configurations de dispositifs MCS disponibles, qui fournissent un soutien circulatoire et ventriculaire univentriculaire ou biventriculaire avec et sans capacité d’oxygénation7. Malgré l’augmentation constante de l’utilisation des DAEP pour traiter à la fois l’AMI et l’ADHF CS, les taux de mortalité sont restés en grande partie inchangés5. Avec les nouvelles preuves des avantages cliniques possibles du déchargement précoce du ventricule gauche (LV) dans AMI8 et l’utilisation précoce de MCS dans AMI CS9, l’utilisation de MCS continue d’augmenter.
Le dispositif MCS LAFAB (Left Atrial to Femoral Artery Bypass) contourne le LV en drainant le sang de l’oreillette gauche (LA) et en le renvoyant dans la circulation artérielle systémique via l’artère fémorale (Figure 1). Il est soutenu par une pompe centrifuge externe qui offre un débit de 2,5 à 5,0 litres par minute (L / m) (pompe de nouvelle génération, désignée LifeSPARC, capable d’un débit allant jusqu’à 8 L / m) en fonction de la taille des canules. Une fois que le sang est extrait de l’AL via la canule veineuse transseptale, il passe à travers la pompe centrifuge externe qui recircule le sang dans le corps du patient via la canule artérielle placée dans l’artère fémorale.
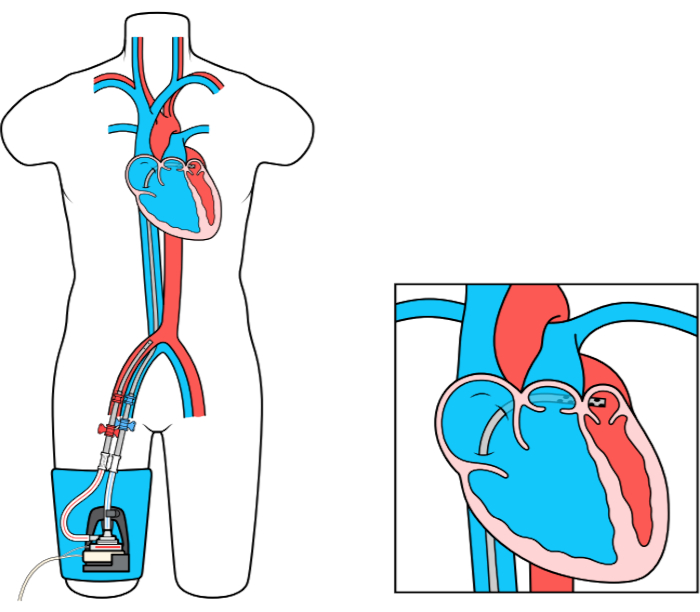
Figure 1 : configuration de LAFAB. Image reproduite avec l’aimable autorisation de TandemLife, une filiale en propriété exclusive de LivaNova US Inc. Veuillez cliquer ici pour voir une version agrandie de ce chiffre.
Protocole
Cette procédure et ce protocole ont été approuvés par le comité d’examen institutionnel et la Food and Drug Administration (FDA) des États-Unis.
1. Critères du patient
- Inclure les patients atteints de CS de stade B et supérieur tel que défini par l’énoncé de consensus SCAI1.
- Inclure comme pont à la transplantation ou système d’assistance ventriculaire gauche durable dans l’insuffisance cardiaque de stade D.
- Inclure comme pont vers la récupération dans AMI compliqué par CS.
- Exclure la contre-indication à l’anticoagulation systémique.
- Exclure l’espérance de vie <6 mois (malignité active).
- Exclure s’il y a présence de thrombus LA.
- Exclure si les patients ont une maladie vasculaire périphérique (PVD) avec de petites artères qui ne peuvent pas accueillir les grandes canules.
- Exclure si les patients ont une lésion neurologique irréversible / coma.
- Exclure si les patients présentent une insuffisance aortique sévère (IA).
- Exclure si les patients présentent une anomalie septale ventriculaire (VSD).
REMARQUE: Le placement du dispositif LAFAB comprend trois processus distincts: 1) configuration du contrôleur et de la pompe; 2) mise en place de canules artérielles et veineuses et accès transeptal sous échocardiogramme transœsophagien (TEE) ou échocardiogramme intracardiaque (ICE); et 3) connecter le système au circuit.
2. Placement de l’oreillette gauche au dispositif de pontage de l’artère fémorale
- Configuration du contrôleur
REMARQUE: Cette étape peut être effectuée lorsque le patient est transporté au laboratoire et que la table est en cours de mise en place pour la procédure. Habituellement, le représentant de l’appareil et l’équipe de perfusionnistes sont présents pour aider au processus.- Ouvrez la boîte et lancez la configuration du contrôleur en procédant comme suit.
- Avant d’allumer le contrôleur, placez 2 piles dans le contrôleur en ouvrant le capot de la batterie. Insérez chaque pile en plaçant le logo face à l’écran de la manette. La rainure de la batterie doit s’aligner sur le boîtier de la batterie clé. Assurez-vous que les piles sont bien installées.
- Installez les 2 autres piles dans la station d’accueil en suivant le même processus.
- Connectez le contrôleur à la station d’accueil, vérifiez qu’il est bien installé sur la station d’accueil et connectez le cordon d’alimentation à la prise de courant et branchez-le à la prise murale pour l’alimentation CA. Le contrôleur peut fonctionner dans la station d’accueil connectée à l’alimentation CA ou, lorsqu’il est séparé de la station d’accueil, il peut fonctionner en utilisant l’alimentation par batterie.
- Montez la station d’accueil et le contrôleur sur un poteau intraveineux à l’aide de la pince.
- Allumez la manette à l’aide des boutons sur le côté.
- Mise en place de la pompe – Amorçage du système
REMARQUE: L’amorçage de la pompe nécessite deux personnes - l’opérateur principal est nettoyé (opérateur stérile) et reste dans le champ stérile. L’opérateur secondaire (opérateur non stérile) manipule le contrôleur dans le champ non stérile. Le désaération de la pompe est une étape cruciale et doit être effectué très soigneusement.- Demandez à l’opérateur secondaire d’ouvrir l’emballage et de présenter le plateau d’amorçage à l’opérateur principal. Demandez à l’opérateur principal d’ouvrir ensuite le drap stérile et de disposer les composants du plateau d’amorçage sur la table stérile. La pompe, l’oxygénateur et le tube d’oxygène vert sont inclus dans le plateau.
- Demandez à l’opérateur principal de remettre la chaîne cinématique de la pompe à l’opérateur secondaire qui la branche ensuite au contrôleur.
- Demandez à l’opérateur stérile de retirer les capuchons de protection sur le tube et d’insérer les extrémités dans le bassin. Le tube bleu est le tube d’entrée qui va dans le port bleu. Le tube rouge est le tube de sortie qui va dans le port rouge du bassin.
- Placez le bassin dans la position prête à remplir inclinée vers l’arrière et loin du port bleu.
- Demandez à l’opérateur secondaire de remplir le bassin avec 4 litres de solution saline.
- Demandez à l’opérateur principal de soulever le bassin et de l’incliner vers une position prête à l’emploi pour amorcer la pompe par gravité.
- Assurez-vous que tout l’air a été retiré du tube et de la pompe. Tapotez doucement le tube et la pompe pour enlever les petites bulles d’air. C’est une étape cruciale.
- Allumez ensuite la pompe à partir de l’extrémité non stérile.
- Enlevez toutes les minuscules bulles d’air dans l’oxygénateur en tapotant doucement sur l’oxygénateur et en positionnant le tuyau de sortie à un niveau plus élevé (position 12 heures) pour que les bulles d’air s’élèvent au-dessus et s’échappent.
- Arrêtez la pompe une fois que toutes les bulles d’air sont enlevées.
- Serrez les tubes d’entrée et de sortie. Retirez les tubes d’entrée et de sortie du bassin, puis fixez le tuyau d’alimentation en oxygène vert au gaz dans l’orifice de l’oxygénateur. Le circuit est maintenant prêt.
- Accès transseptal10,32
- Préparez et drapez le patient de manière stérile.
- Effectuer la procédure sous anesthésie générale avec l’équipe d’anesthésie.
- Une fois que le patient est intubé et sous sédation adéquate, passez la sonde TEE dans l’œsophage et obtenez les images de base. Si vous utilisez ICE, obtenez les images après l’accès veineux.
- Identifiez l’endroit idéal pour la septostomie sur le septum inter-auriculaire (IAS) à l’aide de TEE ou ICE. Utilisez la vue bicaval sur TEE montrant la partie membraneuse de l’IAS à la région de la fossa ovalis pour mieux exposer l’IAS.
- Confirmez l’absence de thrombus dans l’AL où la canule d’entrée sera positionnée à l’aide de TEE ou d’ICE.
- Obtenir un accès veineux fémoral via un guidage échographique avec la technique de Seldinger modifiée et insérer un fil guide de 0,035 »
- Avancez le fil guide jusqu’à la veine cave inférieure (IVC) – jonction auriculaire droite, puis dirigez-le vers l’IAS sous guidage fluoroscopique et TEE ou ICE. À l’aide de multiples projections angiographiques (oblique antérieure droite ou gauche), identifiez le site optimal pour la ponction transeptale. Idéalement, il devrait être fait dans la région du foramen ovale pour minimiser les complications. Chez les patients présentant des septa épais ou anévrismaux ou un IAS qui a déjà été patché ou instrumenté chirurgicalement ou fermé percutané, on peut envisager l’utilisation d’une aiguille transseptale sous tension ou radiofréquence pour assurer une ponction précise sans déviation de l’aiguille.
- Anticoaguler le patient (ACT plus de 250 secondes). Effectuer une ponction transseptale à l’aide d’une aiguille transseptale, insérer un fil guide dans le LA.
- Dilater l’accès veineux et l’IAS avec un dilatateur à 2 étages. Insérez la canule transseptale et avancez-la dans LA, retirez l’introducteur et le fil guide, attendez le saignement arrière et serrez. Canule sécurisée pour le patient.
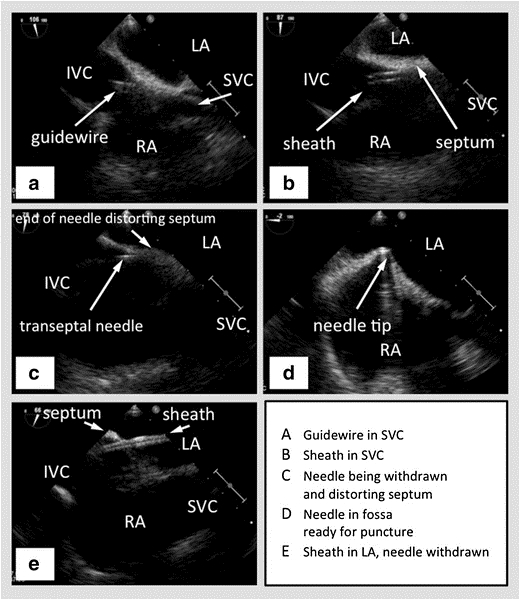
Figure 2 : TEE avec biplan dans la vue bicaval montrant le SVC à droite, le septum interauriculaire horizontal au milieu avec l’oreillette gauche au-dessus et l’oreillette droite en dessous, et l’IVC vers la gauche. (A) - Fil guide passant dans le SVC. (B) - Gaine passant au-dessus du fil dans le SVC. (C) - Aiguille transseptale passant à travers la gaine. (D) - Aiguille transseptale tentant le septum interauriculaire. (E) - Gaine passant à travers le septum interauriculaire dans l’oreillette gauche, après le retrait de l’aiguille. Photo courtoisie47
SVC – Veine cave supérieure, IVC – veine cave inférieure, RA – oreillette droite, LA – oreillette gauche
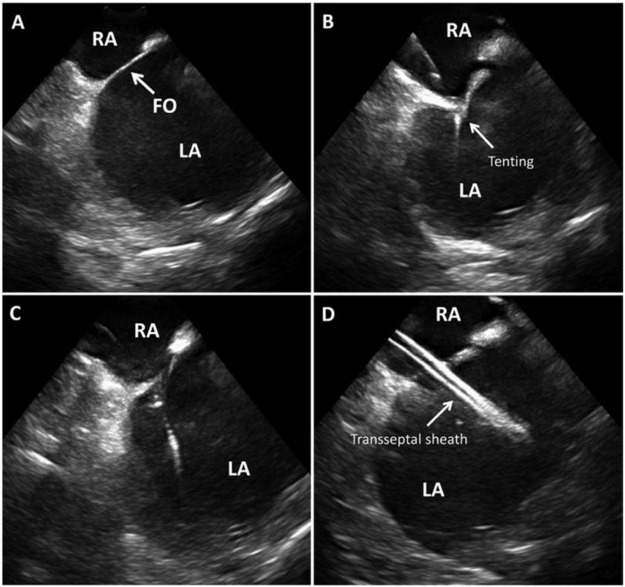
Figure 3 : ICE pour l’accès transeptal Accès trans septal guidé par ICE montrant un septum inter-auriculaire et une fosse ovale (FO) en (A), une tente septale lorsque l’aiguille s’engage dans (B), une perte de tente lorsque l’aiguille traverse (C), une gaine transseptale dans l’oreillette gauche dans D. Photo fournie48 .
RA – Atrium droit, LA – Atrium gauche, FO – Foramen Ovale
-
Accès artériel
- Obtenir un accès artériel fémoral via la technique de Seldinger modifiée en utilisant l’échographie et le guidage angiographique au niveau de la tête fémorale. Insérez un fil guide de 0,035 ».
- Envisagez d’utiliser la technique de « pré-fermeture » à l’aide des divers dispositifs de fermeture d’accès vasculaire disponibles dans le commerce avant d’augmenter l’accès artériel.
- Dilater en série le site d’accès artériel en fonction de la taille de la canule artérielle sélectionnée. Insérez la canule artérielle, retirez l’introducteur et le fil guide, attendez le saignement arrière, puis serrez. Fixez la canule au patient à l’aide des supports.
-
Connexion des composants
- Établissez des connexions humides à humides aux canules pour éviter l’introduction de bulles d’air dans le circuit. C’est une étape cruciale.
- Utilisez une immersion saline ou une infusion constante de solution saline (« cascade ») sur les deux extrémités des canules lorsqu’elles sont connectées.
- Connectez la canule transseptale (veineuse) à l’entrée de la pompe qui est marquée en bleu et la canule artérielle à la sortie de la pompe qui est marquée en rouge.
- Tout d’abord, retirez les pinces veineuses et démarrez la pompe (à partir du boîtier du contrôleur). Ensuite, relâchez les autres pinces séquentiellement, en vérifiant constamment la présence d’air, en libérant la pince artérielle en dernier.
- Ajustez la vitesse de la pompe (en ajustant les régimes) pour optimiser le débit. Confirmez la position de la canule sous fluoroscopie et TEE ou ICE et fixez le circuit au patient.
- Maintenir l’anticoagulation thérapeutique (temps de coagulation activé ACT à 180-220s ou temps de thromboplastine partielle activé aPTT à 65-80s) aussi longtemps que la pompe est en place pour prévenir la thrombose de la pompe et les accidents vasculaires cérébraux. C’est une étape cruciale.
3. Placement du système RAPAB (Right Atrium to Pulmonary Artery Bypass)
- Lancez le contrôleur, amorcez la chambre inférieure de la pompe et vérifiez les bulles d’air - les mêmes étapes décrites ci-dessus.
- Amorcez la chambre supérieure de la pompe, vérifiez la présence d’air et serrez-la - les mêmes étapes décrites ci-dessus.
- Procédure du patient
- Obtenir un accès veineux à la veine jugulaire interne droite (RIJ) via la technique de Seldinger modifiée sous guidage échographique.
- Insérez un cathéter de l’artère pulmonaire (PA) avec une lumière de 0,035 « et avancez-le vers l’AP principal juste avant la bifurcation. Insérez un fil guide rigide de 0,035 » et retirez le cathéter PA.
- Anticoaguler le patient (ACT > 250 s).
- Dilater le site d’accès veineux séquentiellement à l’aide des dilatateurs par étapes fournis dans l’emballage jusqu’à ce que la taille souhaitée soit atteinte (29 Français ou 31 Français).
- Insérez la canule veineuse (par exemple, ProtekDuo) sur le fil de guidage.
- Retirez le fil de guidage, attendez le fond perdu, puis serrez l’orifice distal marqué comme « Distal ».
- Retirez le capuchon de l’hémostase, attendez le saignement arrière et serrez l’orifice proximal marqué comme « proximal ». Fixez la canule au patient via des sutures.
- Vérifiez les canules et établissez des connexions humides à humides entre la pompe et la canule.
- Connectez la canule proximale à l’entrée de la pompe qui est marquée en bleu et la canule distale à la sortie de la pompe qui est marquée en rouge. Allumez la pompe (à partir du contrôleur).
- Relâchez les pinces séquentiellement, en vérifiant constamment les bulles d’air. Ajustez la vitesse de la pompe (en contrôlant les régimes) pour optimiser le débit.
- Confirmer la position de la canule sous fluoroscopie (peut utiliser les directives TEE pour confirmer la position dans l’AP principale) et fixer le circuit au patient. Maintenir l’anticoagulation thérapeutique (ACT à 180-220 s; aPTT à 65-80 s).
4. Retrait de l’appareil
REMARQUE: Une fois que la fonction de l’organe final du patient s’est améliorée et que l’hémodynamique est restée stable avec la récupération de la VL ou des thérapies innovantes telles que la mise en place / greffe durable de LVAD, le dispositif peut être retiré.
- Avant de retirer l’appareil, baissez lentement la vitesse de 0,5 L / min de manière progressive, en observant attentivement l’hémodynamique pour vous assurer qu’il y a suffisamment de CO et des pressions de remplissage normales avec moins de soutien (également connu sous le nom d’étude de descente ou de descente).
- Éteignez la pompe une fois que l’étude de préparation de lit est réussie.
- Assurez-vous que l’ACT est < 150 secondes avant de retirer la canule artérielle. Serrez la suture intravasculaire précédemment placée pour obstruer le site d’artériotomie ou la pression manuelle peut être maintenue pendant au moins 40 minutes pour assurer l’hémostase.
- Retirez la canule transseptale dans la CIV et retirez-la lentement de la veine fémorale. Appliquez une suture de 8 sur le site veineux et maintenez en outre une pression manuelle sur le site pour obtenir une hémostase.
REMARQUE: L’anomalie septale auriculaire (TSA) est généralement petite et n’est pas fermée régulièrement. - Après la procédure, effectuer une surveillance continue de l’hémodynamique du patient et de la fonction de l’organe final pour assurer la stabilité.
- Suppression du RAPAB.
- Semblable à l’ablation de LAFAB, lorsque la fonction de l’organe final du patient s’est stabilisée avec la récupération ou des thérapies innovantes, baissez lentement la pompe de 0,5 L / min, en observant attentivement l’hémodynamique.
- Éteignez la pompe lorsque l’étude de préparation de lit est réussie.
- Une fois que l’ACT est < 150 secondes, retirez la canule veineuse du cou et placez une suture de 8 pour sécuriser le site de ponction. Maintenez la pression manuelle en plus de la suture pour obtenir une hémostase complète.
- Après le retrait, surveillez de près l’hémodynamique et la fonction de l’organe final du patient pour assurer la stabilité.
| Complication | Facteur de risque | Moment de l’événement | Précaution | Gestion |
| Perforation cardiaque et tamponnade | Avancement involontaire de l’aiguille, du dilatateur ou de la gaine le long de la paroi postérieure libre de l’oreillette gauche. | Lors de la ponction transseptale, mise en place de la canule d’entrée | Évaluation précise du septum inter-auriculaire sur TEE ou ICE et optimisation du site et de l’angle de ponction transseptale par angiographie et écho. | Péricardocentèse immédiate pour soulager la tamponnade. Peut nécessiter une intervention chirurgicale. |
| Ischémie aiguë du membre distale à la canulation artérielle | Vaisseaux de petit calibre abritant de grandes canules, maladie artérielle périphérique préexistante | Immédiatement après la procédure | Angiographie périphérique avant la canulation. | Mise en place d’un cathéter de perfusion distale, assistance à la chirurgie vasculaire dans les cas graves. |
| Hémolyse, saignement rétropéritonéal, complications vasculaires telles que la formation de pseudoanévrisme. | Vitesses de pompe plus élevées, thrombose de pompe, DIC, anticoagulation | À tout moment sur la pompe | Optimisez la vitesse de la pompe pour chaque patient individuellement. Évitez l’anticoagulation suprathérapeutique. | Réduire la vitesse de la pompe, maintenir la gamme thérapeutique de l’anticoagulation. |
| Site optimal d’accès artériel à la tête fémorale dans l’artère fémorale commune. | ||||
| Anomalie septale auriculaire résiduelle | Tentatives multiples d’accès transseptal | Après la décannulation | Les défauts hémodynamiquement significatifs peuvent être fermés percutanés. |
Tableau 1 : Complications du dispositif LAFAB33.
Résultats
Applications cliniques du dispositif LAFAB
La technique et la faisabilité d’un système de pontage ventriculaire gauche trans-auriculaire percutané ont été décrites pour la première fois dans les années 1960 par Dennis et al.11,12. Cependant, la ponction transseptale n’a pas été initialement largement adoptée en raison de complications avec la technique de la septostomie. Au cours de la dernière décennie, avec les progrès dans le domaine des interventions percutanées, les opérateurs ont accumulé de l’expérience avec la septostomie auriculaire, ce qui a conduit à une résurgence du dispositif d’assistance ventriculaire transseptale ou dispositif LAFAB.
Dès les premières études cliniques menées dans les années 1990, la stratégie LAFAB a démontré un niveau élevé de préservation du myocarde avec une diminution plus importante de la taille de l’infarctus et un déchargement LV plus important dans AMI CS, par rapport à la pompe à ballonnet intra-aortique (IABP)13.
Dispositif LAFAB pour choc cardiogénique
Le circuit LAFAB est le plus largement utilisé dans le réglage de CS, où il a été démontré qu’il est sûr et efficace pour augmenter le CO14. Un essai randomisé de 2006 comparant le dispositif LAFAB à l’IABP dans CS15 chez 42 patients a démontré que le dispositif LAFAB était plus efficace pour réduire le PCWP et améliorer l’IC (1,2 ± 0,8 [P < 0,05 vs baseline]), bien que la mortalité ne différait pas entre les deux groupes. L’incidence des événements indésirables graves n’était pas significativement différente entre les deux groupes de cette petite cohorte. Un autre essai comparant IABP et LAFAB a montré une amélioration significative de l’indice de puissance cardiaque avec le dispositif LAFAB (0,22 à 0,37 W/ m2, p<0,001), mais avec une tendance vers plus de complications et aucun bénéfice de mortalité dans le groupe LAFAB16. Plus de patients du groupe LAFAB ont présenté une ischémie aiguë des membres significativement plus élevée nécessitant une revascularisation (n = 7 vs n = 0, P = 0,009) et des complications hémorragiques (n = 19 vs n = 8, P = 0,002). Il y avait également une tendance à l’augmentation de l’incidence de la coagulopathie intravasculaire disséminée dans le groupe LAFAB. Plus récemment, Kar et al. ont publié une étude portant sur 117 patients ayant subi une implantation de LAFAB pour un CS sévère réfractaire à l’IABP et au vasopresseur18. Quatre-vingts patients avaient une cardiomyopathie ischémique et 37 avaient une cardiomyopathie non ischémique. Il y avait une amélioration immédiate de l’hémodynamique et de la perfusion des organes finaux dans les deux groupes. L’IC est passé de 0,53 L/min·m2 à 3,0 L/min·m2, p<0,001 et le PCWP est passé de 31,53 ± 10,2 mmHg à 17,29 ± 10,82 mmHg, p < 0,001). Les taux de mortalité à 1 et 6 mois étaient de 40,2 % et 45,3 % respectivement.
| Paramètre | IABP préimplantatoire | VAD préimplantatoire | Valeur de P | Post-implantation IABP | Post-implantation VAD | Valeur de P |
| Débit cardiaque (L/min) | 3.0 (2.5–4.0) | 3.5 (3.3–4.2) | 0.29 | 3.3 (2.9–4.3) | 4.5 (4.0–5.4) | 0.007 |
| IC (L/min/m2) | 1.5 (1.3–2.0) | 1.7 (1.5–2.1) | 0.35 | 1.7 (1.5–2.1) | 2.3 (1.9–2.7) | 0.005 |
| Moyenne de la pression artérielle (mmHg) | 64 (57–74) | 63 (51–70) | 0.50 | 67 (62–84) | 74 (70–84) | 0.38 |
| IPC (W/m2) | 0.22 (0.18–0.30) | 0.22 (0.19–0.30) | 0.72 | 0.28 (0.24–0.36) | 0.37 (0.30–0.47) | 0.004 |
| SVR (dyn×s×cm−5) | 1440 (1034–1758) | 1049 (852–1284) | 0.16 | 1388 (998–1809) | 1153 (844–1425) | 0.08 |
| Fréquence cardiaque (battements/min) | 122 (92–130) | 113 (107–121) | 0.57 | 115 (90–125) | 105 (100–116) | 0.94 |
| PCWP (mmHg) | 27.0 (20.0–30.0) | 20.0 (18.0–23.0) | 0.02 | 21.5 (17.0–26.0) | 16.0 (12.5–19.0) | 0.003 |
| Pression veineuse centrale (mmHg) | 13.0 (11.0–16.5) | 11.0 (9.0–15.3) | 0.29 | 12.0 (10.0–17.5) | 10.0 (8.0–12.0) | 0.06 |
| Moyenne PAP (mmHg) | 32.5 (27.5–38.0) | 28.0 (24.5–34.8) | 0.45 | 28.5 (25.5–33.5) | 24.5 (20.0–26.0) | 0.007 |
| Lactate sérique (mmol/L) | 3.8 (3.5–6.7) | 4.5 (3.1–6.5) | 0.53 | 3.25 (2.7–7.0) | 2.8 (2.3–3.5) | 0.03 |
| Excédent de base standard (mmol/L) | −6,8 [−8,3–(−3,9)] | −5,1 [−7,5–(−4,4)] | 0.74 | −4,3 [−8,8–(−2,3)] | −4,3 [−6,1–(−3,3)] | 0.28 |
| pH | 7.34 (7.28–7.38) | 7.28 (7.24–7.36) | 0.50 | 7.36 (7.28–7.41) | 7.33 (7.31–7.40) | 0.49 |
Tableau 2 : Tableau des résultats de l’amélioration hémodynamique post-LAFAB par rapport à la pompe à ballonnet intra-aortique. Adapté de Thiele et al.17.
Un rapport de 10 patients a également démontré l’utilisation réussie du dispositif LAFAB chez les patients atteints de sténose aortique sévère (SA) et de CS17. Dans cette série de cas, le dispositif LAFAB a été utilisé comme mesure de temporisation pour stabiliser l’hémodynamique et la fonction de l’organe final avant le remplacement définitif de la valve. Huit patients l’ont reçu dans le laboratoire de cathétérisme cardiaque avant le remplacement chirurgical de la valve avec amélioration de la fonction rénale avant la chirurgie et 2 patients ont reçu le soutien de l’appareil dans la salle d’opération après le remplacement de la valve. Au total, 3 patients sont décédés17.
Dispositif LAFAB comme pont vers la transplantation / VAD durable
Une autre application importante du dispositif LAFAB est l’insuffisance cardiaque terminale, où ils sont utilisés comme pont vers un traitement définitif - dispositif d’assistance ventriculaire gauche durable (LVAD) ou transplantation cardiaque19.
Dans une série de 25 patients atteints de CS20, 44% des patients ont subi la mise en place d’une LVAD durable, dont 30% se sont rétablis et 36% sont décédés sous assistance. La durée moyenne du support LAFAB était de 4,8 ± 2,1 jours. Cinquante-six % des patients ont présenté des complications liées aux dispositifs, dont 90 % étaient des complications d’accès vasculaire. Gregoric et al. ont rapporté une série de 9 patients atteints de cardiomyopathie terminale et de choc réfractaire qui ont été pontés avec le dispositif LAFAB vers un LVAD durable. Huit de ces 9 patients ont été pris en charge par IABP avant la mise en place du dispositif LAFAB. La durée moyenne de la DAVG durable était de 5,9 jours. Les 9 patients atteints de CS qui ont reçu le dispositif LAFAB ont montré une amélioration de leur hémodynamique et de leur fonction d’organe final sur le support LAFAB avant de subir une implantation de LVAD21.
Dans une autre série de 5 patients gravement malades atteints de CS22, le dispositif LAFAB a été placé de manière émergente pour le soutien de la BT comme pont vers la transplantation. La durée moyenne du soutien était de 7,6 ± 3,2 jours, et les 5 patients ont subi une transplantation cardiaque avec succès. Aucune complication liée au dispositif n’a été signalée dans cette cohorte.
Agarwal et al. en 2015 ont décrit un cas rare et intéressant de thrombose LVAD durable avec CS traité avec succès avec un traitement fibrinolytique et un soutien temporaire avec LAFAB23.
Dispositif LAFAB pour les interventions percutanées à haut risque
Le dispositif LAFAB a été étudié et largement utilisé pour les interventions coronariennes percutanées à haut risque (HRPCI)25,26,27,28 avec des complications vasculaires liées au dispositif dans des plages acceptables par rapport à d’autres dispositifs comparables. Dans une série récente de 37 patients qui ont subi un placement de dispositif LAFAB pour CS, 28 patients ont subi HRPCI avec succès tout en étant pris en charge avec le dispositif LAFAB. Soixante et onze pour cent des patients de la cohorte ont été renvoyés chez eux avec succès. L’EuroSCORE moyen était de 11 ± 3,4, ce qui indique une grande complexité de cette cohorte gravement malade. Les auteurs ont conclu que le dispositif LAFAB pouvait être utilisé de manière sûre et efficace pour HRPCI29. En plus de HRPCI, le dispositif LAFAB a également été utilisé pour les patients à haut risque subissant un remplacement valvulaire aortique percutané, comme démontré dans une petite série30. Enfin, il existe également un petit rapport de 2 patients sur l’utilisation réussie du dispositif LAFAB pour le choc post-cardiotomie31.
Discussion
Hémodynamique du dispositif LAFAB:
Le profil hémodynamique du dispositif LAFAB est distinct des autres pVAD. En drainant le sang directement de l’AL et en le renvoyant dans l’artère fémorale, l’appareil contourne complètement le LV. Ce faisant, il réduit le volume et la pression diastoliques de fin de LV, contribuant à améliorer la géométrie de LV et entraînant ainsi une diminution du travail de course LV. Cependant, en renvoyant le sang dans l’artère iliaque / aorte descendante, la post-charge augmente. Il en résulte une charge du VL via une pression systolique terminale ventriculaire gauche élevée (LVESP). Dans l’ensemble, la boucle pression-volume se rétrécit et se déplace modestement vers la gauche34. Il en résulte une réduction de la charge de travail myocardique et une diminution de la consommation d’oxygène35. Le LVEDP et le LVESP peuvent être optimisés en augmentant la vitesse de la pompe, en déchargeant davantage le LV36.
Les avantages du dispositif LAFAB comprennent la décompression du LV et la diminution du travail d’AVC, conduisant à la récupération du myocarde. LAFAB décharge le LV indirectement en évacuant le LA (et ne nécessite pas de dispositif séparé pour le déchargement LV). Il peut fournir un soutien cardiaque jusqu’à 4,5 L / min au chevet du patient, et sa durabilité a été bien établie jusqu’à 2 semaines in vivo37.
Les inconvénients de LAFAB résident dans les compétences procédurales avancées requises pour le placement de dispositifs, car la ponction transseptale n’est pas une compétence de laboratoire de cathétérisme cardiaque omniprésente. Le besoin de TEE ou d’ICE ainsi que de fluoroscopie limite l’utilisation de cet appareil au chevet du patient dans les situations émergentes. L’accès vasculaire fémoral empêche la déambulation et nuit à la réadaptation du patient. Comme avec d’autres MCS, l’hémolyse et les complications du site d’accès peuvent également être importantes lorsqu’elles se produisent. Des TSA résiduels peuvent également survenir et affecter négativement les résultats chez les patients qui se rétablissent.
Contre-indications au dispositif LAFAB:
Les contre-indications absolues à l’utilisation du système LAFAB comprennent le VSD préexistant, l’IA sévère, le thrombus LA et l’insertion de dispositifs PVD sévères38.
Atrium droit au pontage de l’artère pulmonaire (RAPAB) pour insuffisance ventriculaire droite:
Le CS ventriculaire droit (RV) dominant ou biventriculaire est mortel avec des taux de mortalité à l’hôpital allant jusqu’à 75 %39. Divers dispositifs MCS ont été utilisés avec succès dans la gestion du RV CS. Semblable au système LAFAB, il existe également un nouveau dispositif de support RV drainant le sang de la RA vers le PA. Il s’agit du système ProtekDuo (Figure 4), qui peut fournir jusqu’à 4 Lpm de débit pour le RV40. Il se compose d’une longue canule à double lumière de 31 F (également disponible en plus petites tailles) qui peut être positionnée de la veine jugulaire interne à travers la PR et le RV, dans le PA41 principal. Le système est soutenu par une pompe centrifuge similaire au système LAFAB. Il vide le sang de la PR et le renvoie à l’AP principale, en contournant le RV. Il peut également être connecté à un oxygénateur pour le soutien pulmonaire. Le système RAPAB aide à décharger le VR et réduit le travail d’AVC du VR42. Cet appareil est de plus en plus utilisé dans le RV CS43, l’embolie pulmonaire massive44 et l’échec du RV de cartectoiotomie après une LVAD ou une greffe45. La majeure partie des données pour le soutien en VR provient du registre TandemHeart Experiences and Methods (THEME)46, où le système RAPAB a été utilisé chez 30 patients atteints d’insuffisance de RV de diverses étiologies, avec une survie à 30 jours de 72,4%, et la plupart des patients étant reliés au rétablissement.

Figure 4 : Schéma du système ProTek Duo. Image reproduite avec l’aimable autorisation de TandemLife, une filiale en propriété exclusive de LivaNova US Inc. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’utilisation du circuit LAFAB peut apporter un avantage différentiel par rapport à une pompe à débit axial transvalvulaire telle qu’Impella dans un certain nombre de scénarios cliniques spécifiques. Comme indiqué précédemment, la pompe LifeSPARC est capable de fournir des niveaux de débit supraphysiologiques (jusqu’à 8 L / min) avec des configurations de canules actuelles et donc des patients plus grands et ceux qui ne sont pas correctement pris en charge ou complètement déchargés sur des pompes à débit axial transvalvulaire (Impella 2,5 L ou CP 4 L) peuvent bénéficier de LAFAB. Deuxièmement, les patients atteints de valves aortiques prothétiques ou d’anatomie valvulaire/racine aortique défavorable, tels que ceux atteints d’endocardite aortique ou de caralite valvulaire critique, et les patients atteints de thrombus LV peuvent être considérés de préférence pour LAFAB. Enfin, LAFAB peut faire partie d’une stratégie de soutien par étapes qui a commencé avec TandemLife VA-ECMO pour le sauvetage cardiopulmonaire aigu suivi d’un drainage LA ultérieur dans le circuit, fournissant ainsi efficacement un soutien biventriculaire presque complet et une oxygénation.
Le dispositif LAFAB est un pVAD efficace et sûr qui peut être utilisé en cas de défaillance aiguë ou chronique du LV fournissant jusqu’à 4,5 à 5 Lpm de soutien circulatoire ainsi qu’un déchargement indirect du LV via la décompression LA. La nécessité d’un accès transseptal peut limiter l’utilisation généralisée de ce dispositif pour la prise en charge LV émergente dans CS. Bien que les données d’observation suggèrent à la fois l’innocuité et l’efficacité du dispositif dans le CS et le HRPCI, des essais contrôlés randomisés de grande envergure bien menés sont nécessaires. Entre-temps, les résultats du registre THEME en cours pourraient faire la lumière sur les résultats réels chez les patients pris en charge avec le dispositif LAFAB.
Déclarations de divulgation
Sandeep Nathan - Divulgations: Consultant, Abiomed, Getinge, CSI, Inc.
Alexander Truesdell - Divulgations : Consultant, Abiomed Inc.
Poonam Velagapudi - Divulgations: Conseil consultatif pour l’Initiative pour la santé des femmes, Abiomed
Remerciements
À l’équipe TandemHeart de LifeSparc.
matériels
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Références
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon