Method Article
Recombineering הומולוגי רקומבינציה בבונה
In This Article
Summary
הומולוגי רקומבינציה טכניקות מאוד לקדם דרוזופילה גנטיקה כך שהיא מאפשרת יצירת מוטציות מולקולריות מדויקות. האימוץ האחרון של recombineering מאפשר לתפעל את החתיכות גדולות של ה-DNA ולהפוך אותם דרוזופילה 6. השיטות שהוצגו כאן משלבים טכניקות אלה כדי ליצור במהירות הומולוגי רקומבינציה וקטורים גדולים.
Abstract
המשך הפיתוח של טכניקות למניפולציה מהירה, בקנה מידה גדולה של לוקוסי גנים אנדוגניים יהיה להרחיב את השימוש בתסיסנית כאורגניזם מודל גנטי למחקר הקשור לאדם מחלה. בשנים אחרונות חלו התקדמות טכנולוגית כמו הומולוגי רקומבינציה וrecombineering. עם זאת, יצירת מוטציות null חד משמעיות או חלבונים אנדוגניים תיוג נשארה מאמץ משמעותי עבור רוב הגנים. כאן, אנו מתארים ומדגימים טכניקות לשימוש בשיטות שיבוט מבוססות recombineering לייצר וקטורים שניתן להשתמש בם כדי למקד ולטפל לוקוסים אנדוגניים in vivo באופן ספציפי, הקמנו שילוב של שלוש טכנולוגיות:. (1) transgenesis BAC / recombineering, ( 2) (3) טכנולוגית Gateway הומולוגית רקומבינציה קצוות החוצה וכדי לספק שיטה יציבה, יעילה וגמישה למניפולצית לוקוסים הגנומי אנדוגניים. בפרוטוקול זה, אנו מספקים פרטי צעד אחר צעד על איך (1) העיצוב individuaוקטורי l, (2) איך לשכפל ברים גדולים של הדנ"א הגנומי לתוך וקטור רקומבינציה הומולוגית באמצעות תיקון פער, ו (3) איך להחליף או לתייג את הגנים של עניין בתוך וקטורים אלה באמצעות סיבוב שני של recombineering. לבסוף, אנו גם מספקים פרוטוקול לאיך לגייס את הקלטות הללו in vivo כדי לייצר פצצה, או גן מתויג באמצעות דפיקה ב. בקלות ניתן לאמץ שיטות אלה למטרות מרובות במקביל ולספק אמצעי למניפולציה של הגנום דרוזופילה במועד ויעיל.
Introduction
נקה מניפולציות מולקולריות מוגדרות של גנים בודדים בלוקוסים אנדוגניים מציעים כלי רב ערך כדי ללמוד מספר עצום של שאלות רלוונטיות לביולוגיה אוקריוטים. תסיסנית להפוך טכניקות גנטיות ליצירת אללים אובדן של פונקציה שהוכיחה להיות מאתגרים עד Golic ועמיתיו הציגו בשנת מיקוד גן vivo באמצעות הומולוגי רקומבינציה לדרוזופילה 1-3. הם הוכיחו כי לוקוסים הגנומי ספציפיים יכולים להיות ממוקדים באמצעות שבר ליניארי של DNA ממבנה מהונדס משולב. דנ"א זה ליניארי "תורם" נוצר in vivo באמצעות רקומבינציה FRT בתיווך (לבלו את ה-DNA מכרומוזום כמולקולה מעגלית) ואחריו ינאריזציה עם meganuclease I-SCEI. למרות שמתודולוגיה זו שימש בהצלחה ליצירת מגוון רחב של נגעים מוגדרים, הטכניקה לא הייתה להרחבה בקלות למניפולציה של גנים רבים במקביל כי כל indiviדורש מבנה נוקאאוט כפול עיצוב ייחודי ומותאם אישית. לדוגמה, קשיים בצורה חלקה מניפולציה שברים גדולים של ה-DNA (> 5 קילו) במבחנה באמצעות אנזים הגבלה קלסית / קשירה או שיבוט PCR, כמו גם את מגבלות הגודל של מסורתי בוקטורי שינוי vivo לעתים קרובות מפריעים ליצירה המהירה של הומולוגי רקומבינציה מיקוד וקטורים. כדי להתגבר על המגבלות האלה, אנחנו בשילוב P [acman] מערכת recombineering / transgenesis, המאפשר תת השיבוט וtransgenesis של עד 100 קילו של ה-DNA, עם קצוות החוצה גן מיקוד המתודולוגיה להקים פלטפורמה יעילה ומהירה יחסית כי הגן מאפשר תסיסנית מיקוד.
רקומבינציה בתיווך הנדסה גנטית (recombineering) היא הומולוגי רקומבינציה מבוססת טכנולוגיית שיבוט עוצמה 4,5. בניגוד לשיבוט אנזים / האנזים הגבלה קונבנציונלי, recombineering אינו מוגבל על ידי הרצף או sizדואר של ה-DNA מניפולציות. Recombineering משתמש א 'מיוחד זן חיידק שמטפח מכונות רקומבינציה מסופקות על ידי λ פגום prophage 4. טכניקה זו אומצה לאחרונה לשימוש בדרוזופילה 6,7. Recombineering בדרוזופילה מסתמך על כרומוזום שונה מותנה amplifiable קטריאלי מלאכותי (BAC) וקטור נקרא P [acman] 6,7. וקטור זה נושא שני מקורותיה של שכפול: OriV, אשר מייצר מספר גבוה עותק על זירוז כימי לטיהור כמויות גדולות של DNA הנדרשות לריצוף והזרקת עובר וOris, אשר שומר על מספר נמוך עותק בתנאים בסיסיים. בנוסף, P [acman] הווקטור מצויד באתר מצורף חיידקים (attB). אתר attB משמש כמצע לΦC31 transgenesis integrase בתיווך המאפשר שילוב של קטעי דנ"א גדולים לתוך אתר נחיתה קבוע מראש בתוך הגנום תסיסנית 8,9.
יש לנו שנוצרו P [acman] וקטור (המכונה P [acman]-KO 1.0) שיכול לשמש כוקטור למיקוד מסתיים החוצה הומולוגי רקומבינציה 10,11. לשלב קצוות החוצה גן מיקוד טכנולוגיה למערכת, הוספנו שניים FRT ושני אתרי I-SCEI. יש לנו גם כללו קלטת שער בתוך וקטור שונה זה כדי לייעל את התהליך של שילוב זרועות ההומולוגיה לP [acman]-KO 1.0. זה מספק דרך מהירה ופשוטה כדי להציג כמעט כל אזור גנומי עניין לתוך וקטור המיקוד. בפרוטוקול זה נתאר כיצד להנדס וקטור באמצעות מיקוד P [acman]-KO 1.0, ואיך לגייס את הווקטור הזה in vivo למקד את לוקוס אנדוגני. לצורך הפרוטוקול זה אנו נשתמש בקלטת RFP / קאן להחליף גן של עניין, אלא מגוון רחב של קלטות המכילות סמן בחירת אנטיביוטיקה ניתן להשתמש בפרוטוקול זה. יש לנו תוכננו ושימש בהצלחה סדרה של קלטות עבורהחלפת גן ותיוג 10,11.
Protocol
1. בחירה של BAC ואזור ליעד
- לרכוש BAC עם הגן של עניין (GOI) (כאן CG32095 משמש כדוגמה), חפש בCG32095 www.flybase.org. תחת סעיף המניות וריאגנטים, בדוק את הסעיף שכותרתו, "הגנום המשובטים" לBács המכיל CG32095. ודא כי BAC כולל לפחות 10 קילו במעלה או במורד הזרם 5 KB הגן של עניין. לחלופין, ניתן למצוא גם בשיבוטי P [acman] וקטור 7 בhttp://www.pacmanfly.org/libraries.html.
- השיבוטים BAC לבוא בתאי DH10B וP [acman] שיבוטים לבוא בEPI300 תאים. השיבוטים גנטיים צריכים להפוך לSW102 תאים, שהם נוחים לrecombineering. "Minipreps מלוכלך" מבוצע (miniprep Qiagen ללא שימוש בעמודה והאצת ה-DNA באמצעות isopropanol) מתחילמתרבות 5 מיליליטר O / N מחוסן עם תאים המכילים BAC. לאחר השעיה מחדש של ה-DNA הטרי גלולה ב 20 μl של DH 2 O, לדלל μl 1 ל100 μl של DH 2 O ולהשתמש μl 1 עד electroporate SW102 electrocompetent. כדי להפוך SW102 electrocompetent להשתמש בפרוטוקול הבא:
- לחסן SW102 תאים לתוך 4 מ"ל של LB. לגדול תרבות ב 32 ° CO / N הרועד ב 250 סל"ד חשוב:. תאי SW102 לא צריכים להיות חשוף לטמפרטורה גבוהה יותר מ 32 מעלות צלזיוס, אלא אם כן האינדוקציה של מכונות רקומבינציה היא רצויה.
- לחסן 1 מ"ל של SW102 התרבות הרווי לLB 44 מ"ל ולגדול על 32 ° C שייקר לOD 600 בין 0.2-0.3 (בדרך כלל על 1-1.5 שעות). הערה: פרוטוקולי recombineering אחרים ממליצים גובר התרבות בנפח קטן יותר כדי OD 600 0.6-0.7, לעומת זאת גובר של החיידקים לצפיפות נמוכה יותר בנפח גדול יותר באופן משמעותי מגביר את השינוי efficiency 12. בנוסף, שינוי זה מפחית את זמן ההמתנה.
- לקרר את התרבות בתרחיף מי קרח למשך 5 דקות חשובה:. במהלך השלבים הבאים חייבים להישמר תאים בטמפרטורות נמוכות. זה חיוני להשגת תאי electrocompetent באיכות טובה.
- צנטריפוגה התרבות על 4 מעלות צלזיוס ב 1500 XG במשך 10 דקות. בטל supernatant ולשטוף גלולה ב 25 מ"ל של קר (4 מעלות צלזיוס) גליצרול 10% 13. ראשית, תאי resuspend ב 5 מ"ל על ידי הקשה ומתערבל הצינור בתרחיף מי קרח (אל פיפטה מעלה ומטה) ולאחר מכן להוסיף את גליצרול 10% הנותרים (20 מ"ל).
- צנטריפוגה ב 4 ° C ב 1500 XG במשך 10 דקות, להשליך supernatant ולשטוף את הכדור בפעם שנייה עם 25% גליצרול 10 מ"ל קר כקרח.
- צנטריפוגה ב 4 ° C ב 1500 XG במשך 10 דקות, להשליך supernatant ולשטוף את הכדור בפעם שלישית עם 25% גליצרול 10 מ"ל קר כקרח.
- צנטריפוגה ב 4 ° C XG ב 1500 למשך 10 דקות וזורקים supernatant. התא גלולה עשויים להיות רופפים מאוד בשלב זה ויש להיזהר בעת השלכת supernatant. Resuspend גלולה ב 1 מ"ל של 10% גליצרול הקר. להעביר את תאי צינור 1.5 מ"ל ו צנטריפוגות במשך 30 שניות בXG 12,000 בmicrocentrifuge שולחן ב 4 ° C. מחק את רוב supernatant עוזב ≈ 90 μl של גליצרול / תאים. התאים מוכנים כעת להיות electroporated. הערה: בשלב זה ניתן לאחסן את התאים ב -80 ° C לשימוש מאוחר יותר. עם זאת, זה עלול להפחית את היכולת.
- Electroporate דנ"א לתוך תאים באמצעות קובט 1 מ"מ ב1,800 V, 25 μF, 200 Ω. לאחר electroporation, להוסיף 300 μl של SOC ולתת לתאים להתאושש במשך שעה 2 ב 32 מעלות צלזיוס (נד לא נדרש). תאי צלחת על אגר LB בתוספת 25 מיקרוגרם / מיליליטר chloramphenicol (או אנטיביוטיקה מתאימה אחרות, בהתאם לBAC שינה או PAC) ו לדגור על 32 מעלות צלזיוס במשך 24-30 שעות.
- זרועות הומולוגיה לגן המיקוד מתוכננות על ידי בחירה10 KB ing של הדנ"א הגנומי במעלה או במורד הזרם 5 KB יחסית לGOI. בחר 500 נ"ב בסוף 10 קילו ו -5 זרועות הומולוגיה kb כדי להגביר (ראה סעיף 2) (איור 1). 500 נ"ב שברים אלו משמשים כזרועות ההומולוגיה משמשות לrecombine אזור גנומי המקיף את GOI לP [acman] KO 1.0. שברים אלו מכונים זרוע שמאלית (לוס אנג'לס) לאזור שמתאים ל5 במעלה הזרם 'זרוע הומולוגיה וזרוע ימנית (ע"ר) לאזור שמתאים ל3 מורד הזרם' זרוע הומולוגיה חשובה:. זרועות הומולוגיה לא צריכים להכיל BamHI אתרי הגבלה, כפי שינאריזציה של פלסמיד (בשלב 3.2) מושגת באמצעות לעכל הגבלת BamHI.
2. הכנס את נשק הומולוגיה לP [acman] 1.0-KO
- להגדיר שתי PCR תגובות בודדות, אחד כדי להגביר את לוס אנג'לס ועוד כדי להגביר את RA. ללוס אנג'לס, השתמש פריימרים attB1-I-SCEI-LA-F וBamHI-LA-R ולהשתמש בפריימרים BamHI-RA-F וattB2-I-SCEI-RA-Rכדי להגביר את דלקת מפרקים שגרונית (טבלת 1). השתמש μl 1 של BAC DNA מצעד 1.2 או 0.5 μl של תרבות חיידקי לילה מבושלת המכילה BAC של עניין כתבנית. הקפד להשתמש פולימראז ה-DNA עם יכולת ההגהה. זה חל על כל הבא PCRs-למעט בדיקת PCR בצעדי 2.8 ו 3.13. הערה: זמן להארכת DNA פולימרז הגהה עשוי להיות שונה מDNA פולימראז תקי הקבוע בהתאם ליצרן. PfuUltra השני פיוז'ן HotStart, שpolymerizes בשיעור של 15 שניות / קילו, ניתן להשתמש בו בשלבים הבאים.
לוס אנג'לס / RA PCR
תנאי PCRμl 1 ה-DNA מminiprep המלוכלך מצעד של 1.2 באק 0.25 μl כל 20 מיקרומטר פריימר 2.5 μl 10X PfuUltra השני הצפת 0.75 μl 10mm (כל אחד) dNTP 0.5 μl פולימראז ה-DNA השני פיוז'ן HotStart PfuUltra 19.75 μl מים 25 μl סה"כ נפח Step1 ° C 2 דקות 95 להפעלת אנזים Step2 95 ° C 20 שניות לפגל שלב 3 60 ° C 20 שניות חישול Step4 72 מעלות צלזיוס הארכה שנייה 20 Step5 עבור לשלב 2 וחזור 29 מחזורים Step6 4 מעלות צלזיוס החזק - הפעל דוגמאות על 1% agarose ג'ל ולחלץ מוצרים באמצעות ערכת התאוששות DNA Zymoclean. Elute את ה-DNA מעמודת Zymoclean עם 10 μl של מים סטריליים.
- לבצע שחבור על ידי חפיפת הארכה (PCR SOE) עם שני שברים באמצעות 10-30 ng של DNA הכולל מכל מוצר מוגבר מטוהר ב2.2 (איור 2). זה בדרך כלל סביב 1/20 של כל מוצר ה-PCR מטוהר:
לוס אנג'לס / RA PCR-סו
תנאי PCR0.5 μl כל לוס אנג'לס וRA מוצר PCR המטוהר כ 10-30 ng 0.25 μl כל 20 מיקרומטר פריימר 2.5 μl 10X PfuUltra השני הצפת 0.75 μl 10mm (כל אחד) dNTP 0.5 μl פולימראז ה-DNA השני פיוז'ן HotStart PfuUltra 19.25 μl מים 25 μl סה"כ נפח Step1 ° C 2 דקות 95 להפעלת אנזים Step2 95 ° C 20 שניות לפגל שלב 3 55 ° C 20 שניות חישול (טמפ התחתון. כדי לאפשר לזרועות כדי לחשל) Step4 72 מעלות צלזיוס הארכה שנייה 20 Step5 עבור לשלב 2 ולחזור מחזור 1 Step6 95 ° C 20 שניות לפגל Step7 60 ° C 20 שניות חישול Step8 72 מעלות צלזיוס הארכה שנייה 20 Step9 עבור לשלב 2 וחזור 27 מחזורים Step10 4 מעלות צלזיוס החזק - הפעל את מדגם PCR על ג'ל agarose ולשחזר את להקת KB 1.0 על ידי מיצוי ג'ל. זוהי קלטת attB1-LA-BamHI-RA-attB2.
- השתמש בערכת אנזים ClonaseII BP Gateway להגדיר תגובת BP בעקבות הפרוטוקול מסופק על ידי היצרן.הקלטת שנוצרה ב2.4 תשמש את ה-DNA ותורם P [acman]-KO 1.0 כוקטור היעד.
- לדלל 50 μl של EPI300 תאי electrocompetent TransforMax על ידי הוספת 30 μl של גליצרול 10% קרים או קר DH 2 א ' להפוך μl 1 של תגובת BP לתוך תאי electrocompetent בעקבות הפרוטוקול מסופק על ידי היצרן. התוספת של מים מדללת את ריכוז מלח הגבוה למדי של תגובת לחץ הדם למניעת פריקת חשמל (קשתי) במהלך electroporation. Electroporate דנ"א לתוך תאים באמצעות קובט 1 מ"מ ב1,800 V, 25 μF, 200 Ω.
- הוסף 300 μl של SOC ולתת תאים להתאושש במשך שעה 1 ב 37 ° C (טלטול הוא לא חובה). תאי צלחת על LB-אגר + 50 מיקרוגרם / מ"ל של מגבר (P [acman]-KO 1.0 מכילים גן התנגדות מגבר). דגירה צלחות על 37 מעלות צלזיוס במשך 18-24 שעות.
- PCR לבדוק מושבות בודדות על ידי קונבנציונלי המושבה PCR באמצעות רצף T3 T3 (הוא במורד הזרם של קלטת השער בP [acman]-KO 1.0 (איורפריימרים 1 יור) וattB1-I-SCEI-LA-F. שיבוטים חיוביים יציגו להקה שפועלת ב 1.2 קילו.
- לגדול תרבות לילה של שיבוט חיובי בLB עם 50 מיקרוגרם / מיליליטר אמפיצילין.
- להגביר P [acman] וקטור-KO 1.0 המכיל את לוס אנג'לס ודלקת מפרקים שהגרוניים בLB 10 מ"ל עם 50 מיקרוגרם / מיליליטר אמפיצילין תרבות באמצעות פתרון שליטת עותק בעקבות הפרוטוקול של היצרן (Epicentre).
- בצע miniprep Qiagen בעקבות הפרוטוקול של היצרן.
3. Recombining האזור הגנומי של עניין לP [acman] 1.0-KO
יום 1
- לחסן SW102 תאים המכילים BAC עניין לתוך 4 מ"ל של LB בתוספת 25 מיקרוגרם / מיליליטר chloramphenicol (CHL) או האנטיביוטיקה הבחירה המתאימה. לגדול התרבות ב 32 ° CO / N רועד ב 250 סל"ד. חשוב: חוץ מבמהלך האינדוקציה בשלב 3.5, SW102 תאים לא צריכים להיות חשופים לטמפרטורה גבוהה יותר מ 32 מעלות צלזיוס, וטמפרטורה גבוהה מפעילה רקומבינציה MAchinery של תאים אלה.
יום 2
- מיקרוגרם דייג'סט של 0.4 P [acman]-KO-1.0 המכיל את זרועות LA ודלקת מפרקים שגרוניות שנוצרו בסעיף 2 ב≈ 20 יחידות של BamHI בתגובת μl 25. לדגור על 37 מעלות צלזיוס למשך לפחות 3 שעות חשובה:. עיכול ארוך הוא קריטי כדי להבטיח עיכול של כל ה-DNA. זה יקטין את מספר השיבוטים החיוביים שגויים בהמשך.
- לחסן 1.0 מ"ל של תרבות SW102/BAC הרווי לתוך 44 מיליליטר LB-Chl (25 מיקרוגרם / מ"ל) ולגדול על 32 ° C שייקר לOD 600 בין 0.2-0.3 (בדרך כלל על 1-1.5 שעות). כולל מדגם זהה נוסף לשליטה שאינו HS. מדגם זה יטופל בדיוק כמו ניסוי אחד בכל היבט אחד למעט HS. תרבות שאינה חום המום זה משמש כביקורת שלילית. המראה של מושבות רבות על צלחת השליטה הלא HS (שלב 3.13) מציין בדרך כלל שינוי לא מעוכל עם P [acman] KO 1.0 לוס אנג'לס/ RA פלסמיד.
- בעוד התרבות גדלה, לרוץ P [acman] BamHI מוגבל-KO על ג'ל. לאחר מכן ג'ל לחלץ וelute DNA ב10 μl מים חימם עד 55 ° C. הערה: אל elute-DNA בכל מאגר. מלחים המצויים במאגר עלולים לגרום לפריקה חשמלית במהלך electroporation.
- חום הלם התרבות על 42 מעלות צלזיוס במשך 15 דקות בדיוק באמבט המים. זה יהיה להפעיל את מכונות recombineering של SW102 תאים. אין לחמם הלם תרבות השליטה.
- מייד לאחר חום הלם, העברת שליטת תרבויות הלא HS חום המום ול50 צינורות הקאנוניים מ"ל מצונן ולתת צינת התרבויות בתרחיף מי קרח למשך 5 דקות חשובה:. במהלך השלבים הבאים חייבים להישמר תאים בטמפרטורות נמוכות . זה חיוני כדי להשיג תאי electrocompetent באיכות טובה.
- צנטריפוגה התרבות ב 1500 XG במשך 10 דקות. בטל supernatant ולשטוף גלולה ב 25 מ"ל של קר (4 מעלות צלזיוס) גליצרול 10% 13. ראשית,תאי resuspend ב 5 מ"ל על ידי הקשה ומתערבל הצינור בתרחיף מי קרח (אל פיפטה מעלה ומטה) ולאחר מכן להוסיף את גליצרול 10% הנותרים (20 מ"ל).
- צנטריפוגה ב 4 ° C ב 1500 XG במשך 10 דקות, להשליך supernatant ולשטוף את הכדור עם 25 קרח גליצרול 10% בפעם שנייה קר מ"ל.
- צנטריפוגה ב 4 ° C ב 1500 XG במשך 10 דקות, להשליך supernatant ולשטוף את הכדור עם 25 קרח גליצרול 10% בפעם שלישית קר מ"ל.
- צנטריפוגה ב 4 ° C ב 1500 XG במשך 10 דקות וזורקים supernatant. התא גלולה עשויים להיות רופפים מאוד בשלב זה ויש להיזהר בעת השלכת supernatant. Resuspend גלולה ב 1 מ"ל של 10% גליצרול הקר. להעביר את תאי צינור 1.5 מ"ל ו צנטריפוגות במשך 30 שניות בXG 12,000 בmicrocentrifuge שולחן ב 4 ° C. מחק את רוב supernatant עוזב ≈ 90 μl מים / תאים. הערה: בתאי נקודה זו יכולה להיות מאוחסנת ב -80 ° C לשימוש מאוחר יותר. עם זאת, זה עלול להפחית את היכולת.
- הוסף 2 μl של BamHI-מתעכל P [acman] (מטרה ל50 ng) לתאים ומערבבים בעדינות בעזרת קצה פיפטה. העברת תאים למ"מ electroporation קובט 1 וelectroporate ב1,800 V, 25 μF, 200 Ω.
- הוסף 300 μl של SOC ולתת לתאים להתאושש במשך שעה 2 ב 32 מעלות צלזיוס (נד לא נדרש). תאי צלחת על אגר LB בתוספת 50 מיקרוגרם / מיליליטר אמפיצילין ולדגור על 32 מעלות צלזיוס במשך 24-30 שעות.
יום 3
- מסך תקין לפער לתיקון באמצעות PCR המושבה. השתמש T3 ו-RA לבדוק פריימרים לדלקת המפרקים שהגרוניים וT7 ותחל בדיקת LA LA ל( טבלת 1). עיצוב 100-200 BP-PCR הגעה LA יחל כלפי האזור ממוקד (לוח 1) PCR-RA וההגעה. מושבות חיוביות מתגובות PCR באמצעות PCR-RA עם הגעה T3 או PCR-LA עם הגעה T7 תציג להקה שפועלת ב800-1,000 נ"ב (איור 3). הערה: זה הוא קריטי כדי לבחון את שתי ידי מאז התאגדות של אחד זרועאך לא אחר לעתים נצפה.
- Grow-PCR מאומתים מושבות על 32 מעלות צלזיוס ב4 מ"ל של LB 50 מיקרוגרם / מיליליטר אמפיצילין ללילה. הפוך את מניית קפוא של תאים אלה לשימוש מאוחר יותר.
4. החלפת האזור הגנומי עם קלטת המיקוד
יום 4
- להגביר את קלטת נוקאאוט RFP / קאן על ידי PCR באמצעות pENTR-RFP/KAN (predigested עם asci וNheI לlinearize) כתבנית ופריימרים 5'HA-RFP / קן-F ו-RFP 3'HA / קאן-R ( טבלת מס '1). קלטת RFP / קאן ניתן לבקש מ11 הפניה.
- ג'ל לטהר את המוצר ה-PCR משחררי ב20 μl של מים סטריליים. קלטת RFP-קאן בתוספת זרועות ההומולוגיה צריכה לרוץ סביב 3 קילו.
- לחסן 1 מ"ל של [acman] תרבות SW102 / P-KO הרווי (שלב 3.13) לתוך 44 מיליליטר LB-Amp (50 מיקרוגרם / מ"ל) ולגדול על 32 ° C שייקר לOD 600 בין 0.2-0.3. כולל מדגם זהה נוסף לשליטה שאינו HS. מדגם זה יטופל רקכמו ניסוי אחד בכל היבט אחד למעט HS.
- לאחר [acman] התרבות-KO SW102 / P מגיעה לצפיפות הרצויה, בצע את השלבים 3.5-3.10.
- Electroporate כ 100 ננוגרם של מיקוד קלטת ל90 μl של acman [] תאי electrocompetent SW102 / P-KO. העברת תאים למ"מ electroporation קובט 1 וelectroporate ב1,800 V, 25 μF, 200 Ω. הוסף 300 μl של SOC ולאפשר לתאים להתאושש במשך שעה 2 ב 32 מעלות צלזיוס (טלטול לא נדרש). הערה: מומלץ מאוד להשתמש בג'ל טרי מטוהר קלטת.
- פלייט תאים באגר LB + מגבר (50 מיקרוגרם / מ"ל) + קן (50 מיקרוגרם / מ"ל) ו דגירה של 24-30 שעות ב 32 ° C.
יום 5
- לגדול 5 מ"ל של תרבות מ5 מושבות שונות על 32 מעלות CO / נ
יום 6
- מבצע "מלוכלך miniprep" ולרוץ חצי את ה-DNA המתקבל על 1% agarose ג'ל לחפש יחסי הציבורesence של משקל מולקולרי נמוך פלסמיד. לא צריך להיות כל פלסמיד שפועל לשאוג 12 KB. (איור 4)
- הפוך 1:500 דילול של ה-DNA משיבוט חיובי ולהשתמש μl 1 עד 50 לelectroporate μl של TransforMax EPI300 חשוב:. הקפד לדלל את ה-DNA כדי למנוע electroporation של פלסמידים מרובים לתא אחד. פלייט תאים באגר LB + מגבר (50 מיקרוגרם / מ"ל) + קן (50 מיקרוגרם / מ"ל) ו דגירה של 18-24 שעות על 37 מעלות צלזיוס
יום 7
- לחסן מושבה אחת ב 10 מ"ל של LB + ולגדול O / נ
יום 8
- מיליליטר זרע 100 של מדיה LB עם תרבות רוויה מצעד 4.10. הוסף אנטיביוטיקה מתאימה בתוספת 100 μl של פתרון 1,000 X עותק שליטה ולדגור על 37 מעלות צלזיוס במשך 5-6 שעות.
- בצע maxiprep ולאמת החדרה של הקלטת באתר על ידי רצף הנכון.
- בנוסף לקביעת רצף, לבצע enzym הגבלהמבחן עיכול דואר עם ה-DNA משיבוט שלא הכיל כל משקל מולקולרי נמוך פלסמיד דנ"א וההורים שלה. את אנזימי ההגבלה שנבחרו יהיו שונים עבור כל גן, אבל המטרה היא למצוא קבוצה של אנזימים המאפשרים לחוקר לאפיין את וקטור recombineered. בדרך של דוגמה, וקטור מיקוד CG32095 היה מתעכל סדרתי עם פאצ'י, asci, BamHI וAatII. המראה של כל להקות והיעדרות הצפויות של כל להקות שגויות מאשר כי וקטור המיקוד כבר recombineered כראוי (איור 5).
5. הזרקת זבובים וגיוס קלטת בVivo
- הזרק את הקלטת באמצעות ΦC31 integrase, לאתר נחיתה מוגדר מראש של בחירה. ספקים חיצוניים, כגון קשת transgenics (http://www.rainbowgene.com), ניתן להשתמש בו עבור שירותי הזרקה חשוב:. DNA חייב להיות טרי עמ 'repared לפני ההזרקה. יעילות שינוי גבוהה יותר נצפתה כאשר ה-DNA הוא מוכנה באתר והזריקה באותו היום.
- לגייס את הקלטת מאתר הנחיתה, השתמש בלומינגטון מניית מספר 25,680 או 25,679. מניות אלה מכילים במורד הזרם ואני Flippase-SCEI של אמרגן הלם חום, על כרומוזום שניים ושלוש, בהתאמה. בנוסף, הם מכילים transgene HS-HID על כרומוזום איזון ועל כרומוזום ה-Y. לאסוף זכרים מהמניות שבחרו ולעבור לנשי בתולות שנשאו את קלטת KO באתר הנחיתה. . סט ~ 30 צלבים ומאפשרים לנקבות להטיל את הביצים במשך 2-3 ימי הערה: מומלץ לבחור את המניות שהן על כרומוזום שונה מהלוקוס הממוקד.
- הורים תהפכו לקבוצה חדשה של 30 בקבוקונים, וזחלי חום הלם על 37 מעלות צלזיוס במשך שעה 1, פעמיים ביום, במשך שלושה ימים רצופים. זעזועי החום להפעיל את הייצור של האנזימים; Flippase ואני-SCEI, ואת גן המוות של התאים הסתירו והרג את הזכרים והזבובים נושאים כרומוזומים איזון. לאפשר להורים בבקבוקונים חדשים התהפכו להטיל ביצים במשך 2-3 ימים, ולאחר מכן לחזור על זעזועי החום לבקבוקונים האלה, לאחר רפרף ההורים החוצה לתוך צלוחיות חדשות שוב. חזור על פעולה זו עבור מספר ההטלות, עד שההורים לא מטילים את הביצים יותר.
- לאסוף נקבות בתולה מצאצאי F1 של זבובי חום ההמומים, ולעבור לy - w - זכרים. לשאוף 150-200; שלוש צלבי בתולות ושלושה זכרים לצלב.
- מסך צאצאי F2 בהיקף ניאון המאפשר זיהוי של RFP בעיניים. מסך לעיניים חיוביות RFP שמוטציה לגנים הלבנים וצהובים (y - w -). תהליך מיון זה באופן חיובי בוחר את קיומו של את קלטת RFP ובוחר על היעדריו של [acman] אתר P הווקטור (מיני לבן) ונחיתה, אשר מסומן על ידי אור צהוב הגן פראי סוג:. זה פחות זמן קוןsuming למסך עבור RFP בעיניים, מאשר המסך הראשון לזבובי י.ו.. אירועי הגיוס יעילים מאוד בזעזועי החום, וכתוצאה מכך רבים זבובים המכילים פחות RFP בעיניים, בהשוואה ל Y - w - זבובים.
- הגדר את הזדווגויות זוג אחד עם כל y - w - RFP + לטוס, שכן כל אירוע גיוס עשוי להיות שונה. למפות את המכרז לכרומוזום הנכון. מיקוד כרומוזום נכון הוא ציין בדרך כלל ב> 95% מהמקרים.
- להקים מניות ולבדוק לאירועי מיקוד נכונים באמצעות טכניקות מקובלות לניתוח כתם דרום. עיצוב 2 KB בדיקה במעלה הזרם (יד שמאל) ומורד הזרם (יד ימין) של הגן להיות ממוקד, ו2 KB (או קצר יותר במידת צורך) פורש ORF נמחק. את שתי הבדיקות הראשונות תניב להקה בknockouts הומוזיגוטים והטרוזיגוטיים, שאינה קיים בwildtype, בעוד ORF לא יניב להקה בנוקאאוט הומוזיגוטים. מהיר ו-PCRאו ORF הוא גם אפשרי, אך זה מסתמך על היעדר להקה.
תוצאות
הגברה של לוס אנג'לס וזרועות הומולוגיה RA צריכה לייצר 500 מוצרי BP ותגובת PCR-SOE אמורה להניב 1.0 קילו מוצר (סעיפים 2.1-2.4; איור 2). תגובת BP ביצע בסעיף 2.5 היא בדרך כלל שינוי מאוד יעיל וחיידקים של תשואות מוצר 5-100 מושבות בממוצע. כמעט כל המושבות שנבדקו עם PCR לבדוק להראות את המוצר ה-PCR הצפוי.
במהלך הסיבוב הראשון של recombineering (סעיף 3) מצפה לקבל מושבות 20-40 לאחר הפיכתו של P מתעכל [acman]-KO-1.0 המכיל את זרועות RA לוס אנג'לס ולתוך SW102 תאים. 40-60% משיבוטים אלה ישאו את מוצר רקומבינציה הרצויה. השליטה ללא חום ההלם צריכה להכיל מעט מאוד, אם בכלל, בהשוואה למושבות תאי חום ההמום. הופעתו של אותו המספר של מושבות על שניהם מדגם ולוחות בקרה בדרך כלל מעידה על קיומו של פלסמיד לא חתוך או איזה זיהום אחר. במקרה זה, ניסוי שוLD להיות מושלך וחזר, הפעם לעכל P [acman]-KO-1.0 נושאים את לוס אנג'לס וזרועות להשלמת RA בעקבות ההוראה המתוארת בשלב 3.2. דוגמה לבדיקת PCR לאחזור של אזור הגנומי של עניין לP [acman]-KO 1.0 שבי ≈ 60 מושבות התקבלו מוצגת באיור 3. כאן 60% מהמושבות שנבדקו נשאו חייב להילקח product.Care רקומבינציה הרצויה שמוצרי ה-PCR הנצפים לרוץ בגודל חזה, שכן להקות PCR סוטה בדרך כלל מצביעות על אירועי recombineering שגויים.
לפעמים אין מושבות יגדלו לאחר הסיבוב הראשון של recombineering. שימוש בתאים עם יעילות תת אופטימלית מייצג את הגורם השכיח ביותר לתגובת recombineering נכשלה. שמירה על התא הקר בכל העת במהלך תקופת ההכנה שלהם והטיפול עדין בשוטף (לא מערבולת) היא קריטית להשגת תאים מוסמכים באיכות גבוהה. נסה להשתמש תמיד טרי מתעכל / מטוהר P [acman]-KO-1.0-DNA כדי להשיג את היעילות הגבוהה ביותר.
לפעמים הסיבוב הראשון של מושבות תשואות recombineering אבל מושבות אלה לא לעבור את בדיקת PCR assay. זה בדרך כלל מעיד על מוצרי recombineering שגויים אבל תוצאה כזו עשויה גם להצביע על בעיות פוטנציאליות עם אחד מסטי פריימר. כדי לאמת את פריימר PCR-הגעה לוס אנג'לס, הקים תגובת PCR בשילוב עם attB1-I-SCEI-LA-F. כדי לאמת את בדיקת PCR-RA-להגדיר תגובת PCR עם attB2-I-SCEI-RA-R. בשני המקרים להשתמש BAC המקורי כתבנית. PCR תגובות אלה אמורות להניב תוצרים של הגודל הצפוי, אשר ישתנו בהתאם לרצף של פריימרים הסימון. תוצאות חיוביות מניסוי שליטה זו תהיה לשלול את האפשרות שחוסר יכולת לזהות שיבוטים חיוביים בשל חוסר יעילות פריימר.
אם ניסיתי בסיבוב הראשון של recombineering מספר פעמים בעקבות הפרוטוקול לעיל ללא כל הצלחה ובצע את כלהציע פקדים, מומלץ לבחור בזוג חדש של 500 זרועות הומולוגיה נ"ב. מסיבות שאינן ברורים בעת הנוכחית, חלק מהאזורים גנטיים עמידים מאוד בפני רקומבינציה ה-DNA. לפעמים פשוט עיצוב זרועות הומולוגיה חדשה ולהעביר אותם לכיוון או הרחק מהגן של עניין פותר את הבעיות הללו.
הסיבוב השני של recombineering (סעיף 4) הוא בדרך כלל הרבה יותר יעיל. בדרך כלל 30-50 מושבות הם נצפו לאחר שינוי, עם 90-95% מאלה המכילים את המבנה הרצוי. הבעיה הנפוצה ביותר בשלב זה הוא השגת מושבות חיוביות שגויות. איור 4 מראה דוגמאות של שיבוטים חיוביים אמת ושקר, לאחר הסיבוב שני של recombineering (סעיף 4).
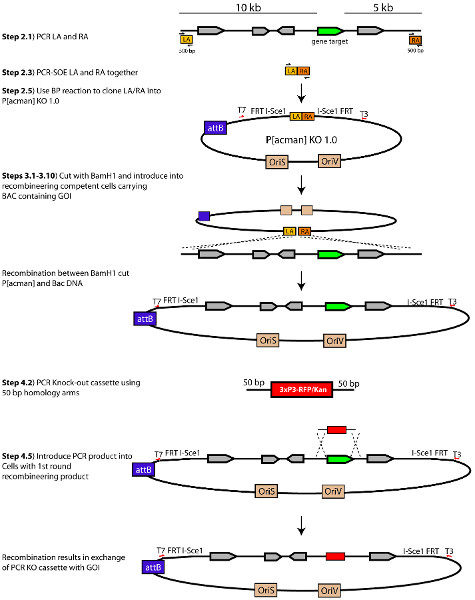
איור 1. סכמטי של עמ 'rocess לייצר P [acman] מיקוד וקטור 1.0-KO. השתנה מצ'אן et al. (2012). לחץ כאן לצפייה בדמות גדולה.

איור 2. סכמטי של שחבור על ידי חפיפת PCR (PCR SOE) שבוצע בשלב 2.3. לחץ כאן לצפייה בדמות גדולה.
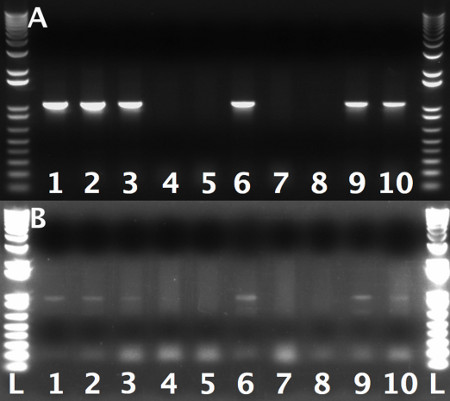
איור 3. PCR-ג'ל לבדוק יעילות של האירוע מראה recombineering הראשון נתיב אחד מייצג מושבה אחת:.. מושבות נבדקו על יד שמאל. אינטגרציה באמצעות T7 ופריימרים סימון-LA ב ': אותם המושבות כמו שנבדקו, לשילוב יד ימין באמצעות T3 ו-RA סימון primers.1kb פלוס בסולם הדנ"א שימש כסמן משקל מולקולרי. הערה: בשל תחול עניים של T3 פריימר יחסית לT7, הלהקות של סימון זרועו הימני היו כהות יותר באופן משמעותי. זה צריך להילקח בחשבון בעת הצגת ג'ל.

איור 4. ה-DNA agarose ג'ל מראה פלסמידים משקל מולקולריים גבוהים (P [acman]) ומשקל מולקולרי נמוך פלסמיד (תבנית מעוכלת) מבודדים משיבוטים חיוביים פוטנציאליים לאחר הסיבוב השני של recombineering. DNA היה מבודד מ4 שיבוטים חיוביים פוטנציאליים ורץ על 1% agarose ג'ל מוכתם ברומיד ethidium. שיבוטים 1,3 ו -4 הם שיבוטים חיוביים אמיתיים. שיבוט 2 הוא חיובי כוזבת כאמור על ידי כל הצורות של AP lasmid שפועל לשאוג 12 KB (להקת הגודל הגדולה ביותר במסלול סולם DNA). סולם 1 קילו פלוס DNA שימש כסמן משקל מולקולרי.

איור 5. מבחן לאירוע רקומבינציה רצוי על ידי הגבלת אנזים עיכול. בדוגמא לעיל מוצג מחשב חזה דפוס פסים של P [acman] לפני-KO CG32095 ולאחר הסיבוב השני של recombineering. ארבעה אנזימים שונים ששימשו: פאצ'י, asci, AatII וBamHI. המוצר בצורה נכונה recombined יקבל את אותן להקות כמו P ההורים שלה [acman]-KO CG32095 פרט לשינוי (ראשי חץ) המיועד. NEBcutter V2.0 שימש לנבא את דפוס הלהקה.
0346/50346fig6highres.jpg "src =" / files/ftp_upload/50346/50346fig6.jpg "/>
איור 6. סכמטי המתאר את ההתגייסות של קלטת מיקוד in vivo. לחץ כאן לצפייה בדמות גדולה.

טבלת מס '1. Primers. לחץ כאן לצפייה בטבלה גדולה יותר.
Discussion
כוחו של אורגניזמים מודל גנטיים במחקר ביו מבוסס במידה רבה על הכלים הזמינים למניפולציה גנטית. הדגמים הקטנים ג elegans ותסיסנית בפרט יאפשר לניתוח גנטי מולקולרי זול ומהיר של מסלולים שלמים ומשפחות הגן מעורבים בהתפתחות או תפקוד רב תאיים. בשנים אחרונות חלו התקדמות משמעותית בפיתוח כלי למניפולציה של גנים בדרוזופילה 14,15. לדוגמה, recombineering, אשר נמצאה בשימוש נרחב בגנטיקת עכבר כדי לתפעל בונה DNA BAC, הותאם לאחרונה לדרוזופילה, באמצעות השימוש בP [acman] הווקטור וtransgenesis ΦC31 בתיווך 6. קלטות בחירה שונות מאפשרות כניסה או מחיקה של רצפים ספציפיים בכל מקום בתוך מבנה באמצעות חיידקים מוסמכים רקומבינציה 4,13. יש לנו שונה מקורי P [acman] וקטור, כך שניתן להשתמש בו לבנייה בהומולוגי רקומבינציה וקטורי vivo כי יעד לוקוסים אנדוגניים בדרוזופילה. וקטור חדש זו מאפשר לאדם ליצור קלטות מיקוד עם זרועות הומולוגיה גדולות יותר מאלו שיכולים להתבצע בקלות באמצעות גזירה והדבקת שיטות שיבוט. יתרה מזאת, קלטת Gateway-שיבוט יש גם שולבה הווקטור הזה, המאפשר לאחד במהירות וביעילות להציג את הדנ"א הגנומי חדש למערכת.
למרות שרוב המתודולוגיה שתוארה כאן הוא פשוט, יש כמה צעדים שנמצאנו קריטי להצלחה של הטכניקה. בשל גודלו של ה-DNA מניפולציות (> 15 KB), בסיבוב הראשון של תגובת recombineering (סעיף 3) מהווה מכשול טכני משמעותי. לפיכך, סיבוב recombineering זה מחייב פרוטוקול רקומבינציה יעיל מאוד. התאמות פרוטוקול שוליות לכאורה, כמו גידול התאים לצפיפות נמוכה יותר, שטיפת התאים שלוש פעמים במקום שתיים ועם גליצרול 10% במקום DH 2 </ Sub> O 13, שיפרו מאוד את יעילות טרנספורמציה של התאים המוסמכים recombineering שלנו. בנוסף, דואג לוודא לוס אנג'לס / RA המכיל P [acman] הוא חתך להשלמה עם BamHI (שלב 3.1) מבטל חיובי שגוי רבות.
אירועי רקומבינציה לא רצויים מייצגים בעיה שכיחה למדי אחרת במהלך recombineering. לדוגמה, יש לנו ציינו מקרים של כפילויות והתקה בתוך מבנים שונים. אירועים אלה יכולים להוביל לבעיות רבות במהלך שינוי דרוזופילה ובגן vivo מיקוד. אימות PCR וניתוח רצפים לא יכולים לזהות את כל האירועים האלה. לפיכך, ניתוח אנזים הגבלה חייבת להתבצע על המוצר המשובט האחרון לפני הזריקה של ה-DNA לעוברי. בדיקה סופית זו הוכיחה קריטית ואפשרה לנו להימנע מהזרקת מבנים המכילים סטיות לא רצויות.
מקסי prepping וקטור המיקוד ממש לפני injection ואף פעם לא מקפיא את ה-DNA משפר באופן משמעותי את יעילות טרנספורמציה של המבנים הגדולים האלה לתוך דרוזופילה. בקיצור, פרטים קטנים עושים את הבדל גדול בהצלחה של שיטות אלה. הפרוטוקולים מפורטים והפגינו כאן מייצגים תובנות ממספר המקורות שונים והניסיון שלנו.
בזמן שאנחנו מקווים הפרוטוקול המובא כאן עוזר לאחרים לאמץ שיטות recombineering במעבדות שלהם, אנחנו מאמינים ששיפורים נוספים וחידודים למתודולוגיה הם עדיין אפשרי. מדי פעם, שברים הגנומי ספציפיים הם קשים לתפעל באמצעות recombineering מסיבות שאינן ברורים לגמרי. יתר על כן, למרות מאמצינו לחסל רקע לא רצוי, אנחנו עדיין מוצאים שחלקים מסוימים של הדנ"א הגנומי נוטים לייצר מוצרים סופיים באופן שגוי recombineered. הבנה עמוקה יותר של תהליך recombineering עשויה להניב פרוטוקולים אופטימליים יותר בעתיד והדיון הפתוח שלrecombineering כישלונות וסיפורי הצלחה תשקוד על השימוש המוצלח של טכניקות רבי עוצמה אלה על ידי קהילת המחקר הרחבה יותר.
Disclosures
אין לי המחברים כל אינטרסים מתחרים בכל הקשור לטכניקות שתוארו כאן.
Acknowledgements
ברצוננו להודות לוגו Bellen ומרכז מאגר בלומינגטון לחומרים כימיים. בנוסף, אנו מודים כהן Venken, הוגו Bellen וכל חברי Buszczak וHiesinger המעבדות לדיונים מועילים. עבודה זו נתמכה על ידי מענקים מהמכון הלאומי לבריאות לACR (T32GM083831), PRH (RO1EY018884) ומגה (RO1GM086647), מענק על ידי מניעת סרטן מכון המחקר של טקסס למגה וPRH (RP100516), וולץ' קרן (I-1657) לPRH. מגה הוא א 'א' וגריר גרסון Fogelson Scholar במחקר ביו וPRH הוא חוקר יוג'ין מק 'דרמוט במחקר ביו במרכז רפואי UT Southwestern.
Materials
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| SW102 Recombination competent bacteria | NCI-Frederick | Recombination Bacteria (SW102, SW105 and SW106) | http://ncifrederick.cancer.gov/research/brb/logon.aspx |
| TransforMax EPI300 electrocopmpetent E. coli | Epicentre | EC300110 | Includes CopyControl induction solution |
| PfuUltra II Fusion HS DNA Polymerase | Aligent Technology Inc. | 600670 | |
| BamHI-HF | New England Biolabs | R3136S | |
| Zymoclean Gel DNA Recovery Kit | Zymo Research | D4001 | |
| Use Gateway BP ClonaseII Enzyme kit | Invitrogen | 11789-020 | |
| P[acman]KO1.010 | Buszczak and Hiesinger Labs | Upon request | |
| pENTR RFP-Kan11 | Buszczak and Hiesinger Labs | Upon request | |
| Flystocks | Bloomington stock center | Stock numbers: 25680, 25679 | y1 w*/Dp(2;Y)G, P{hs-hid}Y; P{70FLP}11 P{70I-SceI}2B snaSco/CyO, P{hs-hid}4 y1 w*/Dp(2;Y)G, P{hs-hid}Y; P{70FLP}23 P{70I-SceI}4A/TM3, P{hs-hid}14, Sb1 |
| Electroporation machine | Biorad GenePulser Xcell with PC module | 165-2662 | |
| Cuvettes | Fisher Brand | #FB101 |
References
- Rong, Y. S., Golic, K. G. A targeted gene knockout in Drosophila. Genetics. 157, 1307-1312 (2001).
- Rong, Y. S., Golic, K. G. Gene targeting by homologous recombination in Drosophila. Science. 288, 2013-2018 (2000).
- Gong, W. J., Golic, K. G. Ends-out, or replacement, gene targeting in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 100, 2556-2561 (1073).
- Warming, S., Costantino, N., Court, D. L., Jenkins, N. A., Copeland, N. G. Simple and highly efficient BAC recombineering using galK selection. Nucleic Acids Res. 33, e36 (2005).
- Copeland, N. G., Jenkins, N. A., Court, D. L. Recombineering: a powerful new tool for mouse functional genomics. Nat. Rev. Genet. 2, 769-779 (2001).
- Venken, K. J., He, Y., Hoskins, R. A., Bellen, H. J. P[acman]: a BAC transgenic platform for targeted insertion of large DNA fragments in D. melanogaster. Science. 314, 1747-1751 (2006).
- Venken, K. J., et al. Versatile P[acman] BAC libraries for transgenesis studies in Drosophila melanogaster. Nat. Methods. 6, 431-434 (2009).
- Groth, A. C., Fish, M., Nusse, R., Calos, M. P. Construction of transgenic Drosophila by using the site-specific integrase from phage phiC31. Genetics. 166, 1775-1782 (2004).
- Bischof, J., Maeda, R. K., Hediger, M., Karch, F., Basler, K. An optimized transgenesis system for Drosophila using germ-line-specific phiC31 integrases. Proceedings of the National Academy of Sciences of the United States of America. 104, 3312-3317 (2007).
- Chan, C. C., et al. Systematic discovery of Rab GTPases with synaptic functions in Drosophila. Current Biology: CB. 21, 1704-1715 (2011).
- Chan, C. C., Scoggin, S., Hiesinger, P. R., Buszczak, M. Combining recombineering and ends-out homologous recombination to systematically characterize Drosophila gene families: Rab GTPases as a case study. Commun. Integr. Biol. 5, 179-183 (2012).
- Wu, N., Matand, K., Kebede, B., Acquaah, G., Williams, S. Enhancing DNA electrotransformation efficiency in Escherichia coli DH10B electrocompetent cells. Electronic Journal of Biotechnology. 13, (2010).
- Wang, S., Zhao, Y., Leiby, M., Zhu, J. A new positive/negative selection scheme for precise BAC recombineering. Mol. Biotechnol. 42, 110-116 (2009).
- Venken, K. J., Bellen, H. J. Transgenesis upgrades for Drosophila melanogaster. Development. 134, 3571-3584 (2007).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448, 151-156 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved