Préparation de réactifs anhydres et équipement
Vue d'ensemble
Source : Laboratoire de Dr. Dana Lashley - College of William and Mary
Démontré par : Timothy Beck et Lucas Arney
Beaucoup de réactions en chimie organique est sensibles à l’humidité et doit être effectué sous l’exclusion attentive de l’eau. Dans ces cas les réactifs ont une affinité élevée pour réagir avec l’eau de l’atmosphère et si la gauche exposés la réaction souhaitée n’aura pas lieu ou donner de faibles rendements, parce que les réactifs sont modifiées chimiquement.
Pour éviter les réactions indésirables avec H2O que ces réactions doivent être réalisées sous atmosphère inerte. Atmosphère inerte est générée par l’exécution de la réaction sous azote gazeux, ou dans des cas plus sensibles, sous un gaz rares comme l’argon.
Tous les composants dans une telle réaction doivent être complètement anhydre, ou pas d’eau. Cela inclut tous les réactifs et solvants utilisés ainsi que tous les verres et les équipements qui entrera en contact avec les réactifs. Les réactions extrêmement sensibles à l’eau doivent être effectuées à l’intérieur d’une boîte à gants qui fournit un complètement scellé hors milieu anhydre pour travailler sous grâce à une paire de gants qui déborde sur un des côtés de la chambre.
Principles
Drying of Glassware
Glassware must be completely dry when running reactions with water-sensitive molecules. Glass, which consists of silicon dioxide (SiO2), has microscopic traces of water adsorbed to its surface, even when it looks dry to the eye. The Si-O bonds attract water and as a result a film of water molecules start coating the surface of glass and accumulate over time. In order to free glassware from water it can be dried over-night in an oven or alternatively flame-dried directly before conducting the reaction. Avoid washing glassware the same day as running a reaction inside of it. Note: for reactions that are not very water-sensitive it is possible to rinse the glassware out with acetone directly before use. This drying method is absolutely insufficient for reactions such as the Grignard reaction.
Advantages and disadvantages of the different methods:
Drying glassware in an oven is time-consuming but is also very convenient and works well for all types of glassware. Flame-drying glassware is much quicker but requires the set-up of a Bunsen burner (which is always an additional safety concern) and may not be used with conical vials. Due to the thickness of the base compared to the rest of the conical vial the tension created during heating can cause cracks in the glass. While drying glassware with acetone is a very quick fix for reactions that are not overly sensitive, one should always keep in mind the generated solvent waste and the cost and environmental burden associated with that.
Drying of Solvents
Many different techniques exist for the drying of solvents with varying degrees of effectiveness. Some laboratories use commercially available systems for the drying of solvents. These systems employ so called drying trains and can dry several different types of solvents simultaneously. This method is very safe and convenient yet rather expensive and not available in most laboratories. Residual water content values of 1-10 ppm can be achieved this way.
Another method of drying solvents is by use of highly reactive metals such as sodium in so-called solvent stills. This method poses several safety concerns due to the risk of fires and explosions and is not usually performed by students in undergraduate teaching labs. It is however frequently used in research labs by more advanced students and professionals. Solvent stills will deliver fairly dry solvents and should be employed for extensive drying of ethers (THF, diethylether, etc) or hydrocarbons. Note: this method should never be used for drying of chlorinated solvents because an explosive reaction may occur. When drying with sodium metal an indicator called benzophenone is used to monitor the drying progress. In the presence of water the solution will be clear or yellow, but when the solvent is dry the solution will be blue or purple. Benzophenone is a ketone and reacts with metallic sodium (Na0) into a ketyl radical, which has a blue/purple color. In the presence of water the radical is protonated to give a colorless product. Residual water content achieved by this method is typically around 10 ppm.
Water may also be removed from liquid reagents or solvents by the use of desiccants, or drying agents. These are highly hygroscopic solids, meaning that they readily absorb and thereby remove water from an organic liquid. In recent years a very effective method has been developed using molecular sieves for the drying of various solvents. This method is much more convenient than the use of active metal solvent stills and bypasses the safety concerns of that method. Molecular sieves are commonly used, and probably the most effective desiccant currently available. They are a microporous material made of sodium and calcium aluminosilicates. The pore-sizes of molecular sieves can vary typically between 2–5 Å (0.2–0.5 nm) and are used to trap or absorb small molecules while larger molecules do not fit inside the pores. The molecular sieves are available in powder or bead form and can be used to trap water (a small molecule) thereby removing it from another liquid with a larger molecular size. Molecular sieves are also common components of everyday life products, for example cat-litter. Molecular sieves are activated in an oven at temperatures above 300 °C at atmospheric pressure for a minimum of 3 h but better overnight. In a vacuum oven a temperature of around 200 °C will suffice. This activation process removes all water with which the pores are saturated even in a freshly purchased and freshly opened bottle of molecular sieves. After activation the molecular sieves should be stored in a conventional drying oven at temperatures above 120 °C or in a desiccator for several weeks before requiring reactivation. Note: whether molecular sieves are still active can easily be determined by placing a small amount of beads in a gloved-hand followed by two volume equivalents of water to the beads. If the sieves are still active they will become very hot to the touch.
Solvents are dried by removing the beads from the oven or desiccator and cooled to room temperature before adding them to a solvent of choice. The solvent is dried over the beads for at least 12 h-5 days before the solvent is considered anhydrous and can be used in a reaction.
The length of the storage time depends on the solvent as does the amount of molecular sieves required. This is typically reported as the % mass/ volume (m/v) loading and describes the amount of molecular sieves used per volume of solvent. For example a 5% m/v means that 5 g of molecular sieves are added per 100 mL of solvent.
For common solvents such as dichloromethane (DCM), acetonitrile, or toluene a storage time of 24 h over 3-Å molecular sieves with 10% m/v is sufficient to reach very low ppm values for residual water content (0.1–0.9 ppm). Tetrahydrofuran (THF) on the other hand should be dried for a duration of 3 days using 20% m/v of 3-Å molecular sieves to reach low residual amounts of water of about 4 ppm. Lower-mass alcohols such as methanol or ethanol should even be stored about 5 days over 3-Å molecular sieves and 20% m/v, which will yield residual water content of 8–10 ppm. Higher molecular weight alcohols should be dried using powdered 3-Å sieves rather than beads. Powdered molecular sieves adsorb at a much faster rate than beads. This results in a non selective adsorption of solvent molecules which are small enough in size to compete with water for entry into the sieve pore (e.g. small alcohol molecules, such as methanol). For large molecular weight alcohols it is safe to use the more active powdered form of the sieves because they are too large to compete with water for the pores.1Note: alcohols are typically very hygroscopic and very low residual water amounts cannot be reached. Table 1 summarizes the findings for the common solvents described above.
Note that slightly larger 4-Å beads are used for drying of amines, dimethylformamide (DMF), and hexamethylphosphoramide (HMPA) by storing them over the beads using 5% w/v for at least 24 h. Molecular sieves should not be used for drying acetone, because they are basic and induce an aldol reaction in acetone.
Another great advantage of molecular sieves is that they can be recycled by rinsing them thoroughly with a volatile organic solvent, followed by drying them at 100 °C for a few hours first (or alternatively air-drying) before reactivating them as usual at temperatures above 300 °C for at least 3 h. Acetone may auto-ignite at high temperatures of > 400 °C. So one must be sure that it has fully evaporated before moving the beads to the high temperature oven. Note: in undergraduate laboratories solvents are sometimes dried using the drying agents listed in Table 2 in the section below. This method is sufficient for reactions that are not very water sensitive but will not render sufficiently dry solvents to run sensitive reactions such as a Grignard reaction.
| Solvent | % m/v | Time of storing solvent over 3 Å molecular sieves | Residual water content (ppm) |
| DCM | 10% | 24 h | ~0.1 |
| Acetonitrile | 10% | 24 h | ~0.5 |
| Toluene | 10% | 24 h | ~0.9 |
| THF | 20% | 3 days | ~4.1 |
| Methanol | 20% | 5 days | ~10.5 |
| Ethanol | 20% | 5 days | ~8.2 |
Table 1. Desiccant amount, drying time and residual water content for various solvent dried over 3 Å molecular sieves.2
Drying of Reagents
Reagents in a chemical reaction can be solid or liquid (and in very rare cases gases). Different methods are employed to dry solids than are used to dry liquids.
Liquid reagents can generally be made anhydrous by similar methods as for solvents described above. Reagents that are freshly purchased are often sufficiently anhydrous. Reagents need to be dried if they are not fresh or if they were synthesized as part of a multi-step synthesis. In a multi-step synthesis the product of one reaction step is the reagent for the next step. The product formation of many reactions requires a quenching step, which means contact with a large quantity of water. Afterward the product, whether it is solid or liquid, should be dried in order to ensure anhydrous conditions for the following step. This is afforded first by extraction, a method by which the aqueous phase is separated from the organic phase thereby removing macroscopic amounts of water. After extraction the organic phase, which contains the product dissolved in an organic solvent, will still have microscopic traces of water present. Following extraction the organic phase must be dried over a highly hygroscopic drying agent that is usually an inorganic salt. There are many different drying agents, and some of the most common ones are listed in Table 2.
For drying purposes, the drying agent is added to the organic phase until freshly added drying agent no longer clumps together but rolls around freely and the solution is clear and not cloudy. The organic phase should be covered and stored over the drying agent for a short period of time (usually an hour) to ensure drying. Afterward the drying agent is filtered off and the solvent is removed under reduced pressure in a rotary evaporator.
For a product that is a liquid, further drying can be achieved by storing it over a drying agent and freshly distilling it before use. For a product that is solid, drying is achieved preferably by storage in a vacuum oven at a temperature below its melting point (mp). For example, if the solid's mp is below 100 °C the oven must be set to a temperature around 15–20 °C below its mp. Water will still evaporate over time and applied vacuum will accelerate the process. Alternatively the solid may be dried by storage inside a vacuum desiccator over an appropriate drying agent (typically P2O5). This may be indicated for cases where the solid's mp is extremely low (below ~50 °C) or when a vacuum oven is not available. After drying, the anhydrous reagent should be stored in a bottle under inert atmosphere (N2or Ar) and the bottle's lid should be tightly sealed with Parafilm. The bottle should be kept inside a desiccator until the reagent is needed. Note: some solid reagents, such as the magnesium metal for a Grignard reaction may be dried inside the apparatus during the flame-drying process.
Liquid reagents can alternatively be dried by molecular sieves as described in the previous section for solvents. This is indicated when large amounts of a reagent need to be dried. Typically reagents in small-scale syntheses are used in small amounts (a few mL or less). Drying of such small amounts with molecular sieves is impractical and drying with the above methods should suffice.
| Drying Agent | Capacity | Speed | Suitability |
| Na2SO4 | high | low | Generally useful |
| MgSO4 | high | high | Generally useful |
| CaCl2 | high | medium | Useful for hydrocarbons* |
| CaSO4 | low | high | Generally useful |
| * Organic liquids that are not hydrocarbons, such as alcohols, amines, and different carbonyl-containing compounds are also absorbed by CaCl2. It can’t be used to dry these liquids but it can help remove these types of impurities from a hydrocarbon. | |||
Table 2. The most commonly used drying agents in organic laboratories.
Procédure
Réactions chimiques qui sont sensibles à l’humidité doivent être effectuées en milieu anhydre, ou d’eau libre.
Réactifs et réactifs peuvent parfois réagir avec ou absorber l’eau de l’atmosphère. Si cela se produit, peuvent modifier les propriétés physiques ou chimiques des réactifs et la réaction souhaitée ne prendra pas place ou conduire à un faible rendement.
Pour éviter toute réaction indésirable avec de l’eau d’origine naturelle sensible des réactions sont réalisées sous atmosphère inerte, comme l’azote ou argon, à l’aide de matériel et réactifs anhydres. Des réactions extrêmement sensibles à l’eau doivent être effectuées à l’intérieur d’une boîte à gants qui peut maintenir un environnement anhydre. Cette vidéo vous montrera comment sécher correctement la verrerie, aux solvants et réactifs afin de lancer une réaction anhydre.
La composition chimique du verre provoque une pellicule d’eau pour recouvrir la surface qui doit être enlevée avant de préparer une réaction anhydre. Chaleur ou l’acétone est souvent utilisé pour enlever cette couche propre verrerie avant utilisation.
De nombreux solvants aussi absorbent l’eau de l’environnement et doivent être séchées avant utilisation. Distillateurs de solvants ou déshydratants sont souvent utilisés pour éliminer l’eau avant la mise en place d’une réaction.
Alambics solvants utilisent des métaux alcalins tels que sodium réagissent avec l’eau et laisser une teneur en eau résiduelle d’environ 10 parties par million.
Déshydratants sont des solides très hygroscopiques, ce qui signifie qu’ils absorbent facilement l’eau. Certains déshydratants, comme le sulfate de sodium, sont utilisés pour enlever l’eau de petites quantités d’un solvant organique et doivent être filtrés avant d’utiliser.
Tamis moléculaires sont le plus couramment utilisé déshydratant et servent à sécher de plus gros volumes de solvants. Ils sont faits d’un matériau microporeux composé d’aluminosilicates de sodium et de calcium.
Tamis moléculaires agissent en eau de piégeage à l’intérieur des perles efficacement désolidarisé de solvant. Une fois utilisés, ils peuvent être régénérés dans un four.
Enfin, il y a plusieurs façons pour sécher les réactifs solides. Une est définie en le stockant dans un four de 15 à 20 ° C au-dessous de son point de fusion. La chaleur fournit l’eau entre le réactif, laissant derrière elle un sec composé.
Si le solide ne peut pas être chauffé ou a trop faible d’un point de fusion il peut être séché dans un dessiccateur à vide. Une fois sec, le réactif anhydre peut être stocké dans une bouteille sous atmosphère inerte à l’intérieur du dessiccateur.
Maintenant que vous avez vu les concepts derrière le matériel et les réactifs pour les réactions anhydres de séchage, nous allons regarder de plus près et voir comment c’est fait en laboratoire.
Secher la verrerie dans un four, d’abord recueillir tous les composants requis pour les appareils à réaction. Retirez tous les morceaux non en verre comme le robinet d’arrêt d’un ballon de Schlenk.
Placer les verres dans un séchage-four réglé à 125 ° C et cuire pendant au moins 24 h avant utilisation.
Après 24h, mettez des gants de protection thermique et retirez le four de la verrerie. Assembler l’appareil tandis que la verrerie est encore chaude.
Lorsque la verrerie est complètement assemblé et cool, rincer l’appareil avec un gaz inerte comme l’azote. Enfin, rajouter les morceaux qui ont été retirés avant le séchage. La verrerie est maintenant prête pour la réaction anhydre.
Une option plus rapide que le four de séchage verrerie consiste à utiliser un bec Bunsen. Certains verres ne devrait pas être flamme séché, alors assurez-vous que la configuration est sûre à la flamme sec avant de commencer. Pour commencer, mettre en place l’appareil complet et supprimez tous les composants qui ne sont pas faites de verre.
Mettez des gants résistants à la chaleur, puis allumer le brûleur Bunsen. BEGIN flamme de sechage de la verrerie en bas de l’appareil de chauffage. Conduire l’eau contenue dans le programme d’installation en déplaçant la flamme vers le haut. Continuez ce processus jusqu'à ce que le brouillard et la vapeur s’arrête.
Attendez que l’appareil refroidir jusqu'à environ 60 ° C, puis utilisez des gants résistants à la chaleur et ajouter le reste de l’appareil qui a été supprimé avant le séchage de la flamme.
Pour sécher à l’aide de tamis moléculaires des solvants, tout d’abord les ajouter dans un récipient en verre thermo-stable.
Les tamis doivent d’abord être séchées pour un fonctionnement correct, placer le récipient dans un 300 à 350 ° C four et cuire au four pendant 3 à 3 ½ h.
Quand les perles sont sèches, utilisez des gants résistants à la chaleur élevées pour retirer le récipient et le stocker dans une étuve à une température supérieure à 120 ° C. Après séchage, les tamis moléculaires peuvent être conservés pendant des semaines avant utilisation.
Lorsqu’elles sont nécessaires, enlever les perles du séchage four ou dessicateur. Travail rapide et couvrir le récipient à partir de ce moment pour minimiser le contact des perles avec de l’eau atmosphérique.
Si les perles le débranchement du four laissez-les refroidir à la température de la pièce à peu près.
Peser la quantité nécessaire de perles actives sur une échelle. Par exemple, pour obtenir un 10 % massique à volume de perles dans un flacon de 500 mL de solvant, 50 g de perles sont nécessaires.
Ajouter les perles au solvant. Pour un solvant volatil, comme le dichlorométhane, laissez le couvercle sur le dessus de la bouteille, mais attendez quelques minutes avant de serrer complètement le couvercle pour éviter l’accumulation de pression.
Sceller la zone autour du couvercle en l’enroulant avec Parafilm pour garder l’humidité. Stocker le solvant dans les perles au moins 24 h. par la suite, le solvant anhydre peut être utilisé dans une réaction.
Alternativement, alambics de solvants à l’aide de la benzophénone et sodium métallique peuvent être utilisés pour sécher les solvants.
Réactifs solides sont souvent dissous dans des solvants organiques. Avant de retirer le liquide et récupérer le réactif solid exès d’eau doivent être retirés de la solution.
Obtenir un récipient sec et ajouter la solution. Ensuite, ajoutez un agent desséchant au conteneur à l’aide d’une spatule. L’agent de séchage sera initialement s’agglutiner ensemble, mais continuez d’ajouter jusqu'à ce que fraîchement ajouté agent de séchage ne sont plus des touffes et se déplace librement.
Couvrir le récipient avec un bouchon ou un papier d’aluminium et laissez agir la solution pendant au moins 1 h.
Pour enlever l’excès d’agent séchage, assembler un appareil de filtration sous vide avec une fiole de côté-bras et entonnoir Büchner. Ajoutez le filtre en papier à l’entonnoir Büchner, puis allumez l’aspirateur.
Décanter lentement la phase organique dans l’entonnoir Büchner. Éviter de transférer le déshydratant, comme peut-être obstruer le filtre. Quand la majeure partie du liquide a été transférée sur l’entonnoir et se jettent dans la fiole ci-dessous, ajouter le reste avec l’agent de séchage et laissez-le reposer pendant quelques minutes.
Éteindre l’aspirateur et transvaser la solution filtrée dans un endroit sec ballon à fond rond. Raccorder le ballon à fond rond d’un évaporateur rotatif et supprimer tous les solvants sous pression réduite. Le solide ou le liquide qui reste devrait maintenant être sec.
À un endroit déjà solide réactif composé dans un récipient ouvert sec et déterminer son poids. Ensuite, placez-le dans une étuve à une température au-dessous du point de fusion du solide. Permettre le réactif sécher pendant plusieurs heures dans le four.
Retirer le récipient du four et placez-le dans un dessicateur. Ensuite, laisser l’échantillon refroidir à température ambiante. Peser à nouveau et s’assurer que la masse est moins qu’avant séchage de four. Répétez les étapes de séchage jusqu'à ce que le poids n’est plus le change. Lorsque cela se produit, le réactif est suffisamment sec.
Si le réactif ne doit pas être utilisé immédiatement, rincer le récipient avec un gaz inerte comme l’azote et l’envelopper de Parafilm autour du couvercle. Placer le récipient dans un dessiccateur et stocker jusqu'à ce que le réactif est nécessaire.
Les réactions anhydres sont utilisées dans une variété de synthèses importantes de chimie organique.
Un exemple classique d’une réaction qui doit être fait dans des conditions anhydres est la réaction de Grignard. Dans la première étape de la réaction, il est impératif que même pas la moindre trace d’eau soient présents. En présence d’eau, le réactif de Grignard agiront préférentiellement comme base, ce qui entraîne la perte des sous-produits indésirables nucléophiles l’activité et la forme.
Plusieurs synthèses organiques doivent être effectuées dans des conditions extrêmement sèches, comme avec cet exemple de synthèse organique aimant. Le matériau précurseur dans ce cas, sodium métallique, est pyrophorique, ce qui signifie qu’il est extrêmement sensible de l’humidité et peut être inflammables ou explosives même au contact de l’humidité dans l’air.
Batteries lithium-ion sont également extrêmement sensibles de l’humidité et doivent être constituées dans une boîte à gants ou une pièce sèche. L’électrode négative se compose d’une batterie lithium composée, tandis que l’électrolyte contient un sel de lithium halogénés. Puisque le lithium est l’humidité sensible toute trace de l’eau introduite dans la cellule de la batterie elle-même diminuerait la capacité.
Vous avez juste regardé introduction de Jupiter à la préparation des réactifs anhydre et l’équipement. Vous devez maintenant comprendre comment préparer la verrerie, aux solvants et réactifs qui sont tous anhydres pour utilisation dans les réactions chimiques.
Merci de regarder !
Résultats
Un exemple classique d’une réaction qui doit être fait dans des conditions anhydres est la réaction de Grignard. (Équation 1)
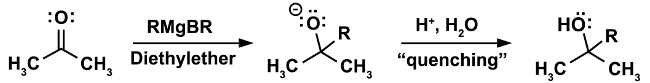
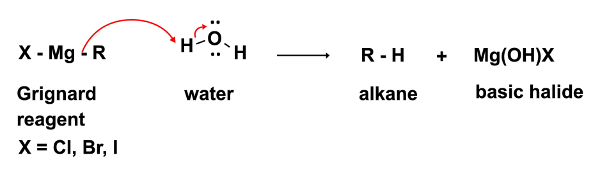
Dans la première étape de la réaction, l’attaque nucléophile de l’organomagnésien RMgX se produit sur un électrophile (dans ce cas une cétone). Dans cette étape, il est impératif que même pas la moindre trace d’eau soient présents. Le réactif de Grignard, tout en un nucléophile fort, est un point d’ancrage encore plus fort. En présence d’eau, elle agira préférentiellement comme base et déprotoner l’eau, ce qui entraîne la perte de l’organomagnésien nucléophile et dans la formation d’un alcane, un sous-produit non désiré. (Équation 2)
References
- Burfield, D. R. and Smithers, R. H. Desiccant efficiency in solvent and reagent drying. 7. Alcohols. J. Org. Chem. 48 (14), 2420-2422 (1983).
- Williams, D. B. G. and Lawton, M. Drying of Organic Solvents: Quantitative Evaluation of the Efficiency of Several Desiccants. J. Org. Chem. 75 (24), 8351-8354 (2010).
Passer à...
Vidéos de cette collection:

Now Playing
Préparation de réactifs anhydres et équipement
Organic Chemistry
79.1K Vues

Introduction à la catalyse
Organic Chemistry
34.1K Vues

Montage d'un chauffage à reflux
Organic Chemistry
166.3K Vues

Réaliser des réactions en dessous de la température ambiante
Organic Chemistry
70.3K Vues

Transfert de solvants via une rampe à vide (ligne Schlenk)
Organic Chemistry
41.5K Vues

Dégazage des liquides par la technique "cycle geler-pomper-dégeler"
Organic Chemistry
55.9K Vues

Purification des composés par recristallisation
Organic Chemistry
705.3K Vues

Séparation des mélanges par précipitation
Organic Chemistry
157.2K Vues

Extraction solide-liquide
Organic Chemistry
237.1K Vues

Utilisation d'un évaporateur rotatif (ou Rotovap) pour éliminer un solvant
Organic Chemistry
212.3K Vues

Distillation fractionnée
Organic Chemistry
332.8K Vues

Préparation de cristaux pour analyse par diffraction des rayons X
Organic Chemistry
32.3K Vues

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.4K Vues

Chromatographie sur colonne
Organic Chemistry
358.4K Vues

Spectroscopie à résonance magnétique nucléaire (RMN)
Organic Chemistry
246.7K Vues