Introduction à la catalyse
Vue d'ensemble
Source : Laboratoire de Dr. Ryan Richards — Colorado School of Mines
La catalyse est parmi les domaines les plus importants des technologies modernes et actuellement représente environ 35 % du produit intérieur brut (PIB) et de subsistance d’environ 33 % de la population mondiale à travers les engrais produits par le procédé Haber. 1 catalyseurs sont des systèmes qui facilitent les réactions chimiques en abaissant l’énergie d’activation et influençant la sélectivité. Catalyse sera une technologie centrale dans la lutte contre l’énergie et les défis des temps modernes.
Principles
Les catalyseurs hétérogènes sont généralement composent d’une entité catalytique de nanoscale (en général un métal), dispersée sur un matériau de support (typiquement oxyde de carbone ou métal), qui augmente la surface et souvent confère une certaine stabilité contre l’agrégation des nanoparticules. Les nanoparticules de catalyseur a sites actifs sur sa surface, où la réaction a lieu. Selon la réaction de ces sites actifs pourraient être faces planes ou bords de cristal sur la surface de la particule. En général, nanoparticules plus petits ont une plus forte activité catalytique, en raison de la plus grande quantité de surfaces atomes par mole de catalyseur. 2
La réaction sur la surface du catalyseur commence par adsorption des réactifs au site actif, suivi de la réaction à la surface. La réaction de surface peut se produire entre une espèce adsorbée et celui de la plus grande partie, appelée le mécanisme Eley-Rideal, ou entre deux espèces adsorbées, appelés le mécanisme de Langmuir-Hinshelwood. Les espèces ont réagi désorbe puis de la surface dans la masse. 2
Prise en charge de palladium de nanoparticules ont montré une activité dans de nombreuses réactions catalytiques importantes et représentent un système modèle pour démontrer un catalyseur hétérogène. Base de palladium recherche catalyseur des efforts sont larges et vont de la mise à niveau de la biomasse pour la décomposition des teintures chimiques dans les effluents d’eaux usées. L’utilisation de catalyseurs de palladium en tant que représentant de catalyseurs hétérogènes est souhaitable car elle permet une séparation facile du catalyseur des produits. 2
Ici, le catalyseur hétérogène se compose de nanoparticules de palladium dispersées sur un support de carbone de grande surface. Actuellement, plusieurs catalyseurs supportés palladium sont disponibles dans le commerce. Dans cet article l’éducation, deux disponibles dans le commerce soutenus palladium matériaux sont utilisés, 1 % de palladium sur charbon actif et 0,5 % de palladium supporté granulaire. Une autre substance, charbon actif, est utilisée comme une expérience de contrôle. La réduction du 4-nitrophénol est choisie pour la réaction catalytique, car il est facile à travailler et les résultats sont visibles à travers un changement de couleur. Ce protocole expérimental fournit une démonstration visuelle très claire d’une réaction catalytique typique.
Procédure
1. préparation de la Solution de 4-nitrophénol mélangée avec du borohydrure de Sodium
- Peser 14 mg du 4-nitrophénol et dissoudre dans de l’eau distillée dans une fiole de verre de 10 mL.
- Peser 57 mg de borohydrure de sodium et dissoudre dans 15 mL de l’eau distillée.
- Mélangez les deux solutions et agitation magnétique pendant 30 min à température ambiante pour une solution uniforme. Blouse, lunettes de sécurité et des gants sont nécessaires comme protection de protocole standard.
2. préparation de la Solution de catalyseur
- Peser 10 mg de palladium sur charbon actif et le palladium sur carbone granulaire respectivement. Peser 10 mg de charbon actif dans le groupe témoin.
- Transfert pesait catalyseurs dans un flacon et ajouter 100 mL de l’eau distillée dans chaque flacon.
- Laisser agir les flacons avec une puissance de sortie de 135 W pendant 10 min jusqu'à ce que les catalyseurs sont bien réparties dans l’eau.
3. réduction catalytique du 4-nitrophénol
- 1,15 ml de la solution préparée de borohydrure 4-nitrophénol et de sodium, transférer dans un flacon de verre de 5 mL.
- Enregistrer la couleur d’une solution dans le flacon, attendre 10 min et dossier si il n’y a aucun changement dans la couleur de la solution.
- Ajouter 1 mL de palladium préparé sur la solution de catalyseur de charbon actif dans le flacon, agiter le flacon à la main pendant 20 s. réaction d’observer pendant 20 min, enregistrer où la couleur de la solution commence à changer et quelle couleur de la solution s’estompe complètement transparent.
- Répétez la même procédure avec le palladium sur solution de catalyseur charbon granulaire.
- Répétez la même procédure avec la solution de catalyseur de charbon actif.
- Comparer le changement de couleur entre trois catalyseurs après 0, 5, 10, 15 et 20 min de temps de réaction. Afin de quantifier ce changement, mesurer les spectres UV-Vis de l’échantillon pendant l’intervalle de réaction de 20 min.
Résultats
La réduction du 4-nitrophénol avec un catalyseur est une réaction de référence dans la littérature pour évaluer le rendement de catalyseur et de mesurer la cinétique. Avant l’ajout du catalyseur, la couleur de la solution est lumière jaune, ce qui correspond à l’ion 4-nitrophénol dans des conditions alcalines. Sans l’ajout d’un catalyseur, la couleur jaune ne se fane pas loin, cela indique que le système de mélange de borohydrure de sodium et le 4-nitrophénol est stable.
Après l’ajout de palladium sur charbon actif et de palladium sur les solutions de catalyseur charbon granulaire, la couleur jaune du 4-nitrophénol solution s’estompe peu à peu. À une échelle de temps d’environ 20 min, la solution devient incolore, ce qui suggère une réduction complète du 4-nitrophénol par le catalyseur.
Après l’addition de la solution de charbon actif, avec aucun catalyseur, la couleur jaune du 4-nitrophénol n’a pas changée dans la fenêtre de la réaction de 20 min. Carbone agit seulement comme un matériel de soutien pour le palladium, sorte de carbone par lui-même n’a pas démontré d’effet catalytique sur la réaction. Le groupe de contrôle ici montre que les nanoparticules de palladium pris en charge sur le carbone est un catalyseur actif tandis que le carbone lui-même n’est pas un rôle de catalyseur. Cette expérience de contrôle montre également que le 4-nitrophénol n’est pas simplement absorbé par le carbone et retiré de la solution.
Observation des spectres d’absorption UV-Vis indique une diminution progressive à près de 400 nm, tout en augmentant à environ 300 nm. Ce changement est révélatrice de la réduction du 4-nitrophénol au cours du processus. La concentration relative du 4-nitrophénol est représentée par l’intensité relative de l’absorption à 400 nm. Une intrigue ln (t/a0) vs temps montre la procédure de réaction de manière quantifiée. Une parcelle de terrain représentatif est montré dans la Figure 1.
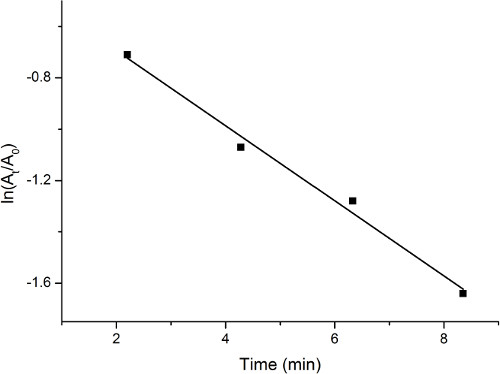
La figure 1. Terrain d’absorption vs temps lors de la réduction du 4-nitrophénol par le catalyseur au palladium sur charbon actif.
Pour les deux catalyseurs palladium utilisés, il n’y a aucune différence entre leur comportement de changement de couleur et leurs spectres. Ce résultat indique palladium participe activement à la réduction catalytique du 4-nitrophénol indépendamment de savoir si elle est prise en charge sur charbon actif ou charbon granulaire.
Applications et Résumé
Comme une réaction de référence, l’application catalytique de nanoparticules de palladium peut être élargi à d’autres domaines. Semblable à la réduction du 4-nitrophénol, qui est un colorometric (la réaction est observée comme un changement de couleur), l’hydrogénation des teintures chimiques peut être accomplie avec le même protocole. Processus d’hydrogénation chimique sont très importantes dans de nombreuses réactions industrielles ainsi que l’élimination des déchets. Chercheurs ont trouvé des applications de catalyseurs dans les réactions d’hydrogénation dans des domaines tels que la pétrochimie. Aux États-Unis, la production de benzène a atteint 415144 millions de gallons au cours du quatrième trimestre de 2010, où le procédé d’hydrogénation a joué un rôle important.
En présence d’un catalyseur au palladium et un environnement de base, les réactions de couplage C-C se produisent entre les alcènes et les halogénures d’aryles/vinyle. 3, 4 , cette réaction est connue comme la réaction de Heck. Les réactions de couplage C-C sont d’une importance vitale pour résoudre les problèmes d’énergie maintenant face à la société. L’implication est si importante que le prix Nobel de chimie 2010 a reçu pour travaux sur palladium catalysé la réaction de couplage. Catalyseurs sont également utilisés dans la synthèse de nanoparticules polymériques. Dans cette application, branches de polymère sont mélangés avec un catalyseur afin d’induire la formation de particules de l’étoiles. 5 Enfin, catalyseurs sont trouvent largement dans la nature et les réactions biologiques en voiture. Ici, elles existent naturellement comme des enzymes spécifiques de forme. 6
References
- Armor, J. What is catalysis? North American Catalysis Society. (2008).
- Thomas, J.M., Thomas, W.J. Principles and Practice of Heterogeneous Catalysis. Wiley-VCH. Germany (2015).
- Heck, R.F., Nolley, J.P. Palladium-catalyzed v Vinylic Hydrogen Substitution Reactions with Aryl, Benzyl and Styryl Halides. J. Org. Chem. 37 (14), (1972).
- Oberholzer, M., Frech, C. M. Mizoroki-Heck Cross-coupling Reactions Catalyzed by Dichloro{bis[1,1',1''-(phosphinetriyl)tripiperidine]}palladium Under Mild Reaction Conditions. J. Vis. Exp. (85), e51444, (2014).
- Liu, J., Gao, A. X., Johnson, J. A. Particles without a Box: Brush-first Synthesis of Photodegradable PEG Star Polymers under Ambient Conditions. J. Vis. Exp. (80), e50874, (2013).
- Fowler, M. L., Ingram-Smith, C. J., Smith, K. S. Direct Detection of the Acetate-forming Activity of the Enzyme Acetate Kinase. J. Vis. Exp. (58), e3474, (2011).
Passer à...
Vidéos de cette collection:

Now Playing
Introduction à la catalyse
Organic Chemistry
34.6K Vues

Montage d'un chauffage à reflux
Organic Chemistry
168.3K Vues

Réaliser des réactions en dessous de la température ambiante
Organic Chemistry
70.7K Vues

Transfert de solvants via une rampe à vide (ligne Schlenk)
Organic Chemistry
41.7K Vues

Dégazage des liquides par la technique "cycle geler-pomper-dégeler"
Organic Chemistry
56.3K Vues

Préparation de réactifs anhydres et équipement
Organic Chemistry
79.4K Vues

Purification des composés par recristallisation
Organic Chemistry
710.0K Vues

Séparation des mélanges par précipitation
Organic Chemistry
158.0K Vues

Extraction solide-liquide
Organic Chemistry
238.1K Vues

Utilisation d'un évaporateur rotatif (ou Rotovap) pour éliminer un solvant
Organic Chemistry
213.0K Vues

Distillation fractionnée
Organic Chemistry
334.7K Vues

Préparation de cristaux pour analyse par diffraction des rayons X
Organic Chemistry
32.9K Vues

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.1K Vues

Chromatographie sur colonne
Organic Chemistry
360.8K Vues

Spectroscopie à résonance magnétique nucléaire (RMN)
Organic Chemistry
248.9K Vues