Identification d'un composé inconnu grâce à la loi de la cryométrie
Vue d'ensemble
Source : Laboratoire de Lynne o ' Connell, Boston College
Quand un composé solide se dissout dans un solvant, du point de congélation de la solution obtenue est inférieur à celle du solvant pur. Ce phénomène est connu comme l’abaissement du point de congélation, et aux changements de température sont directement reliée à la masse moléculaire du soluté. Cette expérience est conçue pour trouver l’identité d’un composé inconnu en utilisant le phénomène de la dépression du point de congélation pour déterminer son poids moléculaire. Le composé sera dissoute dans le cyclohexane et le point de congélation de cette solution, ainsi que celle du cyclohexane pur, seront mesurés. La différence entre ces deux températures permet de calculer le poids moléculaire de la substance inconnue.
Principles
Certaines propriétés d’une solution diffèrent de celles du solvant pur en raison des interactions qui se déroulent entre le soluté et les molécules de solvant. Les propriétés qui présentent de tels changements sont appelées les propriétés colligatives et incluent l’abaissement de la pression de la vapeur, l’altitude du point d’ébullition, abaissement du point de congélation et changements dans la pression osmotique. Ces propriétés dépendent uniquement du nombre de particules dissoutes dans le solvant, pas sur l’identité des particules. Une particule, dans ce cas, est définie comme un ion ou une molécule. Cette expérience se concentre sur la propriété de l’abaissement du point de congélation.
Quand un soluté particulier est dissous dans un solvant, l’expression suivante vaut :
ΔT = T °c- Tf = Kfm
Les termes Tfet Tf renvoient respectivement à la température de point de congélation de la solution et le solvant pur. Le terme « m » indique la molalité de la solution, qui est définie comme le nombre de moles du soluté par 1000 g de solvant. Cette quantité est utilisée, plutôt que de molarité, parce qu’il n’est pas dépendant de la température. La constante, Kf, est appelée la constantand de l’abaissement du point de congélation est dépendant uniquement du solvant. Le changement de température dépend aussi du nombre de particules de solutés en solution - les particules plus présents, plus le changement de température. Pour cette raison, l’équation précédente est parfois écrit :
T °c- Tf = Kfim
où j’ai = nombre de soluté particules produites par unité de formule qui se dissout. Dans une solution contenant un électrolyte, chaque ion est réputée être une particule.
Cette expérience utilise cyclohexane, un composé organique qui est un liquide à température ambiante, comme solvant. Le composé inconnu est une molécule organique non ioniques ; par conséquent, i est égal à 1. Le poids moléculaire de ce composé inconnu peut être déterminé par l’observation du point de congélation d’une solution du composé dans le cyclohexane et comparez-la à la point de congélation du cyclohexane pur.
Le cyclohexane composé a un point de fusion (ou le point de congélation) d’environ 6 ° C. Une série de températures du cyclohexane pur sont obtenues comme il se refroidit de température de la pièce par le biais de son point de congélation dans un bain de glace. Ces températures sont ensuite tracés en fonction du temps. De même, les températures d’une solution du composé inconnu dissous dans le cyclohexane sont obtenues comme il se refroidit au point de congélation, qui sont aussi tracées. Les parcelles doivent ressembler pour les parcelles à la Figure 1. La T °fet les valeurs def T peuvent être extrapolées, tel qu’illustré. L' Figure 1 b, la température ne reste pas tout à fait constante que la solution se fige. Le point de congélation de la solution est le point auquel il tout d’abord commence à geler et apparaît de manière graphique par un changement de la pente de la courbe température-temps.
La molalité, m, d’une solution peut être exprimée en fonction de la masse molaire du soluté :



Substituant cette expression dans l’équation pour l’abaissement du point de congélation (où j’ai = 1), obtient :
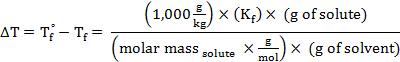
Réarrangeant pour résoudre pour la masse molaire, obtient :

Le poids moléculaire (en UMA) d’une substance a la même valeur numérique que sa masse molaire.
La substance inconnue est l’un des composés suivants :
- Biphényle (C12H10)
- 2-bromochlorobenzène (C6H4BrCl)
- Naphtalène (C10H8)
- Anthracène (C14H10)
- 1, 4-dibromobenzène (C6H4Br2)

La figure 1. Figure 1 a est une courbe de température en fonction du temps pour la détermination de T °fpour le solvant pur. Figure 1 b est une courbe de température en fonction du temps pour la détermination de Tf pour la solution.
Procédure
Une sonde de température reliée à un ordinateur sert à acquérir les lectures de température dans cette expérience. La sonde de température a une incertitude de ± 0,1 ° C.
1. réglage des paramètres dans le logiciel
- Régler la durée de l’expérience à 800 s.
- Définissez la fréquence d’échantillonnage à 1 échantillon par seconde.
- La valeur limite supérieure de l’intervalle de température 40 ° C et la limite inférieure à 0 ° C.
2. mesure du Point de congélation du Cyclohexane
- Pipeter 12,0 mL de cyclohexane du flacon distributeur dans un tube à essai propre et sec.
ATTENTION : Le Cyclohexane est un solvant inflammable. - Nettoyer la sonde de température avec un chiffon non pelucheux pour être sûr que c’est sec.
- Insérer le bouchon avec le brasseur de fil et sonde de température dans le tube à essai.
- Assurez-vous que la pointe de la sonde de température est au centre du liquide et ne pas toucher les côtés ou le fond de l’éprouvette.
- Remplir un bécher de 600 mL sur un tiers plein d’eau et ajoutez la glace jusqu'à ce que le bol soit trois quarts pleine.
- Commencer la collecte de données. L’ordinateur acquiert une lecture chaque seconde de la température.
- Déplacer le tube à essai dans le bain d’eau glacée et maintenez-le ainsi le niveau de liquide dans l’éprouvette est au-dessous du niveau d’eau dans la baignoire.
- Immédiatement commencer à remuer le liquide avec l’aide de l’agitateur de fil, en continu et à une vitesse constante.
- Une fois le gel commence, tant que le liquide et solides sont tous deux présents, la température reste constante jusqu'à ce que toute la masse se solidifie. Permettre à l’ordinateur continuer l’enregistrement de la température jusqu'à ce que l’intrigue s’est stabilisé à une température constante.
Notez que, une fois que le cyclohexane a gelé, la température commence à diminuer à nouveau. - Lorsqu’un nombre suffisant de points de données ont été collecté, arrêter la collecte de données.
- Retirer le tube à essai le bain d’eau glacée et laissez-le chauffer jusqu'à la température ambiante.
- Enregistrer les données.
- Régler l' y-axe limite pour l’intrigue remplisse la page. Titre du graphique et puis l’imprimer.
3. préparer une Solution du composé inconnu
- Peser exactement 0,14 g le matériau inconnu sur un morceau de papier de pesage.
- Vérifiez que le cyclohexane contenu dans le tube à essai a fondu.
- Retirer le bouchon de l’éprouvette et ajouter avec précaution le solide inconnu pour le cyclohexane, évitant la perte de n’importe quel composé adhérant aux parois de l’éprouvette ou le bouchon.
- Remettre le bouchon et peser de nouveau le document pour tenir compte de toute cristaux qui demeure à ce sujet.
- Mélanger la solution pour dissoudre complètement le solide. Il est important qu’aucun cristaux ne demeurent.
- Faire une nouvelle baignoire d’eau glacée.
4. mesure du Point de congélation du composé inconnu
- Préparer l’ordinateur pour recueillir une seconde série de données.
- Commencer la collecte de données.
- Déplacer le tube à essai contenant la solution dans le bain d’eau glacée.
- Commencer immédiatement en agitant la solution en continu et à un rythme constant.
- Recueillir les données pour 300 – 500 s afin de voir clairement le changement de pente qui se produit lorsque la solution se fige.
- Arrêter la collecte de données.
- Enregistrer les données, ajuster les limites de l’axe y, titre du graphique et l’imprimer.
- Ne pas jeter n’importe quel cyclohexane ou un composé inconnu dans l’évier. Verser le mélange liquide dans le bocal de « Déchets de laboratoire ». Rincer la sonde de tube et de la température d’essai avec de l’acétone pour éliminer les dernières traces de n’importe quel cristaux, verser le rinçage dans la fiole de déchets.
Résultats
La masse du cyclohexane qui a été distribué peut être calculée. La densité du cyclohexane est 0,779 g/mL.
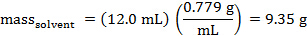
Les valeurs de T °fet Tf peuvent être déterminées des parcelles.
Peuvent également calculer la masse molaire et donc le poids moléculaire du composé inconnu. Pour le cyclohexane, Kf = 20,2 ° C kg/mole de soluté.


masse molaire = 134 g/mol
poids moléculaire = 134 UMA
Le poids moléculaire des composés possibles sont :
- Uma 154,21 de biphényle
- amu 191,46 pour 2-bromochlorobenzène
- 128,17 UMA pour le naphtalène
- 178,23 UMA pour l’anthracène
- 235,90 amu pour 1, 4-dibromobenzène
La valeur déterminée expérimentalement pour le poids moléculaire du composé inconnu est plus proche de la valeur de la littérature pour le naphtalène.
On peut calculer le pourcentage d’erreur.
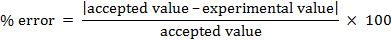
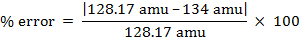
% erreur = 4,55 %
Applications et Résumé
Peut-être l’application la plus visible du phénomène de la dépression du point de congélation se produit pendant les mois d’hiver, quand les routes et les trottoirs deviennent glaciales, et sel est utilisé pour traiter les surfaces glissantes. Quand le sel se mélange avec la glace, du point de congélation de l’eau est enfoncé alors que la glace fond à une température plus basse. Parce que le degré de l’abaissement du point de congélation est dépendant du nombre de particules en solution, sels qui libèrent des trois ions par unité de formule, comme le chlorure de calcium CaCl2, sont souvent utilisés à cet effet. Crème glacée décideurs également faire usage de l’abaissement du point de congélation qui se produit lorsque le sel et la glace sont mélangés. Le point de congélation de la crème est bien inférieure à 0 ° C, surtout lorsqu’elle est combinée avec du sucre et autres ingrédients utilisés pour fabriquer de la crème glacée. Pour cette raison, glace et sel gemme sont combinés dans le conteneur externe d’une sorbetière afin d’atteindre une température basse assez de geler le mélange dans le récipient interne.
Chimistes exploitent le phénomène de la dépression du point de congélation dans l’analyse de composés organiques solides. La pureté d’un produit solide de la synthèse chimique est souvent déterminée par le point de fusion (en théorie, le même que le point de congélation) du matériel de mesure. Si l’impureté est présente dans l’enceinte, le point de fusion observé est plus faible que prévu. Cela se produit parce que, comme le solide commence à fondre, l’impureté agit comme un soluté qui se dissout dans la forme liquide du composé ; ainsi, le point de fusion, ou gel, du composé est déprimé.
L’industrie pharmaceutique utilise de grandes quantités de solvants organiques pour les réactions qui conduisent à la synthèse d’agents thérapeutiques. Ces solvants créent d’importants volumes de déchets liquides dangereux pour l’environnement. Parfois, il est possible de tirer parti de ce phénomène de dépression du point de congélation afin d’éliminer la nécessité d’un solvant dans une synthèse. Lorsque les réactifs solides impliqués dans une réaction sont écrasés ensemble, les points de fusion (ou gel) les deux composés sont abaissées. Si les deux composés ont un point de fusion très bas, la paire devenue liquides à température ambiante lorsqu’ils sont broyés ensemble, qui permet les molécules d’interagir entre eux, donc la réaction peut se produire. Ces processus exempt de dissolvants sont un exemple de la chimie « verte », qui se réfère à des processus chimiques qui réduisent ou éliminent l’utilisation et la production de substances dangereuses.
Passer à...
Vidéos de cette collection:

Now Playing
Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.6K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
655.3K Vues

Solutions et Concentrations
General Chemistry
273.7K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
555.6K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.3K Vues

Déterminer la formule empirique
General Chemistry
180.7K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.3K Vues

Utiliser un pH-mètre
General Chemistry
345.1K Vues

Introduction au titrage
General Chemistry
423.9K Vues

Loi des gaz parfaits
General Chemistry
78.3K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.3K Vues

Principe de Le Châtelier
General Chemistry
264.9K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
195.9K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.4K Vues

Complexes de coordination
General Chemistry
91.3K Vues