Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
Überblick
Quelle: Labor von Lynne o ' Connell – Boston College
Wenn eine feste Substanz in einem Lösungsmittel aufgelöst wird, ist der Gefrierpunkt der erhaltenen Lösung geringer als die des reinen Lösungsmittels. Dieses Phänomen ist bekannt als Gefrierpunkt Depression, und die Veränderung der Temperatur bezieht sich direkt auf das Molekulargewicht des gelösten Stoffes. Dieses Experiment soll die Identität einer unbekannten Verbindung finden mithilfe von dem Phänomen der Gefrierpunkt Depression seine Molekulargewicht zu bestimmen. Die Verbindung wird in Cyclohexan und der Gefrierpunkt der Lösung sowie der reinen Cyclohexan aufgelöst werden, gemessen werden. Der Unterschied zwischen diesen zwei Temperaturen ermöglicht die Berechnung des Molekulargewichtes der unbekannten Substanz.
Grundsätze
Bestimmte Eigenschaften einer Lösung unterscheiden sich von denen eines reinen Lösungsmittels aufgrund von Wechselwirkungen, die zwischen den gelösten und Lösungsmittel Moleküle stattfinden. Die Eigenschaften, die solche Veränderungen aufweisen nennt man die colligative Eigenschaften und Dampfdruck Senkung, Siedepunkt Höhe Gefrierpunkt Depression und Änderungen in osmotischer Druck. Diese Eigenschaften sind nur abhängig von der Anzahl der Partikel in das Lösungsmittel, nicht auf die Identität der Partikel aufgelöst. Als ein Ion oder ein Molekül ist ein Teilchen, in diesem Fall definiert. Dieses Experiment konzentriert sich auf die Eigenschaft der Gefrierpunkt Depression.
Wenn eine bestimmte gelöste Stoff in einem Lösungsmittel aufgelöst hat, gilt der folgende Ausdruck:
ΔT = Tf° - T-f = K-f-m
Die Begriffe Tf° Tf beziehen sich auf die Temperaturen Gefrierpunkt des reinen Lösungsmittels und der Lösung bzw.. Der Begriff "m" steht für das Einheitensymbol der Lösung, die als die Anzahl der Mole des gelösten Stoffes pro 1.000 g des Lösungsmittels definiert ist. Diese Menge wird anstatt Molarity, verwendet, da es nicht temperaturabhängig ist. Die Konstante Kf, bezeichnet man als das Einfrieren-Punkt-Depression-Constantand nur das Lösungsmittel abhängt. Die Veränderung der Temperatur ist auch die Anzahl der gelösten Partikel in Lösung - je mehr Partikel vorhanden, desto größer ist die Änderung in der Temperatur abhängig. Aus diesem Grund ist die vorherige Gleichung manchmal als geschrieben:
Tf° - T-f = Kfim
wo ich = die Anzahl der gelösten Teilchen pro Formeleinheit, das auflöst. Bei einer mit einem Elektrolyt-Lösung jedes Ion gilt ein Teilchen.
Dieses Experiment verwendet Cyclohexan, eine organische Verbindung, die eine Flüssigkeit bei Zimmertemperatur, als Lösungsmittel ist. Die unbekannte Verbindung ist ein nichtionisches organisches Molekül; Ich deshalb gleich 1. Das Molekulargewicht von dieser unbekannten Verbindung kann bestimmt werden, indem Sie beobachten den Gefrierpunkt einer Lösung der Verbindung im Cyclohexan und vergleicht sie mit den Gefrierpunkt des reinen Cyclohexan.
Die Verbindung Cyclohexan hat einen Schmelzpunkt (oder Gefrierpunkt) von ca. 6 ° C. Eine Reihe von Temperaturen von reinen Cyclohexan sind erhalten, wie von der Raumtemperatur durch den Gefrierpunkt im Eisbad abkühlen. Diese Temperaturen werden dann als Funktion der Zeit dargestellt. Ebenso sind Temperaturen von einer Lösung der unbekannten Substanz in Cyclohexan gelöst gewonnen, wie es um den Gefrierpunkt, kühlt die auch gezeichnet werden. Die Grundstücke sollte ähnlich wie die Grundstücke in Abbildung 1aussehen. Tf° und T-f -Werte können extrapoliert werden, wie gezeigt. In Abbildung 1 bbleibt die Temperatur ganz konstant nicht wie die Lösung gefriert. Der Gefrierpunkt der Lösung ist der Punkt, an dem es zunächst zu frieren beginnt und wird grafisch durch eine Änderung in der Steigung der Temperatur-Zeit-Kurve angezeigt.
Das Einheitensymbol, m, einer Lösung kann in Bezug auf die Molmasse des gelösten Stoffes ausgedrückt werden:



Setzt man diesen Ausdruck in die Gleichung für Gefrierpunkt Depression (wo ich = 1), erhält:
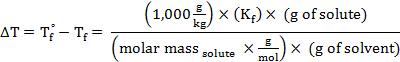
Neu anordnen, um für molare Masse zu lösen, erhält:

Das Molekulargewicht einer Substanz (in amu) hat den gleichen numerischen Wert als seine molare Masse.
Die unbekannte Substanz ist eine der folgenden Verbindungen:
- APEO (C12H10)
- 2-Bromochlorobenzene (C6H4BrCl)
- Naphthalin (C10H8)
- Anthracen (C14H10)
- 1,4-Dibromobenzene (C6H4Br2)

Abbildung 1. Abbildung 1a ist eine Darstellung der Temperatur als Funktion der Zeit zur Bestimmung des Tf° für die reinen Lösungsmittel. Abbildung 1 b ist eine Darstellung der Temperatur als Funktion der Zeit zur Bestimmung des T-f für die Lösung.
Verfahren
Ein Temperaturfühler an einen Computer angeschlossen wird verwendet, um die Temperaturwerte in diesem Experiment zu erwerben. Der Temperaturfühler hat eine Unsicherheit von ±0.1 ° C.
1. Einstellung der Parameter in der Software
- Legen Sie die Länge des Experiments bis 800 s.
- Legen Sie die Sampling-Rate auf 1 Exemplar pro Sekunde.
- Legen Sie die Obergrenze für den Temperaturbereich bis 40 ° C und die Untergrenze auf 0 ° C.
2. Messung des Gefrierpunktes von Cyclohexan
- Verzichten Sie 12,0 mL Cyclohexan aus der Abgabe Flasche in ein Reagenzglas, das sauber und trocken ist.
Achtung: Cyclohexan ist eine brennbare Lösungsmittel. - Wischen Sie den Temperaturfühler mit einem fusselfreien Tuch um sicherzustellen, dass es trocken ist.
- Legen Sie den Stopfen mit der Temperatur-Sonde und Draht-Rührer in das Reagenzglas.
- Stellen Sie sicher, dass die Spitze des Temperaturfühlers in der Mitte der Flüssigkeit und nicht berühren der Seiten oder die Unterseite des Reagenzglases ist.
- Füllen Sie ein 600-mL-Becherglas über 1 / 3 voll Wasser und Eis hinzufügen, bis der Becher drei Viertel ist voll.
- Die Datensammlung zu starten. Der Computer erhält eine Temperaturmessung jede Sekunde.
- Bewegen Sie das Reagenzglas in das Eiswasser Bad und halten sie so das Niveau der Flüssigkeit im Reagenzglas unter das Niveau des Wassers in der Badewanne.
- Sofort beginnen Sie, rühren die Flüssigkeit mit der Draht-Rührer, kontinuierlich und mit einer konstanten Rate.
- Einmal einfrieren beginnt, solange Flüssigkeit und Feste sind beide vorhanden, die Temperatur bleibt konstant, bis die gesamte Masse erstarrt ist. Lassen Sie den Computer weiterhin die Temperatur aufzeichnen, bis die Handlung auf einer konstanten Temperatur eingependelt hat.
Beachten Sie, dass sobald das Cyclohexan gefroren hat, die Temperatur beginnt wieder sinken. - Wenn eine ausreichende Anzahl von Datenpunkten erfasst wurden, stoppen Sie die Datenerhebung.
- Das Reagenzglas aus Eis-Wasserbad nehmen und auf Raumtemperatur aufwärmen lassen.
- Sichern Sie die Daten.
- Passen Sie die y-Achse begrenzt, so dass das Grundstück die Seite füllt. Titel der Grafik, und dann ausdrucken.
3. vorbereiten eine Lösung der unbekannten Verbindung
- Wiegen Sie genau 0,14 g unbekannt Vollmaterial auf ein Stück Papier wiegen.
- Vergewissern Sie sich, dass die Cyclohexan enthalten im Reagenzglas geschmolzen ist.
- Entfernen Sie den Stopfen aus dem Reagenzglas und Cyclohexan, den Verlust von jedem zusammengesetzten festhalten an den Seiten des Reagenzglas oder Stopper fügen Sie sorgfältig den unbekannten Volumenkörper hinzu.
- Ersetzen Sie den Stopper und erneut wiegen Sie das Papier um alle Kristalle, die bleiben auf sie entfallen.
- Rühren Sie die Lösung, um den Volumenkörper vollständig auflösen. Es ist wichtig, dass keine Kristalle bleiben.
- Machen Sie eine neue Eis-Wasserbad.
4. Messung der Gefrierpunkt der unbekannten Verbindung
- Vorbereiten des Computers für einen zweiten Satz von Daten zu sammeln.
- Die Datensammlung zu starten.
- Bewegen Sie das Reagenzglas, das die Lösung in der Eis-Wasserbad enthält.
- Sofort beginnen Sie, rühren die Lösung kontinuierlich und mit einer konstanten Rate.
- Sammeln Sie die Daten für 300-500 s, um die Veränderung der Neigung erkennen, das auftritt, da die Lösung gefriert.
- Die Datenerhebung zu stoppen.
- Sichern Sie Ihre Daten, stellen Sie die Grenzen der y-Achse Titel der Grafik und drucken Sie es.
- Werfen Sie keine Cyclohexan oder unbekannte Verbindung nicht in den Ausguss. Gießen Sie die flüssige Mischung in das "Labor Abfall" Glas. Spülen Sie die Prüfsonde Rohr- und Temperatur mit Aceton zu entfernen die letzten Spuren der alle Kristalle, die Spülungen im Abfall Glas gießen.
Ergebnisse
Die Masse von Cyclohexan, die verzichtet wurde, kann berechnet werden. Die Dichte von Cyclohexan ist 0,779 g/mL.
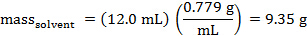
Die Werte für Tf° und Tf können aus den Parzellen ermittelt werden.
Die molare Masse und damit das Molekulargewicht der unbekannten Verbindung kann ebenfalls berechnet werden. Für Cyclohexan, Kf = 20,2 ° C kg/Mol des gelösten Stoffes.


molare Masse = 134 g/Mol
Molekulargewicht = 134 amu
Die Molmassen der möglichen Verbindungen sind:
- 154,21 amu für APEO
- 191,46 amu für 2-Bromochlorobenzene
- 128,17 amu für Naphthalin
- 178,23 amu für Anthracen
- 235,90 amu für 1,4-Dibromobenzene
Für das Molekulargewicht der unbekannten Verbindung experimentell ermittelte Wert ist am nächsten an der Literaturwert für Naphthalin.
Der prozentuale Fehler kann berechnet werden.
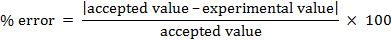
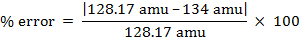
% Fehler = 4,55 %
Anwendung und Zusammenfassung
Vielleicht tritt die sichtbarste Anwendung des Phänomens der Gefrierpunkt Depression während der Wintermonate, wenn Straßen und Bürgersteige eisig werden, und Salz wird verwendet, um die Rutschgefahr zu behandeln. Wenn das Salz mit dem Eis vermischt, wird der Gefrierpunkt des Wassers gedrückt, so dass das Eis bei einer niedrigeren Temperatur schmilzt. Da der Grad der Gefrierpunkt Depression hängt von der Anzahl der Partikel in Lösung ist, sind Salze, die drei Ionen pro Formeleinheit, wie Kalzium-Chlorid (CaCl2) lösen häufig für diesen Zweck eingesetzt. Eis, die Macher auch Gebrauch machen von der Gefrierpunkt Depression, die auftritt, wenn Salz und Eis sind gemischt. Der Gefrierpunkt der Creme liegt deutlich unter 0 ° C, vor allem, wenn es mit Zucker und anderen Zutaten verwendet kombiniert wird, um Eis zu machen. Aus diesem Grund sind Eis und Steinsalz in den äußeren Container eine Eismaschine kombiniert, um eine Temperatur niedrig genug zu erreichen, die Mischung in den inneren Behälter eingeschlossen einzufrieren.
Chemiker nutzen das Phänomen der Gefrierpunkt Depression in der Analyse von festen organischen Verbindungen. Die Reinheit der ein solides Produkt aus einer chemischen Synthese wird bestimmt durch die Messung der Schmelzpunkt des Materials (theoretisch, die identisch mit dem Gefrierpunkt). Wenn eine Verunreinigung in der Verbindung vorhanden ist, ist die beobachtete Schmelzpunkt niedriger als erwartet. Dies tritt auf, weil als Volumenkörper beginnt zu schmelzen, die Verunreinigung als ein gelöster Stoff dient, die in der flüssigen Form der Verbindung aufgelöst wird; so wird der schmelzende oder einfrierende, Punkt der Verbindung gedrückt.
Die Pharmaindustrie verwendet große Mengen organischer Lösungsmittel für Reaktionen, die die Synthese von Therapeutika führen. Diese Lösungsmittel erzeugen erhebliche Mengen an flüssigem Abfall, die umweltschädlich sind. Gelegentlich ist es möglich, den Nutzen des Phänomens Gefrierpunkt Depression, die Notwendigkeit eines Lösungsmittels in einer Synthese zu beseitigen. Wenn solide Reaktionspartner in einer Reaktion beteiligten zusammen zerkleinert werden, sinken die schmelzen (oder Einfrieren) Punkte der beiden Wirkstoffe. Wenn die beiden Verbindungen einen sehr niedrigen Schmelzpunkt haben, werden das Paar tatsächlich Flüssigkeiten bei Zimmertemperatur, wenn sind sie Boden zusammen, wodurch die Moleküle miteinander zu interagieren, so die Reaktion auftreten kann. Diese lösemittelfreien Prozesse sind ein Beispiel für "grüne" Chemie, die auf chemische Verfahren bezieht, die Verringerung oder Beseitigung der Nutzung und Erzeugung von gefährlichen Stoffen.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.6K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
655.3K Ansichten

Lösungen und Konzentrationen
General Chemistry
273.7K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
555.6K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.3K Ansichten

Ermittlung der Summenformel
General Chemistry
180.7K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.3K Ansichten

Verwendung eines pH-Meters
General Chemistry
345.1K Ansichten

Einführung in die Titration
General Chemistry
423.9K Ansichten

Ideale Gasgleichung
General Chemistry
78.3K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.3K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
264.9K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
195.9K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.4K Ansichten

Komplexchemie
General Chemistry
91.3K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten