Depresión del punto de congelación para determinar un compuesto desconocido
Visión general
Fuente: Laboratorio de Lynne o ' Connell, Boston College
Cuando un compuesto sólido se disuelve en un disolvente, el punto de congelación de la solución resultante es menor que la del solvente puro. Este fenómeno es conocido como depresión del punto de congelación, y el cambio de temperatura está directamente relacionada con el peso molecular del soluto. Este experimento está diseñado para encontrar la identidad de un compuesto desconocido utilizando el fenómeno de la depresión del punto de congelación para determinar su peso molecular. El compuesto se disolverá en el ciclohexano y el punto de congelación de esta solución, así como la de ciclohexano puro, será medido. La diferencia entre estas dos temperaturas permite el cálculo del peso molecular de la sustancia desconocida.
Principios
Ciertas propiedades de una solución difieren de las de un solvente puro debido a las interacciones que tienen lugar entre el soluto y las moléculas de solvente. Las propiedades que presentan estos cambios se llaman propiedades coligativas e incluyen baja presión de vapor, elevación del punto de ebullición, depresión del punto de congelación y cambios en la presión osmótica. Estas propiedades dependen sólo del número de partículas disueltas en el solvente, no en la identidad de las partículas. Una partícula, en este caso, se define como un ion o una molécula. Este experimento se centra en la propiedad de la depresión del punto de congelación.
Cuando un determinado soluto se disuelve en un solvente, la siguiente expresión es true:
ΔT = Tf° - Tf = Kfm
Los términos Tf° y Tf se refieren a las temperaturas del punto de congelación del solvente puro y la solución, respectivamente. El término "m" indica el molality de la solución, que se define como el número de moles de soluto por 1.000 g de solvente. Esta cantidad se utiliza, en lugar de molaridad, porque no es dependiente de la temperatura. La constante, Kf, se denomina la constantand de la depresión del punto de congelación depende sólo del solvente. El cambio de temperatura depende también del número de partículas de soluto en solución, las partículas más presente, más el cambio de temperatura. Por esta razón, la ecuación anterior se escribe a veces como:
Tf° - Tf = Kfim
donde = número de partículas de soluto por unidad del fórmula que se disuelve. En una solución que contiene un electrolito, cada ión se considera ser una partícula.
Este experimento utiliza ciclohexano, un compuesto orgánico que es un líquido a temperatura ambiente, como el solvente. El compuesto desconocido es una molécula orgánica no iónico; por lo tanto, i es igual a 1. El peso molecular de este compuesto desconocido puede determinarse observando el punto de congelación de una solución del compuesto en ciclohexano y comparándolo con el punto de congelación del ciclohexano puro.
El ciclohexano compuesto tiene un punto de fusión o punto de congelación de unos 6 ° C. Se obtienen una serie de temperaturas del ciclohexano puro que enfría a temperatura ambiente a través de su punto de congelación en un baño de hielo. Estas temperaturas entonces se trazan en función del tiempo. Asimismo, las temperaturas de una solución del compuesto desconocido disuelto en ciclohexano se obtienen como se enfría hasta el punto de congelación, que también se trazan. Las parcelas deben asemejarse a los diagramas en la figura 1. Los valores def T y Tf° se pueden extrapolar, como se muestra. En la Figura 1b, la temperatura sigue siendo enteramente constante como se congela la solución. El punto de congelación de la solución es el punto en el que primero comienza a congelar y se indica gráficamente por un cambio en la pendiente de la curva de temperatura y tiempo.
El molality, m, de una solución puede expresarse en términos de la masa molar del soluto:



Sustituyendo esta expresión en la ecuación para la depresión del congelar-punto (donde = 1), obtiene:
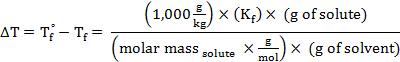
Reorganización para solucionar para masa molar, obtiene:

El peso molecular (en UMA) de una sustancia tiene el mismo valor numérico que la masa molar.
La sustancia desconocida es uno de los siguientes compuestos:
- Bifenilo (C12H10)
- 2-Bromochlorobenzene (C6H4BrCl)
- Naftaleno (C10H8)
- Antraceno (C14H10)
- 1, 4-dibromobenceno (C6H4Br2)

Figura 1. Figura 1a es un complot de la temperatura como función del tiempo para la determinación de Tf° para que el disolvente puro. Figura 1b es una parcela de temperatura como función del tiempo para la determinación de Tf para la solución.
Procedimiento
Se utiliza una sonda de temperatura conectada a un ordenador para la adquisición de las lecturas de temperatura en este experimento. La sonda de temperatura tiene una incertidumbre de ±0. 1 ° C.
1. Ajuste los parámetros en el Software
- Establecer la longitud del experimento a 800 s.
- Establecer la frecuencia de muestreo a 1 muestra por segundo.
- Establecer el límite superior para el rango de temperatura a 40 ° C y el límite inferior a 0 ° C.
2. medición del punto de congelación de ciclohexano
- Dispense 12,0 mL de ciclohexano de la botella dispensadora en un tubo de ensayo limpio y seco.
PRECAUCIÓN: Ciclohexano es un disolvente inflamable. - Limpie la sonda de temperatura con una toallita libre de pelusas para asegurarse de que esté seco.
- Inserte el tapón con el agitador de la sonda y el cable de temperatura en el tubo de ensayo.
- Asegúrese de que la punta de la sonda de temperatura está en el centro del líquido y no toque los lados o la parte inferior de la probeta.
- Llenar un vaso de precipitados de 600 mL sobre un tercio lleno de agua y agregar el hielo hasta que el vaso es de tres cuartos completo.
- Iniciar la recolección de datos. El equipo adquiere una temperatura cada segundo.
- Mover el tubo de ensayo en el baño de agua helada y sujétela con el nivel de líquido en el tubo de ensayo es por debajo del nivel de agua en el baño.
- Comenzar inmediatamente agitando el líquido con el batidor de alambre, continuamente y a un ritmo constante.
- Congelación una vez comienza, mientras el líquido y sólidos están presentes, la temperatura permanece constante hasta que toda la masa se ha solidificado. Espere a que el equipo continuará registrando la temperatura hasta que la trama se ha estabilizado a una temperatura constante.
Tenga en cuenta que una vez que el ciclohexano ha congelado sólido, la temperatura comienza a disminuir nuevamente. - Cuando un número suficiente de puntos de datos se han recogido, detener la recolección de datos.
- Retirar el tubo de ensayo del baño de agua helada y deje que se caliente hasta la temperatura ambiente.
- Guardar los datos.
- Ajustar el y-axis limita así la trama llena la página. Título del gráfico y luego imprimirlo.
3. preparación de una solución del compuesto desconocido
- Pesar exactamente 0,14 g de sólido material desconocido en un pedazo de papel de peso.
- Asegúrese de que el ciclohexano contenida en el tubo de ensayo se ha derretido.
- Quite el tapón del tubo de ensayo y añadir con cuidado el sólido desconocido a ciclohexano, evitando la pérdida de cualquier compuesto adherido a las paredes de la probeta o el tapón.
- Vuelva a colocar el tapón y volver a pesar el papel para dar cuenta de los cristales que permanecen en él.
- Agitar la solución para disolver completamente el sólido. Es importante que no permanezcan cristales.
- Hacer un nuevo baño de hielo.
4. medición del punto de congelación del compuesto desconocido
- Preparar el equipo para recoger un segundo conjunto de datos.
- Iniciar la recolección de datos.
- Mover el tubo de ensayo que contiene la solución en el baño de agua helada.
- Comenzar inmediatamente agitando la solución continuamente y a un ritmo constante.
- Recoger los datos correspondientes a s 300 – 500 con el fin de ver claramente el cambio en la pendiente que se produce cuando la solución se congela.
- Detener la recolección de datos.
- Guardar los datos, ajustar los límites del eje y, el gráfico del título e imprimirlo.
- El fregadero no tirar cualquier ciclohexano o compuesto desconocido. Vierta la mezcla líquida en el recipiente de «Desechos de laboratorio». Lave la sonda de temperatura y tubo de prueba con acetona para eliminar los últimos restos de los cristales, vertiendo los enjuagues en el tarro de basura.
Resultados
Se puede calcular la masa de ciclohexano que se dispensó. La densidad del ciclohexano es 0,779 g/mL.
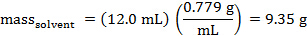
Los valores de Tf Tf° pueden determinarse de las parcelas.
También se pueden calcular la masa molar y así el peso molecular del compuesto desconocido. Para ciclohexano, Kf = 20,2 ° C kg/mol de soluto.


masa molar = 134 g/mol
peso molecular = 134 amu
Los pesos moleculares de los compuestos posibles son:
- 154,21 amu de bifenilo
- 191,46 amu para 2-Bromochlorobenzene
- 128,17 amu de naftaleno
- 178,23 amu para antraceno
- 235,90 amu para 1, 4-dibromobenceno
El valor determinado experimentalmente para el peso molecular del compuesto desconocido es más próximo al valor de la literatura de naftaleno.
Se puede calcular el error porcentual.
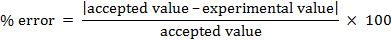
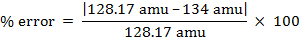
% error = 4.55%
Aplicación y resumen
Quizás la aplicación más visible del fenómeno de la depresión del punto de congelación se produce durante los meses de invierno, cuando los caminos y las aceras se convierten en hielo y sal se usa para tratar las superficies resbaladizas. Cuando la sal se mezcla con el hielo, el punto de congelación del agua es presionado para que el hielo se funde a una temperatura más baja. Porque el grado de la depresión del punto de congelación es dependiente en el número de partículas en solución, sales que liberan tres iones por unidad del fórmula, tales como cloruro de calcio (CaCl2), se utilizan a menudo para este propósito. Helados fabricantes también hacen uso de la depresión del punto de congelación que se produce cuando sal y hielo se mezclan. El punto de congelación de la crema es muy por debajo de 0 ° C, especialmente cuando se combina con azúcar y otros ingredientes usados para hacer el helado. Por esta razón, hielo y sal de la roca se combinan en el envase exterior de un fabricante de helado para conseguir una temperatura baja lo suficiente como para congelar la mezcla en el envase interno.
Químicos explotan el fenómeno de la depresión del congelar-punto en el análisis de compuestos orgánicos sólidos. La pureza de un sólido producto de una síntesis química a menudo se determina midiendo el punto de fusión (en teoría, lo mismo que el punto de congelación) del material. Si una impureza está presente en el compuesto, el punto de fusión observado es menor de lo esperado. Esto ocurre porque el sólido empieza a fundirse, la impureza actúa como un soluto que se disuelve en la forma líquida del compuesto; así, se presiona el punto de fusión o congelación, del compuesto.
La industria farmacéutica utiliza grandes cantidades de solventes orgánicos para las reacciones que conducen a la síntesis de agentes terapéuticos. Estos solventes crean volúmenes considerables de residuos líquidos que son peligrosos para el medio ambiente. En ocasiones, es posible aprovechar el fenómeno de la depresión del congelar-punto para eliminar la necesidad de un solvente en una síntesis. Cuando sólidos reactantes involucrados en una reacción se trituran juntos, se bajan los puntos de fusión (o congelación) de los dos compuestos. Si los dos compuestos tienen un muy bajo punto de fusión, la pareja de hecho, líquidos a temperatura ambiente cuando están Junta, de la tierra que permite que las moléculas interactúan entre sí para que la reacción puede ocurrir. Estos procesos disolventes son un ejemplo de la química "verde", que se refiere a procedimientos químicos que reducen o eliminan el uso y generación de sustancias peligrosas.
Saltar a...
Vídeos de esta colección:

Now Playing
Depresión del punto de congelación para determinar un compuesto desconocido
General Chemistry
160.6K Vistas

Cristalería de laboratorio y usos comunes
General Chemistry
655.5K Vistas

Soluciones y concentraciones
General Chemistry
273.8K Vistas

Determinación de la densidad de un sólido y líquido
General Chemistry
555.7K Vistas

Determinación de la composición porcentual en masa de una solución acuosa
General Chemistry
383.3K Vistas

Determinación de la fórmula empírica
General Chemistry
180.8K Vistas

Determinación de las reglas de solubilidad de compuestos iónicos
General Chemistry
141.3K Vistas

Uso del medidor de pH
General Chemistry
345.2K Vistas

Introducción a la titulación
General Chemistry
424.0K Vistas

Ley del Gas ideal
General Chemistry
78.3K Vistas

Determinación espectrofotométrica de la constante de un equilibrio
General Chemistry
158.3K Vistas

Principio de le Châtelier
General Chemistry
264.9K Vistas

Determinación de las leyes de la velocidad y el orden de la reacción
General Chemistry
195.9K Vistas

Uso de la calorimetría diferencial para medir los cambios en la entalpía
General Chemistry
44.4K Vistas

Complejos de coordinación
General Chemistry
91.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados