Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
Panoramica
Fonte: Laboratorio di Lynne O' Connell — Boston College
Quando un composto solido viene sciolto in un solvente, il punto di congelamento della soluzione risultante è inferiore a quello del solvente puro. Questo fenomeno è noto come depressione del punto di congelamento e il cambiamento di temperatura è direttamente correlato al peso molecolare del soluto. Questo esperimento è progettato per trovare l'identità di un composto sconosciuto utilizzando il fenomeno della depressione del punto di congelamento per determinare il suo peso molecolare. Il composto sarà sciolto in cicloesano e verrà misurato il punto di congelamento di questa soluzione, così come quello del cicloesano puro. La differenza tra queste due temperature consente il calcolo del peso molecolare della sostanza sconosciuta.
Principi
Alcune proprietà di una soluzione differiscono da quelle di un solvente puro a causa delle interazioni che avvengono tra le molecole di soluto e solvente. Le proprietà che mostrano tali cambiamenti sono chiamate proprietà colligative e includono l'abbassamento della pressione di vapore, l'elevazione del punto di ebollizione, la depressione del punto di congelamento e i cambiamenti nella pressione osmotica. Queste proprietà dipendono solo dal numero di particelle disciolte nel solvente, non dall'identità delle particelle. Una particella, in questo caso, è definita come uno ione o una molecola. Questo esperimento si concentra sulla proprietà della depressione del punto di congelamento.
Quando un particolare soluto viene sciolto in un solvente, vale la seguente espressione:
ΔT = Tf° - Tf = Kfm
I termini Tf° e Tf si riferiscono rispettivamente alle temperature del punto di congelamento del solvente puro e della soluzione. Il termine "m" indica la molalità della soluzione, che è definita come il numero di moli di soluto per 1.000 g di solvente. Questa quantità viene utilizzata, piuttosto che la molarità, perché non dipende dalla temperatura. La costante, Kf, è indicata come costante del punto di congelamento-depressione e dipende solo dal solvente. Il cambiamento di temperatura dipende anche dal numero di particelle di soluto in soluzione: più particelle sono presenti, maggiore è il cambiamento di temperatura. Per questo motivo, l'equazione precedente è talvolta scritta come:
Tf° - Tf = Kfim
dove i = il numero di particelle di soluto prodotte per unità di formula che si dissolve. In una soluzione contenente un elettrolita, ogni ione è considerato una particella.
Questo esperimento utilizza cicloesano, un composto organico che è un liquido a temperatura ambiente, come solvente. Il composto sconosciuto è una molecola organica non ionica; pertanto, i è uguale a 1. Il peso molecolare di questo composto sconosciuto può essere determinato osservando il punto di congelamento di una soluzione del composto in cicloesano e confrontandolo con il punto di congelamento del cicloesano puro.
Il cicloesano composto ha un punto di fusione (o punto di congelamento) di circa 6 °C. Una serie di temperature di cicloesano puro si ottengono mentre si raffredda dalla temperatura ambiente attraverso il suo punto di congelamento in un bagno di ghiaccio. Queste temperature vengono quindi tracciate in funzione del tempo. Allo stesso modo, le temperature di una soluzione del composto sconosciuto disciolto nel cicloesano si ottengono mentre si raffredda fino al punto di congelamento, che sono anche tracciati. I grafici dovrebbero essere simili ai grafici nella Figura 1. I valori Tf° e Tf possono essere estrapolati, come mostrato. Nella Figura 1b, la temperatura non rimane del tutto costante quando la soluzione si congela. Il punto di congelamento della soluzione è il punto in cui inizia a congelarsi per la prima volta ed è indicato graficamente da un cambiamento nella pendenza della curva temperatura-tempo.
La molalità, m, di una soluzione può essere espressa in termini di massa molare del soluto:



Sostituendo questa espressione nell'equazione per la depressione del punto di congelamento (dove i = 1), si ottiene:
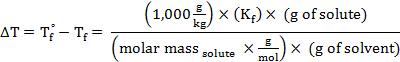
Riorganizzando per risolvere per massa molare, si ottiene:

Il peso molecolare (in amu) di una sostanza ha lo stesso valore numerico della sua massa molare.
La sostanza sconosciuta è uno dei seguenti composti:
- Bifenile (C12H10)
- 2-Bromoclorobenzene (C6H4BrCl)
- Naftalene (C10H8)
- Antracene (C14H10)
- 1,4-Dibromobenzene (C6H4Br2)

Figura 1. La figura 1a è un grafico della temperatura in funzione del tempo per la determinazione di Tf° per il solvente puro. La figura 1b è un grafico della temperatura in funzione del tempo per la determinazione di Tf per la soluzione.
Procedura
Una sonda di temperatura interfacciata a un computer viene utilizzata per acquisire le letture della temperatura in questo esperimento. La sonda di temperatura ha un'incertezza di ±0,1 °C.
1. Impostazione dei parametri nel software
- Impostare la durata dell'esperimento su 800 s.
- Impostare la frequenza di campionamento su 1 campione al secondo.
- Impostare il limite superiore per l'intervallo di temperatura a 40 °C e il limite inferiore a 0 °C.
2. Misurazione del punto di congelamento del cicloesano
- Erogare 12,0 ml di cicloesano dal flacone di erogazione in una provetta pulita e asciutta.
Attenzione: il cicloesano è un solvente infiammabile. - Pulire la sonda di temperatura con una salvietta priva di lanugine per assicurarsi che sia asciutta.
- Inserire il tappo con la sonda di temperatura e l'agitatore a filo nella provetta.
- Assicurarsi che la punta della sonda di temperatura si trova al centro del liquido e non tocchi i lati o il fondo della provetta.
- Riempire un becher da 600 ml pieno d'acqua per circa un terzo e aggiungere ghiaccio fino a quando il becher è pieno per tre quarti.
- Avviare la raccolta dei dati. Il computer acquisisce una lettura della temperatura ogni secondo.
- Spostare la provetta nel bagno di acqua ghiacciata e tenerla in modo che il livello di liquido nella provetta sia inferiore al livello dell'acqua nella vasca da bagno.
- Iniziare immediatamente a mescolare il liquido con l'agitatore a filo, continuamente e ad una velocità costante.
- Una volta iniziato il congelamento, finché sono presenti sia liquidi che solidi, la temperatura rimane costante fino a quando l'intera massa non si è solidificata. Consentire al computer di continuare a registrare la temperatura fino a quando il plottaggio non si è livellato a una temperatura costante.
Si noti che una volta che il cicloesano ha congelato il solido, la temperatura inizia a diminuire di nuovo. - Quando è stato raccolto un numero sufficiente di punti dati, interrompere la raccolta dei dati.
- Rimuovere la provetta dal bagno di acqua ghiacciata e lasciarla riscaldare a temperatura ambiente.
- Salvare i dati.
- Regolate i limiti dell'asse yin modo che il plottaggio riempia la pagina. Intitola il grafico e quindi stampalo.
3. Preparare una soluzione del composto sconosciuto
- Pesare accuratamente 0,14 g del materiale solido sconosciuto su un pezzo di carta pesata.
- Verificare che il cicloesano contenuto nella provetta si sia sciolto.
- Rimuovere il tappo dalla provetta e aggiungere con cura il solido sconosciuto al cicloesano, evitando la perdita di qualsiasi composto aderente ai lati della provetta o del tappo.
- Sostituire il tappo e pesare di nuovo la carta per tenere conto di eventuali cristalli che rimangono su di esso.
- Mescolare la soluzione per sciogliere completamente il solido. È importante che non rimangano cristalli.
- Fai un nuovo bagno di acqua ghiacciata.
4. Misurazione del punto di congelamento del composto sconosciuto
- Preparare il computer per la raccolta di un secondo set di dati.
- Avviare la raccolta dei dati.
- Spostare la provetta che contiene la soluzione nel bagno di acqua ghiacciata.
- Iniziare immediatamente a mescolare la soluzione in modo continuo e ad una velocità costante.
- Raccogliere i dati per 300-500 s per vedere chiaramente il cambiamento di pendenza che si verifica quando la soluzione si blocca.
- Interrompere la raccolta dei dati.
- Salvare i dati, regolare i limiti dell'asse y, intitolare il grafico e stamparlo.
- Non gettare alcun cicloesano o composto sconosciuto nel lavandino. Versare la miscela liquida nel barattolo "Rifiuti di laboratorio". Risciacquare la provetta e la sonda di temperatura con acetone per rimuovere le ultime tracce di eventuali cristalli, versando i risciacqui nel barattolo dei rifiuti.
Risultati
La massa di cicloesano che è stata erogata può essere calcolata. La densità del cicloesano è di 0,779 g/ml.
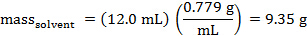
I valori per Tf° e Tf possono essere determinati dalle trame.
È anche possibile calcolare la massa molare, e quindi il peso molecolare, del composto sconosciuto. Per il cicloesano, Kf = 20,2 °C kg/mole di soluto.


massa molare = 134 g/mol
peso molecolare = 134 amu
I pesi molecolari dei possibili composti sono:
- 154.21 amu per Bifenile
- 191.46 amu per 2-Bromoclorobenzene
- 128.17 amu per Naftalene
- 178.23 amu per Antracene
- 235.90 amu per 1,4-Dibromobenzene
Il valore determinato sperimentalmente per il peso molecolare del composto sconosciuto è il più vicino al valore di letteratura per il naftalene.
È possibile calcolare l'errore percentuale.
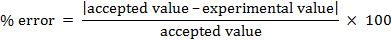
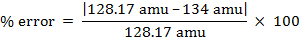
% di errore = 4,55%
Applicazione e Riepilogo
Forse l'applicazione più visibile del fenomeno della depressione del punto di congelamento si verifica durante i mesi invernali, quando strade e marciapiedi diventano ghiacciati e il sale viene usato per trattare le superfici scivolose. Quando il sale si mescola con il ghiaccio, il punto di congelamento dell'acqua viene depresso in modo che il ghiaccio si sciolga a una temperatura più bassa. Poiché il grado di depressione del punto di congelamento dipende dal numero di particelle in soluzione, i sali che rilasciano tre ioni per unità di formula, come il cloruro di calcio (CaCl2), sono spesso utilizzati per questo scopo. I gelatieri fanno anche uso della depressione del punto di congelamento che si verifica quando sale e ghiaccio sono mescolati. Il punto di congelamento della panna è ben al di sotto di 0 °C, soprattutto se combinato con zucchero e altri ingredienti utilizzati per fare il gelato. Per questo motivo, ghiaccio e salgemma vengono combinati nel contenitore esterno di una gelatiera in modo da raggiungere una temperatura abbastanza bassa da congelare la miscela racchiusa nel contenitore interno.
I chimici sfruttano il fenomeno della depressione del punto di congelamento nell'analisi dei composti organici solidi. La purezza di un prodotto solido da una sintesi chimica è spesso determinata misurando il punto di fusione (teoricamente, lo stesso del punto di congelamento) del materiale. Se nel composto è presente un'impurità, il punto di fusione osservato è inferiore al previsto. Ciò si verifica perché, quando il solido inizia a sciogliersi, l'impurità agisce come un soluto che si dissolve nella forma liquida del composto; quindi, il punto di fusione, o congelamento, del composto è depresso.
L'industria farmaceutica utilizza grandi quantità di solventi organici per le reazioni che portano alla sintesi di agenti terapeutici. Questi solventi creano volumi sostanziali di rifiuti liquidi pericolosi per l'ambiente. Occasionalmente, è possibile sfruttare il fenomeno della depressione del punto di congelamento per eliminare la necessità di un solvente in una sintesi. Quando i reagenti solidi coinvolti in una reazione vengono schiacciati insieme, i punti di fusione (o congelamento) dei due composti vengono abbassati. Se i due composti hanno ciascuno un punto di fusione molto basso, la coppia diventa effettivamente liquida a temperatura ambiente quando vengono macinati insieme, il che consente alle molecole di interagire tra loro in modo che la reazione possa verificarsi. Questi processi privi di solventi sono un esempio di chimica "verde", che si riferisce a procedure chimiche che riducono o eliminano l'uso e la generazione di sostanze pericolose.
Vai a...
Video da questa raccolta:

Now Playing
Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.6K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
655.3K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
273.7K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
555.6K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.3K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
180.7K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.3K Visualizzazioni

Uso del pH-metro
General Chemistry
345.1K Visualizzazioni

Introduzione alla titolazione
General Chemistry
423.9K Visualizzazioni

Legge dei gas perfetti
General Chemistry
78.3K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.3K Visualizzazioni

Principio di Le Châtelier
General Chemistry
264.9K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
195.9K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.4K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.3K Visualizzazioni