Solutions et Concentrations
Vue d'ensemble
Source : Laboratoire du Dr Michael Evans, Georgia Institute of Technology
Une solution est un mélange homogène contenant certains composants en petites quantités, appelé des solutés et une composante dans une grande quantité, appelée le solvant. Les solutions solides-liquides contiennent un ou plusieurs solutés solides dissoutes dans un solvant liquid. Les solutions sont omniprésentes dans la chimie : ils sont utilisés pour stocker et gérer de petites quantités de matériel, réaliser des réactions chimiques et élaborer des matériaux aux propriétés contrôlables.
La densité d’un soluté dans une solution est connue comme la concentration du soluté. Concentration peut être exprimée de plusieurs façons, différant dans l’unité utilisée pour exprimer la quantité de soluté, solvant et solution.
Cette démonstration illustre comment préparer une solution de saccharose avec une concentration cible à l’aide de techniques analytiques précises. En outre, diverses mesures de la concentration de cette solution sont présentés et expliqués.
Principles
Lorsqu’immergé dans l’eau, beaucoup de matières solides se défassent en particules (molécules ou ions) entourés de molécules d’eau. Ce processus de dissolution convertit un mélange hétérogène de liquides et solides en un seul mélange homogène composé d’eau liquide et dissous les particules de solutés. Le processus de dissolution de saccharose peut être écrite comme une équation chimique en utilisant les indicatifs de la phase solide et aqueux. L’indicateur (aq) suite à une espèce implique que sont autour de molécules de l’eau et dissolvant cette espèce.

Différentes solutions peuvent contenir un nombre différent de particules dissoutes, et la concentration est une mesure qui quantifie la densité des particules de soluté dans une solution. Une mesure fondamentale de concentration est la fraction molaire du soluté (x) : le nombre de moles de soluté particules (nsoluté) divisé par le nombre total de moles de composants de la solution (tous les solutés et solvant).

En multipliant la fraction molaire par 106 donne les parties par million de la concentration (ppm), le nombre de particules de solutés par millions de particules de solution. Le nombre de moles du soluté par litre de solution ou molarité (M), est une deuxième mesure commune de la concentration.
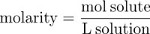
Concentration peut-être aussi être exprimée comme parties en masse, la fraction de la solution de masse en raison du soluté.
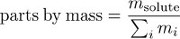
Multipliant les pièces par la concentration en masse de 100 % donne le pourcentage de masse.
Enfin, la molalité est une mesure de concentration qui utilise la masse de solvant, le volume de la solution, et non comme une mesure de la « taille » de la solution. Molalité est le rapport entre le nombre de moles du soluté à la masse de solvant en kilogrammes.
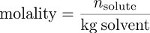
Préparation précise et exacte de la solution avec une molarité cible requiert technique d’analyse minutieuse. Le soluté solid doit être soigneusement pesé et transférer quantitativement (complètement) dans une fiole jaugée. Le solvant peut ensuite être ajouté avec précaution jusqu'à ce que la solution atteigne la marque sur la verrerie. Pour de meilleurs résultats, le soluté puissent se dissoudre complètement dans inférieur au volume total du solvant, et n’importe quel solvant résiduel doit être ajouté si aucun soluté solide n’est visible.
Procédure
1. préparation de 100 mL d’une Solution de saccharose de 0,0100 M
- Déterminer le nombre de moles et la masse de saccharose (C12H22O11) à dissoudre dans 100 mL de solution.
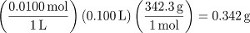
- Peser la masse de saccharose sur la balance. Tout d’abord placer un bateau de peser sur l’équilibre et définir la « tare ». Puis à l’aide d’un scoopula, transvaser avec soin soluté solide du flacon de réactif sur le bateau de pesée jusqu'à ce que la quantité désirée est obtenue.
- Placez un entonnoir dans une fiole jaugée de 100 mL propre et sec. Versez le solide du bateau de peser dans l’entonnoir dans le ballon.
- À l’aide d’une bouteille de lavage contenant de l’eau distillée (solvant), rincer tout restant solide du bateau de peser dans l’entonnoir dans le ballon.
- Ajouter le solvant à l’aide du robinet de l’eau distillée jusqu'à ce que le niveau du liquide atteigne le col de la fiole (mais pas la marque). Boucher et agiter le flacon doucement pour dissoudre le soluté.
- Une fois que tous du soluté est dissout, utiliser un flacon laveur à ajouter avec précaution le solvant du niveau du liquide jusqu’au repère indiqué.
- Boucher et inverser la fiole plusieurs fois pour assurer un bon mélange de la solution.
2. faire une Solution sursaturée de saccharose
- Ajouter 100 mL d’eau distillée dans un bécher de 600 mL.
- Ajouter 220 g de saccharose dans le bécher.
- Placer une barre magnétique remuer dans le bécher et laisser le mélange de remuer pendant 15 min.
- Examiner le mélange : pas tous de saccharose a dissous. Porter le mélange à 50 ºC et remuez pendant un 10 min supplémentaire.
- Examiner le mélange : tous de saccharose a dissous à 50 ° c.
- Laisser la solution refroidir à température ambiante. Examiner la solution : le saccharose supplémentaire qui dissout à 50 ° c reste dissous à température ambiante. La solution à la température ambiante est sursaturée.
Résultats
Étape 1 de la procédure crée 100 mL d’une solution de saccharose de 0,0100 M. Pour convertir des mesures de concentration différente de molarité, déterminer la masse d’eau utilisée pour préparer la solution. Bien que cela peut être mesuré avec précision, en l’absence d’une mesure on peut présumer que le volume des particules de solutés dissous est négligeable (c'est-à-dire le volume d’eau utilisé était 100 mL). À l’aide de la densité de l’eau...

La molalité de saccharose dans cette solution est donc :
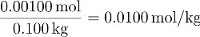
Les parties en masse de saccharose est égale à :
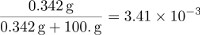
La fraction molaire du saccharose peut être calculée en déterminant le nombre de moles dans 100 g d’eau et en divisant la quantité de saccharose par le nombre total de particules dans la solution.

Étape 2 de la procédure montre que la solubilité du saccharose dans l’eau est fonction de la température. Lors du chauffage, de saccharose dissous dans une solution saturée de repos se dissout, formant une solution saturée de concentration plus élevée à une température plus élevée. Lorsque cette solution se refroidit, saccharose ne pas précipiter hors de la solution. La solution refroidie qui en résulte est sursaturée en saccharose. Ajoutant même une petite quantité de poudre de saccharose supplémentaires dans cette solution peut déclencher une recristallisation rapide de tous le saccharose dissous.
Applications et Résumé
Solutions de solide-liquide sont omniprésentes dans la chimie. Réactions de la plupart des produits chimiques sont exécutées en solution car dissous solutés sont assez mobiles pour mélanger rapidement et de tomber sur un autre. Solutions peuvent également être utilisées pour stocker de petites quantités de solutés en quantités macroscopiques et facilement manipulable. Des solutions présentent certaines propriétés physiques intéressantes appelées propriétés colligatives qui peuvent être attribuées aux effets de la dissolution d’un soluté dans un solvant entropiques.
On peut se demander pourquoi tant de différentes mesures de la concentration de la solution existent. La réponse réside dans les nombreuses applications de solutions et les plusieurs ordres de grandeur sur lequel s’étendent les concentrations. Dans les échantillons d’eau de l’environnement, par exemple, les concentrations des ions métalliques peuvent être de l’ordre de quelques parties par million, il est peu réaliste et potentiellement trompeur d’exprimer cette concentration minuscule comme une fraction de molarité ou taupe. Bien que la molarité est une mesure pratique de concentration pour les calculs de stoechiométrie impliquant des réactions chimiques, molalité convient mieux dans les études de certaines propriétés colligatives.
Perfectionner la technique de préparation de la solution est important, parce que dans de nombreux contextes, une connaissance précise de la concentration est essentielle. Lorsque vous exécutez une réaction chimique, par exemple, utilisation de trop ou trop peu de soluté peut entraîner réactifs gaspillées ou produit de faibles rendements. Études des relations empiriques portant sur la concentration, comme la Loi de Beer, dépendent de la concentration connue avec précision. Souvent, imprécision dans les concentrations de la solution mène directement à l’incertitude des valeurs calculées, telles que les enthalpies de réaction. Bien qu’il soit impossible d’éliminer complètement imprécision, l’utilisation de techniques analytiques pour la fabrication de la solution fait en sorte que l’incertitude soit minimisée.
Passer à...
Vidéos de cette collection:

Now Playing
Solutions et Concentrations
General Chemistry
273.4K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
654.9K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
555.2K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.2K Vues

Déterminer la formule empirique
General Chemistry
180.5K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.1K Vues

Utiliser un pH-mètre
General Chemistry
344.7K Vues

Introduction au titrage
General Chemistry
423.7K Vues

Loi des gaz parfaits
General Chemistry
78.3K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.3K Vues

Principe de Le Châtelier
General Chemistry
264.7K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.6K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
195.8K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.4K Vues

Complexes de coordination
General Chemistry
91.3K Vues