פתרונות וריכוזים
Overview
מקור: המעבדה של ד"ר מייקל אוונס — המכון הטכנולוגי של ג'ורג'יה
פתרון הוא תערובת הומוגנית המכילה כמה רכיבים בכמויות קטנות, הנקראים מסיסים, ורכיב אחד בכמות גדולה, הנקרא הממס. פתרונות נוזליים מוצקים מכילים מסיס מוצק אחד או יותר המומסים בממס נוזלי. פתרונות נמצאים בכל מקום בכימיה: הם משמשים לאחסון ומטפלים בכמויות קטנות של חומר, לבצע תגובות כימיות ולפתח חומרים עם תכונות הניתנות לשליטה.
הצפיפות של solute בתמיסה ידועה בשם הריכוז של solute. ריכוז יכול לבוא לידי ביטוי במספר דרכים, שונה ביחידות המשמשות להעברת כמויות של solute, ממס, פתרון.
הדגמה זו ממחישה כיצד להכין פתרון סוכרוז עם ריכוז יעד באמצעות טכניקות אנליטיות מדויקות. בנוסף, מוצגים ומוסברים אמצעים שונים לריכוז פתרון זה.
Principles
כאשר שקועים במים, מוצקים רבים מתפרקים לחלקיקים (מולקולות או יונים) מוקפים במולקולות מים. תהליך זה של פירוק ממיר תערובת הטרוגנית של מוצק ונוזל לתערובת הומוגנית אחת המורכבת ממים נוזליים וחלקיקים מומסים. תהליך הפירוק של סוכרוז יכול להיכתב כמשוואה כימית באמצעות מייעדי השלבים המוצקים והמ מימיים. המציין (aq) בעקבות מין מרמז כי מולקולות מים מקיפות ומפתות מין זה.

פתרונות שונים עשויים להכיל מספרים שונים של חלקיקים מומסים, וריכוז הוא מדד המכמת את הצפיפות של חלקיקים מלולים בתוך פתרון. מדד בסיסי אחד לריכוז הוא שבר השומה (x) של ה- solute: מספר המולים של חלקיקים מלוטחים (nsolute) חלקי המספר הכולל של מולים של רכיבי פתרון (כולם מסיסים וממסים).

הכפלת שבר השומה ב-106 מעניקה לחלקים ריכוז של מיליון (ppm), מספר החלקיקים ההולכים למיליון חלקיקי תמיסה. מספר המולים של solute לליטר של פתרון, או טחנת (M), הוא מדד נפוץ שני של ריכוז.
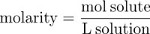
ריכוז עשוי לבוא לידי ביטוי גם כחלקים על ידי מסה, השבר של מסת הפתרון בשל solute.
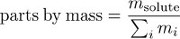
הכפלת החלקים בריכוז המוני ב-100% מעניקה למסה אחוז.
לבסוף, מוליות היא מידה של ריכוז המשתמש במסה של הממס, ולא את נפח הפתרון, כמדד של "גודל" של הפתרון. מוליות היא היחס בין מספר המולים של solute למסת הממס בקילוגרם.
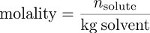
הכנה מדויקת ומדויקת של פתרון עם טחנת מטרה דורשת טכניקה אנליטית זהירה. יש לשקול בזהירות את ההמולה המוצקה ולהעבירה כמותית (לחלוטין) לבקבוק נפחי. לאחר מכן ניתן להוסיף את הממס בזהירות עד שהפתרון מגיע לסימן על כלי הזכוכית. לקבלת התוצאות הטובות ביותר, solute צריך להיות מותר להתמוסס לחלוטין בפחות מהנפח הכולל של ממס, וכל ממס שנותר יש להוסיף כאשר אין solute מוצק גלוי.
Procedure
1. הכנת 100 מ"ל של פתרון סוכרוז 0.0100 M
- לקבוע את מספר שומות ומסה של סוכרוז (C12H22O11) להיות מומס ב 100 מ"ל של פתרון.
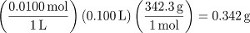
- לשקול את המסה של סוכרוז על האיזון. מקום ראשון סירת שקילה על האיזון ולהגדיר את "משקל טרה". לאחר מכן באמצעות scoopula, בזהירות להעביר מוצק solute מבקבוק ריאגנט לסירה שקילה עד הסכום הרצוי מתקבל.
- מניחים משפך אבקה לתוך בקבוק נפחי נקי ויבש של 100 מ"ל. יוצקים את המוצק מסירת השקילה דרך המשפך לתוך הבקבוקון.
- באמצעות בקבוק כביסה המכיל מים מזוקקים (הממס), לשטוף את כל מוצק שנותר מסירת שק דרך משפך לתוך הבקבוקון.
- מוסיפים ממס באמצעות ברז המים המזוקקים עד שמפלס הנוזל מגיע לצוואר הבקבוקון (אך לא לסימן). מכסים ומערבבים את הבקבוק בעדינות כדי להמיס את ההמולה.
- לאחר שכל solute נמס, להשתמש בבקבוק לשטוף כדי להוסיף ממס בזהירות עד לרמת הנוזל מגיע לסימן.
- לכסות והפוך את הבקבוקון נפחי מספר פעמים כדי להבטיח ערבוב טוב של הפתרון.
2. הכנת פתרון סוכרוז רווי
- הוסיפו 100 מ"ל של מים מזוקקים למכה של 600 מ"ל.
- מוסיפים 220 גרם סוכרוז לתחנית.
- מניחים בר מערבב מגנטי בכיסת ומאפשרים לתערובת לבחוש במשך 15 דקות.
- לבחון את התערובת: לא כל סוכרוז נמס. מחממים את התערובת ל 50 מעלות צלזיוס ומערבבים במשך 10 דקות נוספות.
- לבחון את התערובת: כל סוכרוז יש מומס ב 50 מעלות צלזיוס.
- אפשר לפתרון להתקרר לטמפרטורת החדר. בדוק את הפתרון: סוכרוז נוסף שהתמוסס ב 50 מעלות צלזיוס נשאר מומס בטמפרטורת החדר. הפתרון בטמפרטורת החדר הוא רווי.
Results
שלב הליך 1 יוצר 100 מ"ל של פתרון סוכרוז 0.0100 M. כדי להמיר למדידות ריכוז שאינן טוחנות, לקבוע את המסה של מים המשמשים להכנת הפתרון. למרות שניתן למדוד זאת במדויק, בהיעדר מדידה ניתן להניח כי נפח החלקיקים המומסים הוא זניח (כלומר, נפח המים בהם נעשה שימוש היה 100 מ"ל). באמצעות צפיפות המים...

המולת של סוכרוז בפתרון זה היא אפוא:
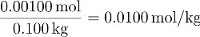
החלקים על ידי מסה של סוכרוז שווה ל:
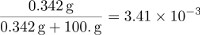
שבר השומה של סוכרוז ניתן לחשב על ידי קביעת מספר השומות ב 100 גרם של מים וחלוקת כמות סוכרוז על ידי הכמות הכוללת של חלקיקים בתמיסה.

שלב הליך 2 ממחיש כי המסיסות של סוכרוז במים תלויה בטמפרטורה. עם החימום, סוכרוז לא פתור נח בתמיסה רוויה מתמוסס, ויוצר פתרון רווי של ריכוז גבוה יותר בטמפרטורה גבוהה יותר. כאשר פתרון זה מתקרר, סוכרוז אינו לזרז את הפתרון. הפתרון מקורר וכתוצאה מכך הוא רווי סוכרוז. הוספת אפילו כמות קטנה של אבקת סוכרוז נוספת לתוך פתרון זה יכול לעורר recrystallization מהיר של כל סוכרוז מומס.
Application and Summary
פתרונות נוזליים מוצקים נמצאים בכל מקום בכימיה. רוב התגובות הכימיות מופעלות בתמיסה מכיוון שמסיסים מומסים ניידים מספיק כדי לערבב במהירות ולהתנגש זה בזה. ניתן להשתמש בפתרונות גם לאחסון כמויות קטנות של מסיסים באמצעי אחסון מקרוסקופיים וקלים לטיפול. פתרונות מציגים כמה תכונות פיזיות מעניינות הנקראות תכונות קולגיקטיביות שניתן לייחס להשפעות האנטרופיות של המסת solute בממס.
אפשר לתהות מדוע קיימים כל כך הרבה מדדים שונים של ריכוז פתרונות. התשובה טמונה ביישומי הפתרונות הרבים ובסדרי הגודל הרבים שעליהם משתרעים הריכוזים. בדגימות של מים מהסביבה, למשל, ריכוזים של יונים ממתכת יכולים להיות בטווח של כמה חלקים למיליון — זה לא מעשי ועלול להטעות לבטא את הריכוז הזעיר הזה כשבר טוחנת או שומה. למרות שהטחונה היא מדד נוח לריכוז לחישובי סטואיצ'ומטריה הכוללים תגובות כימיות, מוליות מתאימה יותר במחקרים של תכונות קולגיקטיביות מסוימות.
שכלול הטכניקה של הכנת פתרון חשוב, כי בהקשרים רבים, ידע מדויק של ריכוז הוא חיוני. כאשר מפעילים תגובה כימית, למשל, שימוש ביותר מדי או מעט מדי solute עלול לגרום מגיבים מבוזבזים או תשואות מוצר נמוכות. מחקרים על יחסים אמפיריים הכרוכים בריכוז, כגון חוק באר, תלויים בריכוזים ידועים בדיוק. לעתים קרובות, חוסר סייג בריכוזים של פתרונות מוביל ישירות לאי ודאות בערכים מחושבים, כגון אנטלפות תגובה. למרות שאי אפשר לבטל לחלוטין את חוסר ההסתה, השימוש בטכניקות אנליטיות להכנת פתרונות מבטיח כי אי הוודאות ממוזערת.
Tags
Skip to...
Videos from this collection:

Now Playing
פתרונות וריכוזים
General Chemistry
273.4K Views

כלי זכוכית ושימושים נפוצים במעבדה
General Chemistry
654.9K Views

קביעת הצפיפות של מוצק ונוזל
General Chemistry
555.2K Views

קביעת הרכב אחוז המסה בפתרון מימי
General Chemistry
383.2K Views

קביעת הנוסחה האמפירית
General Chemistry
180.5K Views

קביעת כללי המסיסות של תרכובות יוניות
General Chemistry
141.1K Views

שימוש במד pH
General Chemistry
344.7K Views

מבוא לתמצית
General Chemistry
423.7K Views

חוק הגז האידיאלי
General Chemistry
78.3K Views

קביעת ספקטרופוטומטריה של קבוע שיווי משקל
General Chemistry
158.3K Views

עקרון לה שאטלייה
General Chemistry
264.7K Views

דיכאון נקודת הקפאה כדי לקבוע תרכובת לא ידועה
General Chemistry
160.6K Views

קביעת חוקי התעריפים וסדר התגובה
General Chemistry
195.8K Views

שימוש בסריקה דיפרנציאלית קלורימטריה למדידת שינויים באנטלפיה
General Chemistry
44.4K Views

מתחמי כימיה של תיאום
General Chemistry
91.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved