Soluciones y concentraciones
Visión general
Fuente: Laboratorio del Dr. Michael Evans, Georgia Institute of Technology
Una solución es una mezcla homogénea que contiene algunos de los componentes en pequeñas cantidades, llamados solutos y uno de los componentes en una gran cantidad, llamada el solvente. Soluciones sólido-líquido contienen uno o varios solutos sólidos disueltos en un disolvente líquido. Las soluciones son ubicuas en química: se utilizan para almacenar y manejar pequeñas cantidades de material, llevar a cabo las reacciones químicas y desarrollar materiales con propiedades controlables.
La densidad de un soluto en una solución se conoce como la concentración del soluto. Concentración puede expresarse de varias maneras, en las unidades utilizadas para expresar las cantidades de soluto, solvente y solución.
Esta demostración muestra cómo preparar una solución de sacarosa con una concentración de destino utilizando técnicas analíticas precisas. Además, diversas medidas de la concentración de esta solución se presentan y explican.
Principios
Cuando sumergido en agua, sólidos muchos rompen en partículas (moléculas o iones) rodeadas por moléculas de agua. Este proceso de disolución convierte una mezcla heterogénea de sólidos y líquidos en una sola mezcla homogénea de agua líquida y partículas de soluto disueltas. El proceso de disolución de sacarosa puede ser escrito como una ecuación química con los designadores de fase sólida y acuosa. El designador (aq) siguiendo una especie implica que rodean las moléculas de agua y solvating esa especie.

Diferentes soluciones pueden contener diferentes números de partículas disueltas, y concentración es una medida que cuantifica la densidad de partículas de soluto en una solución. Una medida fundamental de la concentración es la fracción molar (x) del soluto: el número de moles de partículas de soluto (nsoluto) dividido por el número total de moles de los componentes de la solución (solutos y disolvente).

Multiplicando la fracción por 106 da las partes por millón concentración (ppm), el número de partículas de soluto por millón de partículas de la solución. El número de moles de soluto por litro de solución, o molaridad (M), es una segunda medida común de concentración.
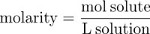
Concentración también puede expresarse como masa de piezas en masa, la fracción de la solución debido al soluto.
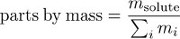
Multiplicando las piezas por la concentración en masa por 100% da el porcentaje total.
Finalmente, el molality es una medida de concentración que utiliza la masa del solvente, más que el volumen de la solución, como una medida del "tamaño" de la solución. Molality es la relación entre el número de moles de soluto con la masa de disolvente en kilogramos.
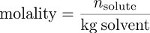
Preparación precisa y exacta de una solución con una molaridad de destino requiere cuidadosa técnica analítica. El soluto sólido debe ser pesado cuidadosamente y transferido cuantitativamente (totalmente) a un matraz aforado. El solvente se puede entonces agregar cuidadosamente hasta que la solución alcance la marca de la cristalería. Para mejores resultados, el soluto se debe disolver completamente en menos de volumen total del solvente y disolventes restantes deben añadirse cuando no soluto sólido es visible.
Procedimiento
1. preparación de 100 mL de una solución de sacarosa de 0,0100 M
- Determinar el número de moles y la masa de sacarosa (C12H22O11) disuelto en 100 mL de solución.
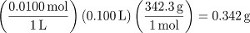
- Pesar la masa de sacarosa en el equilibrio. Primero coloque un barco pesa en la balanza y ajustar el "peso tara". Luego mediante una scoopula, cuidadosamente transferir soluto sólido desde el frasco del reactivo al barco pesa hasta obtener la cantidad deseada.
- Coloque un embudo de polvo en un matraz aforado de la 100 mL limpio y seco. Vierta el sólido desde el barco de peso a través del embudo en el matraz.
- Usando una botella de lavado con agua destilada (el solvente), enjuague cualquier residuo sólido el barco pesa a través del embudo en el matraz.
- Agregar el solvente usando la llave de agua destilada hasta el nivel del líquido alcanza el cuello del matraz (pero no la marca). La tapa y agitar el matraz suavemente para disolver el soluto.
- Una vez que se haya disuelto todo el soluto, utilice una botella de lavado cuidadosamente Añadir disolvente hasta que el nivel del líquido llegue a la marca.
- La tapa e invierta la Fiola varias veces para asegurar una mezcla adecuada de la solución.
2. hacer una solución sobresaturada de sacarosa
- Añadir 100 mL de agua destilada a un vaso de precipitados de 600 mL.
- Añadir 220 g de sacarosa en el vaso.
- Coloque una barra de agitación magnética en el vaso y deje que la mezcla revolviendo durante 15 minutos.
- Examinar la mezcla: no todos de la sucrosa se haya disuelto. Calienta la mezcla a 50 º c y agitar por un adicional 10 min.
- Examinar la mezcla: de la sacarosa ha disuelto a 50 º c.
- Deje que la solución se enfríe a temperatura ambiente. Examinar la solución: la sacarosa adicional que disuelta a 50 º c permanece disuelta a temperatura ambiente. La solución a temperatura ambiente es sobresaturada.
Resultados
Procedimiento paso 1 crea 100 mL de una solución de sacarosa de 0,0100 M. Para convertir medidas de concentración diferente molaridad, determinar la masa de agua utilizada para preparar la solución. Aunque esto se puede medir con precisión, en la ausencia de una medición se puede suponer que el volumen de partículas de soluto disueltos es insignificante (es decir, el volumen de agua utilizado fue 100 mL). Utilizando la densidad del agua...

El molality de sacarosa en esta solución es así:
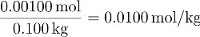
Las partes en masa de sacarosa es igual a:
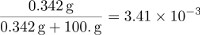
La fracción molar de sacarosa puede calcularse determinando el número de moles en 100 g de agua y dividir la cantidad de sacarosa por la cantidad total de partículas en la solución.

Procedimiento paso 2 ilustra que la solubilidad de la sacarosa en agua es dependiente de la temperatura. Al calentarse, sin disolver sacarosa en una solución saturada se disuelve, formando una solución saturada de una concentración más alta a mayor temperatura. Cuando esta solución se enfría, sacarosa no se precipita de la solución. La solución enfriada resultante está sobresaturada con sacarosa. Adición de incluso una pequeña cantidad de polvo de sacarosa adicional en esta solución puede desencadenar la recristalización rápida de todas la sacarosa disuelta.
Aplicación y resumen
Soluciones sólido-líquido son ubicuas en química. Reacciones químicas más se ejecutan en solución porque disuelven solutos son suficientemente móviles como para mezclar rápidamente y chocan entre sí. Soluciones pueden utilizarse también para almacenar pequeñas cantidades de solutos en volúmenes macroscópicos y fácilmente manipulados. Soluciones exhiben algunas interesantes propiedades físicas llamadas propiedades coligativas que pueden atribuirse a los efectos antrópicos de disolver un soluto en un solvente.
Uno puede preguntarse por qué existen tantos diferentes medidas de concentración de la solución. La respuesta radica en las muchas aplicaciones de las soluciones y las muchos órdenes de magnitud que abarcan las concentraciones. En muestras de agua del ambiente, por ejemplo, las concentraciones de los iones metálicos pueden ser en el rango de unas pocas partes por millón, es impráctico y potencialmente engañosa para expresar esta concentración minúscula como una fracción de molaridad o mole. Aunque la molaridad es una medida conveniente de concentración para los cálculos de estequiometría que involucran reacciones químicas, molality es más apropiado en los estudios de ciertas propiedades coligativas.
Perfeccionamiento de la técnica de preparación de la solución es importante, porque en muchos contextos, el conocimiento preciso de la concentración es esencial. Cuando se ejecuta una reacción química, por ejemplo, uso de soluto demasiado o demasiado poco podría resultar en desperdicio de reactivos o productos bajos rendimientos. Estudios de relaciones empíricas con concentración, como la ley de Beer, dependen de concentraciones exactamente conocidas. A menudo, imprecisión en las concentraciones de solución conduce directamente a la incertidumbre en los valores calculados, como entalpías de reacción. Aunque es imposible eliminar por completo la imprecisión, el uso de técnicas analíticas para la fabricación de la solución garantiza que se minimice la incertidumbre.
Saltar a...
Vídeos de esta colección:

Now Playing
Soluciones y concentraciones
General Chemistry
273.4K Vistas

Cristalería de laboratorio y usos comunes
General Chemistry
654.9K Vistas

Determinación de la densidad de un sólido y líquido
General Chemistry
555.2K Vistas

Determinación de la composición porcentual en masa de una solución acuosa
General Chemistry
383.2K Vistas

Determinación de la fórmula empírica
General Chemistry
180.5K Vistas

Determinación de las reglas de solubilidad de compuestos iónicos
General Chemistry
141.1K Vistas

Uso del medidor de pH
General Chemistry
344.7K Vistas

Introducción a la titulación
General Chemistry
423.7K Vistas

Ley del Gas ideal
General Chemistry
78.3K Vistas

Determinación espectrofotométrica de la constante de un equilibrio
General Chemistry
158.3K Vistas

Principio de le Châtelier
General Chemistry
264.7K Vistas

Depresión del punto de congelación para determinar un compuesto desconocido
General Chemistry
160.6K Vistas

Determinación de las leyes de la velocidad y el orden de la reacción
General Chemistry
195.8K Vistas

Uso de la calorimetría diferencial para medir los cambios en la entalpía
General Chemistry
44.4K Vistas

Complejos de coordinación
General Chemistry
91.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados